Нафталин
| |||
 | |||
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Нафталин [2] | |||
| Другие имена белая смола, камфорная смола, камфорная смола, нафталин, нафталин, антиклещ, альбокарбон, гексален, нафталиновые шарики, хлопья от моли [1] | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 1421310 | |||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.001.863 | ||
| Номер ЕС |
| ||
| 3347 | |||
| КЕГГ | |||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С 10 Н 8 | |||
| Молярная масса | 128,174 г·моль −1 | ||
| Появление | Белые твердые кристаллы/хлопья | ||
| Запах | Сильный запах каменноугольной смолы или нафталина | ||
| Плотность | 1,145 г/см 3 (15,5 °C) [3] 1,0253 г/см 3 (20 °C) [4] 0,9625 г/см 3 (100 °C) [3] | ||
| Температура плавления | 78,2 °C (172,8 °F; 351,3 K) 80,26 °C (176,47 °F; 353,41 K) при 760 мм рт. ст. [4] | ||
| Точка кипения | 217,97 °C (424,35 °F; 491,12 K) при 760 мм рт. ст. [3] [4] | ||
| 19 мг/л (10 °C) 31,6 мг/л (25 °C) 43,9 мг/л (34,5 °C) 80,9 мг/л (50 °C) [4] 238,1 мг/л (73,4 °C) [5] | |||
| Растворимость | Растворим в спиртах , жидком аммиаке , карбоновых кислотах , C6H6 , SO2 , [ 5 ] CCl4 , CS2 , толуоле , анилине [ 6 ] | ||
| Растворимость в этаноле | 5 г/100 г (0 °C) 11,3 г/100 г (25 °C) 19,5 г/100 г (40 °C) 179 г/100 г (70 °C) [6] | ||
| Растворимость в уксусной кислоте | 6,8 г/100 г (6,75 °C) 13,1 г/100 г (21,5 °C) 31,1 г/100 г (42,5 °C) 111 г/100 г (60 °C) [6] | ||
| Растворимость в хлороформе | 19,5 г/100 г (0 °C) 35,5 г/100 г (25 °C) 49,5 г/100 г (40 °C) 87,2 г/100 г (70 °C) [6] | ||
| Растворимость в гексане | 5,5 г/100 г (0 °C) 17,5 г/100 г (25 °C) 30,8 г/100 г (40 °C) 78,8 г/100 г (70 °C) [6] | ||
| Растворимость в масляной кислоте | 13,6 г/100 г (6,75 °C) 22,1 г/100 г (21,5 °C) 131,6 г/100 г (60 °C) [6] | ||
| лог P | 3.34 [4] | ||
| Давление пара | 8,64 Па (20 °C) 23,6 Па (30 °C) 0,93 кПа (80 °C) [5] 2,5 кПа (100 °C) [7] | ||
Константа закона Генри ( k H ) | 0,42438 л·атм/моль [4] | ||
| -91,9·10 −6 см 3 /моль | |||
| Теплопроводность | 98 кПа: 0,1219 Вт/м·К (372,22 К) 0,1174 Вт/м·К (400,22 К) 0,1152 Вт/м·К (418,37 К) 0,1052 Вт/м·К (479,72 К) [8] | ||
Показатель преломления ( nD ) | 1,5898 [4] | ||
| Вязкость | 0,964 сП (80 °С) 0,761 сП (100 °С) 0,217 сП (150 °С) [9] | ||
| Структура | |||
| Моноклинная [10] | |||
| П2 1 /б [10] | |||
| С5 2ч[10] | |||
а = 8,235 Å, b = 6,003 Å, c = 8,658 Å [10] α = 90°, β = 122,92°, γ = 90° | |||
| Термохимия | |||
Теплоемкость ( С ) | 165,72 Дж/моль·К [4] | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 167,39 Дж/моль·К [4] [7] | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | 78,53 кДж/моль [4] | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | 201,585 кДж/моль [4] | ||
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | -5156,3 кДж/моль [4] | ||
| Опасности | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | Легковоспламеняющийся , сенсибилизатор, возможный канцероген . [12] Пыль может образовывать взрывоопасные смеси с воздухом. | ||
| Маркировка СГС : | |||
    [11] [11] | |||
| Опасность | |||
| Н228 , Н302 , Н351 , Н410 [11] | |||
| П210 , П273 , П281 , П501 [11] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 80 °C (176 °F; 353 К) [11] | ||
| 525 °C (977 °F; 798 К) [11] | |||
| Пределы взрывоопасности | 5,9% [11] | ||
| 10 частей на миллион [4] (TWA), 15 частей на миллион [4] (STEL) | |||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LD 50 ( средняя доза ) | 1800 мг/кг (крыса, перорально) 490 мг/кг (крыса, внутривенно) 1200 мг/кг (морская свинка, перорально) 533 мг/кг (мышь, перорально) [14] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (допустимый) | TWA 10 частей на миллион (50 мг/м 3 ) [13] | ||
РЕЛ (рекомендуется) | TWA 10 ppm (50 мг/м 3 ) ST 15 ppm (75 мг/м 3 ) [13] | ||
IDLH (Непосредственная опасность) | 250 частей на миллион [13] | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Нафталин — органическое соединение с формулой C
10ЧАС
8. Это простейший полициклический ароматический углеводород , представляющий собой белое кристаллическое вещество с характерным запахом, который можно обнаружить при концентрациях всего 0,08 ppm по массе . [15] Как ароматический углеводород, нафталин состоит из конденсированной пары бензольных колец. Он является основным ингредиентом традиционных нафталиновых шариков .
История
В начале 1820-х годов два отдельных отчета описали белое твердое вещество с резким запахом, полученное в результате перегонки каменноугольной смолы . В 1821 году Джон Кидд процитировал эти два раскрытия, а затем описал многие свойства этого вещества и способы его получения. Он предложил название нафталин , поскольку оно было получено от вида нафты (широкий термин, охватывающий любую летучую, легковоспламеняющуюся жидкую углеводородную смесь, включая каменноугольную смолу). [16] Химическая формула нафталина была определена Майклом Фарадеем в 1826 году. Структура двух конденсированных бензольных колец была предложена Эмилем Эрленмейером в 1866 году, [17] и подтверждена Карлом Гребе три года спустя. [18]
Физические свойства
Молекулу нафталина можно рассматривать как слияние пары бензольных колец. (В органической химии кольца считаются слитыми, если они разделяют два или более атомов.) Таким образом, нафталин классифицируется как бензоидный полициклический ароматический углеводород (ПАУ). [19]
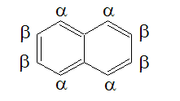
Восемь атомов углерода, которые не являются общими для двух колец, несут по одному атому водорода каждый. Для целей стандартной номенклатуры производных соединений ИЮПАК эти восемь атомов пронумерованы от 1 до 8 последовательно по периметру молекулы, начиная с атома углерода, соседнего с общим. Общие атомы углерода обозначены 4a (между 4 и 5) и 8a (между 8 и 1). [20]
Молекулярная геометрия
Молекула плоская, как и бензол. В отличие от бензола, связи углерод-углерод в нафталине имеют разную длину. Связи C1-C2, C3-C4, C5-C6 и C7-C8 имеют длину около 1,37 Å (137 пм), тогда как другие связи углерод-углерод имеют длину около 1,42 Å (142 пм). Это различие, установленное с помощью рентгеновской дифракции [ 21], согласуется с моделью валентных связей в нафталине и, в частности, с теоремой о перекрестном сопряжении . Эта теорема описывает нафталин как ароматическую бензольную единицу, связанную с диеном , но не сильно сопряженную с ним (по крайней мере, в основном состоянии ), что согласуется с двумя из трех его резонансных структур.
Из-за этого резонанса молекула имеет двустороннюю симметрию поперек плоскости общей углеродной пары, а также поперек плоскости, которая делит пополам связи C2-C3 и C6-C7, и поперек плоскости атомов углерода. Таким образом, существует два набора эквивалентных атомов водорода: альфа- позиции, пронумерованные 1, 4, 5 и 8, и бета- позиции, 2, 3, 6 и 7. Тогда для монозамещенных нафталинов возможны два изомера , соответствующие замещению в альфа- или бета-позиции.

Структурные изомеры нафталина, которые имеют два конденсированных ароматических кольца, включают азулен , который имеет конденсированную кольцевую систему из 5–7 атомов, и бицикло[6.2.0]декапентаен , который имеет конденсированную кольцевую систему из 4–8 атомов. [22]
Точечная группа симметрии нафталина — D 2h .
Электропроводность
Чистый кристаллический нафталин является умеренным изолятором при комнатной температуре с удельным сопротивлением около 10 12 Ом м . Удельное сопротивление падает более чем в тысячу раз при плавлении, до примерно 4 × 10 8 Ом м. Как в жидкости, так и в твердом теле удельное сопротивление зависит от температуры как ρ = ρ 0 exp( E /( kT )), где ρ 0 (Ом м) и E (эВ) - постоянные параметры, k - постоянная Больцмана (8,617 × 10 −5 эВ/ К ), а T - абсолютная температура (К). Параметр E равен 0,73 в твердом теле. Однако твердое тело проявляет полупроводниковый характер ниже 100 К. [23] [24]
Химические свойства
Реакции с электрофилами
В реакциях электрофильного ароматического замещения нафталин реагирует легче, чем бензол. Например, хлорирование и бромирование нафталина протекают без катализатора с образованием 1-хлорнафталина и 1-бромнафталина соответственно. Аналогично, в то время как и бензол, и нафталин могут быть алкилированы с использованием условий реакции Фриделя-Крафтса , нафталин также может быть легко алкилирован реакцией с алкенами или спиртами с использованием серной или фосфорной кислоты в качестве катализатора. [25] Напротив, безводный хлорид алюминия реагирует с нафталином с образованием гексамера, в котором одно кольцо каждого мономера нафталина теряет ароматичность, связываясь с другими мономерами в положениях 1 и 4. [26]
С точки зрения региохимии электрофилы атакуют в альфа-положении. Селективность альфа-замещения по сравнению с бета-замещением можно объяснить с точки зрения резонансных структур промежуточного продукта: для альфа-замещения можно нарисовать семь резонансных структур, из которых четыре сохраняют ароматическое кольцо. Для бета-замещения промежуточный продукт имеет только шесть резонансных структур, и только две из них являются ароматическими. Сульфирование дает «альфа»-продукт нафталин-1-сульфоновую кислоту в качестве кинетического продукта, но нафталин-2-сульфоновую кислоту в качестве термодинамического продукта. 1-изомер образуется преимущественно при 25 °C, а 2-изомер — при 160 °C. Сульфирование с образованием 1- и 2-сульфоновой кислоты происходит легко:
- H2SO4 + C10H8 → C10H7SO3H + H2O
Дальнейшее сульфирование дает ди-, три- и тетрасульфоновые кислоты.
Литирование
Аналогом синтеза фениллития является превращение 1-бромнафталина в 1-литионафталин путем обмена лития на галоген :
- C10H7Br + BuLi → C10H7Li + BuBr
Полученный литионафталин подвергается вторичному литированию, в отличие от поведения фениллития. Эти 1,8-дилитиопроизводные являются предшественниками множества производных перинафталина . [27]
Восстановление и окисление
Со щелочными металлами нафталин образует темно-сине-зеленые соли радикальных анионов, такие как нафталин натрия , Na + C 10 H−
8. Анионы нафталина являются сильными восстановителями.
Нафталин можно гидрировать под высоким давлением в присутствии металлических катализаторов с образованием 1,2,3,4-тетрагидронафталина ( C
10ЧАС
12), также известный как тетралин . Дальнейшее гидрирование дает декагидронафталин или декалин ( С
10ЧАС
18).
Окисление с помощью O
2в присутствии пятиокиси ванадия в качестве катализатора дает фталевый ангидрид :
- С 10 Н 8 + 4,5 О 2 → С 6 Н 4 (СО) 2 О + 2 СО 2 + 2 Н 2 О
Эта реакция лежит в основе основного применения нафталина. Окисление можно также осуществлять с помощью обычных стехиометрических хроматных или перманганатных реагентов.
Производство

С 1960-х по 1990-е годы значительные объемы нафталина производились из тяжелых нефтяных фракций во время переработки , но в настоящее время производство осуществляется в основном из каменноугольной смолы . [ требуется цитата ] Ежегодно производится около 1,3 млн тонн. [ требуется цитата ]
Нафталин является наиболее распространенным компонентом каменноугольной смолы. [ необходима цитата ] Состав каменноугольной смолы варьируется в зависимости от типа угля и обработки, но типичная каменноугольная смола содержит около 10% нафталина по весу. [ необходима цитата ] В промышленной практике перегонка каменноугольной смолы дает масло, содержащее около 50% нафталина, а также двенадцать других ароматических соединений [ необходима цитата ] . Это масло после промывки водным раствором гидроксида натрия для удаления кислотных компонентов (в основном различных фенолов ) и серной кислотой для удаления основных компонентов подвергается фракционной перегонке для выделения нафталина. Сырой нафталин, полученный в результате этого процесса, содержит около 95% нафталина по весу. Основными примесями являются серосодержащее ароматическое соединение бензотиофен (<2%), индан (0,2%), инден (<2%) и метилнафталин (<2%). Нафталин, полученный из нефти, обычно чище, чем тот, что получен из каменноугольной смолы. При необходимости сырой нафталин может быть дополнительно очищен перекристаллизацией из любого из множества растворителей, что приводит к 99% нафталина по весу, что называется 80 °C (температура плавления). [25]
В Северной Америке производителями каменноугольной смолы являются Koppers Inc., Ruetgers Canada Inc. и Recochem Inc., а основным производителем нефти является Monument Chemical Inc. В Западной Европе известными производителями являются Koppers, Ruetgers и Deza. В Восточной Европе нафталин производится различными интегрированными металлургическими комплексами (Северсталь, Евраз, Мечел, ММК) в России , специализированными производителями нафталина и фенола ИНКОР, Енакиевский металлургический завод на Украине и ArcelorMittal Temirtau в Казахстане .
Другие источники и случаи
Нафталин и его алкилгомологи являются основными составляющими креозота .
Следовые количества нафталина вырабатываются магнолиями и некоторыми видами оленей , а также формозскими подземными термитами , возможно, вырабатываемыми термитами в качестве репеллента против «муравьев, ядовитых грибов и червей -нематод ». [28] Некоторые штаммы эндофитного гриба Muscodor albus вырабатывают нафталин среди ряда летучих органических соединений, в то время как Muscodor vitigenus вырабатывает нафталин почти исключительно. [29]
Использует
Нафталин используется в основном как прекурсор для производных химикатов. Крупнейшим применением нафталина является промышленное производство фталевого ангидрида , хотя больше фталевого ангидрида производится из о -ксилола .
Фумигант
Нафталин использовался в качестве фумиганта . Когда-то он был основным ингредиентом в нафталиновых шариках , хотя его использование в значительной степени было заменено альтернативами, такими как 1,4-дихлорбензол . В герметичном контейнере, содержащем гранулы нафталина, пары нафталина накапливаются до уровней, токсичных как для взрослых, так и для личиночных форм многих молей , которые поражают текстильные изделия. Другие виды фумигации нафталина включают использование в почве в качестве фумиганта- пестицида , на чердаках для отпугивания насекомых и животных, таких как опоссумы , [30] и в музейных ящиках и шкафах для хранения, чтобы защитить содержимое от нападения насекомых-вредителей.
Растворитель
Расплавленный нафталин обеспечивает превосходную растворяющую среду для плохо растворимых ароматических соединений. Во многих случаях он более эффективен, чем другие высококипящие растворители, такие как дихлорбензол , бензонитрил , нитробензол и дурол . Реакцию C 60 с антраценом удобно проводить в кипящем нафталине с обратным холодильником, получая аддукт Дильса-Альдера 1:1 . [31] Ароматизация гидропорфиринов была достигнута с использованием раствора DDQ в нафталине. [32]
Производные виды использования
Самым крупным применением нафталина является производство фталевого ангидрида , который является промежуточным продуктом, используемым для изготовления пластификаторов для поливинилхлорида , а также для производства алкидных смол, используемых в красках и лаках.
Сульфоновые кислоты и сульфонаты
Многие нафталинсульфоновые кислоты и сульфонаты полезны. Нафталинсульфоновые кислоты используются в синтезе 1-нафтола и 2-нафтола , прекурсоров для различных красителей, пигментов, химикатов для обработки резины и других химикатов и фармацевтических препаратов. [25] Они также используются в качестве диспергаторов в синтетических и натуральных каучуках, в сельскохозяйственных пестицидах , в красителях и в свинцово-кислотных аккумуляторных пластинах. Нафталиндисульфоновые кислоты, такие как кислота Армстронга, используются в качестве прекурсоров и для образования фармацевтических солей, таких как CFT .
Аминонафталинсульфокислоты являются предшественниками для синтеза многих синтетических красителей .
Алкилнафталинсульфонаты (АНС) используются во многих промышленных приложениях в качестве недетергентных поверхностно-активных веществ ( смачивающих агентов), которые эффективно диспергируют коллоидные системы в водных средах. Основные коммерческие приложения находятся в сельскохозяйственной химической промышленности, где АНС используются для смачиваемых порошков и смачиваемых гранулированных (сухих текучих) составов, а также в текстильной и текстильной промышленности, где смачивающие и пеногасящие свойства АНС используются для отбеливания и окрашивания.
Некоторые полимеры нафталинсульфоната являются суперпластификаторами, используемыми для производства высокопрочного бетона, а также в качестве водоредуцирующих добавок при производстве гипсовых стеновых панелей. [33] Их получают путем обработки нафталинсульфоновой кислоты формальдегидом с последующей нейтрализацией гидроксидом натрия или гидроксидом кальция .
Другие производные виды использования

Многие азокрасители производятся из нафталина. Полезные агрохимикаты включают нафтоксиуксусные кислоты. [25]
Гидрирование нафталина дает тетрагидронафталин ( тетралин ) и декагидронафталин ( декалин ), которые используются как малолетучие растворители . Тетралин используется как растворитель-донор водорода. [25]
Алкилирование нафталина пропиленом дает смесь диизопропилнафталинов , которые полезны в качестве нелетучих жидкостей для чернил. [25]
Замещенные нафталины используются в качестве фармацевтических препаратов, таких как пропранолол ( бета-блокатор ) и набуметон ( нестероидный противовоспалительный препарат ).
Другие применения
Несколько применений нафталина обусловлены его высокой летучестью: он используется для создания искусственных пор при производстве высокопористых шлифовальных кругов ; он используется в инженерных исследованиях теплопередачи с использованием сублимации массы ; и он был исследован в качестве сублимируемого топлива для спутниковых двигателей на холодном газе. [34] [35]
Влияние на здоровье
Воздействие большого количества нафталина может повредить или разрушить эритроциты , чаще всего у людей с наследственным заболеванием, известным как дефицит глюкозо-6-фосфатдегидрогеназы (G6PD) , [36] от которого страдают около 400 миллионов человек. [37] У людей, в частности детей, развилось состояние, известное как гемолитическая анемия , после проглатывания нафталиновых шариков или дезодорирующих блоков, содержащих нафталин. Симптомы включают усталость , отсутствие аппетита, беспокойство и бледность кожи. Воздействие большого количества нафталина может вызвать спутанность сознания , тошноту , рвоту , диарею , кровь в моче и желтуху (желтое окрашивание кожи из-за нарушения функции печени ). [38]
Национальная токсикологическая программа США (NTP) провела эксперимент, в котором самцы и самки крыс и мышей подвергались воздействию паров нафталина по будням в течение двух лет. [39] Как самцы, так и самки крыс продемонстрировали признаки канцерогенеза с увеличением случаев аденомы и нейробластомы носа. Самки мышей продемонстрировали некоторые признаки канцерогенеза, основанные на увеличении случаев альвеолярных и бронхиолярных аденом легких , в то время как самцы мышей не продемонстрировали никаких признаков канцерогенеза.
Международное агентство по изучению рака (МАИР) [40] классифицирует нафталин как возможно канцерогенный для людей и животных ( группа 2B ). МАИР также указывает, что острое воздействие вызывает катаракту у людей, крыс , кроликов и мышей ; и что гемолитическая анемия (описанная выше) может возникнуть у детей и младенцев после перорального или ингаляционного воздействия или после воздействия на мать во время беременности. Был выявлен вероятный механизм канцерогенного воздействия нафталина и некоторых типов освежителей воздуха, содержащих нафталин. [41] [42]
Регулирование
Правительственные агентства США установили профессиональные пределы воздействия нафталина. Управление по охране труда и промышленной гигиене установило допустимый предел воздействия в 10 ppm (50 мг/м 3 ) в течение восьмичасового средневзвешенного по времени значения. Национальный институт охраны труда и промышленной гигиене установил рекомендуемый предел воздействия в 10 ppm (50 мг/м 3 ) в течение восьмичасового средневзвешенного по времени значения, а также краткосрочный предел воздействия в 15 ppm (75 мг/м 3 ). [43] Минимальный порог запаха нафталина составляет 0,084 ppm для людей. [44]
Нафталиновые шарики и другие продукты, содержащие нафталин, запрещены в ЕС с 2008 года. [45] [46]
В Китае запрещено использование нафталина в нафталиновых шариках. [47] В качестве причин запрета приводятся опасность для здоровья человека и распространенное использование натуральной камфары .
Производные нафталина
Частичный список производных нафталина включает следующие соединения:
| Имя | Химическая формула | Молярная масса [г/моль] | Температура плавления [°C] | Температура кипения [°C] | Плотность [г/см 3 ] | Показатель преломления |
|---|---|---|---|---|---|---|
| 1-Нафтойная кислота | С11Н8О2 | 172.18 | 157 | 300 | — | |
| 2-Нафтойная кислота | С11Н8О2 | 172.18 | 185,5 | — | ||
| 1-Нафтоилхлорид | С11Н7ClO | 190,63 | 16–19 | 190 (35 Торр ) | 1.265 | 1.6552 |
| 1-Нафтол | С10Н8О | 144,17 | 94–96 | 278 | 1.224 | — |
| 1-Нафтальдегид | С11Н8О | 156,18 | 1–2 | 160 (15 Торр) | ||
| 1-нитронафталин | С10Н7НО2 | 173.17 | 53–57 | 340 | 1.22 | — |
| 1-Фторнафталин | С 10 Н 7 Ф | 146.16 | −19 | 215 | 1.323 | 1.593 |
| 1-Хлорнафталин | С10Н7Cl | 162.62 | −6 | 259 | 1.194 | 1.632 |
| 2-Хлорнафталин | С10Н7Cl | 162.62 | 59.5 | 256 | 1.138 | 1.643 |
| 1-Бромнафталин | С10Н7Бр | 207.07 | −2 | 279 | 1.489 | 1.670 |
| 1,2,7-Триметилнафталин (Сапоталин) | С 13 Н 14 | 170.25 | 143 | 128 | 0,987 | |
| 1-нонилнафталин [48] | С 19 Н 26 | 254.417 | 8 | 115 | 0,9371 | |
| Нафталин-2-сульфоновая кислота |
Смотрите также
- Камфора
- Диалин , Тетралин , Декалин
- Список межзвездных и околозвездных молекул
- Нафталиновые шарики
- 1-Нафтол , 2-Нафтол
- Реакция Вагнера-Яурегга (классический синтез нафталина)
Ссылки
- ^ Нафталин: торговые названия
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 13, 35, 204, 207, 221– 222, 302, 457, 461, 469, 601, 650. doi :10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ abc "Критерии качества окружающей воды для нафталина" (PDF) . Агентство по охране окружающей среды США. 2014-04-23 . Получено 2014-06-21 .
- ^ abcdefghijklmn Lide, David R., ред. (2009). CRC Handbook of Chemistry and Physics (90-е изд.). Бока-Ратон, Флорида : CRC Press . ISBN 978-1-4200-9084-0.
- ^ abc Anatolievich, Kiper Ruslan. "нафталин". chemister.ru . Получено 2014-06-21 .
- ^ abcdef Seidell, Atherton; Linke, William F. (1919). Растворимость неорганических и органических соединений (2-е изд.). Нью-Йорк: D. Van Nostrand Company. С. 443–446.
- ^ ab Naphthalene в Linstrom, Peter J.; Mallard, William G. (ред.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Национальный институт стандартов и технологий, Гейтерсберг (Мэриленд) (получено 24 мая 2014 г.)
- ^ "Теплопроводность нафталина". DDBST GmbH . Архивировано из оригинала 2016-03-04 . Получено 2014-06-21 .
- ^ "Динамическая вязкость нафталина". DDBST GmbH . Архивировано из оригинала 2016-03-04 . Получено 2014-06-21 .
- ^ abcd Дуглас, Боди Э.; Хо, Ши-Мин (2007). Структура и химия кристаллических твердых тел. Нью-Йорк: Springer Science+Business Media, Inc. стр. 288. ISBN 978-0-387-26147-8.
- ^ abcdef Sigma-Aldrich Co. , Нафталин.
- ^ Канцерогенность нафталина
- ^ abc NIOSH Карманный справочник по химическим опасностям. "#0439". Национальный институт охраны труда и здоровья (NIOSH).
- ^ "Нафталин". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ Amoore JE, Hautala E (1983). «Запах как средство обеспечения химической безопасности: пороги запаха в сравнении с предельными значениями порогового значения и летучими веществами для 214 промышленных химикатов в воздухе и разбавлении водой». J Appl Toxicol . 3 (6): 272– 290. doi :10.1002/jat.2550030603. PMID 6376602. S2CID 36525625.
- ^ Джон Кидд (1821). «Наблюдения над нафталином, своеобразным веществом, напоминающим конкретное эфирное масло, которое образуется при разложении каменноугольной смолы под воздействием красного каления». Philosophical Transactions . 111 : 209–221 . doi :10.1098/rstl.1821.0017. S2CID 97798085.
- ^ Эмиль Эрленмейер (1866). «Studien über die sg Aromatischen Säuren». Аннален дер Химии и Фармации . 137 (3): 327–359 . doi :10.1002/jlac.18661370309.
- ^ К. Гребе (1869) «Ueber die Конституции де Нафталинов» (О структуре нафталина), Annalen der Chemie und Pharmacie , 149 : 20–28.
- ^ "Полициклические ароматические углеводороды (ПАУ)" (PDF) . Архивировано (PDF) из оригинала 2014-11-30.
Нафталин — это ПАУ, который производится в коммерческих целях в США.
- ^ Синяя книга , P-14.4 НУМЕРАЦИЯ
- ^ Cruickshank, DWJ; Sparks, RA (18 октября 1960 г.). «Экспериментальные и теоретические определения длин связей в нафталине, антрацене и других углеводородах». Труды Королевского общества A: математические, физические и инженерные науки . 258 (1293): 270– 285. Bibcode : 1960RSPSA.258..270C. doi : 10.1098/rspa.1960.0187. S2CID 96765335.
- ^ Дитер Кремер; Томас Шмидт; Чарльз В. Бок (1985). «Теоретическое определение молекулярной структуры и конформации. 14. Является ли бицикло[6.2.0]декапентаен ароматическим или антиароматическим?». J. Org. Chem . 50 (15): 2684– 2688. doi :10.1021/jo00215a018.
- ^ Борнманн, Джон А. (1962). «Полупроводность нафталина». Журнал химической физики . 36 (6): 1691– 1692. Bibcode : 1962JChPh..36.1691B. doi : 10.1063/1.1732805. ISSN 0021-9606.
- ^ Schein, LB; Duke, CB; McGhie, AR (1978). «Наблюдение перехода скачков по зонам для электронов в нафталине». Physical Review Letters . 40 (3): 197– 200. Bibcode : 1978PhRvL..40..197S. doi : 10.1103/PhysRevLett.40.197. ISSN 0031-9007.
- ^ abcdef Герд Коллин; Хартмут Хёке; Хельмут Грейм (2003). «Нафталин и гидронафталин». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. ISBN 978-3-527-30673-2..
- ^ Минато Хироси; Хигосаки Нобуюки; Исобе Чиэко (март 1969) [13 июля 1968]. «Полимеризация нафталина и реакции полинафталина». Бюллетень химического общества Японии . 42 (3): 779– 781. doi :10.1246/bcsj.42.779.
- ^ van Soolingen J, de Lang RJ, den Besten R, et al. (1995). "Простая процедура получения 1,8-бис(дифенилфосфино)нафталина". Synthetic Communications . 25 (11): 1741– 1744. doi :10.1080/00397919508015858.
- ^ "Нафталиновый шарик от термитов держит насекомых в страхе". Sci/Tech . BBC News. 8 апреля 1998 г.
- ^ Daisy BH, Strobel GA, Castillo U и др. (ноябрь 2002 г.). «Нафталин, репеллент от насекомых, вырабатывается Muscodor vitigenus, новым эндофитным грибком». Микробиология . 148 (Pt 11): 3737– 41. doi : 10.1099/00221287-148-11-3737 . PMID 12427963.
- ^ "Summary of Possum Repellent Study". Архивировано из оригинала 28 сентября 2013 г.
- ^ К. Комацуа; Ю. Муратаа; Н. Сугитаа; и др. (1993). «Использование нафталина в качестве растворителя для селективного образования аддукта Дильса-Альдера 1: 1 C 60 с антраценом». Буквы тетраэдра . 34 (52): 8473–8476 . doi :10.1016/S0040-4039(00)61362-X.
- ^ М. А. Филатов; А. В. Чепраков (2011). «Синтез новых тетрабензо- и тетранафтопорфиринов с помощью реакций присоединения 4,7-дигидроизоиндола». Тетраэдр . 67 (19): 3559– 3566. doi :10.1016/j.tet.2011.01.052.
- ^ «Диспергирующий и пенообразующий агент, содержащий нафталинсульфонат и альдегидный конденсат».
- ^ Цифакис, Димитриос; Чарльз, Кристин; Босвелл, Род (2020-09-23). «Нафталин как топливо для двигателя Cubesat на холодном газе». Frontiers in Physics . 8 : 389. Bibcode : 2020FrP.....8..389T. doi : 10.3389/fphy.2020.00389 . hdl : 1885/229663 .
- ^ «Новая двигательная система, использующая ключевой ингредиент в шариках от моли, может перемещать спутники в космосе». Australian Broadcasting Corporation . 8 декабря 2021 г. Получено 11 декабря 2021 г.
- ^ Santucci K, Shah B (январь 2000). «Связь нафталина с острой гемолитической анемией». Acad Emerg Med . 7 (1): 42– 7. doi : 10.1111/j.1553-2712.2000.tb01889.x . PMID 10894241.
- ^ "Дефицит глюкозо-6-фосфатдегидрогеназы". Genetics Home Reference . 6 декабря 2017 г. Получено 10 декабря 2017 г.
- ^ Энциклопедия MedlinePlus : Отравление нафталином
- ^ "Технические отчеты NTP 410 и 500". Технические отчеты NTP 410 и 500, доступны на сайте NTP: Long-Term Abstracts & Reports . Архивировано из оригинала 24 октября 2004 г. Получено 6 марта 2005 г.
- ^ Монографии МАИР по оценке канцерогенных рисков для человека. Всемирная организация здравоохранения. 2002. ISBN 978-92-832-1282-9. Получено 25 декабря 2008 г. .
{{cite book}}:|work=проигнорировано ( помощь ) - ^ «Ученые, возможно, разгадали тайну канцерогенных нафталиновых шариков», Physorg.com , 20 июня 2006 г.
- ^ "Нафталин, освежители воздуха и рак". Ассоциация по охране окружающей среды Новой Шотландии . Получено 24 мая 2013 г.
- ^ "CDC - NIOSH Карманный справочник по химическим опасностям - Нафталин". Cdc.gov . Получено 6 марта 2022 г. .
- ^ "Нафталин" (PDF) . Epa.gov . Архивировано (PDF) из оригинала 2016-10-14 . Получено 6 марта 2022 .
- ^ Олдерсон, Эндрю (15 ноября 2008 г.). «Святые натуралы — теперь еврократы запрещают нафталиновые шарики» . The Telegraph . Архивировано из оригинала 12.01.2022 . Получено 23.11.2013 .
- ^ Грей, Керрина (17 ноября 2013 г.). «Совет предостерег от использования ядовитых шариков от моли». Your Local Guardian . Newsquest (London) Ltd. Получено 23.11.2012 .
- ^ 国务院经贸办、卫生部关于停止生产和销售萘丸提倡使用樟脑制品的通知(国经贸调(1993)64 года)
- ^ PubChem. "1-нонилнафталин". pubchem.ncbi.nlm.nih.gov . Получено 24.11.2022 .
Внешние ссылки
- Нафталин — Национальный информационный центр по пестицидам
- Нафталин — веб-сайт Агентства по охране окружающей среды по токсичности воздуха
- Нафталин (PIM 363) — в основном о токсичности нафталина
- Нафталин — CDC – Карманный справочник NIOSH по химическим опасностям
- Нафталин в базе данных свойств пестицидов (PPDB)
- . Энциклопедия Британника . Т. 19 (11-е изд.). 1911. С. 167–168 .