Фениллитий
 | |
 | |
| Имена | |
|---|---|
| Систематическое название ИЮПАК Фениллитий [2] | |
| Другие имена Литиобензол [1] | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| Сокращения | LiPh, PhLi |
| 506502 | |
| ЧЭБИ | |
| ChemSpider | |
| Информационная карта ECHA | 100.008.838 |
| Номер ЕС |
|
| 2849 | |
| МеШ | фениллитий |
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| ЛиК 6ЧАС 5 | |
| Молярная масса | 84,045 г моль −1 |
| Появление | Бесцветные кристаллы. |
| Плотность | 828 мг см −3 |
| Точка кипения | от 140 до 143 °C (от 284 до 289 °F; от 413 до 416 K) |
| Реагирует | |
| Термохимия | |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | 48,3-52,5 кДж моль −1 |
| Опасности | |
| Маркировка СГС : | |
   | |
| Опасность | |
| Н226 , Н250 , Н261 , Н302 , Н312 , Н314 , Н332 | |
| Р210 , Р222 , Р231+Р232 , Р233 , Р240 , Р241 , Р242 , Р243 , Р260 , Р261 , Р264 , Р270 , Р271 , Р280 , Р301+Р312 , Р301+Р330+Р331 , Р302+Р334 , Р302+Р352 , Р303+Р361+Р353 , Р304+Р312 , Р304+Р340 , Р305+Р351+Р338 , Р310 , Р312 , Р321 , Р322 , Р330 , Р363 , Р370+Р378 , П402+П404 , П403+П235 , П405 , П422 , П501 | |
| Паспорт безопасности (SDS) | Внешний ПБС |
| Родственные соединения | |
Родственные соединения | фенилмедь , фенилнатрий , фенилкобальт |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фениллитий — металлоорганический агент с эмпирической формулой C6H5Li . Он чаще всего используется в качестве металлирующего агента в органических синтезах и заменителя реактивов Гриньяра для введения фенильных групп в органических синтезах. [3] Кристаллический фениллитий бесцветен; однако растворы фениллития имеют различные оттенки коричневого или красного цвета в зависимости от используемого растворителя и примесей, присутствующих в растворенном веществе. [4]
Подготовка
Фениллитий был впервые получен реакцией металлического лития с дифенилртутью : [5]
- (C 6 Η 5 ) 2 Ηg + 2Li → 2C 6 Η 5 Li + Ηg
Реакция фенилгалогенида с металлическим литием приводит к образованию фениллития:
- X-Ph + 2Li → Ph-Li + LiX
Фениллитий также можно синтезировать с помощью реакции обмена металла с галогеном:
- н-BuLi + X-Ph → n-BuX + Ph-Li
Преобладающими методами получения фениллития в настоящее время являются два последних синтеза.
Реакции
Основное применение PhLi — облегчение образования углерод-углеродных связей посредством реакций нуклеофильного присоединения и замещения:
- PhLi + R2C = O → PhR2COLi
2-Фенилпиридин получают путем реакции фениллития с пиридином, процесс, включающий путь присоединения-элиминирования: [6]
- C 6 H 5 Li + C 5 H 5 N → C 6 H 5 -C 5 H 4 N + LiH
Структура и свойства
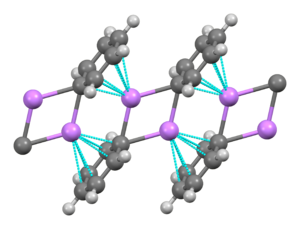
Фениллитий — это литийорганическое соединение, которое образует моноклинные кристаллы. Твердый фениллитий можно описать как состоящий из димерных субъединиц Li 2 Ph 2 . Атомы Li и ипсо- углероды фенильных колец образуют плоское четырехчленное кольцо. Плоскость фенильных групп перпендикулярна плоскости этого кольца Li 2 C 2 . Дополнительная сильная межмолекулярная связь возникает между этими димерами фениллития и π-электронами фенильных групп в соседних димерах, что приводит к бесконечной полимерной лестничной структуре. [7]
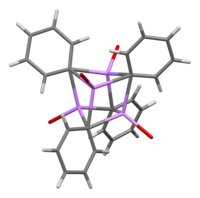
В растворе он принимает различные структуры в зависимости от органического растворителя. В тетрагидрофуране он уравновешивается между мономерным и димерным состояниями. В эфире, в котором он обычно продается, фениллитий существует в виде тетрамера. Четыре атома Li и четыре ипсо углеродных центра занимают чередующиеся вершины искаженного куба. Фенильные группы находятся на гранях тетраэдра и связываются с тремя ближайшими атомами Li.
Длины связей C–Li составляют в среднем 2,33 Å. Молекула эфира связывается с каждым из участков Li через свой атом кислорода. В присутствии LiBr, побочного продукта прямой реакции лития с фенилгалогенидом, комплекс [(PhLi•Et 2 O) 4 ] вместо этого становится [(PhLi•Et 2 O) 3 •LiBr]. Атом Li в LiBr занимает один из литиевых участков в кластере кубанового типа , а атом Br находится в соседнем углеродном участке. [8]
Ссылки
- ^ Обычно используется для описания замещенных производных. См., например, Katsutoshi Kobayashi; Soichi Sato; Horn, Ernst; Naomichi Furukawa (1998), "Первое выделение и характеристика солей катионов сульфения, стабилизированных координацией двух атомов азота", Tetrahedron Letters , 39 : 17, стр. 2593-2596. ISSN 0040-4039. DOI 10.1016/S0040-4039(98)00277-9.
- ^ "фениллитий (CHEBI:51470)". Химические сущности биологического интереса (ChEBI) . Кембридж, Великобритания: Европейский институт биоинформатики. 2009-01-22. Main . Получено 2013-06-01 .
- ^ Вительманн, У.; Бауэр, Р.Дж. «Литий и литиевые соединения». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a15_393. ISBN 978-3-527-30673-2.
- ^ Гилман, Х.; Цёльнер, Э.А.; Селби, В.М. (1932). «Улучшенная процедура получения литийорганических соединений». Журнал Американского химического общества . 54 (5): 1957–1962 . doi :10.1021/ja01344a033.
- ^ Грин, Д. П.; Зуев, Д. (2008). "Фениллитий". Энциклопедия реагентов для органического синтеза . Wiley and Sons. doi :10.1002/047084289X.rp076.pub2. ISBN 978-0471936237.
- ^ Эванс, Дж. К. У.; Аллен, К. Ф. Х. «2-Фенилпиридин» Органические синтезы (1938), т. 18, стр. 70 doi :10.15227/orgsyn.018.0070
- ^ Диннебир, Р. Э.; Беренс, У.; Олбрих, Ф. (1998). «Фениллитий, свободный от основания Льюиса: определение структуры твердого тела методом синхротронной порошковой дифракции». Журнал Американского химического общества . 120 (7): 1430– 1433. doi :10.1021/ja972816e.
- ^ Hope, H.; Power, PP (1983). «Выделение и кристаллические структуры комплексов эфирата фениллития без галогенидов и с высоким содержанием галогенидов [(PhLi•Et 2 O) 4 ] и [(PhLi•Et 2 O) 3 •LiBr]». Журнал Американского химического общества . 105 (16): 5320– 5324. doi :10.1021/ja00354a022.


