Азулен
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Азулен [1] | |||
| Систематическое название ИЮПАК Бицикло[5.3.0]декапентаен | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.005.449 | ||
| КЕГГ | |||
CID PubChem |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С 10 Н 8 | |||
| Молярная масса | 128,174 г·моль −1 | ||
| Температура плавления | от 99 до 100 °C (от 210 до 212 °F; от 372 до 373 K) | ||
| Точка кипения | 242 °C (468 °F; 515 К) | ||
| -98,5·10 −6 см 3 /моль г/л [2] | |||
| Термохимия | |||
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | −1266,5 ккал/моль [3] | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Азулен — ароматическое органическое соединение и изомер нафталина . Нафталин бесцветен, тогда как азулен — темно-синий. Соединение названо в честь своего цвета, так как «azul» по-испански означает «синий». Два терпеноида, ветивазулен (4,8-диметил-2-изопропилазулен) и гваязулен (1,4-диметил-7-изопропилазулен), которые имеют азуленовый скелет, встречаются в природе как компоненты пигментов в грибах, масле гваякового дерева и некоторых морских беспозвоночных.
Азулен имеет долгую историю, восходящую к 15 веку как лазурно-голубой хромофор, полученный путем паровой дистилляции немецкой ромашки . Хромофор был обнаружен в тысячелистнике и полыни и назван в 1863 году Септимусом Пиессе. Его структуру впервые описал Лавослав Ружичка , а затем в 1937 году его органический синтез осуществил Плацидус Платтнер.
Структура и связь


Азулен обычно рассматривается как результат слияния циклопентадиеновых и циклогептатриеновых колец. Подобно нафталину и циклодекапентаену , это 10- пи-электронная система. Он проявляет ароматические свойства: (i) периферические связи имеют схожую длину и (ii) он подвергается замещениям типа Фриделя-Крафтса . Повышение стабильности за счет ароматичности оценивается в два раза ниже, чем у нафталина.
Его дипольный момент равен1,08 D , [6] в отличие от нафталина, дипольный момент которого равен нулю. Эту полярность можно объяснить, рассматривая азулен как слияние 6 π-электронного циклопентадиенильного аниона и 6 π-электронного тропилиевого катиона : один электрон из семичленного кольца переносится в пятичленное кольцо, придавая каждому кольцу ароматическую стабильность по правилу Хюккеля . Исследования реакционной способности подтверждают, что семичленное кольцо является электрофильным, а пятичленное кольцо является нуклеофильным .

Дипольная природа основного состояния отражается в его глубоком цвете, что необычно для небольших ненасыщенных ароматических соединений. [7] Еще одной примечательной особенностью азулена является то, что он нарушает правило Каша , проявляя флуоресценцию из более высокого возбужденного состояния (S 2 → S 0 ). [8]
Органический синтез
Синтетические пути получения азулена давно представляют интерес из-за его необычной структуры. [9] В 1939 году первый метод был описан Сент-Пфау и Платтнером [10], которые исходили из индана и этилдиазоацетата .
Эффективный однореакторный путь подразумевает аннулирование циклопентадиена с ненасыщенными C 5 - синтонами . [11] Альтернативный подход с использованием циклогептатриена давно известен, один из иллюстративных методов показан ниже. [12] [13]
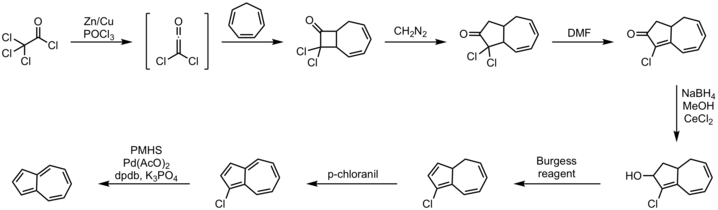
Процедура:
- циклогептатриен 2+2 циклоприсоединение с дихлоркетеном
- реакция внедрения диазометана
- реакция дегидрогалогенирования с ДМФА
- Восстановление Люче до спирта с помощью боргидрида натрия
- реакция элиминирования с реагентом Берджесса
- окисление п -хлоранилом
- дегалогенирование с полиметилгидросилоксаном , ацетатом палладия(II) , фосфатом калия и лигандом DPDB
Другой путь синтеза начинается с солей пиридиния или пирилия с циклопентадиенильным анионом : [14]

Азулен также можно синтезировать с помощью реакции Дильса-Альдера и ретрореакции Дильса-Альдера : [14]

Исходный материал для вышеуказанной реакции может быть получен путем мгновенного вакуумного пиролиза фенилпропиолата.
Металлоорганические комплексы
В металлоорганической химии азулен служит лигандом для низковалентных металлических центров. Иллюстративные комплексы — (азулен)Mo 2 (CO) 6 и (азулен)Fe 2 (CO) 5 . [15]
Производные
1-Гидроксиазулен — нестабильное зеленое масло, не проявляющее кето-енольной таутомерии . [16] 2-Гидроксиазулен получают путем гидролиза 2-метоксиазулена бромистоводородной кислотой. Он стабилен и проявляет кето-енольную таутомерию. [17] Значение p K a 2-гидроксиазулена в воде составляет 8,71. Он более кислый, чем фенол или нафтол . Значение p K a 6-гидроксиазуленов в воде составляет 7,38, что делает его также более кислым, чем фенол или нафтол. [17]
В нафт[ a ]азулене нафталиновое кольцо конденсируется в 1,2-положениях азулена. В одной из таких систем [18] обнаружено отклонение от планарности, аналогичное таковому у тетрагелицена .
Гвайазулен (1,4-диметил-7-изопропилазулен) — алкилированное производное азулена с почти идентичным интенсивно-синим цветом. Он коммерчески доступен для косметической промышленности, где он действует как кондиционирующий агент для кожи.
Ссылки
- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013. Королевское химическое общество . стр. 207. doi :10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Sweet, LI; Meier, PG (1997). «Летальные и сублетальные эффекты азулена и лонгифолена для Microtox®, Ceriodaphnia dubia, Daphnia magna и Pimephales promelas» (PDF) . Бюллетень загрязнения окружающей среды и токсикологии . 58 (2): 268– 274. Bibcode :1997BuECT..58..268S. doi :10.1007/s001289900330. hdl : 2027.42/42354 . PMID 8975804.
- ^ Salter, Carl; Foresman, James B. (1998). «Нафталин и азулен I: полумикробомбовая калориметрия и квантово-механические расчеты». Журнал химического образования . 75 (10): 1341. Bibcode : 1998JChEd..75.1341S. doi : 10.1021/ed075p1341.
- ^ Хармон, AD; Вайсграбер, К.Х.; Вайс, У. (1980). «Предварительно сформированные азуленовые пигменты Lactarius indigo (Schw.) Fries (Russulaceae, Basidiomycetes)». Эксперименты . 36 : 54–56 . doi : 10.1007/BF02003967. S2CID 21207966.
- ^ Николас, Джиллиан Мэй (1998). Австралазийские грибы: исследование натурального продукта (диссертация). стр. 56. doi : 10.26021/9162 .
- ^ Андерсон, Артур Г.; Стеклер, Бернард М. (1959). «Азулен. VIII. Исследование видимых спектров поглощения и дипольных моментов некоторых 1- и 1,3-замещенных азуленов». Журнал Американского химического общества . 81 (18): 4941– 4946. doi :10.1021/ja01527a046.
- ^ Michl, Joseph; Thulstrup, EW (1976). «Почему азулен синий, а антрацен белый? Простая картина мо». Tetrahedron . 32 (2): 205. doi :10.1016/0040-4020(76)87002-0.
- ^ Tétreault, N.; Muthyala, RS; Liu, RSH; Steer, RP (1999). «Управление фотофизическими свойствами многоатомных молекул путем замещения и сольватации: второе возбужденное синглетное состояние азулена». Журнал физической химии A. 103 ( 15): 2524– 31. Bibcode : 1999JPCA..103.2524T. doi : 10.1021/jp984407q.
- ↑ Гордон, Максвелл (1 февраля 1952 г.). «Азулены». Chemical Reviews . 50 (1): 127– 200. doi :10.1021/cr60155a004.
- ^ Санкт-Пфау, Александр; Платтнер, Pl. А. (1939). "Zur Kenntnis der flüchtigen Pflanzenstoffe VIII. Synthese des Vetivazulens". Helvetica Chimica Acta . 22 : 202–208 . doi : 10.1002/hlca.19390220126.
- ^ Хафнер, Клаус; Мейнхардт, Клаус-Петер (1984). «Азулен». Органические синтезы . 62 : 134. дои : 10.15227/orgsyn.062.0134.
- ^ Карре, Себастьен; Блан, Орельен; Кокерель, Йоанн; Бертод, Микаэль; Грин, Эндрю Э.; Депре, Жан-Пьер (2005). «Подход к блюзу: очень гибкий путь к азуленам». Angewandte Chemie, международное издание . 44 (32): 5130–5133 . doi :10.1002/anie.200501276. ПМИД 16013070.
- ^ Лемаль, Дэвид М.; Голдман, Гленн Д. (1988). «Синтез азулена, синего углеводорода». Журнал химического образования . 65 (10): 923. Bibcode : 1988JChEd..65..923L. doi : 10.1021/ed065p923.
- ^ ab Shoji, Taku; Ito, Shunji; Yasunami, Masafumi (1 октября 2021 г.). «Синтез производных азулена из 2H-циклогепта[b]фуран-2-онов в качестве исходных материалов: их реакционная способность и свойства». International Journal of Molecular Sciences . 22 (19): 10686. doi : 10.3390/ijms221910686 . ISSN 1422-0067. PMC 8509482 . PMID 34639027.
- ^ Черчилль, Мелвин Р. (2007). «Комплексы переходных металлов азулена и родственных лигандов». Progress in Inorganic Chemistry . Vol. 11. pp. 53–98 . doi :10.1002/9780470166123.ch2. ISBN 9780470166123.
- ^ Асао, Тойонобу; Сюндзи Ито; Нобору Морита (1989). «1-Гидроксиазулен и 3-гидроксигвайазулен: синтез и их свойства». Tetrahedron Letters . 30 (48): 6693– 6696. doi :10.1016/S0040-4039(00)70653-8.
- ^ ab Takase, Kahei; Toyonobu Asao; Yoshikazu Takagi; Tetsuo Nozoe (1968). «Синтезы и некоторые свойства 2- и 6-гидроксиазуленов». Chemical Communications (7): 368b–370. doi :10.1039/C1968000368B.
- ^ Ямамура, Кимиаки; Кавабата, Сидзука; Кимура, Такатомо; Эда, Кадзуо; Хасимото, Масао (2005). «Новый синтез бензалацетоновых аналогов нафта[ а ]азуленов с помощью внутримолекулярной реакции раскрытия фуранового кольца, опосредованной ионами тропилия, и рентгеновское исследование производного нафта[1,2- а ]азулена». Журнал органической химии . 70 (22): 8902–6 . doi :10.1021/jo051409f. ПМИД 16238325.
Внешние ссылки
- Веб-сайт MSDS Архивировано 18 октября 2007 г. на Wayback Machine
- Веб-сайт паспорта безопасности материалов