Алкин

В органической химии алкин — ненасыщенный углеводород , содержащий по крайней мере одну тройную связь углерод - углерод . [1] Простейшие ациклические алкины только с одной тройной связью и без других функциональных групп образуют гомологический ряд с общей химической формулой C n H 2 n −2 . Алкины традиционно известны как ацетилены, хотя название ацетилен также относится конкретно к C 2 H 2 , формально известному как этин по номенклатуре ИЮПАК . Как и другие углеводороды, алкины, как правило, гидрофобны . [2]
Структура и связь
В ацетилене углы связи H–C≡C составляют 180°. Благодаря этому углу связи алкины имеют стержневидную форму. Соответственно, циклические алкины редки. Бензин не может быть изолирован. Расстояние связи C≡C в 118 пикометров (для C 2 H 2 ) намного короче расстояния C=C в алкенах (132 пм, для C 2 H 4 ) или связи C–C в алканах (153 пм). [3]

Иллюстративные алкины: a , ацетилен, b , два изображения пропина, c , 1-бутин, d , 2-бутин , e , встречающийся в природе 1-фенилгепта-1,3,5-триин, и f , напряженный циклогептин. Тройные связи выделены синим цветом .
Тройная связь очень прочная, ее прочность составляет 839 кДж/моль. Сигма-связь дает 369 кДж/моль, первая пи-связь дает 268 кДж/моль, а вторая пи-связь — 202 кДж/моль. Связи обычно обсуждаются в контексте теории молекулярных орбиталей , которая признает тройную связь возникающей в результате перекрытия s- и p-орбиталей. На языке теории валентных связей атомы углерода в алкиновой связи sp-гибридизованы : каждый из них имеет две негибридизованные p-орбитали и две sp-гибридные орбитали . Перекрытие sp-орбитали каждого атома образует одну sp–sp- сигма-связь . Каждая p-орбиталь одного атома перекрывает одну на другом атоме, образуя две пи-связи, что в общей сложности дает три связи. Оставшаяся sp-орбиталь каждого атома может образовывать сигма-связь с другим атомом, например, с атомами водорода в исходном ацетилене. Две sp-орбитали выступают на противоположные стороны атома углерода.
Конечные и внутренние алкины
Внутренние алкины имеют заместители углерода на каждом ацетиленовом углероде. Симметричные примеры включают дифенилацетилен и 3-гексин . Они также могут быть асимметричными, например, в 2-пентине .
Терминальные алкины имеют формулу RC≡CH , где по крайней мере один конец алкина представляет собой атом водорода. Примером является метилацетилен (пропин по номенклатуре ИЮПАК). Их часто получают путем алкилирования мононатриевого ацетилида . [4] Терминальные алкины, как и сам ацетилен , являются умеренно кислыми, со значениями p K a около 25. Они гораздо более кислые, чем алкены и алканы, которые имеют значения p K a около 40 и 50 соответственно. Кислотный водород на терминальных алкинах может быть заменен различными группами, что приводит к образованию галоген-, силил- и алкоксоалкинов. Карбанионы, образующиеся при депротонировании терминальных алкинов, называются ацетиленидами . [5] Внутренние алкины также значительно более кислые, чем алкены и алканы, хотя и не такие кислые, как терминальные алкины. Связи C–H в α-положении алкинов (пропаргиловые связи C–H) также могут быть депротонированы с использованием сильных оснований с расчетным значением p K a 35. Эта кислотность может быть использована для изомеризации внутренних алкинов в терминальные алкины с использованием реакции алкиновой молнии .
Наименование алкинов
В систематической химической номенклатуре алкины называются с использованием греческой префиксной системы без дополнительных букв. Примерами служат этин или октин. В родительских цепях с четырьмя или более атомами углерода необходимо указать, где расположена тройная связь. Для октина можно написать 3-октин или окт-3-ин, когда связь начинается с третьего атома углерода. Тройной связи присваивается наименьшее возможное число . Если нет высших функциональных групп, родительская цепь должна включать тройную связь, даже если это не самая длинная возможная углеродная цепь в молекуле. Этин обычно называют его тривиальным названием ацетилен.
В химии суффикс -ин используется для обозначения наличия тройной связи. В органической химии суффикс часто следует номенклатуре ИЮПАК . Однако неорганические соединения, характеризующиеся ненасыщенностью в форме тройных связей, могут быть обозначены заместительной номенклатурой с использованием тех же методов, которые используются для алкинов (т. е. название соответствующего насыщенного соединения изменяется путем замены окончания " -ан " на "-ин"). " -диин " используется, когда есть две тройные связи, и так далее. Положение ненасыщенности указывается числовым локантом, непосредственно предшествующим суффиксу "-ин", или "локантами" в случае нескольких тройных связей. Локанты выбираются таким образом, чтобы числа были как можно меньше. "-ин" также используется в качестве суффикса для обозначения групп заместителей, которые трижды связаны с исходным соединением.
Иногда перед ним вставляется число между дефисами, чтобы указать, между какими атомами находится тройная связь. Этот суффикс возник как свернутая форма окончания слова « ацетилен ». Конечный «-e» исчезает, если за ним следует другой суффикс, начинающийся с гласной. [6]
Структурная изомерия
Алкины, имеющие четыре или более атомов углерода, могут образовывать различные структурные изомеры , имея тройную связь в разных положениях или имея некоторые атомы углерода в качестве заместителей, а не части родительской цепи. Возможны также другие неалкиновые структурные изомеры.
- C 2 H 2 : только ацетилен
- C 3 H 4 : только пропин
- C 4 H 6 : 2 изомера: 1-бутин и 2-бутин
- C 5 H 8 : 3 изомера: 1-пентин , 2-пентин и 3-метил-1-бутин
- C 6 H 10 : 7 изомеров: 1-гексин , 2-гексин, 3-гексин , 4-метил-1-пентин, 4-метил-2-пентин, 3-метил-1-пентин, 3,3-диметил-1-бутин
Синтез
Из карбида кальция
Классически ацетилен получали гидролизом (протонированием) карбида кальция (Ca 2+ [:C≡C:] 2– ):
который в свою очередь был синтезирован путем соединения негашеной извести и кокса в электродуговой печи при температуре 2200 °C:
Это был промышленно важный процесс, который обеспечивал доступ к углеводородам из угольных ресурсов для таких стран, как Германия и Китай. Однако энергоемкий характер этого процесса является основным недостатком, и его доля в мировом производстве ацетилена неуклонно снижалась по сравнению с крекингом углеводородов. [7]
Трещины
В коммерческом отношении доминирующим алкином является сам ацетилен, который используется в качестве топлива и предшественника других соединений, например, акрилатов . Ежегодно производятся сотни миллионов килограммов путем частичного окисления природного газа : [8]
Пропин, также используемый в промышленности, также получают путем термического крекинга углеводородов.
Алкилирование и арилирование терминальных алкинов
Терминальные алкины (RC≡CH, включая сам ацетилен) могут быть депротонированы основаниями, такими как NaNH2 , BuLi или EtMgBr , с образованием ацетилид- анионов (RC≡C: – M + , M = Na, Li, MgBr), которые могут быть алкилированы путем присоединения к карбонильным группам ( реакция Фаворского ), раскрытия кольца эпоксидов или замещения типа S N 2 незатрудненных первичных алкилгалогенидов.
В присутствии катализаторов на основе переходных металлов, классически представляющих собой комбинацию Pd(PPh 3 ) 2 Cl 2 и CuI , терминальные ацетилены (RC≡CH) могут реагировать с арилиодидами и бромидами (ArI или ArBr) в присутствии вторичного или третичного амина, такого как Et 3 N, с образованием арилацетиленов (RC≡CAr) в реакции Соногаширы .
Доступность этих надежных реакций делает терминальные алкины полезными строительными блоками для получения внутренних алкинов.
Дегидрогалогенирование и родственные реакции
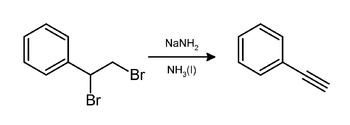
Алкины получают из 1,1- и 1,2- дигалогеналканов путем двойного дегидрогалогенирования . Реакция позволяет получать алкины из алкенов, которые сначала галогенируются , а затем дегидрогалогенируются. Например, фенилацетилен может быть получен из стирола путем бромирования с последующей обработкой полученного 1,2-дибром-1-фенилэтана амидом натрия в аммиаке : [9] [10]
Алкины получаются из винилбромидов с помощью перегруппировки Фрича-Буттенберга-Вихеля . Алкины могут быть получены из альдегидов с помощью реакции Кори-Фукса и из альдегидов или кетонов с помощью гомологизации Сейферта-Гилберта .
Винилгалогениды подвержены дегидрогалогенированию.
Реакции, включая заявки
Имея реактивную функциональную группу , алкины участвуют во многих органических реакциях . Такое использование было впервые предложено Ральфом Рафаэлем , который в 1955 году написал первую книгу, описывающую их универсальность в качестве промежуточных продуктов в синтезе . [11] Несмотря на свою кинетическую стабильность (стойкость) из-за их сильных тройных связей, алкины являются термодинамически нестабильной функциональной группой, о чем можно судить по высокоположительным теплотам образования малых алкинов. Например, ацетилен имеет теплоту образования +227,4 кДж/моль (+54,2 ккал/моль), что указывает на гораздо более высокое содержание энергии по сравнению с его составными элементами. Высокоэкзотермическое горение ацетилена используется в промышленности в ацетилено-кислородных горелках, используемых при сварке. Другие реакции с участием алкинов часто являются высокотермодинамически выгодными (экзотермическими/экзергоническими) по той же причине.
Гидрогенизация
Будучи более ненасыщенными , чем алкены, алкины характерно вступают в реакции, которые показывают, что они «дважды ненасыщены». Алкины способны присоединять два эквивалента H 2 , тогда как алкен присоединяет только один эквивалент. [12] В зависимости от катализаторов и условий алкины присоединяют один или два эквивалента водорода. Частичное гидрирование , останавливающееся после добавления только одного эквивалента для получения алкена , обычно более желательно, поскольку алканы менее полезны:

Крупнейшим применением этой технологии является конверсия ацетилена в этилен на нефтеперерабатывающих заводах (паровой крекинг алканов дает несколько процентов ацетилена, который селективно гидрируется в присутствии палладиевого / серебряного катализатора). Для более сложных алкинов широко рекомендуется использовать катализатор Линдлара , чтобы избежать образования алкана, например, при конверсии фенилацетилена в стирол . [13] Аналогично, галогенирование алкинов дает дигалогениды алкенов или тетрагалогениды алкилов:
Добавление одного эквивалента H2 к внутренним алкинам дает цис-алкены.
Добавление галогенов и родственных реагентов
Алкины характеризуются способностью присоединять два эквивалента галогенов и галогеноводородов.
Добавление неполярных связей E−H через C≡C является общим для силанов, боранов и родственных гидридов. Гидроборирование алкинов дает виниловые бораны, которые окисляются до соответствующего альдегида или кетона. В реакции тиол-ин субстратом является тиол.
Добавление галогеноводородов давно представляет интерес. В присутствии хлорида ртути в качестве катализатора ацетилен и хлористый водород реагируют, давая винилхлорид . Хотя этот метод был заброшен на Западе, он остается основным методом производства в Китае. [14]
Гидратация
Реакция гидратации ацетилена дает ацетальдегид . Реакция протекает путем образования винилового спирта , который таутомеризуется с образованием альдегида. Эта реакция когда-то была основным промышленным процессом, но была вытеснена процессом Ваккера . Эта реакция происходит в природе, катализатором является ацетиленгидратаза .
Гидратация фенилацетилена дает ацетофенон : [15]
(Ph3P)AuCH3 катализирует гидратацию 1,8-нонадиина в 2,8-нонандион: [16]
Изомеризация в аллены
Алкины могут быть изомеризованы сильными основаниями или переходными металлами в аллены . Благодаря их сопоставимой термодинамической стабильности константа равновесия изомеризации алкина/аллена обычно находится в пределах нескольких порядков величины единицы. Например, пропин может быть изомеризован с образованием равновесной смеси с пропадиеном :
Циклоприсоединения и окисление
Алкины подвергаются различным реакциям циклоприсоединения . Реакция Дильса-Альдера с 1,3- диенами дает 1,4-циклогексадиены . Эта общая реакция была широко разработана. Электрофильные алкины являются особенно эффективными диенофилами . «Циклоаддукт», полученный при присоединении алкинов к 2-пирону, устраняет диоксид углерода , давая ароматическое соединение. Другие специализированные циклоприсоединения включают многокомпонентные реакции, такие как тримеризация алкинов , давая ароматические соединения, и [2+2+1]-циклоприсоединение алкина, алкена и оксида углерода в реакции Паусона-Ханда . Неуглеродные реагенты также подвергаются циклизации, например, циклоприсоединение азида к алкину по Хьюзгену, давая триазолы . Процессы циклоприсоединения с участием алкинов часто катализируются металлами, например, метатезис енинов и метатезис алкинов , что позволяет перемешивать карбиновые (RC) центры:
Окислительное расщепление алкинов происходит через циклоприсоединение к оксидам металлов. Наиболее известно, что перманганат калия преобразует алкины в пару карбоновых кислот .
Реакции, специфичные для терминальных алкинов
Терминальные алкины легко преобразуются во многие производные, например, путем реакций сочетания и конденсации. В результате конденсации с формальдегидом и ацетиленом получается бутиндиол : [8] [17]
В реакции Соногаширы терминальные алкины соединяются с арил- или винилгалогенидами:
Эта реакционная способность основана на том факте, что терминальные алкины являются слабыми кислотами, типичные значения pKa которых составляют около 25, что помещает их между значениями аммиака (35) и этанола (16):
где MX = NaNH 2 , LiBu или RMgX .
Реакции алкинов с некоторыми катионами металлов, например, Ag + и Cu +, также дают ацетилиды. Так, несколько капель гидроксида диамминсеребра(I) ( Ag(NH 3 ) 2 OH ) реагируют с терминальными алкинами, что подтверждается образованием белого осадка ацетилида серебра. Эта реакционная способность лежит в основе реакций сочетания алкинов , включая сочетание Кадио-Ходкевича , сочетание Глазера и сочетание Эглинтона , показанное ниже: [18]
В реакции Фаворского и в алкинилировании в целом терминальные алкины присоединяются к карбонильным соединениям, образуя гидроксиалкин .
Металлокомплексы
Алкины образуют комплексы с переходными металлами. Такие комплексы также встречаются в катализируемых металлами реакциях алкинов, таких как тримеризация алкинов . Терминальные алкины, включая сам ацетилен, реагируют с водой, давая альдегиды. Превращение обычно требует металлических катализаторов, чтобы дать этот результат присоединения анти-Марковникова. [19]
Алкины в природе и медицине
По словам Фердинанда Больмана , первое встречающееся в природе ацетиленовое соединение, эфир дегидроматрикарии, было выделено из вида Artemisia в 1826 году. За почти два последующих столетия было обнаружено и описано более тысячи встречающихся в природе ацетиленов. Полиины , подмножество этого класса природных продуктов, были выделены из самых разных видов растений, культур высших грибов, бактерий, морских губок и кораллов. [20] Некоторые кислоты, такие как дегтярная кислота, содержат алкиновую группу. Диины и триины, виды со связью RC≡C–C≡CR′ и RC≡C–C≡C–C≡CR′ соответственно, встречаются в некоторых растениях ( Ichthyothere , Chrysanthemum , Cicuta , Oenanthe и других представителях семейств Asteraceae и Apiaceae ). Некоторые примеры - цикутоксин , оэнантотоксин и фалькаринол . Эти соединения обладают высокой биоактивностью, например, как нематоциды . [21] 1-фенилгепта-1,3,5-триин является примером встречающегося в природе триина. Биосинтетически природные продукты энедиина также получаются из предшественника полиина.
Алкины встречаются в некоторых фармацевтических препаратах, включая контрацептив норэтинодрел . Тройная связь углерод-углерод также присутствует в продаваемых препаратах, таких как антиретровирусный эфавиренз и противогрибковый тербинафин . Молекулы, называемые ендиинами, имеют кольцо, содержащее алкен («ен») между двумя алкиновыми группами («диин»). Эти соединения, например, калихеамицин , являются одними из самых агрессивных известных противоопухолевых препаратов, настолько, что субъединицу ендиина иногда называют «боеголовкой». Энидиины подвергаются перегруппировке посредством циклизации Бергмана , образуя высокореактивные радикальные промежуточные соединения, которые атакуют ДНК внутри опухоли. [22]
Смотрите также
Ссылки
- ^ Алкины. Энциклопедия Британника
- ^ Saul Patai, ed. (1978). Тройная связь углерода-углерода . Том 1. John Wiley & Sons. ISBN 9780470771563.
- ^ Смит, Майкл Б.; Марч, Джерри (2006). Продвинутая органическая химия Марча: реакции, механизмы и структура . стр. 24. doi : 10.1002/0470084960. ISBN 9780470084960.
- ^ К. Н. Кэмпбелл, Б. К. Кэмпбелл (1950). " н -Бутилацетилен". Органические синтезы . 30 : 15. doi :10.15227/orgsyn.030.0015.
- ^ Блох, Дэниел Р. (2012). Органическая химия демистифицирована (2-е изд.). McGraw-Hill. стр. 57. ISBN 978-0-07-176797-2.
- ^ Комиссия по номенклатуре органической химии (1971) [1958 (A: Углеводороды и B: Фундаментальные гетероциклические системы), 1965 (C: Характерные группы)]. Номенклатура органической химии (3-е изд.). Лондон: Butterworths. ISBN 0-408-70144-7.
- ^ Тротуш, Иоан-Теодор; Циммерман, Тобиас; Шют, Ферди (2014-02-12). «Каталитические реакции ацетилена: пересмотр сырья для химической промышленности». Chemical Reviews . 114 (3): 1761– 1782. doi :10.1021/cr400357r. ISSN 0009-2665.
- ^ аб Графье, Хайнц; Кёрниг, Вольфганг; Вайц, Ханс-Мартин; Рейсс, Вольфганг; Стеффан, Гвидо; Диль, Герберт; Боше, Хорст; Шнайдер, Курт; Кечка, Хайнц (2000). «Бутандиолы, бутендиол и бутинедиол». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a04_455. ISBN 978-3-527-30673-2.
- ^ Кеннет Н. Кэмпбелл, Барбара К. Кэмпбелл (1950). "Фенилацетилен". Органические синтезы . 30 : 72. doi :10.15227/orgsyn.030.0072.
- ^ A. Le Coq и A. Gorgues (1979). "Алкиность через катализируемое фазовым переносом дегидрогалогенирование: диэтилацеталь пропиолальдегида". Органические синтезы . 59 : 10. doi :10.15227/orgsyn.059.0010.
- ^ Рафаэль, Ральф Александр (1955). Ацетиленовые соединения в органическом синтезе. Лондон: Butterworths Scientific Publications. OCLC 3134811.
- ^ Россер и Уильямс (1977). Современная органическая химия для A-level . Великобритания: Коллинз. стр. 82. ISBN 0003277402.
- ^ Х. Линдлар; Р. Дюбуа (1973). "Палладиевый катализатор для частичного восстановления ацетиленов". Органические синтезы; Собрание томов , т. 5, стр. 880..
- ^ Дреер, Эберхард-Людвиг; Торкельсон, Теодор Р.; Бойтель, Клаус К. (2011). «Хлорэтаны и хлорэтилены». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.o06_o01. ISBN 978-3527306732.
- ^ Фукуда, Y.; Утимото, K. (1991). «Эффективное превращение неактивированных алкинов в кетоны или ацетали с катализатором на основе золота (III)». J. Org. Chem. 56 (11): 3729. doi :10.1021/jo00011a058.
- ^ Mizushima, E.; Cui, D.-M.; Nath, DCD; Hayashi, T.; Tanaka, M. (2005). "Au(I)-катализируемая гидратация алкинов: 2,8-нонанедион". Органические синтезы . 83 : 55.
- ^ Питер Пэсслер; Вернер Хефнер; Клаус Бакл; Хельмут Мейнасс; Андреас Мейсвинкель; Ханс-Юрген Вернике; Гюнтер Эберсберг; Рихард Мюллер; Юрген Бесслер; Хартмут Берингер; Дитер Майер (2008). "Ацетилен". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a01_097.pub3. ISBN 978-3-527-30673-2.
- ^ К. Штёкель и Ф. Сондхаймер (1974). «[18]Аннулен». Органические синтезы . 54 : 1. дои : 10.15227/orgsyn.054.0001.
- ^ Хинтерманн, Лукас; Лабонн, Орели (2007). «Каталитическая гидратация алкинов и ее применение в синтезе». Синтез . 2007 (8): 1121– 1150. doi :10.1055/s-2007-966002. S2CID 95666091.
- ^ Аннабель Л.К. Ши Шун; Рик Р. Тыквински (2006). «Синтез природных полиинов». Angew. Chem. Int. Ed . 45 (7): 1034– 1057. doi :10.1002/anie.200502071. PMID 16447152.
- ^ Лам, Йорген (1988). Химия и биология природных ацетиленов и родственных соединений (NOARC): труды конференции по химии и биологии природных ацетиленов и родственных соединений (NOARC) . Амстердам: Elsevier. ISBN 0-444-87115-2.
- ^ S. Walker; R. Landovitz; WD Ding; GA Ellestad; D. Kahne (1992). "Поведение расщепления калихеамицина гамма 1 и калихеамицина T". Proc Natl Acad Sci USA . 89 (10): 4608– 12. Bibcode : 1992PNAS...89.4608W. doi : 10.1073 /pnas.89.10.4608 . PMC 49132. PMID 1584797.




![{\displaystyle {\ce {Ca^{2+}[C#C]^2- + 2 HOH -> HC#CH + Ca^{2+}[(HO^{-})2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5561c41cfd81fead9f9813ad5d0d11bc24b20578)












![{\displaystyle {\ce {2R-\!{\equiv }\!-H->[{\ce {Cu(OAc)2}}][{\ce {пиридин}}]R-\!{\equiv }\!-\!{\equiv }\!-R}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fe5690544a4da60b118164e70291e6eae02f82e)

