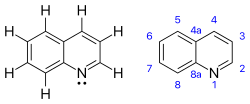
Хинолин
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Хинолин [2] | |||
Систематическое название ИЮПАК
| |||
Другие имена
| |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 107477 | |||
| ХЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.001.865 | ||
| Номер ЕС |
| ||
| 27201 | |||
| КЕГГ | |||
| МеШ | Хинолины | ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 2656 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С 9 Н 7 Н | |||
| Молярная масса | 129,16 г/моль | ||
| Появление | Бесцветная маслянистая жидкость | ||
| Плотность | 1,093 г/мл | ||
| Температура плавления | −15 °C (5 °F; 258 K) | ||
| Точка кипения | 237 °C (459 °F; 510 K), 760 мм рт. ст.; 108–110 °C (226–230 °F), 11 мм рт. ст. | ||
| Слабо растворим | |||
| Растворимость | Растворим в спирте, эфире и сероуглероде. | ||
| Кислотность ( pK a ) | 4,85 (сопряженная кислота) [3] | ||
| −86,0·10 −6 см 3 /моль | |||
| Термохимия | |||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | 174,9 кДж·моль −1 | ||
| Опасности | |||
| Маркировка СГС : | |||
   | |||
| Опасность | |||
| Н302 , Н312 , Н315 , Н319 , Н341 , Н350 , Н411 | |||
| P201 , P202 , P264 , P270 , P273 , P280 , P281 , P301+P312 , P302+P352 , P305+P351+P338 , P308+P313 , P312 , P321 , P322 , P330 , П332+П313 , П337+П313 , П362 , П363 , П391 , П405 , П501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 101 °C (214 °F; 374 К) | ||
| 400 °C (752 °F; 673 К) | |||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LD 50 ( средняя доза ) | 331 мг/кг | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Хинолин — гетероциклическое ароматическое органическое соединение с химической формулой C9H7N . Это бесцветная гигроскопичная жидкость с сильным запахом. Старые образцы, особенно под воздействием света, становятся желтыми, а затем коричневыми. Хинолин слабо растворяется в холодной воде, но легко растворяется в горячей воде и большинстве органических растворителей. [ 4] Сам по себе хинолин имеет мало применений, но многие из его производных полезны в различных приложениях. Ярким примером является хинин , алкалоид, встречающийся в растениях. Идентифицировано более 200 биологически активных хинолиновых и хиназолиновых алкалоидов. [5] [6] 4-гидрокси-2-алкилхинолины (HAQ) участвуют в устойчивости к антибиотикам .
Возникновение и изоляция
Хинолин был впервые извлечен из каменноугольной смолы в 1834 году немецким химиком Фридлибом Фердинандом Рунге ; [4] он назвал хинолин leukol («белое масло» по-гречески). [7] Каменноугольная смола остается основным источником коммерческого хинолина. [8] В 1842 году французский химик Шарль Герхардт получил соединение путем сухой перегонки хинина , стрихнина или цинхонина с гидроксидом калия ; [4] он назвал это соединение хиноилином или хинолеином . [9] Соединения Рунге и Гепхардта, казалось, были различными изомерами , поскольку они реагировали по-разному. Однако немецкий химик Август Хоффман в конечном итоге понял, что различия в поведении были вызваны присутствием загрязняющих веществ и что эти два соединения на самом деле идентичны. [10] Единственное сообщение о хинолине как о натуральном продукте было получено от перуанского палочника Oreophoetes peruana . У них есть пара грудных желез, из которых они выделяют зловонную жидкость, содержащую хинолин, если их потревожить. [11]
Как и другие гетероциклические соединения азота, такие как производные пиридина , хинолин часто сообщается как загрязнитель окружающей среды, связанный с предприятиями по переработке сланца или угля, а также был обнаружен на старых участках обработки древесины. Благодаря своей относительно высокой растворимости в воде хинолин имеет значительный потенциал для мобильности в окружающей среде, что может способствовать загрязнению воды. Хинолин легко разлагается некоторыми микроорганизмами, такими как штамм вида Rhodococcus Q1, который был выделен из почвы и шлама бумажной фабрики. [12]
Хинолины присутствуют в небольших количествах в сырой нефти в составе первичной дизельной фракции. Их можно удалить с помощью процесса, называемого гидроденитрификацией .
Синтез
Хинолины часто синтезируют из простых анилинов с использованием ряда названных реакций .
По часовой стрелке сверху это:
- Синтез хинолина Комбеса с использованием анилинов и β- дикетонов .
- Синтез Конрада-Лимпаха с использованием анилинов и β-кетоэфиров.
- Реакция Дебнера с использованием анилинов с альдегидом и пировиноградной кислотой для образования хинолин-4-карбоновых кислот
- Реакция Дебнера-Миллера с использованием анилинов и α,β-ненасыщенных карбонильных соединений.
- Реакция Гулда-Якобса , начинающаяся с анилина и этилэтоксиметиленмалоната
- Синтез Скраупа с использованием сульфата железа , глицерина , анилина , нитробензола и серной кислоты .
Существует ряд других процессов, требующих специально замещенных анилинов или родственных соединений:
- Синтез хинолина Кэмпса с использованием о-ациламиноацетофенона и гидроксида
- Синтез Фридлендера с использованием 2-аминобензальдегида и ацетальдегида.
- Синтез хинолина по Кнорру с использованием β-кетоанилида и серной кислоты
- Синтез хинолина по Нементовскому с использованием антраниловой кислоты и кетонов
- Реакция Пфитцингера с использованием изатина с основанием и карбонильным соединением для получения замещенных хинолин-4-карбоновых кислот
- Реакция Поварова с использованием анилина , бензальдегида и активированного алкена
Хинолины восстанавливаются до тетрагидрохинолинов энантиоселективно с использованием нескольких каталитических систем. [13] [14]

Приложения
Хинолины используются в производстве красителей и получении гидроксихинолинсульфата и ниацина . Он также используется как растворитель для смол и терпенов .
Хинолин в основном используется в производстве других специальных химикатов . Согласно отчету, опубликованному в 2005 году, ежегодно производилось около 4 тонн . [8] Его основное применение — в качестве предшественника 8-гидроксихинолина , который является универсальным хелатирующим агентом и предшественником пестицидов. Его 2- и 4-метилпроизводные являются предшественниками цианиновых красителей . Окисление хинолина дает хинолиновую кислоту (пиридин-2,3-дикарбоновую кислоту), предшественник гербицида, продаваемого под названием «Assert». [8]
Известно, что восстановление хинолина боргидридом натрия в присутствии уксусной кислоты приводит к образованию кайролина А. [15] (Ср. кайрин )
Некоторые противомалярийные препараты содержат хинолиновые заместители. К ним относятся хинин , хлорохин , амодиахин и примахин .
Хинолин используется как растворитель и реагент в органическом синтезе. [16]
Хинолиниевые соединения (например, соли) также могут использоваться в качестве ингибиторов и усилителей коррозии.
Смотрите также
- Хинолиновые алкалоиды
- 4-Аминохинолин
- 8-Гидроксихинолин
- Пирролохинолинхинон (PQQ), окислительно-восстановительный кофактор и спорная пищевая добавка
- Хиназолин , азапроизводное хинолина
- Хинин
- Похожие простые ароматические кольца
- Изохинолин , аналог с атомом азота в положении 2
- Пиридин , аналог без конденсированного бензольного кольца
- Нафталин , аналог с углеродом вместо азота
- Индол , аналог только с пятичленным азотистым кольцом
Ссылки
- ^ "ХИНОЛИН (БЕНЗОПИРИДИН)". Chemicalland21.com . Получено 2012-06-14 .
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 4, 211. doi :10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Название «хинолин» является сохраненным названием, которое предпочтительнее альтернативных систематических названий слияния «1-бензопиридин» или «бензо[ b ]пиридин».
- ^ Браун, Х.К. и др., в книге Боде, Э.А. и Находа, Ф.К., Определение органических структур физическими методами , Academic Press, Нью-Йорк, 1955.
- ^ abc Чисхолм, Хью , ред. (1911). . Encyclopaedia Britannica . Том 22 (11-е изд.). Cambridge University Press. стр. 759.
- ^ Шан, XF; Моррис-Натшке, SL; Лю, YQ; Го, X; Сюй, XS; Гото, M; Ли, JC; Ян, GZ; Ли, KH (май 2018 г.). «Биологически активные алкалоиды хинолина и хиназолина, часть I». Обзоры медицинских исследований . 38 (3): 775– 828. doi :10.1002/med.21466. PMC 6421866. PMID 28902434 .
- ^ Шан, Сяо-Фэй; Моррис-Начке, Сьюзен Л.; Ян, Гуань-Чжоу; Лю, Ин-Цянь; Го, Сяо; Сюй, Сяо-Шань; Гото, Масуо; Ли, Цзюнь-Кай; Чжан, Цзи-Ю; Ли, Го-Сюн (сентябрь 2018 г.). «Биологически активные хинолиновые и хиназолиновые алкалоиды часть II». Обзоры медицинских исследований . 38 (5): 1614–1660 . doi :10.1002/med.21492. ПМК 6105521 . ПМИД 29485730.
- ^ Ф. Ф. Рунге (1834) «Ueber einige Produkte der Steinkohlendestillation» (О некоторых продуктах перегонки угля), Annalen der Physik und Chemie , 31 (5): 65–78; см. особенно стр. 68: «3. Leukol oder Weissöl» (3. Белое масло [по-гречески] или белое масло [по-немецки]). Из стр. 68: «Diese dritte Basis habe ich Leukol или Weissöl genannt, weil sie keine Farbigen Reactionen zeigt». (Это третье основание я назвал лейколом или белым маслом, потому что оно не проявляет цветных реакций.)
- ^ abc Герд Коллин; Хартмут Хёке. "Хинолин и изохинолин". Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. doi :10.1002/14356007.a22_465. ISBN 978-3-527-30673-2.
- ^ Герхардт, Ч. (1842) «Untersuchungen über die Organischen Basen» (Исследования органических оснований), Annalen der Chemie und Pharmacie , 42 : 310-313. См. также: (Редактор) (1842) «Хинолен или хиноилин» (хинолин или хиноилин), Annalen der Chemie und Pharmacie , 44 : 279-280.
- ↑ Первоначально Хоффманн думал, что лейкол Рунге и хинолеин Герхардта различаются. (См.: Хоффманн, Август Вильгельм (1843) «Chemische Untersuruchungen der Organischen Basen im Steinkohlen-Theeröl» (Химические исследования органических оснований в каменноугольном масле), Annalen der Chemie und Pharmacie , 47 : 37-87; см. особенно стр. 76. -78.) Однако после дальнейшей очистки образца Лейкола , Хоффманн определил, что они действительно идентичны. (См.: (Редактор) (1845) «Vorläufige Notiz über die Identität des Leukols und Chinolins» (Предварительное уведомление о идентичности лейкола и хинолина), Annalen der Chemie und Pharmacie , 53 : 427-428.)
- ^ Эйснер, Т.; Морган, Р.К.; Аттигалле АБ, Смедли, С.Р.; Херат, КБ, Мейнвальд, Дж. (1997) «Защитное производство хинолина фазмидным насекомым (Oreophoetes peruana) J. Exp. Biol. 200, 2493–2500.
- ^ O'Loughlin, Edward J.; Kehrmeyer, Staci R.; Sims, Gerald K. (1996). "Изоляция, характеристика и использование субстрата бактерией, разрушающей хинолин". International Biodegraderation & Biodegradation . 38 (2): 107. Bibcode :1996IBiBi..38..107O. doi :10.1016/S0964-8305(96)00032-7.
- ^ Сюй, Л.; Лам, К.Х.; Джи, Дж.; Ву, Дж.; Фан, К.-Х.; Ло, В.-Х.; Чан, ASC Chem. Коммун. 2005 , 1390.
- ^ Ритц, MT; Ли, X. Chem. Коммун. 2006 , 2159.
- ^ GRIBBLE, Gordon W.; HEALD, Peter W. (1975). "Реакции борогидрида натрия в кислых средах; III. Восстановление и алкилирование хинолина и изохинолина карбоновыми кислотами". Синтез . 1975 (10): 650– 652. doi :10.1055/s-1975-23871. ISSN 0039-7881.
- ^ Шерман, Анджела Р.; Карон, Антуан; Коллинз, Шон К. (2001). «Хинолин». Энциклопедия реагентов для органического синтеза . С. 1– 4. doi :10.1002/047084289X.rq002.pub2. ISBN 9780470842898.
Внешние ссылки
- Международная карта химической безопасности 0071
- Новые методы синтеза хинолинов