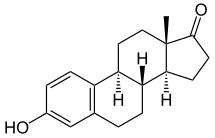
Эстрон
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 3-Гидроксиэстра-1,3,5(10)-триен-17-он | |
| Систематическое название ИЮПАК (3a S ,3b R ,9b S ,11a S )-7-Гидрокси-11a-метил-2,3,3a,3b,4,5,9b,10,11,11a-декагидро-1 H -циклопента[ a ]фенантрен-1-он | |
| Другие имена Эстрон; E1 | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ | |
| ChEMBL | |
| ChemSpider | |
| Информационная карта ECHA | 100.000.150 |
| КЕГГ | |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| С18Н22О2 | |
| Молярная масса | 270,366 г/моль |
| Температура плавления | 254,5 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Эстрон ( E1 ), также пишется как oestrone , является стероидом , слабым эстрогеном и второстепенным женским половым гормоном . [1] Это один из трех основных эндогенных эстрогенов, другие — эстрадиол и эстриол . [1] Эстрон, как и другие эстрогены, синтезируются из холестерина и секретируются в основном из гонад , хотя они также могут образовываться из андрогенов надпочечников в жировой ткани . [2] По сравнению с эстрадиолом, как эстрон, так и эстриол обладают гораздо более слабой активностью в качестве эстрогенов. [1] Эстрон может быть преобразован в эстрадиол и служит в основном в качестве предшественника или метаболического промежуточного продукта эстрадиола. [1] [3] Он является как предшественником, так и метаболитом эстрадиола. [4] [1]
Помимо своей роли естественного гормона, эстрон использовался в качестве лекарственного средства , например, в менопаузальной гормональной терапии ; для получения информации об эстроне как лекарственном средстве см. статью Эстрон (лекарства) .
Биологическая активность
Эстрон является эстрогеном, в частности агонистом эстрогеновых рецепторов ERα и ERβ . [1] [5] Это гораздо менее сильный эстроген, чем эстрадиол, и, как таковой, является относительно слабым эстрогеном. [1] [5] [6] Введенный подкожно мышам, эстрадиол примерно в 10 раз сильнее эстрона и примерно в 100 раз сильнее эстриола . [7] Согласно одному исследованию, относительное сродство связывания эстрона с человеческими ERα и ERβ составляло 4,0% и 3,5% от такового эстрадиола соответственно, а относительная трансактивационная способность эстрона на ERα и ERβ составляла 2,6% и 4,3% от такового эстрадиола соответственно. [5] Соответственно, эстрогенная активность эстрона, как сообщается, составляет приблизительно 4% от активности эстрадиола. [1] В дополнение к своей низкой эстрогенной активности, эстрон, в отличие от эстрадиола и эстриола, не накапливается в тканях-мишенях эстрогена. [1] Поскольку эстрон может трансформироваться в эстрадиол, большая часть или вся эстрогенная активность эстрона in vivo фактически обусловлена преобразованием в эстрадиол. [1] [8] Таким образом, эстрон считается предшественником или прогормоном эстрадиола. [3] В отличие от эстрадиола и эстриола, эстрон не является лигандом рецептора эстрогена, связанного с G-белком (сродство >10 000 нМ). [9]
Клинические исследования подтвердили природу эстрона как относительно инертного предшественника эстрадиола. [1] [10] [11] [12] При пероральном приеме эстрадиола соотношение уровней эстрадиола и эстрона в среднем примерно в 5 раз выше, чем при нормальных физиологических обстоятельствах у женщин в пременопаузе и при парентеральном (непероральном) введении эстрадиола. [1] Пероральное введение менопаузальных заместительных доз эстрадиола приводит к низким уровням эстрадиола в фолликулярной фазе , тогда как уровни эстрона напоминают высокие уровни, наблюдаемые в течение первого триместра беременности . [1] [13] [14] Несмотря на заметно повышенные уровни эстрона при пероральном приеме эстрадиола, но не при трансдермальном приеме эстрадиола, клинические исследования показали, что дозировки перорального и трансдермального эстрадиола, достигающие схожих уровней эстрадиола, обладают эквивалентной и незначительно различающейся эффективностью с точки зрения мер, включая подавление уровней лютеинизирующего гормона и фолликулостимулирующего гормона , ингибирование резорбции костной ткани и облегчение симптомов менопаузы , таких как приливы . [1] [10] [11] [12] [15] Кроме того, было обнаружено, что уровни эстрадиола коррелируют с этими эффектами, тогда как уровни эстрона — нет. [10] [11] Эти результаты подтверждают, что эстрон имеет очень низкую эстрогенную активность, а также указывают на то, что эстрон не снижает эстрогенную активность эстрадиола. [1] [10] [11] [12] Это противоречит некоторым бесклеточным исследованиям in vitro, предполагающим, что высокие концентрации эстрона могут частично противодействовать действию эстрадиола. [16] [17] [18]
| Эстроген | ERПодсказка Рецептор эстрогена РБАПодсказка относительной привязки сродства(%) | Вес матки (%) | Утеротрофия | ЛГПодсказка Лютеинизирующий гормонуровни (%) | ГСПГПодсказка Глобулин, связывающий половые гормоны РБАПодсказка относительной привязки сродства(%) |
|---|---|---|---|---|---|
| Контроль | – | 100 | – | 100 | – |
| Эстрадиол (E2) | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| Эстрон (E1) | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| Эстриол (E3) | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| Эстетрол (E4) | 0,5 ± 0,2 | ? | Неактивный | ? | 1 |
| 17α-Эстрадиол | 4,2 ± 0,8 | ? | ? | ? | ? |
| 2-гидроксиэстрадиол | 24 ± 7 | 285 ± 8 | + б | 31–61 | 28 |
| 2-метоксиэстрадиол | 0,05 ± 0,04 | 101 | Неактивный | ? | 130 |
| 4-гидроксиэстрадиол | 45 ± 12 | ? | ? | ? | ? |
| 4-метоксиэстрадиол | 1,3 ± 0,2 | 260 | ++ | ? | 9 |
| 4-Фторэстрадиол а | 180 ± 43 | ? | +++ | ? | ? |
| 2-гидроксиэстрон | 1,9 ± 0,8 | 130 ± 9 | Неактивный | 110–142 | 8 |
| 2-метоксиэстрон | 0,01 ± 0,00 | 103 ± 7 | Неактивный | 95–100 | 120 |
| 4-гидроксиэстрон | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-метоксиэстрон | 0,13 ± 0,04 | 338 | ++ | 65–92 | 12 |
| 16α-Гидроксиэстрон | 2,8 ± 1,0 | 552 ± 42 | +++ | 7–24 | <0,5 |
| 2-гидроксиэстриол | 0,9 ± 0,3 | 302 | + б | ? | ? |
| 2-метоксиэстриол | 0,01 ± 0,00 | ? | Неактивный | ? | 4 |
| Примечания: Значения представляют собой среднее значение ± SD или диапазон. ER RBA = Относительное сродство связывания с рецепторами эстрогена цитозоля матки крысы . Вес матки = Процентное изменение сырого веса матки овариэктомированных крыс через 72 часа непрерывного введения 1 мкг/час через подкожно имплантированные осмотические насосы . Уровни ЛГ = Уровни лютеинизирующего гормона относительно исходного уровня овариэктомированных крыс через 24–72 часа непрерывного введения через подкожный имплантат. Сноски: a = Синтетический (т. е. не эндогенный ). b = Атипичный утеротрофический эффект, который достигает плато в течение 48 часов (утеротрофия эстрадиола продолжается линейно до 72 часов). Источники: см. шаблон. | |||||
Биохимия

Биосинтез
Эстрон биосинтезируется из холестерина . Основной путь включает андростендион в качестве промежуточного продукта , при этом андростендион трансформируется в эстрон ферментом ароматазой . Эта реакция происходит как в гонадах , так и в некоторых других тканях , в частности, в жировой ткани , и эстрон впоследствии секретируется из этих тканей. [2] В дополнение к ароматизации андростендиона, эстрон также обратимо образуется из эстрадиола ферментом 17β-гидроксистероиддегидрогеназой (17β-HSD) в различных тканях, включая печень , матку и молочную железу . [1]
Механизм действия:
Эстрон действует, проникая в клетки определенных тканей организма и прикрепляясь к ядерным рецепторам. Это взаимодействие затем влияет на то, как экспрессируются гены, что приводит к различным физиологическим реакциям в организме. [20]
Распределение
Эстрон связан примерно на 16% с глобулином, связывающим половые гормоны (ГСПГ), и на 80% с альбумином в кровотоке [1] , а остальная часть (от 2,0 до 4,0%) циркулирует свободно или несвязанно. [21] Он имеет примерно 24% относительной связывающей способности эстрадиола с ГСПГ. [1] Таким образом, эстрон относительно слабо связывается с ГСПГ. [22]
Метаболизм
Эстрон конъюгируется в конъюгаты эстрогенов, такие как сульфат эстрона и глюкуронид эстрона , с помощью сульфотрансфераз и глюкуронидаз , а также может гидроксилироваться ферментами цитохрома P450 в катехолэстрогены, такие как 2-гидроксиэстрон и 4-гидроксиэстрон , или в эстриол . [1] Оба эти превращения происходят преимущественно в печени . [1] Эстрон также может обратимо превращаться в эстрадиол с помощью 17β-HSD. [1] Период полувыведения эстрона из крови составляет около 10–70 минут и аналогичен периоду полувыведения эстрадиола. [23] [24]
Описание: Метаболические пути , участвующие в метаболизме эстрадиола и других природных эстрогенов (например, эстрона, эстриола ) у людей. В дополнение к метаболическим превращениям, показанным на схеме, конъюгация (например, сульфатирование и глюкуронирование ) происходит в случае эстрадиола и метаболитов эстрадиола, которые имеют одну или несколько доступных гидроксильных (–ОН) групп . Источники: см. страницу шаблона. |
Выделение
Эстрон выводится с мочой в форме конъюгатов эстрогена, таких как сульфат эстрона . [1] После внутривенной инъекции меченого эстрона женщинам почти 90% выводится с мочой и калом в течение 4–5 дней. [23] Энтерогепатическая рециркуляция вызывает задержку выведения эстрона. [23]
Это один из трех основных типов эстрогена, который вырабатывается в различных частях тела, включая плаценту, яичники и периферические ткани. [25]
Уровни
| секс | половой гормон | Репродуктивная фаза | Скорость выработки крови | Скорость секреции гонад | Скорость метаболического клиренса | Референтный диапазон (уровни в сыворотке) | |
|---|---|---|---|---|---|---|---|
| Единицы СИ | Единицы измерения, не входящие в систему СИ | ||||||
| Мужчины | Андростендион | – | 2,8 мг/день | 1,6 мг/день | 2200 л/сутки | 2,8–7,3 нмоль/л | 80–210 нг/дл |
| Тестостерон | – | 6,5 мг/день | 6,2 мг/день | 950 л/сутки | 6,9–34,7 нмоль/л | 200–1000 нг/дл | |
| Эстрон | – | 150 мкг/день | 110 мкг/день | 2050 л/сутки | 37–250 пмоль/л | 10–70 пг/мл | |
| Эстрадиол | – | 60 мкг/день | 50 мкг/день | 1600 л/сутки | <37–210 пмоль/л | 10–57 пг/мл | |
| Эстрон сульфат | – | 80 мкг/день | Незначительный | 167 л/день | 600–2500 пмоль/л | 200–900 пг/мл | |
| Женщины | Андростендион | – | 3,2 мг/день | 2,8 мг/день | 2000 л/день | 3,1–12,2 нмоль/л | 89–350 нг/дл |
| Тестостерон | – | 190 мкг/день | 60 мкг/день | 500 л/день | 0,7–2,8 нмоль/л | 20–81 нг/дл | |
| Эстрон | Фолликулярная фаза | 110 мкг/день | 80 мкг/день | 2200 л/сутки | 110–400 пмоль/л | 30–110 пг/мл | |
| лютеиновая фаза | 260 мкг/день | 150 мкг/день | 2200 л/сутки | 310–660 пмоль/л | 80–180 пг/мл | ||
| Постменопауза | 40 мкг/день | Незначительный | 1610 л/сутки | 22–230 пмоль/л | 6–60 пг/мл | ||
| Эстрадиол | Фолликулярная фаза | 90 мкг/день | 80 мкг/день | 1200 л/сутки | <37–360 пмоль/л | 10–98 пг/мл | |
| лютеиновая фаза | 250 мкг/день | 240 мкг/день | 1200 л/сутки | 699–1250 пмоль/л | 190–341 пг/мл | ||
| Постменопауза | 6 мкг/день | Незначительный | 910 л/сутки | <37–140 пмоль/л | 10–38 пг/мл | ||
| Эстрон сульфат | Фолликулярная фаза | 100 мкг/день | Незначительный | 146 л/день | 700–3600 пмоль/л | 250–1300 пг/мл | |
| лютеиновая фаза | 180 мкг/день | Незначительный | 146 л/день | 1100–7300 пмоль/л | 400–2600 пг/мл | ||
| прогестерон | Фолликулярная фаза | 2 мг/день | 1,7 мг/день | 2100 л/сутки | 0,3–3 нмоль/л | 0,1–0,9 нг/мл | |
| лютеиновая фаза | 25 мг/день | 24 мг/день | 2100 л/сутки | 19–45 нмоль/л | 6–14 нг/мл | ||
Примечания и источники Примечания: « Концентрация стероида в кровотоке определяется скоростью, с которой он секретируется железами, скоростью метаболизма предшественников или прегормонов в стероид и скоростью, с которой он извлекается тканями и метаболизируется. Скорость секреции стероида относится к общей секреции соединения из железы за единицу времени. Скорость секреции оценивалась путем отбора проб венозного оттока из железы с течением времени и вычитания артериальной и периферической венозной концентрации гормона. Скорость метаболического клиренса стероида определяется как объем крови, который был полностью очищен от гормона за единицу времени. Скорость продукции стероидного гормона относится к поступлению в кровь соединения из всех возможных источников, включая секрецию из желез и превращение прогормонов в интересующий стероид. В устойчивом состоянии количество гормона, поступающего в кровь из всех источников, будет равно скорости, с которой он очищается (скорость метаболического клиренса), умноженной на концентрацию в крови (скорость продукции = скорость метаболического клиренса × концентрация). Если вклад метаболизма прогормонов в циркулирующий пул стероидов невелик, то скорость продукции будет приблизительно равна скорости секреции». Источники: см. шаблон. | |||||||
Токсичность:
Если эстрон используется слишком часто или принимается в больших количествах, он может вызвать токсичность, приводящую к таким симптомам, как тошнота и рвота. Эстрон следует хранить в оригинальной упаковке или контейнере, чтобы сохранить его качество и эффективность. [25]
Химия
Структуры основных эндогенных эстрогенов Обратите внимание на гидроксильные группы (–OH) : у эстрона (E1) их одна, у эстрадиола (E2) — две, у эстриола (E3) — три, а у эстетрола (E4) — четыре. |
Эстрон, также известный как эстра-1,3,5(10)-триен-3-ол-17-он, является природным эстрановым стероидом с двойными связями в положениях C1, C3 и C5, гидроксильной группой в положении C3 и кетонной группой в положении C17. Название эстрон произошло от химических терминов estr в (эстра-1,3,5(10)-триен) и ket one .
Химическая формула эстрона — C 18 H 22 O 2 , а его молекулярная масса — 270,366 г/моль. Это белый, без запаха, твердый кристаллический порошок с температурой плавления 254,5 °C (490 °F) и удельным весом 1,23. [26] [27] Эстрон горюч при высоких температурах, образуя продукты — оксид углерода (CO) и диоксид углерода (CO 2 ). [26]
Медицинское применение
Эстрон был доступен в виде инъекционного эстрогена для медицинского применения, например, в гормональной терапии симптомов менопаузы , но в настоящее время он в основном больше не продается. [28]
Эстрон, как часть заместительной гормональной терапии (ЗГТ), часто используется для лечения симптомов, вызванных дефицитом эстрогена у женщин в пери- и постменопаузе. Эта терапия направлена на улучшение общего состояния здоровья и облегчение симптомов менопаузы, связанных с дисбалансом эстрогенов. Кроме того, эстрон и другие эстрогены используются для профилактики остеопороза у женщин в постменопаузе, которые подвержены высокому риску переломов и не могут переносить альтернативные лекарства. Эстрогены эффективно усваиваются организмом и впоследствии инактивируются в печени, что делает их эффективными в ЗГТ и профилактике остеопороза. [25]
Противопоказания
Использование эстрона имеет несколько противопоказаний , некоторые примеры включают: гиперчувствительность , анамнез некоторых видов рака, инсульт, венозную тромбоэмболию (ВТЭ), а также беременность или кормление грудью. Эстрогены содержат предупреждение в рамке , чтобы использовать в минимальной эффективной дозе и в течение максимально короткого периода лечения, если используются отдельно или с другим гормоном в классе прогестагенов. [29]
Рак молочной железы
Эстрон противопоказан тем, у кого есть или подозревается рак молочной железы . Использование эстрогенов сопровождается предупреждением в рамке с раком молочной железы для женщин в постменопаузе, так как это может увеличить риск развития инвазивного рака молочной железы. [30] У тех, у кого рак молочной железы, повышается риск гиперкальциемии и метастазов в кости при приеме эстрогенов. [31] У женщин в постменопаузе с раком молочной железы может развиться синдром слабости , когда происходят изменения в гормональном уровне крови, включая повышенный уровень эстрона. Эстрон, основной тип эстрогена, вырабатываемый у женщин в постменопаузе, был обнаружен в более высоких концентрациях по сравнению со стандартными уровнями у тех, кто был отнесен к категории прехрупких, и у тех, кто был отнесен к категории хрупких. [32]
Венозная тромбоэмболия
Риск ВТЭ повышается у тех, кто принимает эстрогены; те, у кого в настоящее время или в анамнезе есть ВТЭ, подвержены большему риску повторного возникновения ВТЭ при приеме эстрогенов. [30] [33] Прием эстрогенов в течение трех недель после родов может повысить риск развития ВТЭ. [34] Риск развития первичной ВТЭ также повышается при наличии семейного анамнеза, генетических мутаций: фактора V Лейдена и протромбина-G20210A , а также беременности и послеродового периода при приеме эстрогенов. [35]
Кормление грудью
Использование эстрогенов может повлиять на способность кормить грудью и может изменить состав грудного молока. Эстрогены использовались для подавления лактации, что может привести к сокращению общей продолжительности лактации и уменьшению объема или невозможности выработки грудного молока. Состав вырабатываемого грудного молока также был замечен другим, что привело к снижению концентрации белков в молоке. Было замечено, что дети матерей, принимавших эстрогены во время кормления грудью, испытывали более медленный набор веса. [34]
Побочные эффекты
Общий
Некоторые распространенные побочные эффекты, наблюдаемые при использовании эстрогенов, включают: набухание груди, болезненность груди, зуд влагалища, аномальное маточное кровотечение, увеличение веса, выпадение волос, желтуху и анафилаксию . [36]
Неблагоприятный эффект
Некоторые побочные эффекты, наблюдаемые при использовании эстрогенов, включают: повышенный риск венозной тромбоэмболии (ВТЭ), инсульта, рака молочной железы, гипертонии и вагинита . [36] [29]
История
Эстрон был первым открытым стероидным гормоном . [37] [38] Он был открыт в 1929 году независимо американскими учеными Эдвардом Дойзи и Эдгаром Алленом и немецким биохимиком Адольфом Бутенандтом , хотя Дойзи и Аллен выделили его на два месяца раньше Бутенандта. [37] [39] [40] Они выделили и очистили эстрон в кристаллической форме из мочи беременных женщин. [39] [40] [41] Дойзи и Аллен назвали его телином , в то время как Бутенандт назвал его прогиноном и впоследствии назвал его фолликулином в своей второй публикации об этом веществе. [40] [42] Позднее Бутенандт был удостоен Нобелевской премии в 1939 году за выделение эстрона и его работу по половым гормонам в целом. [41] [43] Молекулярная формула эстрона была известна к 1931 году, [44] а его химическая структура была определена Бутенандтом к 1932 году. [40] [39] После выяснения его структуры эстрон стали дополнительно называть кетогидроксиэстрином или оксогидроксиэстрином , [45] [46] а название эстрон , на основе его кетоновой группы C17, было официально установлено в 1932 году на первом заседании Международной конференции по стандартизации половых гормонов в Лондоне. [47] [48]
Частичный синтез эстрона из эргостерола был осуществлен Расселом Эрлом Маркером в 1936 году и стал первым химическим синтезом эстрона. [49] [50] Альтернативный частичный синтез эстрона из холестерина с помощью дегидроэпиандростерона (ДГЭА) был разработан Гансом Херлоффом Инхоффеном и Вальтером Хольвегом в 1939 или 1940 году, [49] а полный синтез эстрона был осуществлен Аннером и Мишером в 1948 году. [48]
Одобрение
FDA одобрило эстрон на основании его безопасности и эффективности в соответствии с правилами, изложенными в разделе 505 Федерального закона о пищевых продуктах, лекарственных средствах и косметических средствах. [25]
Ссылки
- ^ abcdefghijklmnopqrstu v Kuhl H (август 2005 г.). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения». Climacteric . 8 (Suppl 1): 3– 63. doi :10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ ab Hornstein T, Schwerin JL (1 января 2012 г.). Биология женщин. Cengage Learning. стр. 369–. ISBN 978-1-285-40102-7.
- ^ ab van Keep PA, Utian WH, Vermeulen A (6 декабря 2012 г.). Спорный климакс: доклады модераторов семинара, представленные на Третьем международном конгрессе по менопаузе, состоявшемся в Остенде, Бельгия, в июне 1981 г. под эгидой Международного общества по менопаузе. Springer Science & Business Media. стр. 92. ISBN 978-94-011-7253-0.
- ^ Червенак Дж. (октябрь 2009 г.). «Биоидентичные гормоны для зрелых женщин». Матуритас . 64 (2): 86–89 . doi : 10.1016/j.maturitas.2009.08.002 . ПМИД 19766414.
- ^ abc Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P и др. (май 2006 г.). «Оценка селективности лиганда с использованием репортерных клеточных линий, стабильно экспрессирующих эстрогеновый рецептор альфа или бета». Биохимическая фармакология . 71 (10): 1459– 1469. doi :10.1016/j.bcp.2006.02.002. PMID 16554039.
- ^ Ruggiero RJ, Likis FE (2002). «Эстроген: физиология, фармакология и формулы для заместительной терапии». Журнал акушерства и женского здоровья . 47 (3): 130– 138. doi :10.1016/s1526-9523(02)00233-7. PMID 12071379.
- ^ Labhart A (6 декабря 2012 г.). Клиническая эндокринология: теория и практика. Springer Science & Business Media. стр. 548–. ISBN 978-3-642-96158-8.
- ^ Фишман Дж., Мартуччи КП. (1980). «Новые концепции эстрогенной активности: роль метаболитов в выражении действия гормонов». В Pasetto N, Paoletti R, Ambrus JL (ред.). Менопауза и постменопауза . Springer. стр. 43–52 . doi :10.1007/978-94-011-7230-1_5. ISBN 978-94-011-7232-5.
- ^ Prossnitz ER, Arterburn JB (июль 2015 г.). «Международный союз базовой и клинической фармакологии. XCVII. G-белок-связанный эстрогеновый рецептор и его фармакологические модуляторы». Pharmacological Reviews . 67 (3): 505– 540. doi :10.1124/pr.114.009712. PMC 4485017 . PMID 26023144.
- ^ abcd Selby P, McGarrigle HH, Peacock M (март 1989). "Сравнение эффектов перорального и трансдермального введения эстрадиола на метаболизм эстрогена, синтез белка, высвобождение гонадотропина, метаболизм костной ткани и климактерические симптомы у женщин в постменопаузе". Клиническая эндокринология . 30 (3): 241– 249. doi :10.1111/j.1365-2265.1989.tb02232.x. PMID 2512035. S2CID 26077537.
- ^ abcd Powers MS, Schenkel L, Darley PE, Good WR, Balestra JC, Place VA (август 1985 г.). «Фармакокинетика и фармакодинамика трансдермальных лекарственных форм 17 бета-эстрадиола: сравнение с обычными пероральными эстрогенами, используемыми для заместительной гормональной терапии». American Journal of Obstetrics and Gynecology . 152 (8): 1099– 1106. doi :10.1016/0002-9378(85)90569-1. PMID 2992279.
- ^ abc Fåhraeus L, Larsson-Cohn U (декабрь 1982 г.). «Эстрогены, гонадотропины и SHBG во время перорального и кожного введения эстрадиола-17 бета женщинам в менопаузе». Acta Endocrinologica . 101 (4): 592– 596. doi :10.1530/acta.0.1010592. PMID 6818806.
- ^ Wright JV (декабрь 2005 г.). «Биоидентичная замена стероидных гормонов: избранные наблюдения за 23 года клинической и лабораторной практики». Annals of the New York Academy of Sciences . 1057 (1): 506– 524. Bibcode : 2005NYASA1057..506W. doi : 10.1196/annals.1356.039. PMID 16399916. S2CID 38877163.
- ^ Friel PN, Hinchcliffe C, Wright JV (март 2005 г.). «Замещение гормонов эстрадиолом: обычные пероральные дозы приводят к чрезмерному воздействию эстрона». Alternative Medicine Review . 10 (1): 36–41 . PMID 15771561.
- ^ De Lignieres B, Basdevant A, Thomas G, Thalabard JC, Mercier-Bodard C, Conard J, et al. (март 1986). «Биологические эффекты эстрадиола-17 бета у женщин в постменопаузе: пероральное и чрескожное введение». Журнал клинической эндокринологии и метаболизма . 62 (3): 536– 541. doi :10.1210/jcem-62-3-536. PMID 3080464.
- ^ Kloosterboer HJ, Schoonen WG, Verheul HA (11 апреля 2008 г.). «Пролиферация клеток молочной железы под действием стероидных гормонов и их метаболитов». В Pasqualini JR (ред.). Рак молочной железы: прогноз, лечение и профилактика . CRC Press. стр. 343–366 . ISBN 978-1-4200-5873-4.
- ^ Sasson S, Notides AC (июль 1983). «Взаимодействие эстриола и эстрона с рецептором эстрогена. II. Ингибирование кооперативного связывания [3H]эстрадиола с рецептором эстрогена, вызванное эстриолом и эстроном». Журнал биологической химии . 258 (13): 8118– 8122. doi : 10.1016/S0021-9258(20)82036-5 . PMID 6863280.
- ^ Лундстрем Э., Коннер П., Нэссен С., Лёфгрен Л., Карлстрем К., Седерквист Г. (2015). «Эстрон - частичный антагонист эстрадиола в нормальной молочной железе». Гинекологическая эндокринология . 31 (9): 747–749 . doi : 10.3109/09513590.2015.1062866. PMID 26190536. S2CID 13617050.
- ^ Häggström M, Richfield D (2014). «Схема путей стероидогенеза человека». WikiJournal of Medicine . 1 (1). doi : 10.15347/wjm/2014.005 . ISSN 2002-4436.
- ^ Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние различных путей введения» (PDF) . Climacteric . 8 (Suppl 1): 3– 63. doi :10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Jameson JL, De Groot LJ (18 мая 2010 г.). Эндокринология – Электронная книга: Взрослые и дети. Elsevier Health Sciences. стр. 2813–. ISBN 978-1-4557-1126-0.
- ^ Бухсбаум HJ (6 декабря 2012 г.). Менопауза. Springer Science & Business Media. стр. 62, 64. ISBN. 978-1-4612-5525-3.
- ^ abc Дорфман Р.И. (1961). «Метаболизм стероидных гормонов». Радиоактивные изотопы в физиологической диагностике и терапии / Künstliche Radioaktive Isotope in Physiologie Diagnostik und Therapie . Спрингер. стр. 1223–1241 . doi : 10.1007/978-3-642-49761-2_39. ISBN 978-3-642-49477-2.
- ^ Sandberg AA, Slaunwhite WR (август 1957 г.). «Исследования фенольных стероидов у людей. II. Метаболическая судьба и гепатобилиарно-энтеральная циркуляция C14-эстрона и C14-эстрадиола у женщин». Журнал клинических исследований . 36 (8): 1266– 1278. doi :10.1172/JCI103524. PMC 1072719. PMID 13463090 .
- ^ abcd "Эстроген". PubChem . Национальная медицинская библиотека США.
- ^ ab "Паспорт безопасности материала Эстрон" (PDF) . ScienceLab.com . Получено 21 февраля 2013 г. .
- ^ "Estrone -PubChem". Национальный центр биотехнологической информации . Получено 6 сентября 2009 г.
- ^ «Лекарства@FDA: Лекарственные препараты, одобренные FDA».
- ^ ab Cusi K, Isaacs S, Barb D, Basu R, Caprio S, Garvey WT и др. (май 2022 г.). «Американская ассоциация клинической эндокринологии. Руководство по клинической практике для диагностики и лечения неалкогольной жировой болезни печени в первичной медицинской помощи и эндокринологических клинических учреждениях: совместно спонсируется Американской ассоциацией по изучению заболеваний печени (AASLD)». Endocrine Practice . 28 (5): 528–562 . doi : 10.1016/j.eprac.2022.03.010 . PMID 35569886.
- ^ ab Crandall CJ, Hovey KM, Andrews CA, Chlebowski RT, Stefanick ML, Lane DS и др. (январь 2018 г.). «Рак молочной железы, рак эндометрия и сердечно-сосудистые события у участниц, использовавших вагинальный эстроген в наблюдательном исследовании Women's Health Initiative». Менопауза . 25 (1): 11– 20. doi :10.1097/GME.00000000000000956. PMC 5734988. PMID 28816933 .
- ^ Консультативная группа по заявлению о позиции гормональной терапии NAMS 2017 (июль 2017 г.). «Заявление о позиции гормональной терапии 2017 г. Североамериканского общества по менопаузе». Менопауза . 24 (7): 728– 753. doi :10.1097/GME.00000000000000921. PMID 28650869.
{{cite journal}}:|author1=имеет общее название ( помощь )CS1 maint: числовые имена: список авторов ( ссылка ) - ^ García-Sánchez J, Mafla-España MA, Tejedor-Cabrera C, Avellán-Castillo O, Torregrosa MD, Cauli O (март 2022 г.). «Индекс активности ароматазы плазмы, гонадотропины и эстрон связаны с синдромом слабости у женщин в постменопаузе с раком молочной железы». Current Oncology . 29 (3): 1744–1760 . doi : 10.3390/curroncol29030144 . PMC 8947022. PMID 35323344 .
- ^ «Различные виды оральных контрацептивов при синдроме поликистозных яичников: систематический обзор и метаанализ». academic.oup.com . Получено 31 июля 2023 г. .
- ^ ab "Контрацептивы, оральные, комбинированные", База данных лекарств и лактации (LactMed®) , Бетесда (Мэриленд): Национальный институт здоровья детей и развития человека, 2006, PMID 30000354 , получено 31 июля 2023 г.
- ^ van Vlijmen EF, Veeger NJ, Middeldorp S, Hamulyák K, Prins MH, Büller HR, Meijer K (август 2011 г.). «Тромботический риск во время использования оральных контрацептивов и беременности у женщин с мутацией фактора V Лейдена или протромбина: рациональный подход к контрацепции». Blood . 118 (8): 2055– 61, quiz 2375. doi : 10.1182/blood-2011-03-345678 . PMID 21659542.
- ^ ab Delgado BJ, Lopez-Ojeda W (2023). "Эстроген". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30855848. Получено 31 июля 2023 г.
- ^ ab Bullough VL (19 мая 1995 г.). Наука в спальне: история исследований секса. Basic Books. стр. 128–. ISBN 978-0-465-07259-0.
Когда Аллен и Дойзи услышали о [тесте Ашейма-Зондека для диагностики беременности], они поняли, что в моче есть богатый и легкодоступный источник гормонов, из которого они могли бы разработать мощный экстракт. [...] Исследование Аллена и Дойзи спонсировалось комитетом, в то время как исследование их главного конкурента, Адольфа Бутенандта (р. 1903) из Геттингенского университета, спонсировалось немецкой фармацевтической фирмой. В 1929 году оба термина объявили о выделении чистого кристаллического женского полового гормона, эстрона, в 1929 году, хотя Дойзи и Аллен сделали это на два месяца раньше Бутенандта.27 К 1931 году эстрон производился в коммерческих целях компанией Parke Davis в этой стране и компанией Schering-Kahlbaum в Германии. Интересно, что когда Бутенандт (который разделил Нобелевскую премию по химии в 1939 году) выделил эстрон и проанализировал его структуру, он обнаружил, что это стероид — первый гормон, отнесенный к этому молекулярному семейству.
[ постоянная мертвая ссылка ] - ↑ Нильш Ю, Фурманн Ю, Ярох С (30 марта 2016 г.). Новые подходы к открытию лекарств. Спрингер. стр. 7–. ISBN 978-3-319-28914-4.
Первый стероидный гормон был выделен из мочи беременных женщин Адольфом Бутенандтом в 1929 году (эстрон; см. рис. 1) (Бутенандт, 1931).
- ^ abc Parl FF (2000). Эстрогены, рецепторы эстрогена и рак молочной железы. IOS Press. С. 4– 5. ISBN 978-0-9673355-4-4.
[Дойзи] сосредоточил свои исследования на выделении женских половых гормонов из сотен галлонов мочи беременных женщин, основываясь на открытии Ашейма и Зондека в 1927 году, что моча беременных женщин обладает эстрогенной активностью [9]. Летом 1929 года Дойзи преуспел в выделении эстрона (названного им телином), одновременно с Адольфом Бутенандтом из Геттингенского университета в Германии, но независимо от него. Дойзи представил свои результаты по кристаллизации эстрона на XIII Международном физиологическом конгрессе в Бостоне в августе 1929 года [10].
- ^ abcd Лейлин Дж. К. (30 октября 1993 г.). Лауреаты Нобелевской премии по химии 1901–1992 гг. Фонд химического наследия. стр. 255–. ISBN 978-0-8412-2690-6.
Адольф Фридрих Иоганн Бутенандт был удостоен Нобелевской премии по химии в 1939 году «за работу над половыми гормонами»; [...] В 1929 году Бутенандт выделил эстрон [...] в чистой кристаллической форме. [...] Бутенандт и Эдвард Дойзи выделили эстрон одновременно, но независимо в 1929 году. [...] Бутенандт сделал большой шаг вперед в истории биохимии, когда выделил эстрон из мочи беременных женщин. [...] В своей первой публикации он назвал его «прогиноном», а затем «фолликулином», [...] К 1932 году [...] он смог определить его химическую структуру, [...]
- ^ ab Greenberg A (14 мая 2014 г.). Химия: десятилетие за десятилетием. Infobase Publishing. стр. 127–. ISBN 978-1-4381-0978-7.
Рациональные химические исследования человеческих половых гормонов начались в 1929 году, когда Адольф Бутенандт выделил из мочи беременных женщин чистый кристаллический эстрон, фолликулярный гормон. [...] Бутенандт и Ружичка разделили Нобелевскую премию по химии 1939 года.
- ^ Labhart A (6 декабря 2012 г.). Клиническая эндокринология: теория и практика. Springer Science & Business Media. стр. 511–. ISBN 978-3-642-96158-8.
EA Doisy и A. Butenandt сообщили почти в одно и то же время о выделении эстроген-активного вещества в кристаллической форме из мочи беременных женщин. NK Adam предложил назвать это вещество эстроном из-за присутствующей в нем группы кетона C-17 (1933).
- ^ Rooke T (1 января 2012 г.). Поиски кортизона. MSU Press. стр. 54–. ISBN 978-1-60917-326-5.
В 1929 году Дойзи выделил и очистил первый эстроген, стероид под названием «эстрон»; позже за эту работу он получил Нобелевскую премию.
- ^ Loriaux DL (23 февраля 2016 г.). «Рассел Эрл Маркер (1902–1995) — Мексиканский ямс». Биографическая история эндокринологии . Wiley. стр. 345–. ISBN 978-1-119-20247-9.
- ^ Кэмпбелл AD (1933). «О плацентарных гормонах и нарушениях менструального цикла». Annals of Internal Medicine . 7 (3): 330. doi :10.7326/0003-4819-7-3-330. ISSN 0003-4819.
- ^ Fluhmann CF (ноябрь 1938 г.). «Эстрогенные гормоны: их клиническое использование». California and Western Medicine . 49 (5): 362–366 . PMC 1659459. PMID 18744783 .
- ^ Фриц МА, Сперофф Л (28 марта 2012 г.). Клиническая гинекологическая эндокринология и бесплодие. Lippincott Williams & Wilkins. стр. 750–. ISBN 978-1-4511-4847-3.
В 1926 году сэр Алан С. Паркс и К. В. Беллерби ввели базовое слово «эстрин» для обозначения гормона или гормонов, которые вызывают эструс у животных, время, когда самки млекопитающих фертильны и восприимчивы к самцам. [...] Терминология была расширена и включила основные эстрогены у людей, эстрон, эстрадиол и эстриол, в 1932 году на первом заседании Международной конференции по стандартизации половых гормонов в Лондоне, [...]
- ^ ab Oettel M, Schillinger E (6 декабря 2012 г.). Эстрогены и антиэстрогены I: Физиология и механизмы действия эстрогенов и антиэстрогенов. Springer Science & Business Media. стр. 2–. ISBN 978-3-642-58616-3.
Структура эстрогенных гормонов была установлена Бутенандтом, Тайером, Маррианом и Хейзлвудом в 1930 и 1931 годах (см. Бутенандт, 1980). После предложения группы Марриана эстрогенным гормонам были даны тривиальные названия эстрадиол, эстрон и эстриол. На первом заседании Международной конференции по стандартизации половых гормонов в Лондоне (1932) был установлен стандартный препарат эстрона. [...] Частичный синтез эстрадиола и эстрона из холестерина и дегидроэпиандростерона был осуществлен Инхоффеном и Хоулегом (Берлин, 1940); полный синтез был осуществлен Аннером и Мишером (Базель, 1948).
- ^ ab Watkins ES (6 марта 2007 г.). «Начало». Эстрогенный эликсир: история заместительной гормональной терапии в Америке . JHU Press. стр. 21–. ISBN 978-0-8018-8602-7.
- ^ Pincus G, Thimann KV (2 декабря 2012 г.). Гормоны V1: физиология, химия и применение. Elsevier. стр. 360–. ISBN 978-0-323-14206-9.



