Марганец
Марганец — химический элемент ; он имеет символ Mn и атомный номер 25. Это твердый, хрупкий, серебристый металл, часто встречающийся в минералах в сочетании с железом . Марганец был впервые выделен в 1770-х годах. Это переходный металл с многогранным набором промышленных применений в сплавах , особенно в нержавеющих сталях . Он улучшает прочность, обрабатываемость и износостойкость. Оксид марганца используется в качестве окислителя; как добавка к резине; а также в производстве стекла, удобрений и керамики. Сульфат марганца может использоваться в качестве фунгицида.
Марганец также является важным элементом питания человека, важным для метаболизма макронутриентов, формирования костей и систем защиты от свободных радикалов . Он является критическим компонентом десятков белков и ферментов. [8] Он находится в основном в костях, но также в печени, почках и мозге. [9] В мозге человека марганец связан с металлопротеинами марганца , в частности с глутаминсинтетазой в астроцитах .
Он знаком в лаборатории в виде темно-фиолетовой соли перманганата калия . Он встречается в активных центрах некоторых ферментов . [10] Особый интерес представляет использование кластера Mn-O , комплекса, выделяющего кислород , в производстве кислорода растениями.
Характеристики
Физические свойства
Марганец — серебристо-серый металл , напоминающий железо. Он твердый и очень хрупкий, трудно плавится, но легко окисляется. [11] Марганец и его обычные ионы парамагнитны . [12] Марганец медленно тускнеет на воздухе и окисляется («ржавеет»), как железо, в воде, содержащей растворенный кислород. [13]
Изотопы
Встречающийся в природе марганец состоит из одного стабильного изотопа , 55 Mn. Было выделено и описано несколько радиоизотопов с атомным весом от 46 u ( 46 Mn) до 72 u ( 72 Mn). Наиболее стабильными являются 53 Mn с периодом полураспада 3,7 миллиона лет, 54 Mn с периодом полураспада 312,2 дня и 52 Mn с периодом полураспада 5,591 дня. Все остальные радиоактивные изотопы имеют период полураспада менее трех часов, а большинство — менее одной минуты. Первичный режим распада в изотопах, более легких, чем наиболее распространенный стабильный изотоп, 55 Mn, — это захват электронов , а первичный режим в более тяжелых изотопах — бета-распад . [14] Марганец также имеет три метасостояния . [14]
Марганец является частью группы элементов железа , которые, как полагают, синтезируются в крупных звездах незадолго до взрыва сверхновой . [15] 53 Mn распадается до 53 Cr с периодом полураспада 3,7 миллиона лет. Из-за своего относительно короткого периода полураспада 53 Mn встречается относительно редко, образуясь при воздействии космических лучей на железо . [16] Изотопное содержание марганца обычно сочетается с изотопным содержанием хрома и находит применение в изотопной геологии и радиометрическом датировании . Изотопные отношения Mn–Cr подкрепляют доказательства, полученные из 26 Al и 107 Pd для ранней истории Солнечной системы . Изменения в отношениях 53 Cr/ 52 Cr и Mn/Cr из нескольких метеоритов предполагают начальное отношение 53 Mn/ 55 Mn, что указывает на то, что изотопный состав Mn–Cr должен быть результатом распада 53 Mn in situ в дифференцированных планетарных телах. Таким образом, 53 Mn предоставляет дополнительные доказательства нуклеосинтетических процессов непосредственно перед слиянием Солнечной системы. [17]
Аллотропы
 | 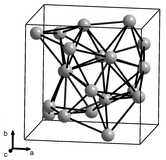 |
Альфа-марганец (α-Mn) является равновесной фазой при комнатной температуре. Он имеет объемно-центрированную кубическую решетку и необычен среди элементарных металлов тем, что имеет очень сложную элементарную ячейку с 58 атомами на ячейку (29 атомов на примитивную элементарную ячейку) в четырех различных типах позиций. [21] [18] Он парамагнитен при комнатной температуре и антиферромагнитен при температурах ниже 95 К (−178 °C). [22]

Бета-марганец (β-Mn) образуется при нагревании выше температуры перехода 973 К (700 °C; 1290 °F). Он имеет примитивную кубическую структуру с 20 атомами на элементарную ячейку в двух типах узлов, которая является такой же сложной, как и структура любого другого элементарного металла. [23] Его легко получить как метастабильную фазу при комнатной температуре путем быстрого охлаждения. Он не показывает магнитного упорядочения , оставаясь парамагнитным вплоть до самой низкой измеренной температуры (1,1 К). [23] [24] [25]
Гамма-марганец (γ-Mn) образуется при нагревании выше 1370 К (1100 °C; 2010 °F). Он имеет простую гранецентрированную кубическую структуру (четыре атома на элементарную ячейку). При закалке до комнатной температуры он превращается в β-Mn, но его можно стабилизировать при комнатной температуре, легируя его по крайней мере 5 процентами других элементов (таких как C, Fe, Ni, Cu, Pd или Au), и эти стабилизированные растворенным веществом сплавы деформируются в гранецентрированную тетрагональную структуру. [26] [25]
Дельта-марганец (δ-Mn) образуется при нагревании выше 1406 К (1130 °C; 2070 °F) и стабилен до точки плавления марганца 1519 К (1250 °C; 2270 °F). Имеет объемно-центрированную кубическую структуру (два атома на кубическую элементарную ячейку). [19] [25]
Химические соединения

Обычные степени окисления марганца — +2, +3, +4, +6 и +7, хотя наблюдались все степени окисления от −3 до +7. Марганец в степени окисления +7 представлен солями интенсивно-фиолетового перманганат-аниона MnO−4. Перманганат калия является широко используемым лабораторным реагентом из-за его окислительных свойств; он используется как местное лекарство (например, при лечении болезней рыб). Растворы перманганата калия были одними из первых красителей и фиксаторов, которые использовались при подготовке биологических клеток и тканей для электронной микроскопии. [28]
Помимо различных перманганатных солей, Mn(VII) представлен нестабильным, летучим производным Mn 2 O 7 . Оксигалогениды (MnO 3 F и MnO 3 Cl) являются мощными окислителями . [11] Наиболее ярким примером Mn в степени окисления +6 является зеленый анион манганата , [MnO 4 ] 2− . Соли манганата являются промежуточными продуктами при извлечении марганца из его руд. Соединения со степенью окисления +5 несколько неуловимы и часто встречаются в сочетании с оксидным (O 2− ) или нитридным (N 3− ) лигандом. [29] Одним из примеров является синий анион гипоманганата [MnO 4 ] 3− . [30]
Mn(IV) несколько загадочен, поскольку он распространен в природе, но гораздо реже встречается в синтетической химии. Наиболее распространенная руда Mn, пиролюзит , - это MnO 2 . Это темно-коричневый пигмент многих пещерных рисунков [31], но он также является распространенным ингредиентом в сухих батареях. [32] Комплексы Mn(IV) хорошо известны, но для них требуются сложные лиганды . Комплексы Mn(IV)-OH являются промежуточным продуктом в некоторых ферментах , включая центр выделения кислорода (OEC) в растениях. [33]
Простые производные Mn 3+ встречаются редко, но могут быть стабилизированы подходящими основными лигандами. Ацетат марганца(III) является окислителем, полезным в органическом синтезе . Твердые соединения марганца(III) характеризуются своим сильным пурпурно-красным цветом и предпочтением искаженной октаэдрической координации, возникающей в результате эффекта Яна-Теллера . [34]

Особенно распространенной степенью окисления для марганца в водном растворе является +2, что имеет бледно-розовый цвет. Известно много соединений марганца(II), таких как аквакомплексы, полученные из сульфата марганца(II) (MnSO4 ) и хлорида марганца(II) (MnCl2 ) . Эта степень окисления также наблюдается в минерале родохрозите ( карбонате марганца(II) ). Марганец(II) обычно существует с высоким спином, S = 5/2 основного состояния из-за высокой энергии спаривания для марганца(II). В марганце(II) нет разрешенных по спину d–d переходов, что объясняет его слабый цвет. [35]
| Степени окисления марганца [36] | |
|---|---|
| −3 | Мn(CO)(NO) 3 |
| −2 | [Mn( 1,5-COD ) 2 ] 2− |
| −1 | HMn(CO) 5 |
| 0 | Мн 2(Колорадо) 10 |
| +1 | МнК 5ЧАС 4Ч. 3(Колорадо) 3 |
| +2 | MnCl 2, МнКО 3, МnО |
| +3 | МнФ 3, Мn(ОАс) 3, Мн 2О 3 |
| +4 | МнО 2 |
| +5 | К 3МнО 4 |
| +6 | К 2МнО 4 |
| +7 | КМnО 4, Мн 2О 7 |
| Обычные степени окисления выделены жирным шрифтом. | |
Марганцевоорганические соединения
Марганец образует большое разнообразие металлоорганических производных, т. е. соединений со связями Mn-C. Металлоорганические производные включают многочисленные примеры Mn в его более низких степенях окисления, т. е. Mn(−III) вплоть до Mn(I). Эта область металлоорганической химии привлекательна, поскольку Mn недорог и относительно малотоксичен. [37]
Наибольший коммерческий интерес представляет "MMT", метилциклопентадиенил марганец трикарбонил , который используется в качестве антидетонационного соединения, добавляемого в бензин (бензин) в некоторых странах. Он содержит Mn(I). В соответствии с другими аспектами химии Mn(II), манганоцен ( Mn(C 5 H 5 ) 2 ) является высокоспиновым. Напротив, его соседний металл железо образует устойчивое на воздухе низкоспиновое производное в форме ферроцена ( Fe(C 5 H 5 ) 2 ). При проведении в атмосфере оксида углерода восстановление солей Mn(II) дает димарганец декакарбонил Mn 2 (CO) 10 , оранжевое и летучее твердое вещество. Устойчивость этого соединения Mn(0) на воздухе (и его многочисленных производных) отражает мощные электронно-акцепторные свойства оксида углерода. Многие алкеновые и алкиновые комплексы получены из Mn 2 (CO) 10 . [ необходима цитата ]
В Mn(CH 3 ) 2 (dmpe) 2 , Mn(II) имеет низкий спин, что контрастирует с высокоспиновым характером его предшественника, MnBr 2 (dmpe) 2 ( dmpe = (CH 3 ) 2 PCH 2 CH 2 P(CH 3 ) 2 ). [38] Полиалкильные и полиарильные производные марганца часто существуют в более высоких степенях окисления, отражая электроноотделяющие свойства алкильных и арильных лигандов. Одним из примеров является [Mn(CH 3 ) 6 ] 2− . [ необходима цитата ]
История
Происхождение названия марганец является сложным. В древние времена два черных минерала были идентифицированы из регионов Магнетес ( либо Магнезия , расположенная в современной Греции, либо Магнезия ад Сипилум , расположенная в современной Турции). [39] Оба они назывались магнес по месту своего происхождения, но считались разными по полу. Мужской магнес притягивал железо и был железной рудой, теперь известной как магнитный железняк или магнетит , и который, вероятно, дал нам термин магнит . Женская магнесовая руда не притягивала железо, но использовалась для обесцвечивания стекла. Этот женский магнес позже был назван магнезией , известной сейчас в наше время как пиролюзит или диоксид марганца . [40] Ни этот минерал, ни элементарный марганец не являются магнитными. В XVI веке диоксид марганца был назван стеклодувами manganesum (обратите внимание на две буквы N вместо одной), возможно, как искажение и соединение двух слов, поскольку алхимикам и стеклодувам в конечном итоге пришлось различать magnesia nigra (черную руду) от magnesia alba (белую руду, также из Magnesia, также используемую в стекольном производстве). Микеле Меркати назвал magnesia nigra manganesa , и, наконец, металл, выделенный из него, стал известен как марганец ( нем . Mangan ). Название magnesia в конечном итоге затем использовалось для обозначения только белой magnesia alba (оксид магния), что дало название магнию для свободного элемента, когда он был выделен гораздо позже. [41]

Диоксид марганца, который широко распространен в природе, издавна использовался в качестве пигмента. Пещерные рисунки в Гаргасе , которым от 30 000 до 24 000 лет, сделаны из минеральной формы пигментов MnO 2. [43]
Соединения марганца использовались египетскими и римскими стеклодувами для придания или удаления цвета со стекла. [44] Использование в качестве «мыла для стеклодувов» продолжалось в Средние века до наших дней и очевидно на примере стекла XIV века из Венеции . [45]

Поскольку он использовался в производстве стекла, диоксид марганца был доступен для экспериментов алхимиков, первых химиков. Игнатий Готфрид Кайм (1770) и Иоганн Глаубер (17 век) обнаружили, что диоксид марганца можно преобразовать в перманганат , полезный лабораторный реагент. [46] Кайм также мог восстановить диоксид марганца, чтобы изолировать металл, но это неизвестно. [47] К середине 18 века шведский химик Карл Вильгельм Шееле использовал диоксид марганца для получения хлора . Сначала соляная кислота или смесь разбавленной серной кислоты и хлорида натрия была сделана для реакции с диоксидом марганца, а позже была использована соляная кислота из процесса Леблана , а диоксид марганца был переработан процессом Уэлдона . Производство отбеливающих агентов хлора и гипохлорита было крупным потребителем марганцевых руд. [ необходима цитата ]
Шееле и другие знали, что пиролюзит (минеральная форма диоксида марганца) содержит новый элемент. Иоганн Готлиб Ган выделил неочищенный образец металлического марганца в 1774 году, что он сделал, восстановив диоксид углеродом . [48]
Содержание марганца в некоторых железных рудах, используемых в Греции, привело к предположениям, что сталь, произведенная из этой руды, содержит дополнительный марганец, что делает спартанскую сталь исключительно твердой. [49] Примерно в начале 19-го века марганец использовался в сталеплавильном производстве, и было выдано несколько патентов. В 1816 году было документально подтверждено, что железо, легированное марганцем, было тверже, но не более хрупким. В 1837 году британский академик Джеймс Купер отметил связь между сильным воздействием марганца на шахтеров и формой болезни Паркинсона . [50] В 1912 году были выданы патенты США на защиту огнестрельного оружия от ржавчины и коррозии с помощью электрохимических конверсионных покрытий из фосфата марганца, и с тех пор этот процесс широко используется. [51]
Изобретение элемента Лекланше в 1866 году и последующее усовершенствование батарей, содержащих диоксид марганца в качестве катодного деполяризатора, увеличило спрос на диоксид марганца. До разработки батарей с никель-кадмием и литием большинство батарей содержали марганец. Цинк-угольная батарея и щелочная батарея обычно используют промышленно производимый диоксид марганца, поскольку природный диоксид марганца содержит примеси. В 20 веке диоксид марганца широко использовался в качестве катода для коммерческих одноразовых сухих батарей как стандартного (цинк-угольного), так и щелочного типов. [52]
Марганец необходим для производства железа и стали благодаря своим серофиксирующим , раскисляющим и легирующим свойствам. [53] Это применение было впервые обнаружено британским металлургом Робертом Форестером Мюшетом (1811–1891), который в 1856 году ввел этот элемент в обиход под названием Spiegeleisen .
Происшествие
Марганец составляет около 1000 частей на миллион (0,1%) земной коры и является 12-м наиболее распространенным элементом . [9] Почва содержит 7–9000 частей на миллион марганца, в среднем 440 частей на миллион. [9] Атмосфера содержит 0,01 мкг/м 3 . [9] Марганец встречается в основном в виде пиролюзита ( MnO 2 ), браунита (Mn 2+ Mn 3+ 6 )SiO 12 ), [54] псиломелана (Ba,H 2 O) 2 Mn 5 O 10 и в меньшей степени в виде родохрозита ( MnCO 3 ).
 |  |  |  |  |
| Марганцевая руда | Псиломелан (марганцевая руда) | Spiegeleisen — это сплав железа с содержанием марганца около 15%. | Дендриты оксида марганца на известняке из Зольнхофена , Германия – разновидность псевдоископаемого . Масштаб в мм. | Минерал родохрозит ( карбонат марганца(II) ) |

Наиболее важной марганцевой рудой является пиролюзит ( MnO2 ). Другие экономически важные марганцевые руды обычно показывают тесную пространственную связь с железными рудами, такими как сфалерит . [11] [55] Наземные ресурсы велики, но распределены неравномерно. Около 80% известных мировых ресурсов марганца находятся в Южной Африке; другие важные месторождения марганца находятся в Украине, Австралии, Индии, Китае, Габоне и Бразилии. [53] Согласно оценке 1978 года, на дне океана находится 500 миллиардов тонн марганцевых конкреций . [56] Попытки найти экономически выгодные методы добычи марганцевых конкреций были прекращены в 1970-х годах. [57]
В Южной Африке большинство выявленных месторождений находятся около Хотазеля в провинции Северный Кейп (марганцевые месторождения Калахари), с оценкой 2011 года в 15 миллиардов тонн. В 2011 году Южная Африка добыла 3,4 миллиона тонн, превзойдя все другие страны. [58]
Марганец в основном добывают в Южной Африке, Австралии, Китае, Габоне, Бразилии, Индии, Казахстане, Гане, Украине и Малайзии. [59]
Производство
Для производства ферромарганца марганцевую руду смешивают с железной рудой и углеродом, а затем восстанавливают либо в доменной печи, либо в электродуговой печи . [60] Полученный ферромарганец имеет содержание марганца 30–80%. [11] Чистый марганец, используемый для производства сплавов без железа, получают путем выщелачивания марганцевой руды серной кислотой и последующего процесса электролиза . [61]

Более прогрессивный процесс извлечения включает прямое восстановление (низкосортной) марганцевой руды путем кучного выщелачивания . Это делается путем просачивания природного газа через дно кучи; природный газ обеспечивает тепло (должно быть не менее 850 °C) и восстановитель (оксид углерода). Это восстанавливает всю марганцевую руду до оксида марганца (MnO), который является выщелачиваемой формой. Затем руда проходит через цикл измельчения для уменьшения размера частиц руды до 150-250 мкм, увеличивая площадь поверхности для облегчения выщелачивания. Затем руду добавляют в выщелачивающий бак с серной кислотой и двухвалентным железом (Fe 2+ ) в соотношении 1,6:1. Железо реагирует с диоксидом марганца (MnO 2 ), образуя гидроксид железа (FeO(OH)) и элементарный марганец (Mn). [ необходима цитата ]
Этот процесс дает около 92% восстановления марганца. Для дальнейшей очистки марганец может быть отправлен на электролизную установку. [62]
Океаническая среда
В 1972 году проект ЦРУ « Азориан » через миллиардера Говарда Хьюза заказал судно «Хьюз Гломар Эксплорер» с легендой о сборе марганцевых конкреций со дна моря. [63] Это вызвало всплеск активности по сбору марганцевых конкреций, что на самом деле не было реализовано до 2020-х годов. Настоящей миссией «Хьюз Гломар Эксплорер» было поднять затонувшую советскую подводную лодку К-129 с целью извлечения советских кодовых книг. [64]
Обильный ресурс марганца в форме марганцевых конкреций, обнаруженных на дне океана. [65] Эти конкреции, состоящие на 29% из марганца, [66] расположены вдоль дна океана . Воздействие сбора конкреций на окружающую среду представляет интерес. [67] [68]
Растворенный марганец (dMn) встречается во всех мировых океанах, 90% которого поступает из гидротермальных источников. [69] Частицы Mn развиваются в плавучих шлейфах над активным источником источника, в то время как dMn ведет себя консервативно. [70] Концентрации Mn различаются в разных водных столбах океана. На поверхности dMn повышается из-за поступления из внешних источников, таких как реки, пыль и шельфовые отложения. Прибрежные отложения обычно имеют более низкие концентрации Mn, но могут увеличиваться из-за антропогенных сбросов от таких отраслей, как горнодобывающая промышленность и производство стали, которые попадают в океан из речных стоков. Поверхностные концентрации dMn также могут повышаться биологически посредством фотосинтеза и физически из-за прибрежного подъема глубинных вод и поверхностных течений, вызываемых ветром. Внутренний цикл, такой как фотовосстановление от УФ-излучения, также может повышать уровни, ускоряя растворение оксидов Mn и окислительное очищение, предотвращая погружение Mn в более глубокие воды. [71] Повышенные уровни на средних глубинах могут возникать вблизи срединно-океанических хребтов и гидротермальных источников. Гидротермальные источники высвобождают в воду жидкость, обогащенную dMn. Затем dMn может перемещаться на расстояние до 4000 км из-за присутствующих микробных капсул, предотвращая обмен с частицами и снижая скорость погружения. Концентрации растворенного Mn еще выше, когда уровень кислорода низкий. В целом, концентрации dMn обычно выше в прибрежных районах и уменьшаются при движении в сторону от берега. [71]
Почвы
Марганец встречается в почвах в трех степенях окисления: двухвалентный катион, Mn2 + и в виде коричневато-черных оксидов и гидроксидов, содержащих Mn(III,IV), таких как MnOOH и MnO2 . pH почвы и окислительно-восстановительные условия влияют на то, какая из этих трех форм Mn доминирует в данной почве. При значениях pH менее 6 или в анаэробных условиях доминирует Mn(II), тогда как в более щелочных и аэробных условиях преобладают оксиды и гидроксиды Mn(III,IV). Эти эффекты кислотности почвы и состояния аэрации на форму Mn могут быть изменены или контролироваться микробной активностью. Микробное дыхание может вызывать как окисление Mn2 + до оксидов, так и восстановление оксидов до двухвалентного катиона. [72]
Оксиды Mn(III,IV) существуют в виде коричневато-черных пятен и небольших узелков на частицах песка, ила и глины. Эти поверхностные покрытия на других частицах почвы имеют большую площадь поверхности и несут отрицательный заряд. Заряженные участки могут адсорбировать и удерживать различные катионы, особенно тяжелые металлы (например, Cr3 + , Cu2 + , Zn2 + и Pb2 + ). Кроме того, оксиды могут адсорбировать органические кислоты и другие соединения. Адсорбция металлов и органических соединений затем может привести к их окислению, в то время как оксиды Mn(III,IV) восстанавливаются до Mn2 + (например, Cr3 + до Cr(VI) и бесцветный гидрохинон до полимеров хинонов цвета чая ). [73]
Приложения
Сталь

Марганец необходим для производства железа и стали благодаря своим серофиксирующим , раскисляющим и легирующим свойствам. Марганец не имеет удовлетворительной замены в этих применениях в металлургии. [53] Производство стали , [74] включая его компонент для производства железа, обеспечило большую часть спроса на марганец, в настоящее время в диапазоне от 85% до 90% от общего спроса. [61] Марганец является ключевым компонентом недорогой нержавеющей стали . [75] [76] Часто ферромарганец (обычно около 80% марганца) является промежуточным продуктом в современных процессах.
Небольшие количества марганца улучшают обрабатываемость стали при высоких температурах, образуя тугоплавкий сульфид и предотвращая образование жидкого сульфида железа на границах зерен. Если содержание марганца достигает 4%, то охрупчивание стали становится доминирующей чертой. Охрупчивание уменьшается при более высоких концентрациях марганца и достигает приемлемого уровня при 8%. Сталь, содержащая от 8 до 15% марганца, имеет высокую прочность на разрыв до 863 МПа. [77] [78] Сталь с 12% марганца была открыта в 1882 году Робертом Хэдфилдом и до сих пор известна как сталь Хэдфилда (мангаллой) . Она использовалась для британских военных стальных шлемов , а позже и в армии США. [79]
Алюминиевые сплавы
Марганец используется в производстве сплавов с алюминием. Алюминий с примерно 1,5% марганца имеет повышенную устойчивость к коррозии за счет зерен, которые поглощают примеси, которые могут привести к гальванической коррозии . [80] Коррозионностойкие алюминиевые сплавы 3004 и 3104 (0,8–1,5% марганца) используются для большинства банок для напитков . [81] До 2000 года использовалось более 1,6 миллиона тонн этих сплавов; при 1% марганца это потребляло 16 000 тонн марганца. [ неудачная проверка ] [81]
Аккумуляторы
Оксид марганца (IV) использовался в оригинальном типе сухой батареи в качестве акцептора электронов из цинка и является черноватым материалом в элементах фонарика углеродно-цинкового типа. Диоксид марганца восстанавливается до оксида-гидроксида марганца MnO(OH) во время разрядки, предотвращая образование водорода на аноде батареи. [82]
- MnO2 + H2O + e− → MnO (OH)2 + OH−
Тот же материал также функционирует в новых щелочных батареях (обычно аккумуляторных элементах), которые используют ту же основную реакцию, но другую смесь электролита. В 2002 году для этой цели было использовано более 230 000 тонн диоксида марганца. [52] [82]

Резисторы
Медные сплавы марганца, такие как манганин , обычно встречаются в металлических элементах шунтовых резисторов, используемых для измерения относительно больших величин тока. Эти сплавы имеют очень низкий температурный коэффициент сопротивления и устойчивы к сере. Это делает сплавы особенно полезными в суровых автомобильных и промышленных условиях. [83]
Удобрения и кормовые добавки
Оксид и сульфат марганца являются компонентами удобрений. В 2000 году, по оценкам, 20 000 тонн этих соединений были использованы в удобрениях только в США. Сопоставимое количество соединений Mn также использовалось в кормах для животных. [84]
Ниша
Метилциклопентадиенил марганцевый трикарбонил является добавкой в некоторые виды неэтилированного бензина для повышения октанового числа и снижения стука двигателя . [85]
Оксид марганца (IV) (диоксид марганца, MnO 2 ) используется в качестве реагента в органической химии для окисления бензиловых спиртов (где гидроксильная группа соседствует с ароматическим кольцом ). Диоксид марганца использовался с древних времен для окисления и нейтрализации зеленоватого оттенка стекла от следовых количеств примесей железа. [45] MnO 2 также используется в производстве кислорода и хлора и для сушки черных красок. В некоторых препаратах он является коричневым пигментом для краски и входит в состав натуральной умбры . [86]
Четырехвалентный марганец используется в качестве активатора в люминофорах красного свечения . Хотя известно много соединений, которые демонстрируют люминесценцию , [87] большинство из них не используются в коммерческих целях из-за низкой эффективности или глубокого красного свечения. [88] [89] Однако сообщалось о нескольких активированных фторидах Mn 4+ как о потенциальных люминофорах красного свечения для светодиодов теплого белого света. [90] [91] Но на сегодняшний день только K 2 SiF 6 :Mn 4+ коммерчески доступен для использования в светодиодах теплого белого света . [92]
Металл иногда используется в монетах; до 2000 года единственной монетой США, в которой использовался марганец, был никель «военного времени» с 1942 по 1945 год. [93] Сплав из 75% меди и 25% никеля традиционно использовался для производства никелевых монет. Однако из-за нехватки никеля во время войны его заменили более доступными серебром и марганцем, в результате чего получился сплав из 56% меди, 35% серебра и 9% марганца. С 2000 года долларовые монеты , например, доллар Сакагавеи и президентские монеты в 1 доллар , изготавливаются из латуни, содержащей 7% марганца, с чистым медным сердечником. [94] В обоих случаях с никелем и долларом использование марганца в монете было необходимо для того, чтобы дублировать электромагнитные свойства предыдущей монеты идентичного размера и стоимости в механизмах торговых автоматов. В случае более поздних долларовых монет США сплав марганца предназначался для того, чтобы воспроизвести свойства сплава меди и никеля, использовавшегося в предыдущем долларе Сьюзен Б. Энтони .
Соединения марганца использовались в качестве пигментов и для окрашивания керамики и стекла. Коричневый цвет керамики иногда является результатом соединений марганца. [95] В стекольной промышленности соединения марганца используются для двух эффектов. Марганец (III) реагирует с железом (II), чтобы уменьшить сильный зеленый цвет в стекле, образуя менее окрашенное железо (III) и слегка розовый марганец (II), компенсируя остаточный цвет железа (III). [45] Большие количества марганца используются для производства розового стекла. В 2009 году Мас Субраманиан и его коллеги из Университета штата Орегон обнаружили, что марганец можно объединить с иттрием и индием, чтобы образовать интенсивно синий , нетоксичный, инертный, устойчивый к выцветанию пигмент , YInMn Blue , [96] первый новый синий пигмент, открытый за 200 лет. [97]
Биохимия

Многие классы ферментов содержат марганцевые кофакторы , включая оксидоредуктазы , трансферазы , гидролазы , лиазы , изомеразы и лигазы . Другие ферменты, содержащие марганец, — это аргиназа и Mn-содержащая супероксиддисмутаза ( Mn-SOD ). Некоторые обратные транскриптазы многих ретровирусов (хотя и не лентивирусов , таких как ВИЧ ) содержат марганец. Полипептиды , содержащие марганец, — это дифтерийный токсин , лектины и интегрины . [98]
Кислород -выделяющий комплекс (OEC), содержащий четыре атома марганца, является частью фотосистемы II, содержащейся в тилакоидных мембранах хлоропластов. OEC отвечает за терминальное фотоокисление воды во время световых реакций фотосинтеза , т. е. является катализатором, который делает O 2 вырабатываемым растениями. [99] [100]
Здоровье и питание человека
Марганец является важным элементом питания человека и присутствует в качестве кофермента в нескольких биологических процессах, которые включают метаболизм макронутриентов, формирование костей и системы защиты от свободных радикалов . Марганец является критическим компонентом в десятках белков и ферментов. [8] Человеческое тело содержит около 12 мг марганца, в основном в костях. Оставшаяся часть мягких тканей сосредоточена в печени и почках. [9] В человеческом мозге марганец связан с металлопротеинами марганца , в первую очередь с глутаминсинтетазой в астроцитах . [101]
| Мужчины | Женщины | ||
|---|---|---|---|
| Возраст | ИП (мг/день) | Возраст | ИП (мг/день) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| беременных: 2 | |||
| лактация: 2,6 | |||
Регулирование
Институт медицины США (IOM) обновил Оценочные средние потребности (EAR) и Рекомендуемые диетические нормы (RDA) для минералов в 2001 году. Для марганца не было достаточной информации для установления EAR и RDA, поэтому потребности описываются как оценки для Адекватного потребления (AI). Что касается безопасности, IOM устанавливает Допустимые верхние уровни потребления (UL) для витаминов и минералов, когда имеются достаточные доказательства. В случае марганца UL для взрослых устанавливается на уровне 11 мг/день. В совокупности EAR, RDA, AI и UL называются Референтными диетическими нормами потребления (DRI). [102] Дефицит марганца встречается редко. [103]
Европейское агентство по безопасности пищевых продуктов (EFSA) называет коллективный набор информации Диетическими референтными значениями, с Референтным потреблением населения (PRI) вместо RDA и Средней потребностью вместо EAR. AI и UL определяются так же, как в Соединенных Штатах. Для людей в возрасте 15 лет и старше AI устанавливается на уровне 3,0 мг/день. AI для беременности и лактации составляет 3,0 мг/день. Для детей в возрасте 1–14 лет AI увеличиваются с возрастом от 0,5 до 2,0 мг/день. AI для взрослых выше, чем RDA в США. [104] EFSA рассмотрело тот же вопрос безопасности и решило, что недостаточно информации для установления UL. [105]
Для маркировки пищевых продуктов и диетических добавок в США количество в порции выражается в процентах от суточной нормы (%DV). Для маркировки марганца 100% суточной нормы составляли 2,0 мг, но с 27 мая 2016 года она была пересмотрена до 2,3 мг, чтобы соответствовать RDA. [106] [107] Таблица старых и новых суточных норм для взрослых приведена в Reference Daily Intake .
Чрезмерное воздействие или потребление может привести к состоянию, известному как марганцевый ганизм , нейродегенеративному расстройству, которое вызывает гибель дофаминергических нейронов и симптомы, похожие на болезнь Паркинсона . [9] [108]
Дефицит
Дефицит марганца у людей, что встречается редко, приводит к ряду медицинских проблем. Дефицит марганца вызывает деформацию скелета у животных и подавляет выработку коллагена при заживлении ран. [109]
Контакт
В воде
Водный марганец имеет большую биодоступность , чем пищевой марганец. Согласно результатам исследования 2010 года, [110] более высокие уровни воздействия марганца в питьевой воде связаны с повышенным интеллектуальным ухудшением и снижением коэффициентов интеллекта у детей школьного возраста. Предполагается, что долгосрочное воздействие из-за вдыхания естественного марганца в воде для душа подвергает риску до 8,7 миллионов американцев. [111] Однако данные указывают на то, что организм человека может восстановиться от определенных неблагоприятных последствий чрезмерного воздействия марганца, если воздействие прекратить и организм сможет очиститься от избытка. [112]
Уровень Mn может повышаться в морской воде, когда происходят периоды гипоксии. [113] С 1990 года появились сообщения о накоплении Mn в морских организмах, включая рыб, ракообразных, моллюсков и иглокожих. Определенные ткани являются мишенями у разных видов, включая жабры, мозг, кровь, почки и печень/ гепатопанкреас . У этих видов были зарегистрированы физиологические эффекты. Mn может влиять на обновление иммуноцитов и их функциональность, такую как фагоцитоз и активация профенолоксидазы , подавляя иммунную систему организмов. Это делает организмы более восприимчивыми к инфекциям. По мере изменения климата увеличивается распространение патогенов, и для того, чтобы организмы могли выживать и защищаться от этих патогенов, им нужна здоровая, сильная иммунная система. Если их системы будут скомпрометированы из-за высокого уровня Mn, они не смогут бороться с этими патогенами и умрут. [69]
Бензин

Метилциклопентадиенил марганец трикарбонил (ММТ) — это добавка, разработанная для замены соединений свинца в бензинах с целью повышения октанового числа . ММТ используется только в нескольких странах. Топливо, содержащее марганец, имеет тенденцию образовывать карбиды марганца, которые повреждают выпускные клапаны .
Воздух
По сравнению с 1953 годом уровень марганца в воздухе снизился. [114] Как правило, воздействие концентраций окружающего воздуха Mn, превышающих 5 мкг Mn/м 3, может привести к симптомам, вызванным Mn. Повышенная экспрессия белка ферропортина в клетках эмбриональной почки человека (HEK293) связана с уменьшением внутриклеточной концентрации Mn и ослабленной цитотоксичностью , характеризующейся обратным ростом поглощения глутамата , сниженного Mn, и уменьшением утечки лактатдегидрогеназы . [115]
Регулирование
Воздействие марганца в Соединенных Штатах регулируется Управлением по охране труда и промышленной гигиене (OSHA). [116] Люди могут подвергаться воздействию марганца на рабочем месте, вдыхая его или глотая. OSHA установило допустимый предел ( допустимый предел воздействия ) для воздействия марганца на рабочем месте в размере 5 мг/м3 в течение 8-часового рабочего дня. Национальный институт охраны труда и промышленной гигиене (NIOSH) установил рекомендуемый предел воздействия (REL) в размере 1 мг/м3 в течение 8-часового рабочего дня и краткосрочный предел в размере 3 мг/м3 . При уровнях 500 мг/м3 марганец немедленно становится опасным для жизни и здоровья . [117]
Здоровье и безопасность
Марганец необходим для здоровья человека, хотя и в миллиграммовых количествах.
Текущая максимальная безопасная концентрация в соответствии с правилами Агентства по охране окружающей среды США составляет 50 мкг Mn/л. [118]
Марганец
Избыточное воздействие марганца чаще всего связано с марганизмом , редким неврологическим расстройством, связанным с чрезмерным приемом или вдыханием марганца. Исторически сложилось так, что лица, занятые в производстве или обработке марганцевых сплавов [119] [120], подвергались риску развития марганизма; однако правила охраны труда и техники безопасности защищают рабочих в развитых странах. [116] Это расстройство было впервые описано в 1837 году британским ученым Джоном Купером, который изучал двух пациентов, которые были шлифовщиками марганца. [50]
Марганизм — это двухфазное расстройство. На ранних стадиях у опьяневшего человека может возникнуть депрессия, перепады настроения, компульсивное поведение и психоз. Ранние неврологические симптомы сменяются поздней стадией марганизма, которая напоминает болезнь Паркинсона . Симптомы включают слабость, монотонную и замедленную речь, невыразительное лицо, тремор, наклонную вперед походку, неспособность ходить назад без падений, ригидность и общие проблемы с ловкостью, походкой и равновесием. [50] [121] В отличие от болезни Паркинсона , марганизм не связан с потерей обоняния, и пациенты, как правило, не реагируют на лечение L-ДОФА . [122] Симптомы поздней стадии марганизма со временем становятся более серьезными, даже если источник воздействия удален и уровень марганца в мозге возвращается к норме. [121]
Было показано, что хроническое воздействие марганца вызывает заболевание, похожее на паркинсонизм, характеризующееся двигательными нарушениями. [123] Это состояние не поддается лечению с помощью типичных методов лечения, используемых при лечении болезни Паркинсона , что указывает на альтернативный путь к типичной дофаминергической потере в черной субстанции . [123] Марганец может накапливаться в базальных ганглиях , что приводит к аномальным движениям. [124] Мутация гена SLC30A10, транспортера оттока марганца, необходимого для снижения внутриклеточного Mn, была связана с развитием этого заболевания, похожего на паркинсонизм. [125] Тельца Леви, типичные для болезни Паркинсона, не наблюдаются при паркинсонизме, вызванном Mn. [124]
Эксперименты на животных дали возможность изучить последствия чрезмерного воздействия марганца в контролируемых условиях. У (неагрессивных) крыс марганец вызывает поведение убийства мышей. [126]
Токсичность
| Опасности | |
|---|---|
| Маркировка СГС : | |
| H401 | |
| С273 , С501 [127] | |
| NFPA 704 (огненный алмаз) | |
Соединения марганца менее токсичны, чем соединения других распространенных металлов, таких как никель и медь . [128] Однако воздействие пыли и паров марганца не должно превышать предельного значения 5 мг/м3 даже в течение коротких периодов из-за его уровня токсичности. [129] Отравление марганцем связано с нарушением двигательных навыков и когнитивными расстройствами . [130]
Нейродегенеративные заболевания
Белок, называемый DMT1, является основным транспортером всасывания марганца из кишечника и может быть основным транспортером марганца через гематоэнцефалический барьер . DMT1 также переносит вдыхаемый марганец через носовой эпителий . Предполагаемый механизм токсичности марганца заключается в том, что нарушение регуляции приводит к окислительному стрессу , митохондриальной дисфункции , опосредованной глутаматом эксайтотоксичности и агрегации белков. [131]
Смотрите также
- Экспортер марганца , мембранный транспортный белок
- Список стран по производству марганца
- Паркеризация
Ссылки
- ^ "Стандартные атомные веса: марганец". CIAAW . 2017.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 мая 2022 г.). "Стандартные атомные веса элементов 2021 г. (Технический отчет ИЮПАК)". Чистая и прикладная химия . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Selected Values of the Crystallographic Properties of Elements . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcdefgh Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 28. ISBN 978-0-08-037941-8.
- ^ Mn(–2) известен в Mn(cod)2−2; см. Джон Э. Эллис (2006). «Приключения с веществами, содержащими металлы в отрицательных степенях окисления». Неорганическая химия . 45 (8). doi :10.1021/ic052110i.
- ^ Уист, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Chinese Physics C. 45 ( 3): 030001. doi :10.1088/1674-1137/abddae.
- ^ ab Erikson, Keith M.; Ascher, Michael (2019). «Глава 10. Марганец: его роль в болезнях и здоровье». В Sigel, Astrid; Freisinger, Eva; Sigel, Roland KO; Carver, Peggy L. (ред.). Essential Metals in Medicine: Therapeutic Use and Toxicity of Metal Ions in the Clinic . Metal Ions in Life Sciences. Том 19. Берлин: de Gruyter GmbH. стр. 253–266 . doi :10.1515/9783110527872-016. ISBN 978-3-11-052691-2. PMID 30855111. S2CID 73725546.
- ^ abcdef Эмсли, Джон (2001). «Марганец». Строительные блоки природы: путеводитель по элементам от А до Я. Оксфорд, Великобритания: Oxford University Press. С. 249–253. ISBN 978-0-19-850340-8.
- ^ Рот, Джером; Понзони, Сильвия; Ашнер, Майкл (2013). «Гомеостаз и транспорт марганца». В Banci, Lucia (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том 12. Springer. стр. 169–201 . doi :10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5560-4. PMC 6542352 . PMID 23595673.Электронная книга ISBN 978-94-007-5561-1 .
- ^ abcd Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). «Манган». Lehrbuch der Anorganischen Chemie (на немецком языке) (изд. 91–100). Вальтер де Грюйтер. С. 1110–1117 . ISBN. 978-3-11-007511-3.
- ^ Лид, Дэвид Р. (2004). Магнитная восприимчивость элементов и неорганических соединений, в Справочнике по химии и физике. CRC press. ISBN 978-0-8493-0485-9. Архивировано из оригинала 17 декабря 2019 . Получено 7 сентября 2019 .
- ↑ Марганец в Британской энциклопедии
- ^ ab Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). "Оценка ядерных свойств с помощью NUBASE2016" (PDF) . Chinese Physics C. 41 ( 3): 030001. Bibcode : 2017ChPhC..41c0001A. doi : 10.1088/1674-1137/41/3/030001.
- ^ Клери, Дэниел (4 июня 2020 г.). «Самые яркие взрывы галактики становятся ядерными из-за неожиданного триггера: пар мертвых звезд». Наука . Получено 26 июля 2021 г.
- ^ Шефер, Йорг; Фастерманн, Томас; Херцог, Грегори Ф.; Кни, Клаус; Коршинек, Гюнтер; Масарик, Йозеф; Мейер, Астрид; Путивцев Михаил; Ругель, Георг; Шлюхтер, Кристиан; Серифиддин, Фериде; Винклер, Гизела (2006). «Земной марганец-53 – новый монитор процессов на поверхности Земли». Письма о Земле и планетологии . 251 ( 3–4 ): 334–345 . Бибкод : 2006E&PSL.251..334S. дои : 10.1016/j.epsl.2006.09.016.
- ^
- Бирк, Дж.; Ротару, М.; Аллегре, К. (1999). «Эволюция 53Mn-53Cr ранней Солнечной системы». Geochimica et Cosmochimica Acta . 63 ( 23–24 ): 4111–4117 . Бибкод : 1999GeCoA..63.4111B. дои : 10.1016/S0016-7037(99)00312-9.
- Lugmair, G.; Shukolyukov, A. (1998). «Ранние временные шкалы солнечной системы согласно систематике 53Mn-53Cr». Geochimica et Cosmochimica Acta . 62 (16): 2863– 2886. Bibcode : 1998GeCoA..62.2863L. doi : 10.1016/S0016-7037(98)00189-6.
- Шуколюков, Александр; Лугмайр, Гюнтер В. (2000). «О гетерогенности 53Mn в ранней Солнечной системе». Space Science Reviews . 92 : 225–236 . Bibcode : 2000SSRv...92..225S. doi : 10.1023/A:1005243228503.
- Тринкье, А.; Бирк, Дж.; Аллегре, К.; Гепель, К.; Ульфбек, Д. (2008). «Возвращение к систематике 53Mn – 53Cr ранней Солнечной системы». Geochimica et Cosmochimica Acta . 72 (20): 5146–5163 . Бибкод : 2008GeCoA..72.5146T. дои : 10.1016/j.gca.2008.03.023.
- ^ abc Young, DA (1975). "Фазовые диаграммы элементов". Международная система ядерной информации . LNL: 15. Получено 30 января 2023 г.
- ^ ab Dhananjayan, N.; Banerjee, T. (1969). Кристаллографические модификации марганца и характеристики их превращений. Глава 1: Структура электроосажденного марганца. CSIR-NML. С. 3–28 .
- ^ Kemmitt, RDW; Peacock, RD (1973). Химия марганца, технеция и рения. Pergamon Texts in Inorganic Chemistry . Saint Louis: Elsevier Science. стр. 778. ISBN 978-1-4831-3806-0. OCLC 961064866.
- ^ Брэдли, А. Дж.; Тьюлис, Дж. (1927). «Кристаллическая структура α-марганца». Труды Лондонского королевского общества, серия A. 115 ( 771): 456– 471. Bibcode : 1927RSPSA.115..456B. doi : 10.1098/rspa.1927.0103 . ISSN 0950-1207.
- ^ Лоусон, AC; Ларсон, Аллен C.; Аронсон, MC; и др. (1994). «Магнитный и кристаллографический порядок в α-марганце». J. Appl. Phys . 76 (10): 7049– 7051. Bibcode :1994JAP....76.7049L. doi :10.1063/1.358024. ISSN 0021-8979.
- ^ ab Prior, Timothy J; Nguyen-Manh, Duc; Couper, Victoria J; Battle, Peter D (2004). "Ферромагнетизм в структуре бета-марганца: Fe 1,5 Pd 0,5 Mo 3 N". Journal of Physics: Condensed Matter . 16 (13): 2273– 2281. Bibcode : 2004JPCM...16.2273P. doi : 10.1088/0953-8984/16/13/008. ISSN 0953-8984. S2CID 250784683.
- ^ Фунахаси, С.; Кохара, Т. (1984). «Диффузное рассеяние нейтронов в β-марганце». J. Appl. Phys . 55 (6): 2048–2050 . Bibcode : 1984JAP....55.2048F. doi : 10.1063/1.333561. ISSN 0021-8979.
- ^ abc Душанек, Х.; Мон, П.; Шварц, К. (1989). «Антиферромагнитное и ферромагнитное гамма-марганцевое обобщение метода фиксированного спинового момента». Physica B: Condensed Matter . 161 ( 1– 3): 139– 142. doi :10.1016/0921-4526(89)90120-8. ISSN 0921-4526.
- ^ Bacon, GE; Cowlam, N (1970). «Исследование некоторых сплавов гамма-марганца методом нейтронной дифракции». Journal of Physics C: Solid State Physics . 3 (3): 675– 686. Bibcode : 1970JPhC....3..675B. doi : 10.1088/0022-3719/3/3/023. ISSN 0022-3719.
- ^ "Гл. 20". Неорганическая химия Шрайвера и Аткинса . Oxford University Press. 2010. ISBN 978-0-19-923617-6.
- ^ Luft, JH (1956 ) . «Перманганат – новый фиксатор для электронной микроскопии». Журнал биофизической и биохимической цитологии . 2 (6): 799– 802. doi :10.1083/jcb.2.6.799. PMC 2224005. PMID 13398447.
- ^
- Man, Wai-Lun; Lam, William WY; Lau, Tai-Chu (2014). «Реакционная способность нитридных комплексов рутения (VI), осмия (VI) и марганца (V), содержащих основание Шиффа и простые анионные лиганды». Accounts of Chemical Research . 47 (2): 427– 439. doi :10.1021/ar400147y. PMID 24047467.
- Голдберг, Дэвид П. (2007). «Корролазины: новые рубежи в стабильности и реакционной способности высоковалентных металлопорфириноидов». Accounts of Chemical Research . 40 (7): 626– 634. doi :10.1021/ar700039y. PMID 17580977.
- ↑ Гринвуд и Эрншоу 1984, стр. 1221–22.
- ^ Привет, Питер Дж.; Анастасакис, Константинос; Де Йонг, Вибрен; Ван Хозель, Аннелис; Робрукс, Уил; Соресси, Мари (2016). «Выбор и использование диоксида марганца неандертальцами». Научные отчеты . 6 : 22159. Бибкод : 2016NatSR...622159H. дои : 10.1038/srep22159. ПМЦ 4770591 . ПМИД 26922901.
- ↑ Гринвуд и Эрншоу 1984, стр. 1218–20.
- ^ Яно, Джунко; Ячандра, Виттал (2014). «Кластер Mn4Ca в фотосинтезе: где и как вода окисляется до диоксида углерода». Chemical Reviews . 114 (8): 4175– 4205. doi :10.1021/cr4004874. PMC 4002066 . PMID 24684576.
- ^ Арслан, Эврим; Лалансетт, Роджер А.; Бернал, Иван (2017). «Историческое и научное исследование свойств трис-ацетилацетонатов металлов (III)». Struct Chem . 28 : 201–212 . doi :10.1007/s11224-016-0864-0.
- ^ Рейнер-Кэнхэм, Джеффри; Овертон, Тина (2003). Описательная неорганическая химия . Macmillan. стр. 491. ISBN 0-7167-4620-4..
- ^ Шмидт, Макс (1968). «VII. Небенгруппа». Anorganische Chemie II (на немецком языке). Wissenschaftsverlag. стр. 100–109 .
- ^ Кадассери, Картика Дж.; Макмиллан, Саманта Н.; Лейси, Дэвид К. (2019). «Возрождение химии органомарганца(I). Бидентатные комплексы фосфина и фенола марганца(I)». Неорганическая химия . 58 (16): 10527– 10535. doi : 10.1021/acs.inorgchem.9b00941. PMID 31247867.
- ^ Джиролами, Грегори С.; Уилкинсон, Джеффри; Торнтон-Петт, Марк; Херстхаус, Майкл Б. (1983). «Комплексы гидрид, алкил и этилен 1,2-бис(диметилфосфино)этана марганца и кристаллические структуры MnBr2(dmpe)2, [Mn(AlH4)(dmpe)2]2 и MnMe2(dmpe)2». Журнал Американского химического общества . 105 (22): 6752– 6753. Bibcode : 1983JAChS.105.6752G. doi : 10.1021/ja00360a054.
- ^ languagehat (28 мая 2005 г.). "МАГНИТ". languagehat.com . Получено 18 июня 2020 г. .
- ^ Плиний Старший . "Глава 25 — МАГНИТ: ТРИ СРЕДСТВА". Естественная история Плиния. КНИГА XXXVI. ЕСТЕСТВЕННАЯ ИСТОРИЯ КАМНЕЙ.
- ↑ Calvert, JB (24 января 2003 г.). «Хром и марганец». Архивировано из оригинала 31 декабря 2016 г. Получено 10 декабря 2022 г.
- ^ Chalmin, Emilie; Menu, Michel; Vignaud, Colette (2003). «Анализ наскальной живописи и технологий палеолитических художников». Measurement Science and Technology . 14 (9): 1590– 1597. doi :10.1088/0957-0233/14/9/310. S2CID 250842390.
- ^ Chalmin, E.; Vignaud, C.; Salomon, H.; Farges, F.; Susini, J.; Menu, M. (2006). «Минералы, обнаруженные в черных пигментах палеолита с помощью просвечивающей электронной микроскопии и микроструктуры поглощения рентгеновских лучей вблизи края» (PDF) . Applied Physics A . 83 (12): 213– 218. Bibcode :2006ApPhA..83..213C. doi :10.1007/s00339-006-3510-7. hdl :2268/67458. S2CID 9221234.
- ^ Sayre, EV; Smith, RW (1961). «Композиционные категории античного стекла». Science . 133 (3467): 1824– 1826. Bibcode :1961Sci...133.1824S. doi :10.1126/science.133.3467.1824. PMID 17818999. S2CID 25198686.
- ^ abc Mccray, W. Patrick (1998). «Стеклоделие в Италии эпохи Возрождения: новаторство венецианского cristallo». JOM . 50 (5): 14– 19. Bibcode :1998JOM....50e..14M. doi :10.1007/s11837-998-0024-0. S2CID 111314824.
- ^ Ранке-Мадсен, Э. (1975). «Открытие элемента». Centaurus . 19 (4): 299– 313. Bibcode : 1975Cent...19..299R. doi : 10.1111/j.1600-0498.1975.tb00329.x.
- ^ Miśkowiec, Paweł (2022). «Игра в названия: история наименований химических элементов — часть 1 — от античности до конца 18 века». Основы химии . 25 : 29–51 . doi : 10.1007/s10698-022-09448-5 .
- ^ Хэдфилд, Роберт (1927). «Металлический марганец и его свойства: также руды, и производство ферромарганца и его история». Журнал Института железа и стали . 115 (1): 251–252 .
- ^ Алессио, Л.; Кампанья, М.; Луккини, Р. (2007). «От свинца к марганцу через ртуть: мифология, наука и уроки профилактики». Американский журнал промышленной медицины . 50 (11): 779– 787. doi :10.1002/ajim.20524. PMID 17918211.
- ^ abc Купер, Джон (1837). «О воздействии черной окиси марганца при вдыхании в легкие». Br. Ann. Med. Pharm. Vital Stat. Gen. Sci . 1 : 41– 42.
- ^ Олсен, Сверре Э.; Тангстад, Мерете; Линдстад, Тор (2007). «История омарганца». Производство марганцевых ферросплавов . Тапир Академик Пресс. стр. 11–12 . ISBN. 978-82-519-2191-6.
- ^ аб Прейслер, Эберхард (1980). «Современные Verfahren der Großchemie: Браунштайн». Chemie in unserer Zeit (на немецком языке). 14 (5): 137–148 . doi :10.1002/ciuz.19800140502.
- ^ abcd Mineral Commodity Summaries 2009 (Отчет). Отдел водных ресурсов, Геологическая служба США. 2009. doi :10.3133/mineral2009.
- ^ Bhattacharyya, PK; Dasgupta, Somnath; Fukuoka, M.; Roy Supriya (1984). "Геохимия браунита и связанных с ним фаз в метаморфизованных неизвестковых марганцевых рудах Индии". Contributions to Mineralogy and Petrology . 87 (1): 65– 71. Bibcode : 1984CoMP...87...65B. doi : 10.1007/BF00371403. S2CID 129495326.
- ^ Кук, Найджел Дж.; Чобану, Кристиана Л.; Принг, Аллан; Скиннер, Уильям; Симидзу, Масааки; Данюшевский, Леонид; Сайни-Эйдукат, Бернхардт; Мельчер, Фрэнк (2009). «Следы и второстепенные элементы в сфалерите: исследование LA-ICPMS». Geochimica et Cosmochimica Acta . 73 (16): 4761–4791 . Бибкод : 2009GeCoA..73.4761C. дои : 10.1016/j.gca.2009.05.045.
- ^ Ван, X; Шредер, ХК; Винс, М; Шлоссмахер, У; Мюллер, ВЭГ (2009). «Марганцевые/полиметаллические конкреции: микроструктурная характеристика экзолитобионтических и эндолитобионтических микробных биопленок с помощью сканирующей электронной микроскопии». Micron . 40 (3): 350–358 . doi :10.1016/j.micron.2008.10.005. PMID 19027306.
- ^ Организация Объединенных Наций (1978). «Марганцевые конкреции: размеры и перспективы». Морская геология . Библиотека форума природных ресурсов. 41 ( 3–4 ). Springer: 343. Bibcode : 1981MGeol..41..343C. doi : 10.1016/0025-3227(81)90092-X. ISBN 978-90-277-0500-6. OCLC 4515098.
- ^ "Добыча марганца в Южной Африке – Обзор". MBendi Information Services. Архивировано из оригинала 5 февраля 2016 года . Получено 10 декабря 2022 года .
- ^ Эллиотт, Р.; Колей, К.; Мостагель, С.; Барати, М. (2018). «Обзор обработки марганца для производства сталей TRIP/TWIP, часть 1: Текущая практика и основы обработки». JOM . 70 (5): 680– 690. Bibcode :2018JOM....70e.680E. doi :10.1007/s11837-018-2769-4. S2CID 139950857.
- ^ Corathers, LA; Machamer, JF (2006). «Марганец». Промышленные минералы и горные породы: товары, рынки и использование (7-е изд.). SME. стр. 631–636 . ISBN 978-0-87335-233-8.
- ^ ab Zhang, Wensheng; Cheng, Chu Yong (2007). "Обзор металлургии марганца. Часть I: Выщелачивание руд/вторичных материалов и восстановление электролитического/химического диоксида марганца". Гидрометаллургия . 89 ( 3–4 ): 137–159 . Bibcode : 2007HydMe..89..137Z. doi : 10.1016/j.hydromet.2007.08.010.
- ^ Chow, Norman; Nacu, Anca; Warkentin, Doug; Aksenov, Igor & Teh, Hoe (2010). "Извлечение марганца из низкосортных ресурсов: завершена программа металлургических испытаний на стенде" (PDF) . Kemetco Research Inc. Архивировано из оригинала (PDF) 2 февраля 2012 г.
- ^ "Секрет ЦРУ на дне океана". BBC News . 19 февраля 2018 г. Получено 3 мая 2018 г.
- ^ «Проект Азориан: рассекреченная ЦРУ история Glomar Explorer». Архив национальной безопасности в Университете Джорджа Вашингтона. 12 февраля 2010 г. Получено 18 сентября 2013 г.
- ^ Hein, James R. (январь 2016 г.). Encyclopedia of Marine Geosciences - Marganese Nodules. Springer. стр. 408–412 . Получено 2 февраля 2021 г.
- ^ Международный орган по морскому дну. "Полиметаллические конкреции" (PDF) . isa.org . Международный орган по морскому дну. Архивировано из оригинала (PDF) 23 октября 2021 г. . Получено 2 февраля 2021 г. .
- ^ Oebius, Horst U; Becker, Hermann J; Rolinski, Susanne; Jankowski, Jacek A (январь 2001 г.). «Параметризация и оценка воздействия на морскую среду, вызванного глубоководной добычей марганцевых конкреций». Deep Sea Research Part II: Topical Studies in Oceanography . 48 ( 17– 18): 3453– 3467. Bibcode :2001DSRII..48.3453O. doi :10.1016/s0967-0645(01)00052-2. ISSN 0967-0645.
- ^ Томпсон, Кирстен Ф.; Миллер, Кэтрин А.; Карри, Дункан; Джонстон, Пол; Сантильо, Дэвид (2018). «Добыча полезных ископаемых на морском дне и подходы к управлению глубоководным морским дном». Frontiers in Marine Science . 5. doi : 10.3389/fmars.2018.00480 . hdl : 10871/130176 . S2CID 54465407.
- ^ ab Hernroth, Bodil; Tassidis, Helena; Baden, Susanne P. (март 2020 г.). «Иммуносупрессия водных организмов, подвергшихся воздействию повышенных уровней марганца: от глобальной до молекулярной перспективы». Developmental & Comparative Immunology . 104 : 103536. doi : 10.1016/j.dci.2019.103536. ISSN 0145-305X. PMID 31705914. S2CID 207935992.
- ^ Рэй, Дурбар; Бабу, EVSSK; Сурья Пракаш, Л. (1 января 2017 г.). «Природа взвешенных частиц в гидротермальном шлейфе на 3°40' с. ш. Карлсбергского хребта: сравнение с глубоководной океанической взвешенной материей». Current Science . 112 (1): 139. doi : 10.18520/cs/v112/i01/139-146 . ISSN 0011-3891.
- ^ ab Sim, Nari; Orians, Kristin J. (октябрь 2019 г.). «Годовая изменчивость растворенного марганца в северо-восточной части Тихого океана вдоль линии P: 2010–2013 гг.». Marine Chemistry . 216 : 103702. Bibcode : 2019MarCh.21603702S. doi : 10.1016/j.marchem.2019.103702. ISSN 0304-4203. S2CID 203151735.
- ^ Бартлетт, Ричмонд; Росс, Дональд (2005). «Химия окислительно-восстановительных процессов в почвах». В Табатабаи, Массачусетс; Спаркс, Д.Л. (ред.). Химические процессы в почвах . Серия книг SSSA, № 8. Мэдисон, Висконсин: Американское общество почвоведов. С. 461–487 . LCCN 2005924447.
- ^ Диксон, Джо Б.; Уайт, Г. Норман (2002). «Оксиды марганца». В Диксоне, Дж. Б.; Шульце, Д. Г. (ред.). Минералогия почв и ее применение в окружающей среде . Серия книг SSSA № 7. Мэдисон, Висконсин: Американское общество почвоведов. С. 367–386 . LCCN 2002100258.
- ^ Верховен, Джон Д. (2007). Металлургия стали для неметаллургов . Materials Park, Огайо: ASM International. стр. 56–57 . ISBN 978-0-87170-858-8.
- ^ Марганец USGS 2006
- ^ Дастур, YN; Лесли, WC (1981). «Механизм упрочнения при обработке в марганцевой стали Гадфильда». Metallurgical Transactions A. 12 ( 5): 749– 759. Bibcode : 1981MTA....12..749D. doi : 10.1007/BF02648339. S2CID 136550117.
- ^ Стэнсби, Джон Генри (2007). Железо и сталь. Читайте книги. стр. 351–352 . ISBN 978-1-4086-2616-0.
- ^ Брэди, Джордж С.; Клаузер, Генри Р.; Ваккари. Джон А. (2002). Справочник по материалам: энциклопедия для менеджеров, технических специалистов, менеджеров по закупкам и производству, техников и руководителей. Нью-Йорк, Нью-Йорк: McGraw-Hill. С. 585–587 . ISBN 978-0-07-136076-0.
- ^ Твидейл, Джеффри (1985). «Сэр Роберт Эббот Хэдфилд FRS (1858–1940) и открытие марганцевой стали Джеффри Твидейл». Заметки и записи Лондонского королевского общества . 40 (1): 63–74 . doi :10.1098/rsnr.1985.0004. JSTOR 531536. S2CID 73176861.
- ^ "Химические свойства алюминия 2024 позволяют". Metal Suppliers Online, LLC . Получено 30 апреля 2009 г.
- ^ ab Kaufman, John Gilbert (2000). "Применение алюминиевых сплавов и закалок". Введение в алюминиевые сплавы и закалки . ASM International. стр. 93–94 . ISBN 978-0-87170-689-8.
- ^ ab Dell, RM (2000). «Батареи: пятьдесят лет развития материалов». Solid State Ionics . 134 ( 1– 2): 139– 158. doi :10.1016/S0167-2738(00)00722-0.
- ^ "WSK1216" (PDF) . vishay . Vishay Intertechnology . Получено 30 апреля 2022 г. .
- ^ Reidies, Arno H. (2000). "Соединения марганца". Энциклопедия промышленной химии Ульмана . doi :10.1002/14356007.a16_123. ISBN 9783527303854.
- ^ «Комментарии Агентства по охране окружающей среды по поводу присадки к бензину MMT». epa.gov . EPA. 5 октября 2015 г. Получено 25 июня 2023 г.
- ↑ Краткий Оксфордский словарь английского языка (5-е изд.). Oxford University Press. 2002. ISBN 978-0-19-860457-0.
Красно-коричневая земля, содержащая оксиды железа и марганца, более тёмная, чем охра и сиена, используемая для изготовления различных пигментов.
- ^ Чэнь, Дакуин; Чжоу, Ян; Чжун, Цзясон (2016). «Обзор активаторов Mn 4+ в твердых телах для теплых белых светодиодов». RSC Advances . 6 (89): 86285– 86296. Bibcode : 2016RSCAd...686285C. doi : 10.1039/C6RA19584A.
- ^ Baur, Florian; Jüstel , Thomas (2016). «Зависимость оптических свойств активированного Mn4 + A2Ge4O9 (A=K,Rb) от температуры и химической среды». Журнал люминесценции . 177 : 354–360 . Bibcode : 2016JLum..177..354B. doi : 10.1016/j.jlumin.2016.04.046.
- ^ Jansen, T.; Gorobez, J.; Kirm, M.; Brik, MG; Vielhauer, S.; Oja, M.; Khaidukov, NM; Makhov, VN; Jüstel, T. (1 января 2018 г.). "Narrow Band Deep Red Photoluminescence of Y2Mg3Ge3O12:Mn4+,Li+ Inverse Garnet for High Power Phosphor Converted LEDs". ECS Journal of Solid State Science and Technology . 7 (1): R3086 – R3092 . doi : 10.1149/2.0121801jss . S2CID 103724310.
- ^ Янсен, Томас; Баур, Флориан; Юстель, Томас (2017). «Красное излучение K 2 NbF 7 :Mn 4+ и K 2 TaF 7 :Mn 4+ для светодиодных приложений с теплым белым светом». Журнал люминесценции . 192 : 644– 652. Bibcode : 2017JLum..192..644J. doi : 10.1016/j.jlumin.2017.07.061.
- ^ Чжоу, Чжи; Чжоу, Нань; Ся, Мао; Ёкояма, Мейсо; Хинтцен, Х.Т. (Берт) (6 октября 2016 г.). «Ход исследований и перспективы применения люминесцентных материалов, активированных переходным металлом Mn 4+ ». Журнал химии материалов C. 4 (39): 9143–9161 . doi : 10.1039/c6tc02496c.
- ^ "Система светодиодного фосфора TriGain с использованием красных комплексных фторидов, легированных Mn4+" (PDF) . GE Global Research . Получено 10 декабря 2022 г. .
- ^ Кувахара, Рэймонд Т.; Скиннер III, Роберт Б.; Скиннер младший, Роберт Б. (2001). «Никелевая чеканка в Соединенных Штатах». Western Journal of Medicine . 175 (2): 112– 114. doi :10.1136/ewjm.175.2.112. PMC 1071501. PMID 11483555.
- ^ "Дизайн доллара Сакагавеи". Монетный двор США. Архивировано из оригинала 22 апреля 2021 года . Получено 4 мая 2009 года .
- ^ Шепард, Анна Ослер (1956). «Марганцевые и железо-марганцевые краски». Керамика для археолога . Институт Карнеги в Вашингтоне. С. 40–42 . ISBN 978-0-87279-620-1.
- ^ Ли, Джун; Лоргер, Саймон; Сталик, Джудит К.; Слейт, Артур В.; Субраманиан, МА (3 октября 2016 г.). «От удачи к рациональному проектированию: настройка синего тригонального бипирамидального хромофора Mn 3+ на фиолетовый и пурпурный посредством применения химического давления». Неорганическая химия . 55 (19): 9798– 9804. doi :10.1021/acs.inorgchem.6b01639. ISSN 0020-1669. PMID 27622607.
- ^ Сильверман, Элиан (28 июня 2018 г.). «Каким образом вы открываете совершенно новый синий пигмент? Случайно». TED Ideas . Получено 26 июня 2024 г.
- ^ Райс, Дерек Б.; Мэсси, Эллисса А.; Джексон, Тимоти А. (2017). «Промежуточные соединения марганца и кислорода в реакциях активации связи O–O и переноса атома водорода». Accounts of Chemical Research . 50 (11): 2706–2717 . doi :10.1021/acs.accounts.7b00343. PMID 29064667.
- ^ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (май 2011). "Кристаллическая структура фотосистемы II, выделяющей кислород, с разрешением 1,9 Å" (PDF) . Nature . 473 (7345): 55– 60. Bibcode :2011Natur.473...55U. doi :10.1038/nature09913. PMID 21499260. S2CID 205224374.
- ^ Dismukes, G. Charles; Willigen, Rogier T. van (2006). "Marganese: The Oxygen-Evolving Complex & Models". Marganese: The Oxygen-Evolving Complex & Models Частично основано на статье Manganese: Oxygen-Evolving Complex & Models Ларса-Эрика Андреассона и Торе Вангорда, опубликованной в Encyclopedia of Inorganic Chemistry, First Edition, First Edition . Encyclopedia of Inorganic Chemistry . doi :10.1002/0470862106.ia128. ISBN 978-0470860786.
- ^ Такеда, А. (2003). «Влияние марганца на функцию мозга». Обзоры исследований мозга . 41 (1): 79– 87. doi :10.1016/S0165-0173(02)00234-5. PMID 12505649. S2CID 1922613.
- ^ ab Institute of Medicine (US) Panel on Micronutrients (2001). "Марганец". Диетические рекомендуемые нормы потребления витамина А, витамина К, мышьяка, бора, хрома, хрома, йода, железа, марганца, молибдена, никеля, кремния, ванадия и хрома . National Academy Press. стр. 394–419 . ISBN 978-0-309-07279-3. PMID 25057538.
- ^ См . «Марганец». Центр информации о микроэлементах . Институт Лайнуса Полинга при Университете штата Орегон . 23 апреля 2014 г.
- ^ «Обзор рекомендуемых значений диетического питания для населения ЕС, разработанный Группой EFSA по диетическим продуктам, питанию и аллергиям» (PDF) . 2017.
- ^ Допустимые верхние уровни потребления витаминов и минералов (PDF) , Европейское агентство по безопасности пищевых продуктов, 2006 г.
- ^ «Федеральный регистр, 27 мая 2016 г. Маркировка пищевых продуктов: Пересмотр этикеток с информацией о пищевой ценности и пищевых добавках. Страница FR 33982» (PDF) .
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". База данных этикеток диетических добавок (DSLD) . Архивировано из оригинала 7 апреля 2020 г. . Получено 16 мая 2020 г. .
- ^ Сильва Авила, Дайана; Луис Пунтель, Робсон; Ашнер, Майкл (2013). «Марганец в здоровье и болезнях». В Астрид Сигель; Хельмут Сигель; Роланд КО Сигель (ред.). Взаимосвязи между ионами основных металлов и болезнями человека . Ионы металлов в науках о жизни. Том 13. Springer. стр. 199–227 . doi :10.1007/978-94-007-7500-8_7. ISBN 978-94-007-7499-5. PMC 6589086 . PMID 24470093.
- ^ Ван, Цуй-Юэ; Ся, Вэй-Хао; Ван, Линь; Ван, Чжэнь-Юн (1 ноября 2021 г.). «Дефицит марганца вызывает дисхондроплазию большеберцовой кости у птиц, ингибируя пролиферацию и дифференцировку хондроцитов». Исследования в области ветеринарии . 140 : 164–170 . doi :10.1016/j.rvsc.2021.08.018. PMID 34481207.
- ^ Бушар, М. Ф.; Сове, С.; Барбо, Б.; Легран, М.; Буффар, Т.; Лимож, Э.; Беллинджер, Д. К.; Мерглер, Д. (2011). «Ухудшение интеллекта у детей школьного возраста, подвергшихся воздействию марганца из питьевой воды». Перспективы охраны окружающей среды и здоровья . 119 (1): 138– 143. Bibcode : 2011EnvHP.119..138B. doi : 10.1289/ehp.1002321. PMC 3018493. PMID 20855239.
- ^ Barceloux, Donald; Barceloux, Donald (1999). «Марганец». Клиническая токсикология . 37 (2): 293– 307. doi :10.1081/CLT-100102427. PMID 10382563.
- ^ Devenyi, A. G; Barron, T. F; Mamourian, A. C (1994). «Дистония, гиперинтенсивные базальные ганглии и высокие уровни марганца в цельной крови при синдроме Алажилля». Гастроэнтерология . 106 (4): 1068–71 . doi :10.1016/0016-5085(94)90769-2. PMID 8143974. S2CID 2711273.
- ^ Hernroth, Bodil; Krång, Anna-Sara; Baden, Susanne (февраль 2015 г.). «Бактериостатическое подавление у норвежского омара (Nephrops norvegicus), подвергшегося воздействию марганца или гипоксии под давлением закисления океана». Aquatic Toxicology . 159 : 217– 224. Bibcode : 2015AqTox.159..217H. doi : 10.1016/j.aquatox.2014.11.025. ISSN 0166-445X. PMID 25553539.
- ^ Агентство по регистрации токсичных веществ и заболеваний (2012) 6. Потенциал воздействия на человека, в токсикологическом профиле марганца, Атланта, Джорджия: Министерство здравоохранения и социальных служб США.
- ^ Yin, Z.; Jiang, H.; Lee, ES; Ni, M.; Erikson, KM; Milatovic, D.; Bowman, AB; Aschner, M. (2010). «Ферропортин — это белок, реагирующий на марганец, который снижает цитотоксичность и накопление марганца» (PDF) . Journal of Neurochemistry . 112 (5): 1190– 8. doi :10.1111/j.1471-4159.2009.06534.x. PMC 2819584 . PMID 20002294.
- ^ ab «Темы безопасности и охраны здоровья: соединения марганца (как Mn)». Управление по охране труда и технике безопасности США .
- ^ "NIOSH Pocket Guide to Chemical Hazards – Соединения марганца и пары (как Mn)". Центры по контролю и профилактике заболеваний . Получено 19 ноября 2015 г.
- ^ "Загрязнители питьевой воды". Агентство по охране окружающей среды США . Получено 2 февраля 2015 г.
- ^ Базелт, Р. (2008) Распределение токсичных лекарств и химических веществ в организме человека , 8-е издание, Biomedical Publications, Фостер-Сити, Калифорния, стр. 883–886, ISBN 0-9626523-7-7 .
- ^ Нормандин, Луиза; Хазелл, А.С. (2002). «Нейротоксичность марганца: обновление патофизиологических механизмов». Метаболические заболевания мозга . 17 (4): 375–87 . doi :10.1023/A:1021970120965. PMID 12602514. S2CID 23679769.
- ^ ab Cersosimo, MG; Koller, WC (2007). «Диагностика паркинсонизма, вызванного марганцем». NeuroToxicology . 27 (3): 340–346 . doi :10.1016/j.neuro.2005.10.006. PMID 16325915.
- ^ Лу, CS; Хуанг, CC; Чу, Н.С.; Кальн, Д.Б. (1994). «Неэффективность леводопы при хроническом манганизме». Неврология . 44 (9): 1600–1602 . doi :10.1212/WNL.44.9.1600. PMID 7936281. S2CID 38040913.
- ^ ab Guilarte TR, Gonzales KK (август 2015 г.). «Паркинсонизм, вызванный марганцем, не является идиопатическим заболеванием Паркинсона: экологические и генетические доказательства». Toxicological Sciences (обзор). 146 (2): 204– 12. doi :10.1093/toxsci/kfv099. PMC 4607750 . PMID 26220508.
- ^ ab Kwakye GF, Paoliello MM, Mukhopadhyay S, Bowman AB, Aschner M (июль 2015 г.). «Паркинсонизм, вызванный марганцем, и болезнь Паркинсона: общие и отличительные черты». Int J Environ Res Public Health (обзор). 12 (7): 7519– 40. doi : 10.3390/ijerph120707519 . PMC 4515672 . PMID 26154659.
- ^ Перес ТВ, Шеттингер М. Р., Чен П., Карвальо Ф., Авила Д. С., Боуман А. Б., Ашнер М. (ноябрь 2016 г.). «Нейротоксичность, вызванная марганцем: обзор ее поведенческих последствий и нейропротекторных стратегий». BMC Pharmacology & Toxicology (обзор). 17 (1): 57. doi : 10.1186/s40360-016-0099-0 . PMC 5097420 . PMID 27814772.
- ^ Лазришвили, И. и др. (2016). «Нагрузка марганцем вызывает поведение убийства мышей у неагрессивных крыс». Журнал биологической физики и химии . 16 (3): 137– 141. doi :10.4024/31LA14L.jbpc.16.03.
- ^ "Паспорт безопасности". Sigma-Aldrich . Получено 26 июля 2021 г. .
- ^ Хасан, Хизер (2008). Марганец. The Rosen Publishing Group. стр. 31. ISBN 978-1-4042-1408-8.
- ^ "Marganese Chemical Background". Институт Меткалфа по морской и экологической отчетности Университета Род-Айленда. Апрель 2006 г. Архивировано из оригинала 28 августа 2006 г. Получено 30 апреля 2008 г.
- ^ "Информационная система оценки рисков. Резюме токсичности для марганца". Национальная лаборатория Оук-Ридж . Получено 23 апреля 2008 г.
- ^ Прабхакаран, К.; Гош, Д.; Чапман, ГД; Гунасекар, П.Г. (2008). «Молекулярный механизм дофаминергической токсичности, вызванной воздействием марганца». Brain Research Bulletin . 76 (4): 361– 367. doi :10.1016/j.brainresbull.2008.03.004. ISSN 0361-9230. PMID 18502311. S2CID 206339744.
Источники
- Гринвуд, Норман Н.; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press . ISBN 978-0-08-022057-4.
Внешние ссылки
- Национальный реестр загрязняющих веществ – Информационный бюллетень по марганцу и его соединениям
- Международный институт марганца
- Страница темы NIOSH по марганцу
- Марганец в Периодической таблице видео (Ноттингемский университет)
- Все о марганцевых дендритах
- Шлак электродуговой печи (ЭДП)








