Технеций
Технеций — химический элемент ; он имеет символ Tc и атомный номер 43. Это самый легкий элемент, все изотопы которого радиоактивны . Технеций и прометий — единственные радиоактивные элементы, соседи которых в смысле атомного номера оба стабильны. Весь доступный технеций производится как синтетический элемент . Встречающийся в природе технеций — это продукт спонтанного деления в урановой руде и ториевой руде (наиболее распространенный источник) или продукт захвата нейтронов в молибденовых рудах. Этот серебристо-серый кристаллический переходный металл находится между марганцем и рением в группе 7 периодической таблицы , и его химические свойства являются промежуточными между свойствами обоих соседних элементов. Наиболее распространенным природным изотопом является 99 Tc, только в следовых количествах.
Многие свойства технеция были предсказаны Дмитрием Менделеевым еще до его открытия; Менделеев заметил пробел в своей периодической таблице и дал неоткрытому элементу временное название экамарганец ( Em ). В 1937 году технеций стал первым преимущественно искусственным элементом, который был получен, отсюда и его название (от греческого technetos , «искусственный», + -ium ).
Один короткоживущий ядерный изомер , испускающий гамма-лучи , технеций-99m , используется в ядерной медицине для самых разных тестов, таких как диагностика рака костей. Основное состояние нуклида технеция -99 используется как источник бета-частиц без гамма-излучения . Долгоживущие изотопы технеция, производимые в коммерческих целях, являются побочными продуктами деления урана -235 в ядерных реакторах и извлекаются из ядерных топливных стержней . Поскольку даже самый долгоживущий изотоп технеция имеет относительно короткий период полураспада (4,21 миллиона лет), обнаружение технеция в красных гигантах в 1952 году помогло доказать, что звезды могут производить более тяжелые элементы .
История
Ранние предположения
С 1860-х по 1871 год ранние формы периодической таблицы, предложенные Дмитрием Менделеевым, содержали пробел между молибденом (элемент 42) и рутением (элемент 44). В 1871 году Менделеев предсказал, что этот отсутствующий элемент займет пустое место под марганцем и будет иметь схожие химические свойства. Менделеев дал ему временное название эка-марганец (от eka , санскритского слова, обозначающего один ), потому что он находился на одну позицию ниже известного элемента марганца. [6]
Ранние ошибочные определения
Многие ранние исследователи, как до, так и после публикации периодической таблицы, стремились первыми открыть и назвать недостающий элемент. Его расположение в таблице предполагало, что его должно быть легче найти, чем другие неоткрытые элементы. Но это оказалось не так из-за радиоактивности технеция.
| Год | Истец | Предлагаемое имя | Фактический материал |
|---|---|---|---|
| 1828 | Готфрид Осанн | Полиний | Иридий |
| 1845 | Генрих Розе | Пелопий [7] | Сплав ниобия и тантала |
| 1847 | Р. Германн | Ильмений [8] | Сплав ниобия и тантала |
| 1877 | Серж Керн | Давюм | Сплав иридия , родия и железа |
| 1896 | Проспер Барьер | Люциум | Иттрий |
| 1908 | Масатака Огава | Ниппоний | Рений , который был неизвестным дви -марганцем [9] [10] |
Невоспроизводимые результаты
.jpg/440px-Periodisches_System_der_Elemente_(1904-1945,_now_Gdansk_University_of_Technology).jpg)
Немецкие химики Вальтер Ноддак , Отто Берг и Ида Таке сообщили об открытии элемента 75 и элемента 43 в 1925 году и назвали элемент 43 мазурием (в честь Мазурии в Восточной Пруссии , ныне в Польше , региона, откуда произошла семья Вальтера Ноддака). [11] Это название вызвало значительное негодование в научном сообществе, поскольку оно было истолковано как указание на серию побед немецкой армии над русской армией в регионе Мазур во время Первой мировой войны; поскольку Ноддаки оставались на своих академических должностях, пока нацисты были у власти, подозрения и враждебность по отношению к их заявлению об открытии элемента 43 продолжались. [12] Группа бомбардировала колумбит пучком электронов и вывела присутствие элемента 43, изучив рентгеновские эмиссионные спектрограммы . [13] Длина волны производимых рентгеновских лучей связана с атомным номером формулой, выведенной Генри Мозли в 1913 году. Команда заявила, что обнаружила слабый рентгеновский сигнал на длине волны, производимой элементом 43. Более поздние экспериментаторы не смогли повторить открытие, и оно было отклонено как ошибка. [14] [15] Тем не менее, в 1933 году серия статей об открытии элементов цитировала название мазурий для элемента 43. [16] Были предприняты некоторые более поздние попытки реабилитировать заявления Ноддаков, но они опровергнуты исследованием Пола Куроды о количестве технеция, которое могло присутствовать в рудах, которые они изучали: оно не могло превышать 3 × 10−11 мкг /кг руды, и, таким образом, было бы необнаружимым методами Ноддаков. [12] [17]
Официальное открытие и последующая история
Открытие элемента 43 было окончательно подтверждено в эксперименте 1937 года в Университете Палермо на Сицилии Карло Перье и Эмилио Сегре . [18] В середине 1936 года Сегре посетил Соединенные Штаты, сначала Колумбийский университет в Нью-Йорке, а затем Национальную лабораторию Лоуренса в Беркли в Калифорнии. Он убедил изобретателя циклотрона Эрнеста Лоуренса позволить ему забрать некоторые выброшенные части циклотрона, которые стали радиоактивными . Лоуренс отправил ему по почте молибденовую фольгу, которая была частью дефлектора в циклотроне. [19]
Сегре привлек своего коллегу Перье, чтобы попытаться доказать с помощью сравнительной химии, что активность молибдена действительно была связана с элементом с атомным номером 43. В 1937 году им удалось выделить изотопы технеций-95m и технеций-97 . [20] [21] [ оспаривается – обсудить ] Чиновники Университета Палермо хотели, чтобы они назвали свое открытие панормиумом , в честь латинского названия Палермо , Panormus . В 1947 году [20] элемент 43 был назван в честь греческого слова technetos ( τεχνητός ), что означает «искусственный», поскольку это был первый элемент, полученный искусственно. [7] [11] Сегре вернулся в Беркли и встретился с Гленном Т. Сиборгом . Они выделили метастабильный изотоп технеций-99m , который теперь используется примерно в десяти миллионах медицинских диагностических процедур ежегодно. [22]
В 1952 году астроном Пол В. Меррилл в Калифорнии обнаружил спектральную сигнатуру технеция (в частности, длины волн 403,1 нм , 423,8 нм, 426,2 нм и 429,7 нм) в свете красных гигантов S-типа . [23] Звезды были близки к концу своей жизни, но были богаты короткоживущим элементом, что указывало на то, что он производился в звездах в результате ядерных реакций . Эти доказательства подкрепили гипотезу о том, что более тяжелые элементы являются продуктом нуклеосинтеза в звездах. [21] Совсем недавно такие наблюдения предоставили доказательства того, что элементы образуются путем захвата нейтронов в s-процессе . [24]
После этого открытия было проведено много поисков природных источников технеция в земных материалах. В 1962 году технеций-99 был выделен и идентифицирован в урановой смоляной смоле из Бельгийского Конго в очень малых количествах (около 0,2 нг/кг), [24] где он возник как продукт спонтанного деления урана-238 . Природный ядерный реактор деления в Окло содержит доказательства того, что были произведены значительные количества технеция-99, которые с тех пор распались на рутений-99 . [24]
Характеристики
Физические свойства
Технеций — серебристо-серый радиоактивный металл , внешне похожий на платину , обычно получаемый в виде серого порошка. [25] Кристаллическая структура чистого металла в объеме — гексагональная плотноупакованная , а кристаллическая структура чистого металла в нанодисперсном состоянии — кубическая . Нанодисперсный технеций не имеет расщепленного спектра ЯМР, [26] в то время как гексагональный объемный технеций имеет спектр ЯМР Tc-99, расщепленный на 9 сателлитов. [25] [27] Атомарный технеций имеет характерные линии излучения на длинах волн 363,3 нм , 403,1 нм, 426,2 нм, 429,7 нм и 485,3 нм. [28] Параметры элементарной ячейки орторомбического металла Tc были зарегистрированы, когда Tc загрязнен углеродом ( a = 0,2805(4), b = 0,4958(8), c = 0,4474(5)·нм для Tc-C с 1,38 мас.% C и a = 0,2815(4), b = 0,4963(8), c = 0,4482(5)·нм для Tc-C с 1,96 мас.% C). [29] Металлическая форма является слегка парамагнитной , что означает, что ее магнитные диполи выравниваются с внешними магнитными полями , но будут принимать случайные ориентации после удаления поля. [30] Чистый, металлический, монокристаллический технеций становится сверхпроводником II типа при температурах ниже 7,46 К (−265,69 °C; −446,24 °F). [31] [b] Ниже этой температуры технеций имеет очень большую глубину магнитного проникновения , большую, чем любой другой элемент, за исключением ниобия . [32]
Химические свойства
Технеций находится в 7 группе периодической таблицы, между рением и марганцем . Как и предсказывает периодический закон , его химические свойства находятся между этими двумя элементами. Из этих двух технеций больше похож на рений, особенно по своей химической инертности и тенденции к образованию ковалентных связей . [33] Это согласуется с тенденцией элементов 5 периода напоминать своих коллег из 6 периода больше, чем из 4 периода из-за лантаноидного сжатия . В отличие от марганца, технеций нелегко образует катионы ( ионы с чистым положительным зарядом). Технеций проявляет девять степеней окисления от −1 до +7, причем наиболее распространенными являются +4, +5 и +7. [34] Технеций растворяется в царской водке , азотной кислоте и концентрированной серной кислоте , но не в соляной кислоте любой концентрации. [25]
Металлический технеций медленно тускнеет во влажном воздухе [34] и в виде порошка горит в кислороде . При реакции с водородом при высоком давлении он образует гидрид TcH 1.3 [35], а при реакции с углеродом — Tc 6 C, [29] с параметром ячейки 0,398 нм, а также нанодисперсный карбид с низким содержанием углерода с параметром 0,402 нм. [36]
Технеций может катализировать разрушение гидразина азотной кислотой , и это свойство обусловлено его множественностью валентностей. [37] Это вызвало проблему при отделении плутония от урана при переработке ядерного топлива , где гидразин используется в качестве защитного восстановителя для сохранения плутония в трехвалентном, а не в более стабильном четырехвалентном состоянии. Проблема усугублялась взаимно усиленной экстракцией растворителем технеция и циркония на предыдущей стадии, [38] и потребовала модификации процесса.
Соединения
Пертехнетат и другие производные
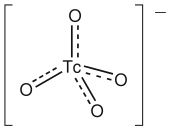
Наиболее распространенной и легкодоступной формой технеция является пертехнетат натрия , Na[TcO 4 ]. Большая часть этого материала производится путем радиоактивного распада из [ 99 MoO 4 ] 2− : [39] [40]
Пертехнетат ( TcO−
4) лишь слабо гидратируется в водных растворах, [41] и ведет себя аналогично перхлорат-аниону, оба из которых являются тетраэдрическими . В отличие от перманганата ( MnO−
4), он является лишь слабым окислителем .
Сродни пертехнетату — гептоксид технеция . Это бледно-желтое, летучее твердое вещество получается путем окисления металла Tc и связанных с ним прекурсоров:
Это молекулярный оксид металла, аналогичный оксиду марганца . Он имеет центросимметричную структуру с двумя типами связей Tc−O с длинами связей 167 и 184 пм. [42]
Гептоксид технеция гидролизуется до пертехнетата и пертехнетовой кислоты в зависимости от pH: [43] [44]
HTcO 4 — сильная кислота. В концентрированной серной кислоте [TcO 4 ] − переходит в октаэдрическую форму TcO 3 (OH)(H 2 O) 2 , сопряженное основание гипотетического триаквокомплекса [ TcO 3 (H 2 O) 3 ] + . [45]
Другие производные халькогенидов
Технеций образует диоксид , [46] дисульфид , диселенид и дителлурид . Неопределенный Tc 2 S 7 образуется при обработке пертехната сероводородом. Он термически разлагается на дисульфид и элементарную серу. [47] Аналогичным образом диоксид может быть получен восстановлением Tc 2 O 7 .
В отличие от случая с рением, триоксид технеция не был выделен. Однако TcO 3 был идентифицирован в газовой фазе с помощью масс-спектрометрии . [48]
Простые гидридные и галогенидные комплексы
Технеций образует комплекс TcH2−
9. Калиевая соль изоструктурна с ReH2−
9[49] При высоком давлении также сообщалось об образовании TcH 1.3 из элементов. [35]

Известны следующие бинарные (содержащие только два элемента) галогениды технеция: TcF 6 , TcF 5 , TcCl 4 , TcBr 4 , TcBr 3 , α-TcCl 3 , β-TcCl 3 , TcI 3 , α-TcCl 2 и β-TcCl 2 . Степени окисления варьируются от Tc(VI) до Tc(II). Галогениды технеция демонстрируют различные типы структур, такие как молекулярные октаэдрические комплексы, протяженные цепи, слоистые листы и металлические кластеры, организованные в трехмерную сеть. [50] [51] Эти соединения получают путем объединения металла и галогена или путем менее прямых реакций.
TcCl 4 получают хлорированием металлического Tc или Tc 2 O 7 . При нагревании TcCl 4 дает соответствующие хлориды Tc(III) и Tc(II). [51]
Структура TcCl 4 состоит из бесконечных зигзагообразных цепочек октаэдров TcCl 6 с общими ребрами . Он изоморфен тетрахлоридам переходных металлов циркония , гафния и платины . [51]
.jpg/440px-Chloro-containing_coordination_complexes_of_technetium_(Tc-99).jpg)
Существуют две полиморфные модификации трихлорида технеция : α- и β-TcCl 3 . Полиморфная модификация α также обозначается как Tc 3 Cl 9 . Она имеет конфациальную биоктаэдрическую структуру . [52] Она получается путем обработки хлорацетата Tc 2 (O 2 CCH 3 ) 4 Cl 2 с помощью HCl. Как и Re 3 Cl 9 , структура α-полиморфной модификации состоит из треугольников с короткими расстояниями MM. β-TcCl 3 имеет октаэдрические центры Tc, которые организованы парами, как это также видно для трихлорида молибдена . TcBr 3 не принимает структуру ни одной из фаз трихлорида. Вместо этого он имеет структуру трибромида молибдена , состоящую из цепочек конфациальных октаэдров с чередующимися короткими и длинными контактами Tc—Tc. TcI 3 имеет ту же структуру, что и высокотемпературная фаза TiI 3 , представляющая собой цепочки конфациальных октаэдров с равными контактами Tc—Tc. [51]
Известно несколько анионных галогенидов технеция. Бинарные тетрагалогениды могут быть преобразованы в гексагалогениды [TcX 6 ] 2− (X = F, Cl, Br, I), которые принимают октаэдрическую молекулярную геометрию . [24] Более восстановленные галогениды образуют анионные кластеры со связями Tc–Tc. Ситуация аналогична для родственных элементов Mo, W, Re. Эти кластеры имеют ядерность Tc 4 , Tc 6 , Tc 8 и Tc 13 . Более стабильные кластеры Tc 6 и Tc 8 имеют форму призмы, где вертикальные пары атомов Tc соединены тройными связями, а плоские атомы — одинарными связями. Каждый атом технеция образует шесть связей, а оставшиеся валентные электроны могут быть насыщены одним аксиальным и двумя мостиковыми лигандными атомами галогена, такими как хлор или бром . [53]
Координационные и металлоорганические комплексы

Технеций образует множество координационных комплексов с органическими лигандами. Многие из них были хорошо изучены из-за их значимости для ядерной медицины . [54]
Технеций образует множество соединений со связями Tc–C, т. е. технециевые органические комплексы. Известными представителями этого класса являются комплексы с лигандами CO, ареновыми и циклопентадиенильными. [55] Бинарный карбонил Tc 2 (CO) 10 представляет собой белое летучее твердое вещество. [56] В этой молекуле два атома технеция связаны друг с другом; каждый атом окружен октаэдрами из пяти карбонильных лигандов. Длина связи между атомами технеция, 303 пм, [57] [58] значительно больше, чем расстояние между двумя атомами в металлическом технеции (272 пм). Похожие карбонилы образуются родственными соединениями технеция , марганцем и рением. [59] Интерес к технециевым органическим соединениям также был мотивирован приложениями в ядерной медицине . [55] Технеций также образует акво-карбонильные комплексы, одним из наиболее известных является комплекс [Tc(CO) 3 (H 2 O) 3 ] + , которые необычны по сравнению с другими карбонилами металлов. [55]
Изотопы
Технеций с атомным номером Z = 43 является элементом с наименьшим номером в периодической таблице, все изотопы которого радиоактивны . Второй по легкости исключительно радиоактивный элемент, прометий , имеет атомный номер 61. [34] Атомные ядра с нечетным числом протонов менее стабильны, чем ядра с четным числом, даже когда общее число нуклонов (протоны + нейтроны ) четное, [60] а элементы с нечетным числом имеют меньше стабильных изотопов .
Наиболее стабильными радиоактивными изотопами являются технеций-97 с периодом полураспада4,21 ± 0,16 миллионов лет и технеций-98 с4,2 ± 0,3 миллиона лет; текущие измерения их периодов полураспада дают перекрывающиеся доверительные интервалы, соответствующие одному стандартному отклонению , и поэтому не позволяют однозначно определить наиболее стабильный изотоп технеция. Следующий наиболее стабильный изотоп — технеций-99, период полураспада которого составляет 211 100 лет. [1] Тридцать четыре других радиоизотопа были охарактеризованы с массовыми числами в диапазоне от 86 до 122. [1] Большинство из них имеют периоды полураспада менее часа, исключениями являются технеций-93 (2,73 часа), технеций-94 (4,88 часа), технеций-95 (20 часов) и технеций-96 (4,3 дня). [61]
Основной режим распада для изотопов легче технеция-98 ( 98 Tc) — электронный захват , в результате которого образуется молибден ( Z = 42). [62] Для технеция-98 и более тяжелых изотопов основным режимом является бета-испускание (испускание электрона или позитрона ), в результате которого образуется рутений ( Z = 44), за исключением того, что технеций-100 может распадаться как путем бета-испускания, так и электронного захвата. [62] [63]
Технеций также имеет многочисленные ядерные изомеры , которые являются изотопами с одним или несколькими возбужденными нуклонами. Технеций-97m ( 97m Tc; «m» означает метастабильность ) является наиболее стабильным, с периодом полураспада 91 день и энергией возбуждения 0,0965 МэВ. [61] За ним следуют технеций-95m (61 день, 0,03 МэВ) и технеций-99m (6,01 часа, 0,142 МэВ). [61]
Технеций-99 ( 99 Tc) является основным продуктом деления урана-235 ( 235 U), что делает его наиболее распространенным и наиболее доступным изотопом технеция. Один грамм технеция-99 производит 6,2 × 108 распадовв секунду (другими словами,удельнаяактивность99Tc составляет 0,62 ГБк/г).[30]
Возникновение и производство
Технеций встречается в земной коре в ничтожно малых концентрациях около 0,003 частей на триллион. Технеций настолько редок, потому что периоды полураспада 97 Tc и 98 Tc составляют всего 4,2 миллиона лет. С момента образования Земли прошло более тысячи таких периодов , поэтому вероятность выживания даже одного атома первичного технеция фактически равна нулю. Однако небольшие количества существуют в виде продуктов спонтанного деления в урановых рудах . Килограмм урана содержит приблизительно 1 нанограмм (10 −9 г), что эквивалентно десяти триллионам атомов технеция. [21] [64] [65] Некоторые красные гигантские звезды со спектральными типами S-, M- и N демонстрируют спектральную линию поглощения, указывающую на присутствие технеция. [25] [66] Эти красные гиганты неофициально известны как звезды технеция .
Отходы деления
В отличие от редкого природного явления, большие количества технеция-99 производятся каждый год из отработанных ядерных топливных стержней , которые содержат различные продукты деления. Деление грамма урана-235 в ядерных реакторах дает 27 мг технеция-99, что дает технецию выход продуктов деления 6,1%. [30] Другие делящиеся изотопы производят аналогичные выходы технеция, такие как 4,9% из урана-233 и 6,21% из плутония-239 . [67] По оценкам, 49 000 ТБк ( 78 метрических тонн ) технеция было произведено в ядерных реакторах между 1983 и 1994 годами, что является доминирующим источником земного технеция. [68] [69] Только часть продукции используется в коммерческих целях. [c]
Технеций-99 образуется в результате ядерного деления как урана-235, так и плутония-239. Поэтому он присутствует в радиоактивных отходах и в ядерных осадках от взрывов атомных бомб . Его распад, измеряемый в беккерелях на количество отработанного топлива, является основным источником радиоактивности ядерных отходов примерно через 104 ~ 106 летпосле создания ядерных отходов.[68]С 1945 по 1994 годв окружающую среду во время атмосферныхядерных испытанийТБк.[68][70]Количество технеция-99 из ядерных реакторов, выброшенного в окружающую среду до 1986 года, составляет порядка 1000 ТБк (около 1600 кг), в основном за счетпереработки ядерного топлива; большая часть этого была сброшена в море. С тех пор методы переработки сократили выбросы, но по состоянию на 2005 год основной выброс технеция-99 в окружающую среду произошел нав СеллафилдеИрландское морепо оценкам, 550 ТБк (около 900 кг).[69] С 2000 года количество было ограничено нормативами до 90 ТБк (около 140 кг) в год.[71]Сброс технеция в море привел к загрязнению некоторых морепродуктов незначительными количествами этого элемента. Например,европейские омарыи рыба из западнойКамбриисодержат около 1 Бк/кг технеция.[72][73][d]
Продукт деления для коммерческого использования
Метастабильный изотоп технеций-99m непрерывно образуется как продукт деления урана или плутония в ядерных реакторах :
Поскольку отработанное топливо выдерживается в течение нескольких лет перед переработкой, весь молибден-99 и технеций-99m распадаются к тому времени, когда продукты деления отделяются от основных актинидов при обычной ядерной переработке . Жидкость, оставшаяся после извлечения плутония и урана ( PUREX ), содержит высокую концентрацию технеция в виде TcO−
4но почти все это технеций-99, а не технеций-99m. [75]
Подавляющее большинство технеция-99m, используемого в медицинской работе, производится путем облучения специальных мишеней из высокообогащенного урана в реакторе, извлечения молибдена-99 из мишеней на перерабатывающих предприятиях [40] и восстановления в диагностическом центре технеция-99m, полученного при распаде молибдена-99. [76] [77] Молибден-99 в форме молибдата MoO2−
4адсорбируется на кислом оксиде алюминия ( Al
2О
3) в экранированном колоночном хроматографе внутри генератора технеция-99m («технециевая корова», также иногда называемая «молибденовой коровой»). Период полураспада молибдена-99 составляет 67 часов, поэтому короткоживущий технеций-99m (период полураспада: 6 часов), который является результатом его распада, постоянно образуется. [21] Растворимый пертехнетат TcO−
4Затем его можно химически извлечь путем элюирования с использованием солевого раствора . Недостатком этого процесса является то, что он требует мишеней, содержащих уран-235, которые подлежат мерам безопасности, применяемым к делящимся материалам. [78] [79]

Почти две трети мировых поставок поступают из двух реакторов: Национального исследовательского универсального реактора в Chalk River Laboratories в Онтарио, Канада, и реактора High Flux в Nuclear Research and Consultancy Group в Петтене, Нидерланды. Все основные реакторы, которые производят технеций-99m, были построены в 1960-х годах и близки к концу срока службы . Два новых канадских реактора Multipurpose Applied Physics Lattice Experiment, запланированные и построенные для производства 200% потребности в технеции-99m, освободили всех других производителей от строительства собственных реакторов. С отменой уже испытанных реакторов в 2008 году будущие поставки технеция-99m стали проблематичными. [80]
Утилизация отходов
Длительный период полураспада технеция-99 и его способность образовывать анионные виды создают серьезную проблему для долгосрочного захоронения радиоактивных отходов . Многие из процессов, разработанных для удаления продуктов деления на заводах по переработке, нацелены на катионные виды, такие как цезий (например, цезий-137 ) и стронций (например, стронций-90 ). Следовательно, пертехнетат улетучивается через эти процессы. Текущие варианты захоронения предпочитают захоронение в континентальных, геологически стабильных породах. Основная опасность при такой практике заключается в вероятности того, что отходы будут контактировать с водой, которая может выщелачивать радиоактивное загрязнение в окружающую среду. Анионный пертехнетат и иодид, как правило, не адсорбируются на поверхности минералов и, скорее всего, будут вымыты. Для сравнения, плутоний , уран и цезий, как правило, связываются с частицами почвы. Технеций может быть иммобилизован некоторыми средами, такими как микробная активность в донных отложениях озер [81] , и химия окружающей среды технеция является областью активных исследований. [82]
Альтернативный метод утилизации, трансмутация , был продемонстрирован в ЦЕРНе для технеция-99. В этом процессе технеций (технеций-99 как металлическая мишень) бомбардируется нейтронами для образования короткоживущего технеция-100 (период полураспада = 16 секунд), который распадается путем бета-распада до стабильного рутения -100. Если целью является извлечение пригодного к использованию рутения, необходима чрезвычайно чистая мишень из технеция; если в мишени присутствуют небольшие следы второстепенных актинидов, таких как америций и кюрий , они, вероятно, подвергнутся делению и образуют больше продуктов деления , которые увеличивают радиоактивность облученной мишени. Образование рутения-106 (период полураспада 374 дня) из «свежего деления», вероятно, увеличит активность конечного металлического рутения, которому затем потребуется более длительное время охлаждения после облучения, прежде чем рутений можно будет использовать. [83]
Фактическое отделение технеция-99 от отработанного ядерного топлива — длительный процесс. Во время переработки топлива он выходит как компонент высокорадиоактивной жидкости отходов. После нескольких лет выдержки радиоактивность снижается до уровня, при котором становится возможным извлечение долгоживущих изотопов, включая технеций-99. Серия химических процессов дает металлический технеций-99 высокой чистоты. [84]
Активация нейтронов
Молибден-99 , который распадается с образованием технеция-99m, может быть образован путем нейтронной активации молибдена-98. [85] При необходимости другие изотопы технеция не производятся в значительных количествах путем деления, а производятся путем нейтронного облучения родительских изотопов (например, технеций-97 может быть получен путем нейтронного облучения рутения-96 ). [86]
Ускорители частиц
Возможность производства технеция-99m с бомбардировкой протонами с энергией 22 МэВ мишени из молибдена-100 в медицинских циклотронах после реакции 100 Mo(p,2n) 99m Tc была продемонстрирована в 1971 году. [87] Недавний дефицит медицинского технеция-99m возродил интерес к его производству путем бомбардировки протонами изотопно обогащенных (>99,5%) мишеней из молибдена-100. [88] [89] Изучаются другие методы получения молибдена-99 из молибдена-100 с помощью реакций (n,2n) или (γ,n) в ускорителях частиц. [90] [91] [92]
Приложения
Ядерная медицина и биология

Технеций-99m («m» указывает на то, что это метастабильный ядерный изомер) используется в радиоактивных изотопных медицинских тестах . Например, технеций-99m является радиоактивным индикатором , который медицинское оборудование для визуализации отслеживает в организме человека. [21] [88] Он хорошо подходит для этой роли, поскольку он испускает легко обнаруживаемые гамма-лучи 140 кэВ , а его период полураспада составляет 6,01 часа (это означает, что около 94% его распадается до технеция-99 за 24 часа). [30] Химия технеция позволяет ему связываться с различными биохимическими соединениями, каждое из которых определяет, как он метаболизируется и откладывается в организме, и этот единственный изотоп может быть использован для множества диагностических тестов. Более 50 распространенных радиофармпрепаратов основаны на технеции-99m для визуализации и функциональных исследований мозга , сердечной мышцы, щитовидной железы , легких , печени , желчного пузыря , почек , скелета , крови и опухолей . [93]
Более долгоживущий изотоп технеций-95m с периодом полураспада 61 день используется в качестве радиоактивного индикатора для изучения движения технеция в окружающей среде, а также в растительных и животных системах. [94]
Промышленная и химическая
Технеций-99 распадается почти полностью путем бета-распада, испуская бета-частицы с постоянными низкими энергиями и без сопутствующих гамма-лучей. Более того, его длительный период полураспада означает, что эта эмиссия уменьшается очень медленно со временем. Его также можно извлечь до высокой химической и изотопной чистоты из радиоактивных отходов. По этим причинам он является стандартным бета-излучателем Национального института стандартов и технологий (NIST) и используется для калибровки оборудования. [95] Технеций-99 также был предложен для оптоэлектронных устройств и наноразмерных ядерных батарей . [96]
Подобно рению и палладию , технеций может служить катализатором . В таких процессах, как дегидрирование изопропилового спирта , он является гораздо более эффективным катализатором, чем рений или палладий. Однако его радиоактивность является серьезной проблемой в безопасных каталитических применениях. [97]
Когда сталь погружают в воду, добавление небольшой концентрации (55 ppm ) пертехнетата(VII) калия в воду защищает сталь от коррозии, [98] даже если температура повышается до 250 °C (523 K). [99] По этой причине пертехнетат использовался в качестве анодного ингибитора коррозии для стали, хотя радиоактивность технеция создает проблемы, которые ограничивают это применение автономными системами. [100] В то время как (например) CrO2−
4может также ингибировать коррозию, для этого требуется концентрация в десять раз выше. В одном эксперименте образец углеродистой стали выдерживался в водном растворе пертехнетата в течение 20 лет и все еще не подвергся коррозии. [99] Механизм, с помощью которого пертехнетат предотвращает коррозию, не совсем понятен, но, по-видимому, включает обратимое образование тонкого поверхностного слоя ( пассивацию ). Одна из теорий утверждает, что пертехнетат реагирует с поверхностью стали, образуя слой диоксида технеция , который предотвращает дальнейшую коррозию; тот же эффект объясняет, как железный порошок может быть использован для удаления пертехнетата из воды. Эффект быстро исчезает, если концентрация пертехнетата падает ниже минимальной концентрации или если добавляется слишком высокая концентрация других ионов. [101]
Как уже отмечалось, радиоактивная природа технеция (3 МБк/л при требуемых концентрациях) делает эту защиту от коррозии непрактичной почти во всех ситуациях. [98] Тем не менее, защита от коррозии с помощью ионов пертехнетата была предложена (но никогда не принята) для использования в кипящих реакторах . [101]
Меры предосторожности
Технеций не играет никакой естественной биологической роли и обычно не встречается в организме человека. [25] Технеций производится в большом количестве при ядерном делении и распространяется быстрее, чем многие радионуклиды. По-видимому, он обладает низкой химической токсичностью. Например, никаких существенных изменений в формуле крови, весе тела и органов, а также потреблении пищи не было обнаружено у крыс, которые принимали до 15 мкг технеция-99 на грамм пищи в течение нескольких недель. [102] В организме технеций быстро преобразуется в стабильный TcO−
4ион, который хорошо растворяется в воде и быстро выводится. Радиологическая токсичность технеция (на единицу массы) является функцией соединения, типа излучения для рассматриваемого изотопа и периода полураспада изотопа. [103]
Со всеми изотопами технеция необходимо обращаться осторожно. Наиболее распространенный изотоп, технеций-99, является слабым бета-излучателем; такое излучение задерживается стенками лабораторной посуды. Основная опасность при работе с технецием — вдыхание пыли; такое радиоактивное загрязнение легких может представлять значительный риск возникновения рака. Для большинства работ достаточно осторожного обращения в вытяжном шкафу , а перчаточный бокс не нужен. [104]
Примечания
- ^ Самый стабильный изотоп технеция не может быть определен на основе существующих данных из-за перекрывающихся неопределенностей измерений для периодов полураспада двух самых долгоживущих изотопов. Период полураспада 97 Tc с неопределенностью, соответствующей одному стандартному отклонению, равен4,21 ± 0,16 миллионов лет, тогда как для 98 Tc это4,2 ± 0,3 миллиона лет; эти измерения имеют перекрывающиеся доверительные интервалы . [1]
- ^ Нерегулярные кристаллы и следы примесей повышают эту температуру перехода до 11,2 К для 99,9% чистого порошка технеция. [31]
- ^ С 2005 года [обновлять]технеций-99 в форме пертехнетата аммония доступен владельцам разрешения Национальной лаборатории Ок-Ридж . [25]
- ^ Анаэробные , спорообразующие бактерии рода Clostridium способны восстанавливать Tc(VII) до Tc(IV). Бактерии Clostridia играют роль в восстановлении железа, марганца и урана, тем самым влияя на растворимость этих элементов в почве и отложениях. Их способность восстанавливать технеций может определять большую часть подвижности технеция в промышленных отходах и других подземных средах. [74]
Ссылки
- ^ abcd Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "Оценка ядерных свойств NUBASE2020" (PDF) . Chinese Physics C. 45 ( 3): 030001. doi :10.1088/1674-1137/abddae.
- ^ abc Arblaster, John W. (2018). Selected Values of the Crystallographic Properties of Elements . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcdef Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 28. ISBN 978-0-08-037941-8.
- ^ Mattolat, C.; Gottwald, T.; Raeder, S.; Rothe, S.; Schwellnus, F.; Wendt, K.; Thörle-Pospiech, P.; Trautmann, N. (24 мая 2010 г.). "Определение первого потенциала ионизации технеция". Physical Review A. 81 : 052513. doi :10.1103/PhysRevA.81.052513.
- ^ Уист, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Йонге; Пауэлс, EK (1996). «Технеций, недостающий элемент». Европейский журнал ядерной медицины . 23 (3): 336–44 . doi :10.1007/BF00837634. PMID 8599967. S2CID 24026249.
- ^ ab Holden, NE "История происхождения химических элементов и их первооткрыватели". Брукхейвенская национальная лаборатория . Получено 5 мая 2009 г.
- ^ Германн, Р. (1847). «Untersuchungen über das Ilmenium». Журнал практической химии . 40 : 457–480 . doi : 10.1002/prac.184704001110.
- ^ Yoshihara, HK (2004). «Открытие нового элемента „ниппоний“: переоценка пионерских работ Масатаки Огавы и его сына Эйдзиро Огавы». Spectrochimica Acta Часть B. 59 ( 8): 1305– 1310. Bibcode : 2004AcSpB..59.1305Y. doi : 10.1016/j.sab.2003.12.027.
- ^ Хисамацу, Ёдзи; Эгашира, Казухиро; Маэно, Ёситеру (2022). «Ниппоний Огавы и его переназначение на рений». Основы химии . 24 : 15–57 . doi : 10.1007/s10698-021-09410-x .
- ^ ab van der Krogt, P. "Technetium". Elentymolgy and Elements Multidict . Получено 5 мая 2009 г.
- ^ Аб Скерри, Эрик (2013). Сказка о семи стихиях . Издательство Оксфордского университета. С. 109–114 , 125–131 . ISBN. 978-0-19-539131-2.
- ^ Эмсли 2001, стр. 423.
- ^ Армстронг, Дж. Т. (2003). «Технеций». Новости химии и машиностроения . 81 (36): 110. doi :10.1021/cen-v081n036.p110 . Получено 11 ноября 2009 г.
- ^ Nies, KA (2001). "Ida Tacke and the warfare behind the discovery of fission". Архивировано из оригинала 9 августа 2009 года . Получено 5 мая 2009 года .
- ^ Weeks, ME (1933). «Открытие элементов. XX. Недавно открытые элементы». Журнал химического образования . 10 (3): 161– 170. Bibcode : 1933JChEd..10..161W. doi : 10.1021/ed010p161.
- ^ Хабаши, Фатхи (2006). «История элемента 43 — технеция». Журнал химического образования . 83 (2): 213. Бибкод : 2006JChEd..83..213H. дои : 10.1021/ed083p213.1 . Проверено 2 января 2023 г.
- ^ Хейзерман, Д. Л. (1992). "Элемент 43: Технеций". Исследование химических элементов и их соединений . Нью-Йорк, Нью-Йорк: TAB Books. стр. 164. ISBN 978-0-8306-3018-9.
- ^ Сегре, Эмилио (1993). Разум всегда в движении: автобиография Эмилио Сегре. Беркли, Калифорния: Издательство Калифорнийского университета. С. 115–118. ISBN 978-0520076273.
- ^ ab Perrier, C.; Segrè, E. (1947). "Технеций: элемент с атомным номером 43". Nature . 159 (4027): 24. Bibcode :1947Natur.159...24P. doi :10.1038/159024a0. PMID 20279068. S2CID 4136886.
- ^ abcde Эмсли 2001, стр. 422–425.
- ^ Хоффман, Дарлин К.; Гиорсо, Альберт; Сиборг, Гленн Т. (2000). "Глава 1.2: Первые дни в Берклийской радиационной лаборатории". Трансурановые люди: внутренняя история . Национальная лаборатория Лоуренса в Беркли . Беркли, Калифорния: Издательство Калифорнийского университета. стр. 15. ISBN 978-1-86094-087-3. Архивировано из оригинала 24 января 2007 . Получено 31 марта 2007 .
- ^ Merrill, PW (1952). «Технеций в звездах». Science . 115 (2992): 479– 489, особенно 484. Bibcode :1952Sci...115..479.. doi :10.1126/science.115.2992.479. PMID 17792758.
- ^ abcd Schwochau 2000, стр. 7–9
- ^ abcdef Hammond 2004, стр. [ нужна страница ] .
- ^ Кузнецов, Виталий В.; Пуано, Фредерик; Герман, Константин Э.; Филатова, Елена А. (11 ноября 2024 г.). "Pivotal role of 99Tc NMR spectroscopic in solid-state and molecular chemistry". Communications Chemistry . 7 (1): 259. doi :10.1038/s42004-024-01349-2. ISSN 2399-3669. PMC 11555319 . PMID 39528801.
- ^ Тарасов, ВП; Муравлев, Ю. Б.; Герман, КЕ; Попова, НН (2001). "99Tc ЯМР нанесенных наночастиц технеция". Доклады физической химии . 377 ( 1– 3): 71– 76. doi :10.1023/A:1018872000032. S2CID 91522281.
- ^ Лиде, Дэвид Р. (2004–2005). «Линейчатые спектры элементов». Справочник CRC . Издательство CRC. С. 10–70 (1672). ISBN 978-0-8493-0595-5.
- ^ ab German, KE; Перетрухин В.Ф.; Гедговд, КН; Григорьев, М.С.; Тарасов А.В.; Плеханов Ю. В.; и др. (2005). «Карбид Tc и новая ромбическая металлическая фаза Tc». Журнал ядерных и радиохимических наук . 6 (3): 211–214 . doi : 10.14494/jnrs2000.6.3_211 .
- ^ abcd Римшоу, С. Дж. (1968). Хэмпел, К. А. (ред.). Энциклопедия химических элементов . Нью-Йорк, Нью-Йорк: Reinhold Book Corporation. С. 689–693.
- ^ ab Schwochau 2000, стр. 96.
- ^ Autler, SH (лето 1968 г.). Технеций как материал для сверхпроводимости переменного тока (PDF) . Летнее исследование 1968 г. по сверхпроводящим устройствам и ускорителям . Получено 5 мая 2009 г. .
- ↑ Гринвуд и Эрншоу 1997, стр. 1044.
- ^ abc Husted, R. (15 декабря 2003 г.). "Технеций". Периодическая таблица элементов. Лос-Аламос, Нью-Мексико: Национальная лаборатория Лос-Аламоса . Получено 11 октября 2009 г.
- ^ Аб Чжоу, Ди; Семенок Дмитрий В.; Волков Михаил А.; Троян Иван А.; Серегин Алексей Юрьевич; Чепкасов Илья Владимирович; и др. (6 февраля 2023 г.). «Синтез гидрида технеция TcH1.3 при 27 ГПа». Физический обзор B . 107 (6): 064102. arXiv : 2210.01518 . Бибкод : 2023PhRvB.107f4102Z. doi :10.1103/PhysRevB.107.064102.
- ^ Кузнецов, Виталий В.; Герман, Константин Е.; Наговицына, Ольга А.; Филатова, Елена А.; Волков, Михаил А.; Ситанская, Анастасия В.; Пшеничкина, Татьяна В. (31 октября 2023 г.). «Путь к стабилизации нанотехнеция в аморфной углеродной матрице: методы подготовки, данные XAFS и электрохимические исследования». Неорганическая химия . 62 (45): 18660– 18669. doi :10.1021/acs.inorgchem.3c03001. ISSN 0020-1669. PMID 37908073.
- ^ Гарравей, Джон (1984). «Окисление гидразина азотной кислотой, катализируемое технецием». Журнал Less Common Metals . 97 : 191–203 . doi :10.1016/0022-5088(84)90023-7.
- ^ Гарравей, Дж. (1985). «Совместная экстракция пертехнетата и циркония три-н-бутилфосфатом». Журнал Less Common Metals . 106 (1): 183– 192. doi :10.1016/0022-5088(85)90379-0.
- ^ Швохау 2000, стр. 127–136.
- ^ ab Moore, PW (апрель 1984). "Технеций-99 в генераторных системах" (PDF) . Журнал ядерной медицины . 25 (4): 499– 502. PMID 6100549 . Получено 11 мая 2012 .
- ^ Устынюк, Юрий А.; Глориозов Игорь П.; Жохова Нелли И.; Герман Константин Евгеньевич; Калмыков, Степан Н. (15 ноября 2021 г.). «Гидратация пертехнетат-аниона. Исследование DFT». Журнал молекулярных жидкостей . 342 : 117404. doi : 10.1016/j.molliq.2021.117404. ISSN 0167-7322.
- ^ Кребс, Б. (1969). «Оксид технеция (VII): Ein ÜbergangsmetallOX mit Molekülstruktur im festen Zustand» [Оксид технеция (VII), оксид переходного металла с молекулярной структурой в твердом состоянии]. Angewandte Chemie (на немецком языке). 81 (9): 328–329 . Бибкод : 1969АнгЧ..81..328К. дои : 10.1002/ange.19690810905.
- ^ Швохау 2000, стр. 127.
- ^ Херрелл, AY; Бьюзи, Р.Х.; Гейер, К.Х. (1977). Оксид технеция (VII) в неорганическом синтезе . Том. XVII. стр. 155–158 . ISBN. 978-0-07-044327-3.
- ^ Poineau F, Weck PF, German K, Maruk A, Kirakosyan G, Lukens W и др. (2010). "Speciation of heptavalent technetium in Serbia acid: Structural and spectroscopic studies" (PDF) . Dalton Transactions . 39 (37): 8616– 8619. doi :10.1039/C0DT00695E. PMID 20730190. S2CID 9419843. Архивировано из оригинала (PDF) 5 марта 2017 г. . Получено 14 ноября 2011 г. .
- ^ Швохау 2000, стр. 108.
- ^ Швохау 2000, стр. 112–113.
- ^ Гибсон, Джон К. (1993). «Высокотемпературные оксидные и гидроксидные паровые разновидности технеция». Radiochimica Acta . 60 ( 2–3 ): 121–126 . doi :10.1524/ract.1993.60.23.121. S2CID 99795348.
- ^ Швохау 2000, стр. 146.
- ^ Джонстон, Э.В. (май 2014 г.). Двойные галогениды технеция (диссертация). Лас-Вегас, Невада: Университет Невады . doi :10.34917/5836118 – через UNLV Theses, Dissertations, Professional Papers, and Capstones.
- ^ abcd Пуано, Фредерик; Джонстон, Эрик В.; Червински, Кеннет Р.; Саттельбергер, Альфред П. (2014). «Последние достижения в химии галогенидов технеция». Accounts of Chemical Research . 47 (2): 624– 632. doi :10.1021/ar400225b. PMID 24393028.
- ^ Poineau, Frederic; Johnstone, Erik V.; Weck, Philippe F.; Kim, Eunja; Forster, Paul M.; Scott, Brian L.; et al. (2010). «Синтез и структура трихлорида технеция». Журнал Американского химического общества . 132 (45): 15864– 15865. doi :10.1021/ja105730e. PMID 20977207.
- ^ Герман, К. Э.; Крючков, С. В. (2002). «Полиядерные кластеры галогенидов технеция». Журнал неорганической химии . 47 (4): 578–583 . Архивировано из оригинала 22 декабря 2015 г.
- ^ Бартоломе, Марк Д.; Луи, Аника С.; Валиант, Джон Ф.; Зубиета, Джон (2010). «Радиофармацевтические препараты на основе технеция и галлия: сравнение и сопоставление химии двух важных радиометаллов для эпохи молекулярной визуализации». Chemical Reviews . 110 (5): 2903– 20. doi :10.1021/cr1000755. PMID 20415476.
- ^ abc Alberto, Roger (2010). "Органометаллические радиофармацевтические препараты". Медицинская металлоорганическая химия . Темы металлоорганической химии. Том 32. С. 219– 246. doi :10.1007/978-3-642-13185-1_9. ISBN 978-3-642-13184-4.
- ^ Hileman, JC; Huggins, DK; Kaesz, HD (1961). «Технеций карбонил». Журнал Американского химического общества . 83 (13): 2953– 2954. doi :10.1021/ja01474a038.
- ^ Бейли, МФ; Даль, Лоуренс Ф. (1965). «Кристаллическая структура декакарбонила дитехнеция». Неорганическая химия . 4 (8): 1140– 1145. doi :10.1021/ic50030a011.
- ^ Уоллах, Д. (1962). "Элементарная ячейка и пространственная группа карбонила технеция, Tc2(CO)10". Acta Crystallographica . 15 (10): 1058. Bibcode : 1962AcCry..15.1058W. doi : 10.1107/S0365110X62002789.
- ^ Швохау 2000, стр. 286, 328.
- ^ Клейтон, Д. Д. (1983). Принципы звездной эволюции и нуклеосинтеза: с новым предисловием . Издательство Чикагского университета. стр. 547. ISBN 978-0-226-10953-4.
- ^ abc Holden, NE (2006). Lide, DR (ред.). Handbook of Chemistry and Physics (87-е изд.). Boca Raton, FL: CRC Press. стр. 11‑88 – 11‑89. ISBN 978-0-8493-0487-3.
- ^ ab Sonzogni, AA (ред.). "Chart of nuclides". Национальный центр ядерных данных. Брукхейвен, Нью-Йорк: Брукхейвенская национальная лаборатория . Архивировано из оригинала 25 августа 2009 года . Получено 11 ноября 2009 года .
- ^ Lide, David R., ред. (2004–2005). «Таблица изотопов». Справочник CRC по химии и физике . Бока-Ратон, Флорида: CRC press.
- ^ Диксон, П.; Кертис, Дэвид Б.; Масгрейв, Джон; Рёнш, Фред; Роуч, Джефф; Рокоп, Дон (1997). «Анализ естественно произведенного технеция и плутония в геологических материалах». Аналитическая химия . 69 (9): 1692– 1699. doi :10.1021/ac961159q. PMID 21639292.
- ^ Кертис, Д.; Фабрика-Мартин, июнь; Диксон, Пол; Крамер, Ян (1999). «Необычные элементы природы: плутоний и технеций». Geochimica et Cosmochimica Acta . 63 (2): 275. Бибкод : 1999GeCoA..63..275C. дои : 10.1016/S0016-7037(98)00282-8.
- ^ Мур, CE (1951). «Технеций на Солнце». Science . 114 (2951): 59– 61. Bibcode : 1951Sci...114...59M. doi : 10.1126/science.114.2951.59. PMID 17782983.
- ^ Швохау 2000, стр. 374–404.
- ^ abc Yoshihara, K. (1996). "Технеций в окружающей среде". В Yoshihara, K.; Omori, T. (ред.). Технеций и рений: их химия и ее применение . Темы в Current Chemistry. Т. 176. Берлин / Гейдельберг, Германия: Springer-Verlag. стр. 17–35 . doi :10.1007/3-540-59469-8_2. ISBN 978-3-540-59469-7.
- ^ ab Гарсия-Леон, М. (2005). "99Tc в окружающей среде: источники, распределение и методы" (PDF) . Журнал ядерных и радиохимических наук . 6 (3): 253– 259. doi : 10.14494/jnrs2000.6.3_253 .
- ^ Десмет, Г.; Миттенэр, К. (1986). Технеций в окружающей среде. Springer. стр. 69. ISBN 978-0-85334-421-6.
- ^ Тагами, К. (2000). «Поведение технеция-99 в земной среде — полевые наблюдения и эксперименты с радиоактивными индикаторами». Журнал ядерных и радиохимических наук . 4 : A1 – A8 . doi : 10.14494/jnrs2000.4.a1 .
- ^ Szefer, P.; Nriagu, JO (2006). Минеральные компоненты в пищевых продуктах. CRC Press. стр. 403. ISBN 978-0-8493-2234-1.
- ^ Харрисон, Дж. Д.; Фиппс, А. (2001). «Передача через кишечник и дозы от технеция из окружающей среды». Журнал радиологической защиты . 21 (1): 9– 11. Bibcode : 2001JRP....21....9H. doi : 10.1088/0952-4746/21/1/004. PMID 11281541. S2CID 250752077.
- ^ Фрэнсис, AJ; Додж, CJ; Мейнкен, GE (2002). «Биотрансформация пертехнетата клостридиями». Радиохимика Акта . 90 ( 9–11 ): 791–797 . doi :10.1524/ract.2002.90.9-11_2002.791. S2CID 83759112.
- ^ Швохау 2000, стр. 39.
- ↑ US 3799883, Хирофуми Арино, «Ступенька из древесного угля с серебряным покрытием», выдан 26 марта 1974 г., передан Union Carbide Corporation
- ^ Комитет по производству медицинских изотопов без высокообогащенного урана (2009). Производство медицинских изотопов без высокообогащенного урана . National Academies Press. стр. vii. ISBN 978-0-309-13040-0.
- ^ Лютценкирхен, К.-Р. «Сыщики ядерной криминалистики отслеживают происхождение незаконно перевозимых материалов». Национальная лаборатория Лос-Аламоса. Архивировано из оригинала 16 февраля 2013 года . Получено 11 ноября 2009 года .
- ^ Snelgrove, JL; Hofman, GL (1995). Development and Processing of LEU Targets for Mo-99 Production (PDF) . Международное совещание 1995 года по уменьшению обогащения для исследовательских и испытательных реакторов, 18–21 сентября 1994 года, Париж, Франция. ANL.gov . Получено 5 мая 2009 года .
- ^ Томас, Грегори С.; Маддахи, Джамшид (2010). «Нехватка технеция». Журнал ядерной кардиологии . 17 (6): 993– 8. doi :10.1007/s12350-010-9281-8. PMID 20717761. S2CID 2397919.
- ^ Герман, Константин Э.; Фирсова, Е.В.; Перетрухин, В.Ф.; Хижняк, ТВ; Симонов, М. (2003). «Биоаккумуляция Tc, Pu и Np на донных отложениях двух типов пресноводных озер Московской области». Радиохимия . 45 (6): 250–256 . Bibcode :2003Radch..45..250G. doi :10.1023/A:1026008108860. S2CID 55030255.
- ^ Шоу, Г. (2007). Радиоактивность в земной среде. Elsevier. стр. 147. ISBN 978-0-08-043872-6.
- ^ Альтомаре, П.; Бернарди (1979). Альтернативные концепции утилизации высокоактивных и трансурановых радиоактивных отходов. Агентство по охране окружающей среды США.
- ^ Швохау 2000, стр. 87–96.
- ^ "Руководство по радиоизотопам, полученным в реакторах" (PDF) . МАГАТЭ. Январь 2003 г. Получено 27 августа 2009 г.
- ^ Келли, Дж. Дж. (1980). Наблюдение за сбросами и радиацией в окружающую среду: симпозиум. ASTM International. стр. 91.
- ^ Бивер, Дж. Э.; Хапф, Х. Б. (ноябрь 1971 г.). «Производство 99mTc на медицинском циклотроне: исследование осуществимости» (PDF) . Журнал ядерной медицины . 12 (11): 739–741 . PMID 5113635.
- ^ ab Laurence Knight (30 мая 2015 г.). «Элемент, который может заставить кости светиться». BBC News . Получено 30 мая 2015 г.
- ^ Guérin B, Tremblay S, Rodrigue S, Rousseau JA и др. (2010). «Циклотронное производство 99mTc: подход к медицинскому изотопному кризису» (PDF) . Журнал ядерной медицины . 51 (4): 13N – 6N . PMID 20351346.
- ^ Scholten, Bernhard; Lambrecht, Richard M.; Cogneau, Michel; Vera Ruiz, Hernan; Qaim, Syed M. (25 мая 1999 г.). "Функции возбуждения для циклотронного производства 99m Tc и 99 Mo". Applied Radiation and Isotopes . 51 (1): 69– 80. Bibcode : 1999AppRI..51...69S. doi : 10.1016/S0969-8043(98)00153-5.
- ^ Takács, S.; Szűcs, Z.; Tárkányi, F.; Hermanne, A.; Sonck, M. (1 января 2003 г.). «Оценка реакций, вызванных протонами, на 100 Mo: новые сечения для производства 99m Tc и 99 Mo». Журнал радиоаналитической и ядерной химии . 257 (1): 195– 201. doi :10.1023/A:1024790520036. S2CID 93040978.
- ^ Celler, A.; Hou, X.; Bénard, F.; Ruth, T. (2011). «Теоретическое моделирование выходов для реакций, вызванных протонами, на природных и обогащенных молибденовых мишенях». Physics in Medicine and Biology . 56 (17): 5469– 5484. Bibcode : 2011PMB....56.5469C. doi : 10.1088/0031-9155/56/17/002. PMID 21813960. S2CID 24231457.
- ^ Швохау 2000, стр. 414.
- ^ Швохау 2000, стр. 12–27.
- ^ Швохау 2000, стр. 87.
- ^ Джеймс С. Туленко; Дин Шенфельд; Дэвид Хинтенланг; Карл Крейн; Шеннон Риджуэй; Хосе Сантьяго; Чарльз Шир (30 ноября 2006 г.). University Research Program in Robotics REPORT (PDF) (Report). Университет Флориды. doi :10.2172/895620 . Получено 12 октября 2007 г. .
- ^ Швохау 2000, стр. 87–90.
- ^ ab "Technetium (Tc)". American Elements: The Materials Science Company . Получено 24 мая 2024 г.
- ^ ab Emsley 2001, стр. 425.
- ^ "Гл. 14 Методы разделения" (PDF) . EPA: 402-b-04-001b-14-final . Агентство по охране окружающей среды США. Июль 2004 г. Архивировано (PDF) из оригинала 8 марта 2014 г. Получено 4 августа 2008 г.
- ^ ab Schwochau 2000, стр. 91.
- ^ Десмет, Г.; Миттенэр, К. (1986). Технеций в окружающей среде. Springer. стр. 392–395 . ISBN 978-0-85334-421-6.
- ^ Швохау 2000, стр. 371–381.
- ^ Швохау 2000, стр. 40.
Библиография
- Эмсли, Дж. (2001). Строительные блоки природы: путеводитель по элементам от А до Я. Оксфорд, Англия, Великобритания: Oxford University Press. ISBN 978-0-19-850340-8.
- Гринвуд, NN; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд, Великобритания: Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Hammond, CR (2004). "The Elements". Справочник по химии и физике (81-е изд.). Boca Raton, FL: CRC press. ISBN 978-0-8493-0485-9.
- Шерри, Эрик (2013). Повесть о семи стихиях . Оксфорд, Великобритания: Oxford University Press. ISBN 9780195391312.
- Швохау, К. (2000). Технеций: Химия и радиофармацевтические применения. Вайнхайм, Делавэр: Wiley-VCH. ISBN 978-3-527-29496-1– через Google Книги.
Дальнейшее чтение
- Choppin, G.; Liljenzin, J.-O .; Rydberg, J. (2002). "Масса ядра и стабильность". Радиохимия и ядерная химия (3-е изд.). Butterworth-Heinemann. стр. 41–57 . ISBN 978-0-7506-7463-8– через Google Книги.
- Коттон, ФА; Уилкинсон, Г.; Мурильо, Калифорния; Бохманн, М. (1999). Продвинутая неорганическая химия (6-е изд.). Нью-Йорк, штат Нью-Йорк: Джон Уайли и сыновья. ISBN 978-0-471-19957-1.
- Шерри, Э. Р. (2007). Периодическая таблица: ее история и ее значение . Oxford University Press. ISBN 978-0-19-530573-9.
- Wilson, BJ, ред. (1966). Радиохимическое руководство (2-е изд.). Технология AEA. ISBN 978-0-7058-1768-4.
- «Технеций». EnvironmentalChemistry.com . Получено 1 декабря 2002 г. .
- Таблица нуклидов (Отчет). Национальный центр ядерных данных. Брукхейвен, Нью-Йорк: Брукхейвенская национальная лаборатория . Архивировано из оригинала 28 апреля 2021 г.
Внешние ссылки
- Технеций (видео). Периодическая таблица видео . Ноттингем, Великобритания: Ноттингемский университет.



![{\displaystyle {\ce {^{238}_{92}U ->[{\ce {sf}}] ^{137}_{53}I + ^{99}_{39}Y + 2^{1}_{0}n}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/69e432873016029d0ca91cbd92c76fc15631fd66)
![{\displaystyle {\ce {^{99}_{39}Y ->[\beta^-][1.47\,{\ce {s}}] ^{99}_{40}Zr ->[\beta ^-][2.1\,{\ce {s}}] ^{99}_{41}Nb ->[\beta^-][15.0\,{\ce {s}}] ^{99}_{42}Mo ->[\beta^-][65.94\,{\ce {h}}] ^{99}_{43}Tc ->[\beta^-][211,100\, {\ce {y}}] ^{99}_{44}Ru}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/33a9d13cb741fa5c8efce11540847d7deac9654b)

