Железо
Железо — химический элемент ; он обозначается символом Fe (от латинского ferrum — «железо») и имеет атомный номер 26. Это металл , который принадлежит к первой переходной серии и группе 8 периодической таблицы . По массе это самый распространенный элемент на Земле , образующий большую часть внешнего и внутреннего ядра Земли . Это четвертый по распространенности элемент в земной коре , в основном отложенный метеоритами в металлическом состоянии.
Для извлечения пригодного к использованию металла из железной руды требуются печи или горны, способные достигать температуры 1500 °C (2730 °F), что примерно на 500 °C (932 °F) выше, чем требуется для выплавки меди . Люди начали осваивать этот процесс в Евразии во 2-м тысячелетии до н. э. , а использование железных инструментов и оружия начало вытеснять медные сплавы — в некоторых регионах только около 1200 г. до н. э. Это событие считается переходом от бронзового века к железному веку . В современном мире железные сплавы, такие как сталь , нержавеющая сталь , чугун и специальные стали , являются наиболее распространенными промышленными металлами из-за их механических свойств и низкой стоимости. Таким образом, сталелитейная промышленность очень важна с экономической точки зрения, а железо является самым дешевым металлом, его цена составляет несколько долларов за килограмм или фунт.
Чистые и гладкие поверхности чистого железа имеют зеркальный серебристо-серый цвет. Железо легко реагирует с кислородом и водой , образуя гидратированные оксиды железа от коричневого до черного цвета , обычно известные как ржавчина . В отличие от оксидов некоторых других металлов, которые образуют пассивирующие слои, ржавчина занимает больший объем, чем металл, и, таким образом, отслаивается, обнажая больше свежих поверхностей для коррозии. С химической точки зрения наиболее распространенными степенями окисления железа являются железо(II) и железо(III) . Железо разделяет многие свойства других переходных металлов, включая другие элементы 8 группы , рутений и осмий . Железо образует соединения в широком диапазоне степеней окисления , от −4 до +7. Железо также образует множество координационных соединений ; некоторые из них, такие как ферроцен , ферриоксалат и берлинская лазурь, имеют существенное промышленное, медицинское или исследовательское применение.
Тело взрослого человека содержит около 4 граммов (0,005% веса тела) железа, в основном в гемоглобине и миоглобине. Эти два белка играют важную роль в транспортировке кислорода кровью и хранении кислорода в мышцах . Для поддержания необходимого уровня метаболизм железа у человека требует минимального количества железа в рационе. Железо также является металлом в активном центре многих важных окислительно-восстановительных ферментов, связанных с клеточным дыханием , окислением и восстановлением у растений и животных. [10]
Характеристики
Аллотропы

Известно по крайней мере четыре аллотропа железа (различающееся расположение атомов в твердом теле), условно обозначаемые α , γ , δ и ε .
Первые три формы наблюдаются при обычных давлениях. Когда расплавленное железо охлаждается выше точки замерзания 1538 °C, оно кристаллизуется в δ-аллотроп, который имеет объемно-центрированную кубическую (ОЦК) кристаллическую структуру . При дальнейшем охлаждении до 1394 °C оно переходит в γ-аллотроп железа, гранецентрированную кубическую (ГЦК) кристаллическую структуру, или аустенит . При 912 °C и ниже кристаллическая структура снова становится ОЦК α-аллотропом железа. [11]
Физические свойства железа при очень высоких давлениях и температурах также были тщательно изучены [12] [13] из-за их значимости для теорий о ядрах Земли и других планет. Выше примерно 10 ГПа и температурах в несколько сотен кельвинов или ниже α-железо переходит в другую гексагональную плотноупакованную (ГПУ) структуру, которая также известна как ε-железо . Более высокотемпературная γ-фаза также переходит в ε-железо, но делает это при более высоком давлении.
Существуют некоторые противоречивые экспериментальные доказательства существования стабильной β- фазы при давлениях выше 50 ГПа и температурах не менее 1500 К. Предполагается, что она имеет орторомбическую или двойную ГПУ-структуру. [14] (Как ни странно, термин «β-железо» иногда также используется для обозначения α-железа выше его точки Кюри, когда оно переходит из ферромагнитного в парамагнитное состояние, хотя его кристаллическая структура не изменилась. [11] )
Обычно предполагается, что внутреннее ядро Земли состоит из железоникелевого сплава с ε (или β) структурой. [15]
Температуры плавления и кипения
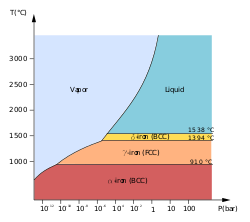
Температуры плавления и кипения железа, а также его энтальпия атомизации , ниже, чем у более ранних 3d-элементов от скандия до хрома , что показывает уменьшенный вклад 3d-электронов в металлическую связь, поскольку они все больше и больше притягиваются ядром в инертное ядро; [16] однако, они выше, чем значения для предыдущего элемента марганца, поскольку этот элемент имеет наполовину заполненную 3d-подоболочку и, следовательно, его d-электроны нелегко делокализованы. Та же тенденция наблюдается для рутения, но не для осмия . [17]
Температура плавления железа экспериментально хорошо определена для давлений менее 50 ГПа. Для больших давлений опубликованные данные (по состоянию на 2007 год) по-прежнему варьируются на десятки гигапаскалей и более тысячи кельвинов. [18]
Магнитные свойства

Ниже точки Кюри 770 °C (1420 °F; 1040 K) α-железо переходит из парамагнитного в ферромагнитное состояние : спины двух неспаренных электронов в каждом атоме обычно выстраиваются в ряд со спинами его соседей, создавая общее магнитное поле . [20] Это происходит потому, что орбитали этих двух электронов (d z 2 и d x 2 − y 2 ) не направлены в сторону соседних атомов в решетке и, следовательно, не участвуют в металлической связи. [11]
При отсутствии внешнего источника магнитного поля атомы спонтанно разделяются на магнитные домены , около 10 микрометров в поперечнике, [21] так, что атомы в каждом домене имеют параллельные спины, но некоторые домены имеют другие ориентации. Таким образом, макроскопический кусок железа будет иметь почти нулевое общее магнитное поле.
Приложение внешнего магнитного поля заставляет домены, намагниченные в том же общем направлении, расти за счет соседних, которые указывают в других направлениях, усиливая внешнее поле. Этот эффект используется в устройствах, которым необходимо направлять магнитные поля для выполнения проектной функции, таких как электрические трансформаторы , магнитные записывающие головки и электродвигатели . Примеси, дефекты решетки или границы зерен и частиц могут «закрепить» домены в новых положениях, так что эффект сохраняется даже после снятия внешнего поля – таким образом превращая железный предмет в (постоянный) магнит . [20]
Подобное поведение демонстрируют некоторые соединения железа, такие как ферриты , включая минеральный магнетит , кристаллическую форму смешанного оксида железа (II, III) Fe 3 O 4 (хотя механизм атомного масштаба, ферримагнетизм , несколько отличается). Кусочки магнетита с естественной постоянной намагниченностью ( магнитные железняки ) служили первыми компасами для навигации. Частицы магнетита широко использовались в магнитных носителях информации, таких как сердечники памяти , магнитные ленты , дискеты и диски , пока их не заменили материалы на основе кобальта .
Изотопы
Железо имеет четыре стабильных изотопа : 54 Fe (5,845% от природного железа), 56 Fe (91,754%), 57 Fe (2,119%) и 58 Fe (0,282%). Также было создано двадцать четыре искусственных изотопа. Из этих стабильных изотопов только 57 Fe имеет ядерный спин (− 1 ⁄ 2 ). Нуклид 54 Fe теоретически может подвергаться двойному захвату электронов в 54 Cr, но этот процесс никогда не наблюдался, и был установлен только нижний предел периода полураспада 4,4×10 20 лет. [22]
60Fe — это вымерший радионуклид с длительным периодом полураспада (2,6 миллиона лет). [23] Он не обнаружен на Земле, но его конечным продуктом распада является его внучка, стабильный нуклид 60Ni . [ 9] Большая часть прошлых работ по изотопному составу железа была сосредоточена на нуклеосинтезе 60Fe посредством изучения метеоритов и рудообразования. За последнее десятилетие достижения в области масс -спектрометрии позволили обнаружить и количественно оценить мельчайшие, происходящие естественным образом изменения в соотношениях стабильных изотопов железа. Большая часть этой работы проводится научными сообществами Земли и планет , хотя появляются приложения к биологическим и промышленным системам. [24]
В фазах метеоритов Семаркона и Червоный Кут корреляция между концентрацией 60 Ni, внучки 60 Fe, и обилием стабильных изотопов железа предоставила доказательства существования 60 Fe во время формирования Солнечной системы . Возможно, энергия, выделившаяся при распаде 60 Fe, вместе с энергией, выделившейся 26 Al , способствовала переплавке и дифференциации астероидов после их образования 4,6 миллиарда лет назад. Обилие 60 Ni, присутствующее во внеземном материале , может дать дальнейшее понимание происхождения и ранней истории Солнечной системы . [25]
Самый распространенный изотоп железа 56 Fe представляет особый интерес для ученых-ядерщиков, поскольку он представляет собой наиболее распространенную конечную точку нуклеосинтеза . [26] Поскольку 56 Ni (14 альфа-частиц ) легко образуется из более легких ядер в альфа-процессе в ядерных реакциях в сверхновых (см. процесс горения кремния ), он является конечной точкой цепочек синтеза внутри чрезвычайно массивных звезд . Хотя добавление большего количества альфа-частиц возможно, тем не менее последовательность фактически заканчивается на 56 Ni, поскольку условия внутри звезд вызывают конкуренцию между фотораспадом и альфа-процессом в пользу фотораспада около 56 Ni. [27] [28] Этот 56 Ni, период полураспада которого составляет около 6 дней, создается в большом количестве в этих звездах, но вскоре распадается двумя последовательными позитронными выбросами в продуктах распада сверхновой в газовом облаке остатков сверхновой , сначала до радиоактивного 56 Co, а затем до стабильного 56 Fe. Таким образом, железо является наиболее распространенным элементом в ядре красных гигантов , а также является наиболее распространенным металлом в железных метеоритах и в плотных металлических ядрах планет , таких как Земля . [29] Оно также очень распространено во Вселенной по сравнению с другими стабильными металлами примерно с таким же атомным весом . [29] [30] Железо является шестым по распространенности элементом во Вселенной и наиболее распространенным тугоплавким элементом. [31]

Хотя еще один небольшой прирост энергии может быть получен путем синтеза 62 Ni , который имеет немного более высокую энергию связи, чем 56 Fe, условия в звездах не подходят для этого процесса. Производство элементов в сверхновых значительно благоприятствует железу по сравнению с никелем, и в любом случае 56 Fe все еще имеет меньшую массу на нуклон, чем 62 Ni из-за его более высокой доли более легких протонов. [32] Следовательно, элементы тяжелее железа требуют сверхновой для своего образования, включающей быстрый захват нейтронов путем запуска ядер 56 Fe. [29]
В далеком будущем Вселенной, если предположить, что распад протона не произойдет, холодный синтез , происходящий посредством квантового туннелирования, заставит легкие ядра в обычной материи слиться в ядра 56 Fe. Деление и испускание альфа-частиц затем заставят тяжелые ядра распасться на железо, превратив все объекты звездной массы в холодные сферы чистого железа. [33]
Происхождение и распространение в природе
Космогенез
Обилие железа на каменистых планетах, таких как Земля, обусловлено его обильным производством во время неконтролируемого синтеза и взрыва сверхновых типа Ia , которые рассеивают железо в космосе. [34] [35]
Металлическое железо

Металлическое или самородное железо редко встречается на поверхности Земли, поскольку оно имеет тенденцию к окислению. Однако, как полагают, как внутреннее , так и внешнее ядро Земли , которые вместе составляют 35% массы всей Земли, в основном состоят из сплава железа, возможно, с никелем . Считается, что электрические токи в жидком внешнем ядре являются источником магнитного поля Земли . Считается, что другие планеты земной группы ( Меркурий , Венера и Марс ), а также Луна имеют металлическое ядро, состоящее в основном из железа. Также считается, что астероиды типа М частично или в основном состоят из сплава металлического железа.
Редкие железные метеориты являются основной формой естественного металлического железа на поверхности Земли. Изделия из холоднодеформированного метеоритного железа были найдены в различных археологических памятниках, датируемых временем, когда выплавка железа еще не была развита; и инуиты в Гренландии , как сообщается, использовали железо из метеорита Кейп-Йорк для инструментов и охотничьего оружия. [36] Примерно 1 из 20 метеоритов состоит из уникальных железо-никелевых минералов тэнита (35–80% железа) и камасита (90–95% железа). [37] Самородное железо также редко встречается в базальтах, которые образовались из магм, вступивших в контакт с богатыми углеродом осадочными породами, которые снизили летучесть кислорода в достаточной степени для кристаллизации железа. Это известно как теллурическое железо и описано в нескольких местах, таких как остров Диско в Западной Гренландии, Якутия в России и Бюль в Германии. [38]
Минералы мантии
Ферропериклаз (Mg,Fe)O , твердый раствор периклаза (MgO) и вюстита (FeO), составляет около 20% объема нижней мантии Земли, что делает его второй по распространенности минеральной фазой в этом регионе после силикатного перовскита (Mg,Fe)SiO 3 ; он также является основным хозяином железа в нижней мантии. [39] В нижней части переходной зоны мантии реакция γ- (Mg,Fe) 2 [SiO 4 ] ↔ (Mg,Fe)[SiO 3 ] + (Mg,Fe)O превращает γ-оливин в смесь силикатного перовскита и ферропериклаза и наоборот. В литературе эту минеральную фазу нижней мантии также часто называют магнезиовюститом. [40] Силикатный перовскит может составлять до 93% нижней мантии, [41] а магниево-железная форма, (Mg,Fe)SiO 3 , считается наиболее распространенным минералом на Земле, составляя 38% ее объема. [42]
Земная кора

Хотя железо является наиболее распространенным элементом на Земле, большая часть этого железа сосредоточена во внутреннем и внешнем ядрах. [43] [44] Доля железа, которая находится в земной коре, составляет всего около 5% от общей массы коры и, таким образом, является лишь четвертым по распространенности элементом в этом слое (после кислорода , кремния и алюминия ). [45]
Большая часть железа в земной коре соединяется с различными другими элементами, образуя множество железных минералов . Важный класс — это минералы оксида железа , такие как гематит (Fe 2 O 3 ), магнетит (Fe 3 O 4 ) и сидерит (FeCO 3 ), которые являются основными рудами железа . Многие магматические породы также содержат сульфидные минералы пирротин и пентландит . [46] [47] Во время выветривания железо имеет тенденцию выщелачиваться из сульфидных отложений в виде сульфата и из силикатных отложений в виде бикарбоната. Оба они окисляются в водном растворе и осаждаются даже при слегка повышенном pH в виде оксида железа (III) . [48]

Крупные месторождения железа — это полосчатые железистые формации , тип горной породы, состоящий из повторяющихся тонких слоев оксидов железа, чередующихся с полосами бедного железом сланца и кремня . Полосчатые железистые формации были заложены в период между 3700 миллионами лет назад и 1800 миллионами лет назад . [49] [50]
Материалы, содержащие тонко измельченные оксиды железа (III) или оксид-гидроксиды, такие как охра , использовались в качестве желтых, красных и коричневых пигментов с доисторических времен. Они также вносят вклад в цвет различных пород и глин , включая целые геологические формации, такие как Painted Hills в Орегоне и Buntsandstein («цветной песчаник», британский Bunter ). [51] Через Eisensandstein ( юрский «железный песчаник», например, из Донцдорфа в Германии) [52] и Bath stone в Великобритании соединения железа отвечают за желтоватый цвет многих исторических зданий и скульптур. [53] Пресловутый красный цвет поверхности Марса происходит от реголита , богатого оксидом железа . [54]
Значительное количество железа содержится в сульфиде железа, минерале пирите (FeS2 ) , но извлечь из него железо трудно, и поэтому оно не разрабатывается. [55] Фактически, железо настолько распространено, что добыча обычно сосредоточена только на рудах с очень высоким его содержанием. [56]
Согласно отчету International Resource Panel 's Metal Stocks in Society , глобальный запас железа, используемый обществом, составляет 2200 кг на душу населения. Более развитые страны отличаются в этом отношении от менее развитых стран (7000–14000 против 2000 кг на душу населения). [57]
Океаны
Наука об океане продемонстрировала роль железа в древних морях как в морской биоте, так и в климате. [58]
Химия и соединения
Степень окисления | Представительное соединение |
|---|---|
| −4 (д 10 с 2 ) | [FeIn 6− x Sn x ] [59] |
| −2 (д 10 ) | Тетракарбонилферрат динатрия (реагент Коллмана) |
| −1 (д 9 ) | Фе 2(Колорадо)2− 8 |
| 0 (д 8 ) | Пентакарбонил железа |
| 1 (д 7 ) | Димер дикарбонила циклопентадиенилжелеза («Fp 2 ») |
| 2 (д 6 ) | Сульфат железа , ферроцен |
| 3 (д 5 ) | Хлорид железа , тетрафторборат ферроцения |
| 4 (д 4 ) | Fe(диарс) 2Кл2+ 2, FeO( BF4 ) 2 |
| 5 (д 3 ) | FeO3− 4 |
| 6 (д 2 ) | Феррат калия |
| 7 (д 1 ) | [FeO 4 ] – (матричная изоляция, 4К) |
Железо демонстрирует характерные химические свойства переходных металлов , а именно способность образовывать переменные степени окисления, отличающиеся шагами одного и очень большой координацией и металлоорганической химией : действительно, именно открытие соединения железа, ферроцена , произвело революцию в последней области в 1950-х годах. [60] Железо иногда рассматривается как прототип всего блока переходных металлов из-за его распространенности и огромной роли, которую оно сыграло в технологическом прогрессе человечества. [61] Его 26 электронов расположены в конфигурации [ Ar]3d 6 4s 2 , из которых 3d и 4s электроны относительно близки по энергии, и, таким образом, некоторое количество электронов может быть ионизировано. [17]
Железо образует соединения в основном в степенях окисления +2 ( железо(II) , « железное ») и +3 ( железо(III) , «железное»). Железо также встречается в более высоких степенях окисления , например, пурпурный феррат калия ( K2FeO4 ) , который содержит железо в степени окисления +6. Анион [FeO4 ] – с железом в степени окисления +7, вместе с железо(V)-пероксоизомером, был обнаружен с помощью инфракрасной спектроскопии при 4 К после соконденсации атомов Fe, подвергнутых лазерной абляции, со смесью O2 / Ar. [62] Железо(IV) является распространенным промежуточным продуктом во многих биохимических реакциях окисления. [63] [64] Многочисленные железоорганические соединения содержат формальные степени окисления +1, 0, −1 или даже −2. Степени окисления и другие свойства связей часто оцениваются с помощью метода мёссбауэровской спектроскопии . [65] Многие соединения со смешанной валентностью содержат как центры железа (II), так и железа (III), такие как магнетит и берлинская лазурь ( Fe 4 (Fe[CN] 6 ) 3 ). [64] Последняя используется как традиционный «синий» цвет в чертежах . [66]
Железо является первым из переходных металлов, который не может достичь своей групповой степени окисления +8, хотя его более тяжелые родственники рутений и осмий могут, причем рутений испытывает больше трудностей, чем осмий. [11] Рутений проявляет водную катионную химию в своих низких степенях окисления, похожую на химию железа, но осмий этого не делает, предпочитая высокие степени окисления, в которых он образует анионные комплексы. [11] Во второй половине 3d переходного ряда вертикальное сходство вниз по группам конкурирует с горизонтальным сходством железа с его соседями кобальтом и никелем в периодической таблице, которые также являются ферромагнитными при комнатной температуре и имеют схожую химию. Таким образом, железо, кобальт и никель иногда группируются вместе как триада железа . [61]
В отличие от многих других металлов, железо не образует амальгам с ртутью . В результате ртуть продается в стандартизированных 76-фунтовых колбах (34 кг), изготовленных из железа. [67]
Железо, безусловно, является наиболее реакционноспособным элементом в своей группе; оно пирофорно , когда мелко измельчено, и легко растворяется в разбавленных кислотах, давая Fe2 + . Однако оно не реагирует с концентрированной азотной кислотой и другими окисляющими кислотами из-за образования непроницаемого оксидного слоя, который, тем не менее, может реагировать с соляной кислотой . [11] Высокочистое железо, называемое электролитическим железом , считается устойчивым к ржавчине из-за своего оксидного слоя.
Бинарные соединения
Оксиды и сульфиды
Железо образует различные оксидные и гидроксидные соединения ; наиболее распространенными являются оксид железа(II,III) ( Fe3O4 ) и оксид железа(III) ( Fe2O3 ). Оксид железа(II) также существует, хотя он нестабилен при комнатной температуре. Несмотря на свои названия, на самом деле все они являются нестехиометрическими соединениями , состав которых может различаться. [68] Эти оксиды являются основными рудами для производства железа (см. кричные печи и доменные печи). Они также используются в производстве ферритов , полезных магнитных носителей информации в компьютерах и пигментов. Самый известный сульфид - это железный колчедан (FeS2 ) , также известный как золото дураков из-за его золотистого блеска. [64] Это не соединение железа(IV), а на самом деле полисульфид железа(II), содержащий Fe2 + и S2−
2ионы в искаженной структуре хлорида натрия . [68]

Галогениды
_chloride_hexahydrate.jpg/440px-Iron(III)_chloride_hexahydrate.jpg)
Бинарные галогениды железа и железа хорошо известны. Галогениды железа обычно возникают при обработке металлического железа соответствующей галогеноводородной кислотой с получением соответствующих гидратированных солей. [64]
- Fe + 2HX → FeX 2 + H 2 (X = F, Cl, Br, I)
Железо реагирует с фтором, хлором и бромом, образуя соответствующие галогениды железа, наиболее распространенным из которых является хлорид железа . [69]
- 2Fe + 3X2 → 2FeX3 ( X = F, Cl, Br)
Исключением является иодид железа , который термодинамически нестабилен из-за окислительной способности Fe 3+ и высокой восстановительной способности I − : [69]
- 2 I − + 2 Fe 3+ → I 2 + 2 Fe 2+ (E 0 = +0,23 В)
Йодид железа, черное твердое вещество, нестабилен в обычных условиях, но может быть получен посредством реакции пентакарбонила железа с йодом и оксидом углерода в присутствии гексана и света при температуре −20 °C, при исключении кислорода и воды. [69] Известно, что комплексы йодида железа с некоторыми мягкими основаниями являются стабильными соединениями. [70] [71]
Химия растворов

Стандартные восстановительные потенциалы в кислых водных растворах для некоторых распространенных ионов железа приведены ниже: [11]
[Fe(H 2 O) 6 ] 2+ + 2 е − ⇌ Fe Е 0 = −0,447 В [Fe(H 2 O) 6 ] 3+ + е − ⇌ [Fe( H2O ) 6 ] 2+ Е0 = +0,77 В FeO2−
4+ 8 Н 3 О + + 3 е −⇌ [Fe( H2O ) 6 ] 3+ + 6H2O Е 0 = +2,20 В
Красно-фиолетовый тетраэдрический анион феррата (VI) является настолько сильным окислителем, что он окисляет аммиак до азота (N 2 ), а воду до кислорода: [69]
- 4 FeO2−
4+ 34 ч.
2О → 4 [Fe(H 2 O) 6 ] 3+ + 20 ОН−
+ 3 О 2
Бледно-фиолетовый гексаводокомплекс [ Fe(H 2 O) 6 ] 3+ представляет собой кислоту, которая при pH выше 0 полностью гидролизуется: [72]
[Fe( H2O ) 6 ] 3+ ⇌ [Fe(H2O ) 5 ( OH)] 2+ + H + К = 10−3,05 моль дм −3 [Fe( H2O ) 5 (ОН)] 2+ ⇌ [Fe(H2O ) 4 ( OH) 2 ] + + H + К = 10−3,26 моль дм −3 2[Fe( H2O ) 6 ] 3+ ⇌ [Fe( H2O ) 4 (OH)]4+2+ 2Н + + 2Н 2 О К = 10−2,91 моль дм −3
-sulfate-heptahydrate-sample.jpg/440px-Iron(II)-sulfate-heptahydrate-sample.jpg)
При повышении pH выше 0 образуются вышеуказанные желтые гидролизованные виды, а при повышении выше 2–3 из раствора выпадает красновато-коричневый водный оксид железа(III) . Хотя Fe3 + имеет конфигурацию ad5 , его спектр поглощения не похож на спектр Mn2 + с его слабыми запрещенными по спину d–d полосами, поскольку Fe3 + имеет более высокий положительный заряд и является более поляризующим, что снижает энергию поглощения переноса заряда от лиганда к металлу . Таким образом, все вышеуказанные комплексы довольно сильно окрашены, за исключением иона гексакво, и даже у него в спектре доминирует перенос заряда в ближней ультрафиолетовой области. [72] С другой стороны, бледно-зеленый ион гексакво железа(II) [Fe(H2O ) 6 ] 2+ не подвергается заметному гидролизу. Диоксид углерода не выделяется при добавлении карбонатных анионов, что вместо этого приводит к осаждению белого карбоната железа(II) . При избытке углекислого газа образуется слаборастворимый бикарбонат, который обычно встречается в грунтовых водах, но быстро окисляется на воздухе, образуя оксид железа (III) , который и является причиной коричневых отложений, присутствующих в значительном количестве ручьев. [73]
Координационные соединения
Благодаря своей электронной структуре железо имеет очень большую координационную и металлоорганическую химию.

Известно много координационных соединений железа. Типичным шестикоординационным анионом является гексахлороферрат(III), [FeCl 6 ] 3− , обнаруженный в смешанной соли тетракис(метиламмоний) гексахлороферрат(III) хлорида . [74] [75] Комплексы с несколькими бидентатными лигандами имеют геометрические изомеры . Например, комплекс транс - хлоргидридобис(бис-1,2-(дифенилфосфино)этан)железа(II) используется в качестве исходного материала для соединений с фрагментом Fe( dppe ) 2 . [76] [77] Ион ферриоксалата с тремя оксалатными лигандами демонстрирует спиральную хиральность с его двумя несовмещаемыми геометриями, обозначенными Λ (лямбда) для оси левого винта и Δ (дельта) для оси правого винта, в соответствии с соглашениями ИЮПАК. [72] Ферриоксалат калия используется в химической актинометрии и вместе с его натриевой солью подвергается фотовосстановлению, применяемому в старых фотографических процессах. Дигидрат оксалата железа(II) имеет полимерную структуру с копланарными ионами оксалата, соединяющими между центрами железа, с кристаллизационной водой, расположенной в форме шапок каждого октаэдра, как показано ниже. [78]

iron(III)_chloride.jpg/440px-Pentaaqua(thiocyanato)iron(III)_chloride.jpg)
Комплексы железа (III) очень похожи на комплексы хрома (III), за исключением предпочтения железа (III) к O -донорным вместо N -донорных лигандов. Последние, как правило, гораздо более нестабильны, чем комплексы железа (II), и часто диссоциируют в воде. Многие комплексы Fe–O показывают интенсивные цвета и используются в качестве тестов на фенолы или енолы . Например, в тесте с хлоридом железа , используемом для определения присутствия фенолов, хлорид железа (III) реагирует с фенолом, образуя темно-фиолетовый комплекс: [72]
- 3 ArOH + FeCl 3 → Fe(OAr) 3 + 3 HCl (Ar = арил )
Среди галогенидных и псевдогалогенидных комплексов наиболее стабильны фторокомплексы железа(III), причем бесцветный [FeF5 ( H2O ) ] 2− является наиболее стабильным в водном растворе. Хлорокомплексы менее стабильны и предпочитают тетраэдрическую координацию, как в [FeCl4 ] − ; [FeBr4 ] − и [FeI4 ] − легко восстанавливаются до железа(II). Тиоцианат является распространенным тестом на присутствие железа(III), поскольку он образует кроваво-красный [Fe(SCN)(H2O ) 5 ] 2+ . Как и марганец(II), большинство комплексов железа(III) являются высокоспиновыми, исключение составляют те, у которых лиганды находятся высоко в спектрохимическом ряду , такие как цианид . Примером низкоспинового комплекса железа(III) является [Fe(CN) 6 ] 3− . Железо демонстрирует большое разнообразие электронных спиновых состояний , включая все возможные значения спинового квантового числа для элемента d-блока от 0 (диамагнитного) до 5 ⁄ 2 (5 неспаренных электронов). Это значение всегда равно половине числа неспаренных электронов. Комплексы с нулём или двумя неспаренными электронами считаются низкоспиновыми, а с четырьмя или пятью — высокоспиновыми. [68]
Комплексы железа(II) менее стабильны, чем комплексы железа(III), но предпочтение к лигандам-донорам O менее выражено, так что, например, [Fe(NH 3 ) 6 ] 2+ известно, а [Fe(NH 3 ) 6 ] 3+ нет. Они имеют тенденцию окисляться до железа(III), но это можно смягчить низким pH и конкретными используемыми лигандами. [73]
Металлоорганические соединения

Пентакарбонил железа
Химия органического железа — это изучение металлоорганических соединений железа, где атомы углерода ковалентно связаны с атомом металла. Они многочисленны и разнообразны, включая цианидные комплексы , карбонильные комплексы , сэндвичевые и полусэндвичевые соединения .

Берлинская лазурь или «ферроцианид железа», Fe 4 [Fe(CN) 6 ] 3 , является старым и хорошо известным комплексом железа и цианида, широко используемым в качестве пигмента и в ряде других применений. Его образование можно использовать в качестве простого теста мокрой химии для различения водных растворов Fe 2+ и Fe 3+ , поскольку они реагируют (соответственно) с феррицианидом калия и ферроцианидом калия с образованием берлинской лазури. [64]
Другим старым примером железоорганического соединения является пентакарбонил железа , Fe(CO) 5 , в котором нейтральный атом железа связан с атомами углерода пяти молекул оксида углерода . Соединение может быть использовано для получения порошка карбонильного железа , высокореакционной формы металлического железа. Термолиз пентакарбонила железа дает тридодекакарбонил железа , Fe3 ( CO) 12 , комплекс с кластером из трех атомов железа в его ядре. Реагент Коллмана, динатрий тетракарбонилферрат , является полезным реагентом для органической химии; он содержит железо в степени окисления −2. Димер дикарбонила циклопентадиенилжелеза содержит железо в редкой степени окисления +1. [79]
Знаменательным событием в этой области стало открытие в 1951 году удивительно стабильного сэндвичевого соединения ферроцена Fe(C 5 H 5 ) 2 Посоном и Кили [80] и независимо Миллером и коллегами [81] , чья удивительная молекулярная структура была определена всего год спустя Вудвордом и Уилкинсоном [82] и Фишером [83] . Ферроцен по-прежнему остается одним из важнейших инструментов и моделей в этом классе. [84]
В качестве катализаторов используются железоцентрированные металлоорганические соединения . Например, комплекс Кнёлкера является катализатором переноса гидрирования для кетонов . [85]
Промышленное использование
Соединения железа , производимые в промышленных масштабах, — это сульфат железа(II) (FeSO4 · 7H2O ) и хлорид железа(III) (FeCl3 ) . Первый из них является одним из наиболее доступных источников железа(II), но менее устойчив к окислению в воздухе, чем соль Мора ( (NH4 ) 2Fe ( SO4 ) 2 · 6H2O ) . Соединения железа(II) имеют тенденцию окисляться до соединений железа(III) в воздухе. [ 64]
История
Развитие металлургии железа
Железо — один из элементов, несомненно известных древнему миру. [86] Его обрабатывали или ковали на протяжении тысячелетий. Однако железные артефакты большого возраста встречаются гораздо реже, чем предметы из золота или серебра, из-за легкости, с которой железо подвергается коррозии. [87] Технология развивалась медленно, и даже после открытия плавки потребовалось много столетий, чтобы железо заменило бронзу в качестве металла, используемого для инструментов и оружия.
Метеоритное железо

Бусы, изготовленные из метеоритного железа в 3500 г. до н. э. или ранее, были найдены в Герцехе , Египет, Г. А. Уэйнрайтом . [88] Бусы содержат 7,5% никеля, что является признаком метеоритного происхождения, поскольку железо, встречающееся в земной коре, обычно содержит лишь незначительные примеси никеля.
Метеоритное железо высоко ценилось из-за своего небесного происхождения и часто использовалось для ковки оружия и инструментов. [88] Например, в гробнице Тутанхамона был найден кинжал, изготовленный из метеоритного железа , содержащий такие же пропорции железа, кобальта и никеля, как и метеорит, обнаруженный в этом районе, отложенный древним метеоритным дождем. [89] [90] [91] Предметы, которые, вероятно, были изготовлены из железа египтянами, датируются периодом от 3000 до 2500 г. до н.э. [87]
Метеоритное железо сравнительно мягкое и пластичное, легко поддается холодной ковке , но может стать хрупким при нагревании из-за содержания никеля . [92]
Кованое железо

Первое производство железа началось в Среднем Бронзовом веке , но потребовалось несколько столетий, прежде чем железо вытеснило бронзу. Образцы выплавленного железа из Асмара, Месопотамии и Талль-Чагар-Базара на севере Сирии были сделаны где-то между 3000 и 2700 годами до нашей эры. [93] Хетты основали империю в северо - центральной Анатолии около 1600 года до нашей эры. Они, по-видимому, были первыми, кто понял производство железа из его руды и высоко ценил его в своем обществе. [94] Хетты начали выплавлять железо между 1500 и 1200 годами до нашей эры, и эта практика распространилась на остальную часть Ближнего Востока после падения их империи в 1180 году до нашей эры. [93] Последующий период называется железным веком .
Артефакты из выплавленного железа найдены в Индии, датируемые периодом с 1800 по 1200 гг. до н.э., [95] и в Леванте примерно с 1500 г. до н.э. (предполагая выплавку в Анатолии или на Кавказе ). [96] [97] Предполагаемые ссылки (сравните историю металлургии в Южной Азии ) на железо в индийских Ведах использовались для заявлений об очень раннем использовании железа в Индии, соответственно, для датировки текстов как таковых. Термин ригведы ayas (металл) относится к меди, в то время как железо, которое называется śyāma ayas , буквально «черная медь», впервые упоминается в постригведической Атхарваведе . [98]
Некоторые археологические свидетельства свидетельствуют о том, что железо выплавлялось в Зимбабве и на юго-востоке Африки еще в восьмом веке до нашей эры. [99] Обработка железа была завезена в Грецию в конце одиннадцатого века до нашей эры, откуда она быстро распространилась по всей Европе. [100]

Распространение обработки железа в Центральной и Западной Европе связано с кельтской экспансией. По словам Плиния Старшего , использование железа было распространено в римскую эпоху. [88] На землях, которые сейчас считаются Китаем, железо появляется примерно в 700–500 годах до нашей эры. [101] Выплавка железа, возможно, была завезена в Китай через Центральную Азию. [102] Самые ранние свидетельства использования доменной печи в Китае датируются I веком нашей эры, [103] а вагранки использовались уже в период Воюющих царств (403–221 гг. до н. э.). [104] Использование доменной и ваграночной печи оставалось широко распространенным во времена династий Тан и Сун . [105]
Во время промышленной революции в Британии Генри Корт начал перерабатывать железо из чугуна в кованое железо (или прутковое железо), используя инновационные производственные системы. В 1783 году он запатентовал процесс пудлингования для переработки железной руды. Позже его усовершенствовали другие, включая Джозефа Холла . [106]
Чугун
Чугун впервые был произведен в Китае в V веке до нашей эры, [107], но в Европе его почти не было до средневекового периода. [108] [109] Самые ранние артефакты из чугуна были обнаружены археологами на территории современного уезда Лухэ провинции Цзянсу в Китае. Чугун использовался в древнем Китае для ведения войны , сельского хозяйства и архитектуры. [110] В средневековый период в Европе были найдены способы производства кованого железа из чугуна (в этом контексте известного как чугун ) с использованием кузнечных горнов . Для всех этих процессов в качестве топлива требовался древесный уголь . [111]

Средневековые доменные печи были около 10 футов (3,0 м) в высоту и сделаны из огнеупорного кирпича; нагнетание воздуха обычно обеспечивалось ручными мехами. [109] Современные доменные печи стали намного больше, с горнами диаметром четырнадцать метров, что позволяет им производить тысячи тонн железа каждый день, но по сути работают во многом так же, как и в средние века. [111]
В 1709 году Авраам Дарби I установил доменную печь на коксе для производства чугуна, заменив древесный уголь, хотя продолжал использовать доменные печи. Последующая доступность недорогого железа была одним из факторов, приведших к промышленной революции . К концу 18-го века чугун начал заменять кованое железо для определенных целей, потому что он был дешевле. Содержание углерода в железе не было связано с различиями в свойствах кованого железа, чугуна и стали до 18-го века. [93]
Поскольку железо становилось все более дешевым и распространенным, оно также стало основным конструкционным материалом после строительства инновационного первого железного моста в 1778 году. Этот мост до сих пор стоит как памятник роли железа в промышленной революции. После этого железо использовалось в рельсах, лодках, кораблях, акведуках и зданиях, а также в железных цилиндрах паровых двигателей . [111] Железные дороги сыграли центральную роль в формировании современности и идей прогресса [112] , и в разных языках железные дороги называют железной дорогой (например, во французском chemin de fer , в немецком Eisenbahn , в турецком demiryolu , в русском железная дорога , в китайском, японском и корейском鐵道, вьетнамском đường sắt ).
Сталь
Сталь (с меньшим содержанием углерода, чем в чугуне, но большим, чем в кованом железе) впервые была произведена в древности с использованием кричного завода . Кузнецы в Луристане в западной Персии производили хорошую сталь к 1000 году до нашей эры. [93] Затем были разработаны улучшенные версии, сталь Вутц из Индии и дамасская сталь около 300 года до нашей эры и 500 года нашей эры соответственно. Эти методы были специализированными, и поэтому сталь не стала основным товаром до 1850-х годов. [113]
Новые методы его производства путем науглероживания прутков железа в процессе цементации были изобретены в 17 веке. В период промышленной революции были изобретены новые методы производства пруткового железа без древесного угля, которые позже были применены для производства стали. В конце 1850-х годов Генри Бессемер изобрел новый сталеплавильный процесс, включающий продувку воздуха через расплавленный чугун для производства мягкой стали. Это сделало сталь намного более экономичной, тем самым приведя к тому, что кованое железо больше не производилось в больших количествах. [114]
Основы современной химии
В 1774 году Антуан Лавуазье использовал реакцию водяного пара с металлическим железом внутри раскаленной железной трубки для получения водорода в своих экспериментах, что привело к демонстрации закона сохранения массы , что сыграло важную роль в превращении химии из качественной науки в количественную. [115]
Символическая роль
.jpg/440px-Eisernes_Kreuz_(1914).jpg)
Железо играет определенную роль в мифологии и нашло различное применение в качестве метафоры и в фольклоре . В « Трудах и днях » греческого поэта Гесиода (строки 109–201) перечисляются различные эпохи человека, названные в честь металлов, таких как золото, серебро, бронза и железо, чтобы учесть последовательные эпохи человечества. [116] Железный век был тесно связан с Римом, и в «Метаморфозах» Овидия
Добродетели в отчаянии покидают землю; и развращенность человека становится всеобщей и полной. Затем на смену пришла твердая сталь.
— Овидий, Метаморфозы , Книга I, Железный век, строка 160 и далее
Примером важности символической роли железа может служить Немецкая кампания 1813 года . Фридрих Вильгельм III тогда заказал первый Железный крест в качестве военной награды. Производство берлинских железных украшений достигло пика в период между 1813 и 1815 годами, когда прусская королевская семья призвала граждан жертвовать золотые и серебряные украшения на финансирование военных нужд. Надпись Ich gab Gold für Eisen (Я отдал золото за железо) использовалась также в более поздних военных действиях. [117]
Производство металлического железа

Лабораторные маршруты
Для некоторых ограниченных целей, когда это необходимо, чистое железо производится в лаборатории в небольших количествах путем восстановления чистого оксида или гидроксида водородом или путем образования пентакарбонила железа и нагревания его до 250 °C, так что он разлагается с образованием чистого железного порошка. [48] Другим методом является электролиз хлорида железа на железном катоде. [118]
Главный промышленный маршрут
| Страна | Железная руда | Чугун | Прямое железо | Сталь |
|---|---|---|---|---|
 Китай Китай | 1,114.9 | 549,4 | 573,6 | |
 Австралия Австралия | 393,9 | 4.4 | 5.2 | |
 Бразилия Бразилия | 305.0 | 25.1 | 0,011 | 26.5 |
 Япония Япония | 66.9 | 87,5 | ||
 Индия Индия | 257.4 | 38.2 | 23.4 | 63,5 |
 Россия Россия | 92.1 | 43.9 | 4.7 | 60.0 |
 Украина Украина | 65,8 | 25.7 | 29.9 | |
 Южная Корея Южная Корея | 0.1 | 27.3 | 48.6 | |
 Германия Германия | 0,4 | 20.1 | 0,38 | 32.7 |
| Мир | 1,594.9 | 914.0 | 64,5 | 1,232.4 |
В настоящее время промышленное производство железа или стали состоит из двух основных этапов. На первом этапе железная руда восстанавливается коксом в доменной печи , а расплавленный металл отделяется от грубых примесей, таких как силикатные минералы . На этом этапе получается сплав — чугун в чушках , — который содержит относительно большое количество углерода. На втором этапе количество углерода в чугуне в чушках снижается путем окисления , чтобы получить кованое железо, сталь или чугун. [120] На этом этапе могут быть добавлены другие металлы для образования легированных сталей .
Обработка в доменной печи
В доменную печь загружают железную руду, обычно гематит Fe 2 O 3 или магнетит Fe 3 O 4 , а также кокс ( уголь , который был отдельно обожжен для удаления летучих компонентов) и флюс ( известняк или доломит ). «Потоки» воздуха, предварительно нагретого до 900 °C (иногда с обогащением кислородом), продувают через смесь в количестве, достаточном для превращения углерода в оксид углерода : [120]
- 2С + О2 → 2СО
Эта реакция повышает температуру примерно до 2000 ° C. Окись углерода восстанавливает железную руду до металлического железа: [120]
- Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2
Часть железа в высокотемпературной нижней части печи напрямую реагирует с коксом: [120]
- 2 Fe 2 O 3 + 3 C → 4 Fe + 3 CO 2
Флюс удаляет кремнистые минералы из руды, которые в противном случае засорили бы печь: Тепло печи разлагает карбонаты до оксида кальция , который реагирует с любым избытком кремнезема , образуя шлак , состоящий из силиката кальция CaSiO 3 или других продуктов. При температуре печи металл и шлак оба расплавлены. Они собираются на дне в виде двух несмешивающихся жидких слоев (со шлаком наверху), которые затем легко разделяются. [120] Шлак может использоваться в качестве материала в дорожном строительстве или для улучшения бедных минералами почв для сельского хозяйства . [109]
Таким образом, сталелитейная промышленность остается одним из крупнейших промышленных источников выбросов CO2 в мире. [121]
- Китайская иллюстрация XVII века, изображающая рабочих у доменной печи, выплавляющих кованое железо из чугуна [122]
- Как добывали железо в 19 веке
- Железоделательная печь в Колумбусе, штат Огайо, 1922 г.
Сталеплавильное производство
Чугун, полученный доменным способом, содержит до 4–5% углерода (по массе) с небольшим количеством других примесей, таких как сера, магний, фосфор и марганец. Этот высокий уровень углерода делает его относительно слабым и хрупким. Уменьшение количества углерода до 0,002–2,1% дает сталь , которая может быть в 1000 раз тверже чистого железа. Затем можно изготавливать большое разнообразие стальных изделий путем холодной обработки , горячей прокатки , ковки , механической обработки и т. д. Удаление примесей из чугуна, но оставление 2–4% углерода приводит к получению чугуна , который литейные цеха отливают в такие изделия, как печи, трубы, радиаторы, фонарные столбы и рельсы. [120]
Стальные изделия часто подвергаются различным видам термической обработки после ковки. Отжиг заключается в нагревании до 700–800 °C в течение нескольких часов, а затем постепенном охлаждении. Это делает сталь более мягкой и более податливой к обработке. [123]
- Эта куча железорудных окатышей будет использоваться в производстве стали.
- Горшок с расплавленным железом, используемый для производства стали.
Прямое восстановление железа
Из-за экологических проблем были разработаны альтернативные методы обработки железа. « Прямое восстановление железа » восстанавливает железную руду до железистого куска, называемого «губчатым» железом или «прямым» железом, которое пригодно для сталеплавильного производства. [109] Процесс прямого восстановления состоит из двух основных реакций:
Природный газ частично окисляется (с помощью тепла и катализатора): [109]
- 2 СН4 + О2 → 2 СО + 4 Н2
Затем железная руда обрабатывается этими газами в печи, в результате чего получается твердое губчатое железо: [109]
- Fe 2 O 3 + CO + 2 H 2 → 2 Fe + CO 2 + 2 H 2 O
Кремний удаляется путем добавления известнякового флюса, как описано выше. [109]
Термитный процесс
При воспламенении смеси алюминиевого порошка и оксида железа в результате термитной реакции образуется металлическое железо :
- Fe 2 O 3 + 2 Al → 2 Fe + Al 2 O 3
Альтернативно, чугун может быть превращен в сталь (с содержанием углерода до 2%) или кованое железо (коммерчески чистое железо). Для этого использовались различные процессы, включая кузнечные печи , пудлинговые печи, бессемеровские конвертеры , мартеновские печи , кислородные печи и электродуговые печи . Во всех случаях цель состоит в том, чтобы окислить часть или весь углерод вместе с другими примесями. С другой стороны, другие металлы могут быть добавлены для изготовления легированных сталей. [111]
Электролиз расплавленных оксидов
Электролиз расплавленного оксида (MOE) использует электролиз расплавленного оксида железа для получения металлического железа. Он изучается в лабораторных экспериментах и предлагается как метод промышленного производства железа, который не имеет прямых выбросов углекислого газа. Он использует жидкий железный катод, анод, образованный из сплава хрома, алюминия и железа, [124] а электролит представляет собой смесь расплавленных оксидов металлов, в которой растворена железная руда. Ток поддерживает электролит в расплавленном состоянии и восстанавливает оксид железа. В дополнение к жидкому железу производится газообразный кислород. Единственные выбросы углекислого газа происходят от любого ископаемого топлива - вырабатываемого электричества, используемого для нагрева и восстановления металла. [125] [126] [127]
Приложения
| Материал | TS (МПа) | BH ( по Бринеллю ) |
|---|---|---|
| Железные усы | 11000 | |
| Аусформованная (закаленная) сталь | 2930 | 850–1200 |
| Мартенситная сталь | 2070 | 600 |
| Бейнитная сталь | 1380 | 400 |
| Перлитная сталь | 1200 | 350 |
| Холоднодеформированное железо | 690 | 200 |
| Мелкозернистое железо | 340 | 100 |
| Углеродсодержащее железо | 140 | 40 |
| Чистое, монокристаллическое железо | 10 | 3 |
Как конструкционный материал
Железо является наиболее широко используемым из всех металлов, составляя более 90% мирового производства металлов. Его низкая стоимость и высокая прочность часто делают его материалом выбора для выдерживания напряжения или передачи сил, например, при строительстве машин и станков , рельсов , автомобилей , корпусов судов , арматурных стержней для бетона и несущих каркасов зданий. Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для производства стали. [130]
Механические свойства
Механические свойства железа и его сплавов чрезвычайно важны для их структурного применения. Эти свойства можно оценить различными способами, включая тест Бринелля , тест Роквелла и тест на твердость по Виккерсу .
Свойства чистого железа часто используются для калибровки измерений или для сравнения тестов. [129] [131] Однако механические свойства железа существенно зависят от чистоты образца: чистые монокристаллы железа на самом деле мягче алюминия, [128] а самое чистое промышленно производимое железо (99,99%) имеет твердость 20–30 по Бринеллю. [132] Чистое железо (99,9%~99,999%), в частности называемое электролитическим железом , производится в промышленных масштабах путем электролитического рафинирования .
Увеличение содержания углерода приведет к значительному повышению твердости и прочности железа на разрыв. Максимальная твердость 65 Rc достигается при содержании углерода 0,6%, хотя сплав имеет низкую прочность на разрыв. [133] Из-за мягкости железа с ним гораздо легче работать, чем с его более тяжелыми сородичами рутением и осмием . [17]
Виды сталей и сплавов

α-Железо — довольно мягкий металл, который может растворять только небольшую концентрацию углерода (не более 0,021% по массе при 910 °C). [134] Аустенит (γ-железо) также мягкий и металлический, но может растворять значительно больше углерода (до 2,04% по массе при 1146 °C). Эта форма железа используется в типе нержавеющей стали, используемой для изготовления столовых приборов, а также оборудования для больниц и предприятий общественного питания. [21]
Коммерчески доступное железо классифицируется на основе чистоты и обилия добавок. Чугун содержит 3,5–4,5% углерода [135] и содержит различные количества загрязняющих веществ, таких как сера , кремний и фосфор . Чугун не является товарным продуктом, а скорее промежуточным этапом в производстве чугуна и стали. Уменьшение загрязняющих веществ в чугуне, которые отрицательно влияют на свойства материала, таких как сера и фосфор, дает чугун, содержащий 2–4% углерода, 1–6% кремния и небольшое количество марганца . [120] Чугун имеет температуру плавления в диапазоне 1420–1470 К, что ниже, чем у любого из его двух основных компонентов, и делает его первым продуктом, который плавится при совместном нагревании углерода и железа. [11] Его механические свойства сильно различаются и зависят от формы, которую углерод принимает в сплаве. [17]
«Белые» чугуны содержат углерод в форме цементита , или карбида железа (Fe 3 C). [17] Это твердое, хрупкое соединение доминирует в механических свойствах белых чугунов, делая их твердыми, но неустойчивыми к ударам. Сломанная поверхность белого чугуна полна тонких граней сломанного карбида железа, очень бледного, серебристого, блестящего материала, отсюда и название. Медленное охлаждение смеси железа с 0,8% углерода ниже 723 °C до комнатной температуры приводит к отдельным, чередующимся слоям цементита и α-железа, которое является мягким и ковким и называется перлитом за свой внешний вид. Быстрое охлаждение, с другой стороны, не дает времени для этого разделения и создает твердый и хрупкий мартенсит . Затем сталь можно закалить, повторно нагрев до промежуточной температуры, изменив пропорции перлита и мартенсита. Конечный продукт при содержании углерода ниже 0,8% представляет собой смесь перлита и α-Fe, а при содержании углерода выше 0,8% — смесь перлита и цементита. [17]
В сером чугуне углерод существует в виде отдельных мелких чешуек графита , а также делает материал хрупким из-за острых кромок чешуек графита, которые создают места концентрации напряжений внутри материала. [136] Более новый вариант серого чугуна, называемый ковким чугуном , специально обрабатывается следовыми количествами магния для изменения формы графита на сфероиды или узелки, что снижает концентрацию напряжений и значительно увеличивает ударную вязкость и прочность материала. [136]
Кованое железо содержит менее 0,25% углерода, но большое количество шлака , который придает ему волокнистые свойства. [135] Кованое железо более устойчиво к коррозии, чем сталь. Его почти полностью заменила мягкая сталь , которая корродирует быстрее, чем кованое железо, но она дешевле и более широко доступна. Углеродистая сталь содержит 2,0% углерода или меньше, [137] с небольшим количеством марганца , серы , фосфора и кремния. Легированные стали содержат различные количества углерода, а также других металлов, таких как хром , ванадий , молибден , никель, вольфрам и т. д. Содержание в них сплавов повышает их стоимость, и поэтому они обычно используются только для специальных целей. Однако одной из распространенных легированных сталей является нержавеющая сталь . Недавние разработки в черной металлургии привели к появлению все большего ассортимента микролегированных сталей, также называемых « HSLA » или высокопрочными низколегированными сталями, содержащими крошечные добавки для получения высокой прочности и часто впечатляющей вязкости при минимальных затратах. [137] [138] [139]
Сплавы с высокочистым элементным составом (например, сплавы электролитического железа ) обладают особенно улучшенными свойствами, такими как пластичность , прочность на разрыв , ударная вязкость , усталостная прочность , жаропрочность и коррозионная стойкость.
Помимо традиционных применений, железо также используется для защиты от ионизирующего излучения. Хотя оно легче другого традиционного защитного материала, свинца , оно гораздо прочнее механически. [140]
Главным недостатком железа и стали является то, что чистое железо и большинство его сплавов сильно страдают от ржавчины , если не защищены каким-либо образом, что составляет более 1% от мировой экономики. [141] Окраска , гальванизация , пассивация , пластиковое покрытие и воронение используются для защиты железа от ржавчины путем исключения воды и кислорода или катодной защиты . Механизм ржавления железа следующий: [141]
- Катод: 3 O 2 + 6 H 2 O + 12 e − → 12 OH −
- Анод: 4 Fe → 4 Fe 2+ + 8 e − ; 4 Fe 2+ → 4 Fe 3+ + 4 e −
- В целом: 4 Fe + 3 O 2 + 6 H 2 O → 4 Fe 3+ + 12 OH − → 4 Fe(OH) 3 или 4 FeO(OH) + 4 H 2 O
Электролитом обычно является сульфат железа (II) в городских районах (образуется, когда атмосферный диоксид серы атакует железо), а также частицы соли в атмосфере в приморских районах. [141]
Катализаторы и реагенты
Поскольку Fe недорогой и нетоксичный, много усилий было направлено на разработку катализаторов и реагентов на основе Fe . Однако железо менее распространено в качестве катализатора в коммерческих процессах, чем более дорогие металлы. [142] В биологии ферменты, содержащие Fe, широко распространены. [143]
Железные катализаторы традиционно используются в процессе Габера-Боша для производства аммиака и в процессе Фишера-Тропша для преобразования оксида углерода в углеводороды для топлива и смазочных материалов. [144] Порошковое железо в кислой среде используется в восстановлении Бешампа , превращении нитробензола в анилин . [145]
Соединения железа
Оксид железа (III), смешанный с алюминиевым порошком, может быть воспламенен для создания термитной реакции , используемой при сварке крупных железных деталей (например, рельсов ) и очистке руд. Оксид железа (III) и оксигидроксид используются в качестве красноватых и охристых пигментов .
Хлорид железа (III) находит применение в очистке воды и сточных вод , при окраске тканей, в качестве красителя в красках, как добавка в корм для животных и как травитель для меди при производстве печатных плат . [146] Его также можно растворить в спирте для образования настойки железа, которая используется в качестве лекарства для остановки кровотечения у канареек . [147]
Сульфат железа (II) используется в качестве предшественника других соединений железа. Он также используется для снижения содержания хромата в цементе. Он используется для обогащения продуктов питания и лечения железодефицитной анемии . Сульфат железа (III) используется для осаждения мелких частиц сточных вод в воде резервуара. Хлорид железа (II) используется в качестве восстанавливающего флокулянта, при образовании комплексов железа и магнитных оксидов железа, а также в качестве восстанавливающего агента в органическом синтезе. [146]
Нитропруссид натрия — препарат, используемый в качестве сосудорасширяющего средства . Он входит в список основных лекарственных средств Всемирной организации здравоохранения . [148]
Биологическая и патологическая роль
Железо необходимо для жизни. [10] [149] [150] Железо -серные кластеры широко распространены и включают нитрогеназу , ферменты, ответственные за биологическую фиксацию азота . Железосодержащие белки участвуют в транспортировке, хранении и использовании кислорода. [10] Железосодержащие белки участвуют в переносе электронов . [151]

Примерами железосодержащих белков в высших организмах являются гемоглобин, цитохром (см. высоковалентное железо ) и каталаза . [10] [152] Средний взрослый человек содержит около 0,005% веса тела железа, или около четырех граммов, из которых три четверти находятся в гемоглобине — уровень, который остается постоянным, несмотря на то, что только около одного миллиграмма железа усваивается каждый день, [151] потому что организм человека перерабатывает свой гемоглобин для содержания железа. [153]
Росту микроорганизмов может способствовать окисление железа (II) или восстановление железа (III). [154]
Биохимия
Получение железа представляет собой проблему для аэробных организмов, поскольку трехвалентное железо плохо растворяется при pH, близком к нейтральному. Таким образом, эти организмы выработали средства для поглощения железа в виде комплексов, иногда поглощая двухвалентное железо перед тем, как окислить его обратно до трехвалентного железа. [10] В частности, бактерии выработали очень высокоаффинные секвестрирующие агенты, называемые сидерофорами . [155] [156] [157]
После поглощения в клетках человека , хранение железа точно регулируется. [10] [158] Основным компонентом этой регуляции является белок трансферрин , который связывает ионы железа, поглощенные из двенадцатиперстной кишки , и переносит их в крови к клеткам. [10] [159] Трансферрин содержит Fe 3+ в середине искаженного октаэдра, связанный с одним азотом, тремя кислородами и хелатирующим карбонатным анионом, который улавливает ион Fe 3+ : он имеет такую высокую константу стабильности , что он очень эффективен при поглощении ионов Fe 3+ даже из самых стабильных комплексов. В костном мозге трансферрин восстанавливается из Fe 3+ в Fe 2+ и хранится в виде ферритина для включения в гемоглобин. [151]
Наиболее известными и изученными бионеорганическими соединениями железа (биологическими молекулами железа) являются гем-протеины : примерами являются гемоглобин , миоглобин и цитохром P450 . [10] Эти соединения участвуют в транспортировке газов, построении ферментов и переносе электронов . [151] Металлопротеины представляют собой группу белков с кофакторами ионов металлов . Некоторые примеры железосодержащих металлопротеинов — ферритин и рубредоксин . [151] Многие жизненно важные ферменты содержат железо, такие как каталаза , [160] липоксигеназы , [161] и IRE-BP . [162]
Гемоглобин является переносчиком кислорода, который содержится в эритроцитах и придает им цвет, транспортируя кислород по артериям из легких в мышцы, где он переносится в миоглобин , который хранит его до тех пор, пока он не понадобится для метаболического окисления глюкозы , вырабатывая энергию. [10] Здесь гемоглобин связывается с углекислым газом , образующимся при окислении глюкозы, который транспортируется гемоглобином по венам (преимущественно в виде анионов бикарбоната ) обратно в легкие, где он выдыхается. [151] В гемоглобине железо находится в одной из четырех гемовых групп и имеет шесть возможных координационных мест: четыре заняты атомами азота в порфириновом кольце, пятое — имидазольным азотом в остатке гистидина одной из белковых цепей, присоединенных к гемовой группе, а шестое зарезервировано для молекулы кислорода, с которой оно может обратимо связываться. [151] Когда гемоглобин не присоединен к кислороду (и тогда называется дезоксигемоглобином), ион Fe 2+ в центре гемовой группы (в гидрофобной белковой внутренней части) находится в высокоспиновой конфигурации . Таким образом, он слишком велик, чтобы поместиться внутри порфиринового кольца, которое вместо этого изгибается в купол с ионом Fe 2+ примерно в 55 пикометрах над ним. В этой конфигурации шестой координационный участок, зарезервированный для кислорода, блокируется другим остатком гистидина. [151]
Когда дезоксигемоглобин захватывает молекулу кислорода, этот остаток гистидина перемещается и возвращается, как только кислород надежно прикреплен, чтобы сформировать с ним водородную связь . Это приводит к тому, что ион Fe2 + переключается в низкоспиновую конфигурацию, что приводит к уменьшению ионного радиуса на 20%, так что теперь он может вписаться в порфириновое кольцо, которое становится плоским. [151] Кроме того, эта водородная связь приводит к наклону молекулы кислорода, что приводит к углу связи Fe–O–O около 120°, что позволяет избежать образования мостиков Fe–O–Fe или Fe–O2 – Fe, которые привели бы к переносу электронов, окислению Fe2 + до Fe3 + и разрушению гемоглобина. Это приводит к перемещению всех белковых цепей, что приводит к изменению формы других субъединиц гемоглобина на форму с большим сродством к кислороду. Таким образом, когда дезоксигемоглобин захватывает кислород, его сродство к большему количеству кислорода увеличивается, и наоборот. [151] Миоглобин, с другой стороны, содержит только одну гемовую группу, и, следовательно, этот кооперативный эффект не может возникнуть. Таким образом, в то время как гемоглобин почти насыщен кислородом при высоких парциальных давлениях кислорода, обнаруженных в легких, его сродство к кислороду намного ниже, чем у миоглобина, который оксигенируется даже при низких парциальных давлениях кислорода, обнаруженных в мышечной ткани. [151] Как описано эффектом Бора (названным в честь Христиана Бора , отца Нильса Бора ), сродство гемоглобина к кислороду уменьшается в присутствии углекислого газа. [151]

Окись углерода и трехфтористый фосфор ядовиты для человека, поскольку они связываются с гемоглобином подобно кислороду, но с гораздо большей силой, так что кислород больше не может транспортироваться по всему организму. Гемоглобин, связанный с окисью углерода, известен как карбоксигемоглобин . Этот эффект также играет незначительную роль в токсичности цианида , но там основным эффектом является его вмешательство в правильное функционирование белка переноса электронов цитохрома a . [151] Цитохромные белки также включают гемовые группы и участвуют в метаболическом окислении глюкозы кислородом. Шестое координационное место затем занимает либо другой имидазольный азот, либо метиониновая сера, так что эти белки в значительной степени инертны к кислороду — за исключением цитохрома a, который связывается непосредственно с кислородом и, таким образом, очень легко отравляется цианидом. [151] Здесь перенос электронов происходит, поскольку железо остается в низкоспиновом состоянии, но изменяется между степенями окисления +2 и +3. Поскольку восстановительный потенциал каждого шага немного больше, чем предыдущего, энергия высвобождается шаг за шагом и, таким образом, может быть сохранена в аденозинтрифосфате . Цитохром a немного отличается, так как он находится на митохондриальной мембране, напрямую связывается с кислородом и переносит протоны, а также электроны, следующим образом: [151]
- 4 Цит 2+ + О 2 + 8Н+
внутри→ 4 Цит 3+ + 2 Н 2 О + 4Н+
снаружи
Хотя гем-протеины являются наиболее важным классом железосодержащих протеинов, железо-серные протеины также очень важны, поскольку участвуют в переносе электронов, что возможно, поскольку железо может стабильно существовать в состояниях окисления +2 или +3. Они имеют один, два, четыре или восемь атомов железа, каждый из которых приблизительно тетраэдрически координирован с четырьмя атомами серы; из-за этой тетраэдрической координации они всегда имеют высокоспиновое железо. Самым простым из таких соединений является рубредоксин , который имеет только один атом железа, координированный с четырьмя атомами серы из остатков цистеина в окружающих пептидных цепях. Другой важный класс железо-серных протеинов — ферредоксины , которые имеют несколько атомов железа. Трансферрин не принадлежит ни к одному из этих классов. [151]
Способность морских мидий удерживать сцепление со скалами в океане обеспечивается использованием ими металлоорганических железных связей в их богатых белком кутикулах . На основе синтетических реплик, присутствие железа в этих структурах увеличило модуль упругости в 770 раз, прочность на разрыв в 58 раз и прочность в 92 раза. Количество напряжения, необходимое для их постоянного повреждения, увеличилось в 76 раз. [164]
Питание
Диета
Железо широко распространено, но особенно богатыми источниками пищевого железа являются красное мясо , устрицы , бобы , птица , рыба , листовые овощи , кресс-салат , тофу и патока . [10] Хлеб и сухие завтраки иногда специально обогащаются железом. [10] [165]
Железо, поставляемое диетическими добавками, часто встречается в виде фумарата железа (II) , хотя сульфат железа (II) дешевле и усваивается так же хорошо. [146] Элементарное железо, или восстановленное железо, несмотря на то, что усваивается всего на одну треть или две трети эффективности (по сравнению с сульфатом железа), [166] часто добавляется в такие продукты, как хлопья для завтрака или обогащенная пшеничная мука. Железо наиболее доступно для организма, когда хелатировано аминокислотами [167] и также доступно для использования в качестве обычной добавки железа . Глицин , наименее дорогая аминокислота, чаще всего используется для производства добавок глицината железа. [168]
Рекомендации по питанию
Институт медицины США (IOM) обновил Оценочные средние потребности (EAR) и Рекомендуемые диетические нормы (RDA) для железа в 2001 году. [10] Текущая EAR для железа для женщин в возрасте 14–18 лет составляет 7,9 мг/день, 8,1 мг/день для возраста 19–50 лет и 5,0 мг/день в дальнейшем (постменопауза). Для мужчин EAR составляет 6,0 мг/день для возраста 19 лет и старше. RDA составляет 15,0 мг/день для женщин в возрасте 15–18 лет, 18,0 мг/день для возраста 19–50 лет и 8,0 мг/день в дальнейшем. Для мужчин 8,0 мг/день в возрасте 19 лет и старше. RDA выше, чем EAR, чтобы определить количество, которое будет покрывать людей с более высокими, чем средние, потребностями. RDA для беременности составляет 27 мг/день, а для лактации — 9 мг/день. [10] Для детей в возрасте от 1 до 3 лет — 7 мг/день, 10 мг/день для возраста от 4 до 8 лет и 8 мг/день для возраста от 9 до 13 лет. Что касается безопасности, IOM также устанавливает допустимые верхние уровни потребления (UL) для витаминов и минералов, когда имеются достаточные доказательства. В случае железа UL установлен на уровне 45 мг/день. В совокупности EAR, RDA и UL называются диетическими референтными нормами потребления . [169]
Европейское агентство по безопасности пищевых продуктов (EFSA) называет коллективный набор информации Диетическими референтными значениями, с Референтным потреблением населения (PRI) вместо RDA и Средней потребностью вместо EAR. AI и UL определяются так же, как в Соединенных Штатах. Для женщин PRI составляет 13 мг/день в возрасте 15–17 лет, 16 мг/день для женщин в возрасте 18 лет и старше, находящихся в пременопаузе, и 11 мг/день в постменопаузе. Для беременности и лактации 16 мг/день. Для мужчин PRI составляет 11 мг/день в возрасте 15 лет и старше. Для детей в возрасте от 1 до 14 лет PRI увеличивается с 7 до 11 мг/день. PRI выше, чем RDA в США, за исключением беременности. [170] EFSA рассмотрело тот же вопрос безопасности, но не установило UL. [171]
Младенцам могут потребоваться добавки железа, если их кормят коровьим молоком из бутылочки. [172] Те, кто часто сдает кровь, подвержены риску низкого уровня железа, и им часто рекомендуют принимать добавки железа. [173]
Для маркировки пищевых продуктов и диетических добавок в США количество в порции выражается в процентах от суточной нормы (%DV). Для маркировки железа 100% суточной нормы составляли 18 мг, и по состоянию на 27 мая 2016 года [обновлять]оставались неизменными на уровне 18 мг. [174] [175] Таблица старых и новых суточных норм для взрослых приведена в Reference Daily Intake .
Дефицит
Дефицит железа является наиболее распространенным дефицитом питательных веществ в мире. [10] [176] [177] [178] Когда потеря железа не компенсируется адекватным потреблением железа с пищей, возникает состояние латентного дефицита железа , которое со временем приводит к железодефицитной анемии, если ее не лечить, которая характеризуется недостаточным количеством эритроцитов и недостаточным количеством гемоглобина. [179] Дети, женщины в пременопаузе (женщины детородного возраста) и люди с плохим питанием наиболее восприимчивы к заболеванию. Большинство случаев железодефицитной анемии являются легкими, но если ее не лечить, могут возникнуть такие проблемы, как учащенное или нерегулярное сердцебиение, осложнения во время беременности и задержка роста у младенцев и детей. [180]
Мозг устойчив к острому дефициту железа из-за медленного транспорта железа через гематоэнцефалический барьер. [181] Острые колебания уровня железа (отмеченные уровнем ферритина в сыворотке) не отражают уровень железа в мозге, но предполагается, что длительный дефицит железа в питании со временем снижает концентрацию железа в мозге. [182] [183] В мозге железо играет роль в транспорте кислорода, синтезе миелина, митохондриальном дыхании и является кофактором для синтеза и метаболизма нейротрансмиттеров. [184] Животные модели дефицита железа в питании сообщают о биомолекулярных изменениях, напоминающих те, которые наблюдаются при болезнях Паркинсона и Хантингтона. [185] [186] Однако возрастное накопление железа в мозге также было связано с развитием болезни Паркинсона. [187]
Избыток
Поглощение железа жестко регулируется человеческим организмом, который не имеет регулируемых физиологических средств выделения железа. Только небольшое количество железа теряется ежедневно из-за отшелушивания эпителиальных клеток слизистой оболочки и кожи, поэтому контроль уровня железа в первую очередь достигается путем регулирования поглощения. [188] Регуляция поглощения железа нарушена у некоторых людей в результате генетического дефекта , который отображается в области гена HLA-H на хромосоме 6 и приводит к аномально низким уровням гепсидина , ключевого регулятора поступления железа в кровеносную систему у млекопитающих. [189] У этих людей чрезмерное потребление железа может привести к расстройствам перегрузки железом , известным в медицине как гемохроматоз . [10] Многие люди имеют недиагностированную генетическую восприимчивость к перегрузке железом и не знают о семейной истории этой проблемы. По этой причине людям не следует принимать добавки железа, если они не страдают дефицитом железа и не проконсультировались с врачом. По оценкам, гемохроматоз является причиной 0,3–0,8% всех метаболических заболеваний у европеоидной расы. [190]
Передозировка потребляемого железа может привести к чрезмерному уровню свободного железа в крови. Высокий уровень свободного двухвалентного железа в крови реагирует с перекисями , образуя высокореактивные свободные радикалы , которые могут повредить ДНК , белки , липиды и другие клеточные компоненты. Токсичность железа возникает, когда клетка содержит свободное железо, что обычно происходит, когда уровень железа превышает доступность трансферрина для связывания железа. Повреждение клеток желудочно-кишечного тракта также может помешать им регулировать всасывание железа, что приводит к дальнейшему повышению уровня железа в крови. Железо обычно повреждает клетки в сердце , печени и других местах, вызывая неблагоприятные эффекты, которые включают кому , метаболический ацидоз , шок , печеночную недостаточность , коагулопатию , долгосрочное повреждение органов и даже смерть. [191] Люди испытывают токсичность железа, когда уровень железа превышает 20 миллиграммов на каждый килограмм массы тела; 60 миллиграммов на килограмм считаются смертельной дозой . [192] Чрезмерное потребление железа, часто возникающее в результате употребления детьми большого количества таблеток сульфата железа , предназначенных для взрослых, является одной из наиболее распространенных токсикологических причин смерти у детей в возрасте до шести лет. [192] Диетическая рекомендуемая норма потребления (DRI) устанавливает допустимый верхний уровень потребления (UL) для взрослых на уровне 45 мг/день. Для детей в возрасте до четырнадцати лет UL составляет 40 мг/день. [193]
Медицинское лечение отравления железом является сложным и может включать использование специального хелатирующего агента, называемого дефероксамином, для связывания и выведения избытка железа из организма. [191] [194] [195]
СДВГ
Некоторые исследования показали, что низкий уровень таламического железа может играть роль в патофизиологии СДВГ . [196] Некоторые исследователи обнаружили, что добавки железа могут быть эффективными, особенно при невнимательном подтипе расстройства. [197]
Некоторые исследователи в 2000-х годах предположили связь между низким уровнем железа в крови и СДВГ. Исследование 2012 года не обнаружило такой корреляции. [198]
Рак
Роль железа в защите от рака можно описать как «палку о двух концах» из-за его повсеместного присутствия в непатологических процессах. [199] У людей, проходящих химиотерапию, может развиться дефицит железа и анемия , для восстановления уровня железа в организме используется внутривенная терапия железом . [200] Перегрузка железом, которая может возникнуть из-за большого потребления красного мяса, [10] может инициировать рост опухоли и повысить восприимчивость к началу рака, [200] особенно колоректального рака . [10]
Морские системы
Железо играет важную роль в морских системах и может выступать в качестве ограничивающего питательного вещества для планктонной активности. [201] Из-за этого слишком большое снижение железа может привести к снижению темпов роста фитопланктонных организмов, таких как диатомовые водоросли. [202] Железо также может окисляться морскими микробами в условиях с высоким содержанием железа и низким содержанием кислорода. [203]
Железо может попадать в морские системы через прилегающие реки и напрямую из атмосферы. Как только железо попадает в океан, оно может распределяться по всей толще воды через смешивание океана и через рециркуляцию на клеточном уровне. [204] В Арктике морской лед играет важную роль в хранении и распределении железа в океане, истощая океаническое железо, когда оно замерзает зимой, и высвобождая его обратно в воду, когда летом происходит таяние. [205] Круговорот железа может изменять формы железа от водных до частиц, изменяя доступность железа для первичных производителей. [206] Увеличение света и тепла увеличивает количество железа, которое находится в формах, которые могут использоваться первичными производителями. [207]
Смотрите также
- К экономически важным месторождениям железа относятся:
- Рудник Каражас в штате Пара, Бразилия, считается крупнейшим месторождением железа в мире.
- Эль-Мутун в Боливии, где находится 10% доступных в мире запасов железной руды.
- Бассейн Хамерсли — крупнейшее месторождение железной руды в Австралии .
- Киирунаваара в Швеции, где находится одно из крупнейших в мире месторождений железной руды
- Район добычи железной руды Месаби является основным районом добычи железной руды в США.
- Металлургическая промышленность
- Цикл железа
- Наночастица железа
- Наночастица железа и платины
- Удобрение железом – предлагаемое удобрение океанов для стимуляции роста фитопланктона.
- Бактерии, окисляющие железо
- Список стран по производству железа
- Гранулирование – процесс создания железорудных окатышей
- Нержавеющее железо
- Сталь
Ссылки
- ^ "Стандартные атомные веса: железо". CIAAW . 1993.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 мая 2022 г.). "Стандартные атомные веса элементов 2021 г. (Технический отчет ИЮПАК)". Чистая и прикладная химия . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Selected Values of the Crystallographic Properties of Elements . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcd Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 28. ISBN 978-0-08-037941-8.
- ^ Ram, RS; Bernath, PF (2003). "Фурье-преобразование эмиссионной спектроскопии системы g 4 Δ–a 4 Δ FeCl". Журнал молекулярной спектроскопии . 221 (2): 261. Bibcode : 2003JMoSp.221..261R. doi : 10.1016/S0022-2852(03)00225-X.
- ^ Демазо, Г.; Бюффа, Б.; Паучард, М.; Хагенмюллер, П. (1982). «Последние разработки в области высоких степеней окисления переходных элементов при стабилизации оксидов шестикоординированного железа(V)». Zeitschrift für anorganische und allgemeine Chemie . 491 : 60–66. дои : 10.1002/zaac.19824910109.
- ^ Lu, J.; Jian, J.; Huang, W.; Lin, H.; Li, J; Zhou, M. (2016). «Экспериментальная и теоретическая идентификация степени окисления Fe(VII) в FeO 4 − ». Физическая химия Химическая физика . 18 (45): 31125–31131. Bibcode :2016PCCP...1831125L. doi :10.1039/C6CP06753K. PMID 27812577.
- ^ Кардарелли, Франсуа (2008). Справочник по материалам: краткий настольный справочник . Лондон: Springer. стр. 65. ISBN 1-84628-668-9.
- ^ ab Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Chinese Physics C. 45 ( 3): 030001. doi :10.1088/1674-1137/abddae.
- ^ abcdefghijklmnopq "Железо". Центр информации о микроэлементах, Институт Лайнуса Полинга, Университет штата Орегон, Корваллис, Орегон. Апрель 2016 г. Получено 6 марта 2018 г.
- ^ abcdefgh Гринвуд и Эрншоу 1997, стр. 1075–79.
- ^ Tateno S, Hirose K (2010). «Структура железа во внутреннем ядре Земли». Science . 330 (6002). Американская ассоциация содействия развитию науки: 359–361. Bibcode :2010Sci...330..359T. doi :10.1126/science.1194662. PMID 20947762. S2CID 206528628.
- ^ Chamati, Gaminchev (2014). "Динамическая устойчивость Fe под высоким давлением". Journal of Physics . 558 (1). IOP Publishing: 012013. Bibcode : 2014JPhCS.558a2013G. doi : 10.1088/1742-6596/558/1/012013 .
- ^ Бёлер, Рейнхард (2000). «Эксперименты при высоком давлении и фазовая диаграмма материалов нижней мантии и ядра». Обзоры геофизики . 38 (2). Американский геофизический союз: 221–45. Bibcode : 2000RvGeo..38..221B. doi : 10.1029/1998RG000053 . S2CID 33458168.
- ^ Стиксруд, Ларс; Вассерман, Евгений; Коэн, Рональд Э. (10 ноября 1997 г.). «Состав и температура внутреннего ядра Земли». Журнал геофизических исследований: Твердая Земля . 102 (B11): 24729–39. Bibcode : 1997JGR...10224729S. doi : 10.1029/97JB02125 .
- ↑ Гринвуд и Эрншоу 1997, стр. 1116.
- ^ abcdef Гринвуд и Эрншоу 1997, стр. 1074–75.
- ^ Бёлер, Рейнхард; Росс, М. (2007). "Свойства горных пород и минералов_Плавление под высоким давлением". Mineral Physics . Treatise on Geophysics. Vol. 2. Elsevier. pp. 527–41. doi :10.1016/B978-044452748-6.00047-X. ISBN 9780444527486.
- ^ Штейнмец, Чарльз (1917). "рис. 42". Теория и расчет электрических цепей. McGraw-Hill.
- ^ аб Каллити; Компакт-диск Грэм (2008). Введение в магнитные материалы, 2-е. Нью-Йорк: Wiley – IEEE. п. 116. ИСБН 978-0-471-47741-9.
- ^ ab Bramfitt, BL; Benscoter, Arlan O. (2002). "Фазовая диаграмма железа и углерода". Справочник металлографа: практика и процедуры для железа и стали . ASM International. стр. 24–28. ISBN 978-0-87170-748-2.
- ^ Bikit, I.; Krmar, M.; Slivka, J.; Vesković, M.; Čonkić, Lj.; Aničin, I. (1 октября 1998 г.). «Новые результаты по двойному β-распаду железа». Physical Review C. 58 ( 4): 2566–2567. Bibcode : 1998PhRvC..58.2566B. doi : 10.1103/PhysRevC.58.2566. ISSN 0556-2813.
- ^ Rugel, G.; Faestermann, T.; Knie, K.; Korschinek, G.; Poutivtsev, M.; Schumann, D.; Kivel, N.; Günther-Leopold, I.; Weinreich, R.; Wohlmuther, M. (2009). "Новое измерение периода полураспада 60Fe". Physical Review Letters . 103 (7): 072502. Bibcode : 2009PhRvL.103g2502R. doi : 10.1103/PhysRevLett.103.072502. PMID 19792637.
- ^ Dauphas, N.; Rouxel, O. (2006). "Масс-спектрометрия и естественные вариации изотопов железа" (PDF) . Mass Spectrometry Reviews . 25 (4): 515–50. Bibcode :2006MSRv...25..515D. doi :10.1002/mas.20078. PMID 16463281. Архивировано из оригинала (PDF) 10 июня 2010 г.
- ^ Mostefaoui, S.; Lugmair, GW; Hoppe, P.; El Goresy, A. (2004). «Доказательства наличия живого 60Fe в метеоритах». New Astronomy Reviews . 48 (1–4): 155–59. Bibcode : 2004NewAR..48..155M. doi : 10.1016/j.newar.2003.11.022.
- ^ Fewell, MP (1995). «Атомный нуклид с самой высокой средней энергией связи». American Journal of Physics . 63 (7): 653. Bibcode : 1995AmJPh..63..653F. doi : 10.1119/1.17828.
- ^ Fewell, MP (1 июля 1995 г.). «Атомный нуклид с самой высокой средней энергией связи». American Journal of Physics . 63 (7): 653–658. Bibcode : 1995AmJPh..63..653F. doi : 10.1119/1.17828. ISSN 0002-9505.
- ^ Бербидж, Э. Маргарет ; Бербидж, ГР ; Фаулер, Уильям А .; Хойл, Ф. (1 октября 1957 г.). «Синтез элементов в звездах». Reviews of Modern Physics . 29 (4): 547–650. Bibcode : 1957RvMP...29..547B. doi : 10.1103/RevModPhys.29.547 .
- ^ abc Гринвуд и Эрншоу 1997, стр. 12.
- ^ Вусли, С.; Янка, Т. (2006). «Физика коллапса ядра сверхновых». Nature Physics . 1 (3): 147–54. arXiv : astro-ph/0601261 . Bibcode : 2005NatPh...1..147W. doi : 10.1038/nphys172. S2CID 118974639.
- ^ Макдональд, И.; Слоан, GC; Зейлстра, AA; Мацунага, Н.; Мацуура, М.; Крамер, KE; Бернард-Салас, Дж.; Марквик, А.Дж. (2010). «Ржавые старые звезды: источник пропавшего межзвездного железа?». The Astrophysical Journal Letters . 717 (2): L92–L97. arXiv : 1005.3489 . Bibcode : 2010ApJ...717L..92M. doi : 10.1088/2041-8205/717/2/L92. S2CID 14437704.
- ^ Баутиста, Мануэль А.; Прадхан, Анил К. (1995). «Содержание железа и никеля в областях H~II и остатках сверхновых». Бюллетень Американского астрономического общества . 27 : 865. Бибкод : 1995AAS...186.3707B.
- ^ Дайсон, Фримен Дж. (1979). «Время без конца: физика и биология в открытой вселенной». Обзоры современной физики . 51 (3): 447–60. Bibcode : 1979RvMP...51..447D. doi : 10.1103/RevModPhys.51.447.
- ^ Арон, Джейкоб. «Космические пули сверхновой могли засеять железное ядро Земли». New Scientist . Получено 2 октября 2020 г.
- ^ Кросвелл, Кен. «Железо в огне: сверхновые звезды, которые могли бы». Scientific American . Получено 3 января 2021 г.
- ^ Бухвальд, В. Ф. (1992). «Об использовании железа эскимосами в Гренландии». Характеристика материалов . 29 (2): 139–176. doi :10.1016/1044-5803(92)90112-U.
- ^ Эмилиани, Чезаре (1992). Планета Земля: космология, геология и эволюция жизни и окружающей среды. Cambridge University Press. стр. 152. Bibcode :1992pecg.book.....E. ISBN 978-0-521-40949-0.
- ^ Pernet-Fisher, J.; Day, JMD; Howarth, GH; Ryabov, VV; Taylor, LA (2017). «Атмосферная дегазация и образование самородного железа во время взаимодействия углеродистых осадков и базальтового расплава». Earth and Planetary Science Letters . 460 : 201–212. Bibcode : 2017E&PSL.460..201P. doi : 10.1016/j.epsl.2016.12.022 .
- ^ Старк, Энн М. (20 сентября 2007 г.) Исследователи обнаружили зону спинового перехода мантии, что привело к разгадке структуры Земли. Национальная лаборатория Лоуренса в Ливерморе
- ^ Ферропериклаз. Mindat.org
- ^ Мураками, М.; Охиши Ю.; Хирао Н.; Хиросе К. (2012). «Перовскитовая нижняя мантия, выведенная из данных о скорости звука при высоком давлении и температуре». Nature . 485 (7396): 90–94. Bibcode :2012Natur.485...90M. doi :10.1038/nature11004. PMID 22552097. S2CID 4387193.
- ^ Sharp, T. (27 ноября 2014 г.). «Бриджманит – наконец-то назван». Science . 346 (6213): 1057–58. Bibcode :2014Sci...346.1057S. doi :10.1126/science.1261887. PMID 25430755. S2CID 206563252.
- ^ Kong, LT; Li, JF; Shi, QW; Huang, HJ; Zhao, K. (6 марта 2012 г.). «Динамическая устойчивость железа в условиях высоких температур и давлений». EPL . 97 (5): 56004p1–56004p5. Bibcode :2012EL.....9756004K. doi :10.1209/0295-5075/97/56004. S2CID 121861429.
- ^ Гаминчев, КГ; Чамати, Х. (3 декабря 2014 г.). «Динамическая устойчивость железа под высоким давлением». J. Phys . 558 (1): 012013(1–7). Bibcode : 2014JPhCS.558a2013G. doi : 10.1088/1742-6596/558/1/012013 .
- ^ Морган, Джон В. и Андерс, Эдвард (1980). «Химический состав Земли, Венеры и Меркурия». Proc. Natl. Acad. Sci. 77 (12): 6973–77. Bibcode :1980PNAS...77.6973M. doi : 10.1073/pnas.77.12.6973 . PMC 350422 . PMID 16592930.
- ^ "Пирротит". Mindat.org . Получено 7 июля 2009 г. .
- ^ Кляйн, Корнелис и Корнелиус С. Херлбат, младший (1985) Руководство по минералогии, Wiley, 20-е изд., стр. 278–79 ISBN 0-471-80580-7
- ^ ab Greenwood & Earnshaw 1997, стр. 1071.
- ^ Lyons, TW; Reinhard, CT (2009). «Ранняя Земля: кислород для поклонников хэви-метала». Nature . 461 (7261): 179–181. Bibcode :2009Natur.461..179L. doi : 10.1038/461179a . PMID 19741692. S2CID 205049360.
- ^ Cloud, P. (1973). «Палеоэкологическое значение полосчатой железистой формации». Экономическая геология . 68 (7): 1135–43. Bibcode : 1973EcGeo..68.1135C. doi : 10.2113/gsecongeo.68.7.1135.
- ^ Дикинсон, Роберт Э. (1964). Германия: региональная и экономическая география (2-е изд.). Лондон: Метуэн.
- ^ Naturwerksteine в Баден-Вюртемберге. Landesamt für Geologie, Rohstoffe und Bergbau, Баден-Вюртемберг
- ^ "Tales From The Riverbank". Minerva Stone Conservation. Архивировано из оригинала 28 сентября 2015 г. Получено 22 сентября 2015 г.
- ^ Клингельхёфер, Г.; Моррис, Р.В.; Соуза, П.А.; Родионов, Д.; Шрёдер, К. (2007). «Два земных года мёссбауэровских исследований поверхности Марса с помощью MIMOS II». Hyperfine Interactions . 170 (1–3): 169–77. Bibcode : 2006HyInt.170..169K. doi : 10.1007/s10751-007-9508-5. S2CID 98227499.
- ^ Виндерлих, Р.; Питер, В. (1954). Lehrbuch der Chemie für Höhere Lehranstalten: Einheitsausgabe für Unter- und Oberstufe (на немецком языке). Висбаден: Vieweg+Teubner Verlag. п. 75. ИСБН 978-3-663-04370-6. OCLC 913701506.
- ^ Бертау, Мартин (2013). Industrielle Anorganische Chemie (на немецком языке). Вайнхайм: Wiley-VCH. п. 696. ИСБН 978-3-527-64956-3. OCLC 855858511.
- ^ Запасы металлов в обществе: научный синтез, 2010, Международная группа по ресурсам , ЮНЕП
- ^ Столл, Хизер (17 февраля 2020 г.). «30 лет железной гипотезы ледниковых периодов». Nature . 578 (7795). Springer Science and Business Media LLC: 370–371. Bibcode :2020Natur.578..370S. doi :10.1038/d41586-020-00393-x. ISSN 0028-0836. PMID 32066927. S2CID 211139074.
- ^ Fe(−4), Ru(−4) и Os(−4) были обнаружены в богатых металлами соединениях, содержащих октаэдрические комплексы [MIn 6− x Sn x ]; Pt(−3) (как димерный анион [Pt–Pt] 6− ), Cu(−2), Zn(−2), Ag(−2), Cd(−2), Au(−2) и Hg(−2) были обнаружены (как димерные и мономерные анионы; изначально сообщалось, что димерные ионы являются [T–T] 2− для Zn, Cd, Hg, но позже было показано, что они являются [T–T] 4− для всех этих элементов) в La 2 Pt 2 In, La 2 Cu 2 In, Ca 5 Au 3 , Ca 5 Ag 3 , Ca 5 Hg 3 , Sr 5 Cd 3 , Ca 5 Zn 3 (структура (AE 2+ ) 5 (T–T) 4− T 2− ⋅4e − ), Yb 3 Ag 2 , Ca 5 Au 4 и Ca 3 Hg 2 ; Au(–3) наблюдался в ScAuSn и других 18-электронных полугейслеровых соединениях. См. Changhoon Lee; Myung-Hwan Whangbo (2008). "Late transition metal anions performing as p-metal elements". Solid State Sciences . 10 (4): 444–449. Bibcode :2008SSSci..10..444K. doi :10.1016/j.solidstatesciences.2007.12.001.и Чанхун Ли; Мён-Хван Вангбо; Юрген Кёлер (2010). "Анализ электронных структур и химических связей в богатых металлами соединениях. 2. Присутствие димерных (T–T) 4– и изолированных T 2– анионов в полярных интерметаллических соединениях типа Cr 5 B 3 AE 5 T 3 (AE = Ca, Sr; T = Au, Ag, Hg, Cd, Zn)". Zeitschrift für Anorganische und Allgemeine Chemie . 636 (1): 36–40. doi :10.1002/zaac.200900421.
- ↑ Гринвуд и Эрншоу 1997, стр. 905.
- ^ ab Greenwood & Earnshaw 1997, стр. 1070.
- ^ Лу, Цзюнь-Бо; Цзянь, Цзивэнь; Хуан, Вэй; Линь, Хайлу; Ли, Цзюнь; Чжоу, Минфэй (16 ноября 2016 г.). «Экспериментальная и теоретическая идентификация степени окисления Fe(VII) в FeO 4 − ». Phys. Chem. Chem. Phys . 18 (45): 31125–31131. Bibcode :2016PCCP...1831125L. doi :10.1039/c6cp06753k. PMID 27812577.
- ^ Нам, Вонву (2007). «Высоковалентные комплексы железа (IV)–оксо с гемовыми и негемовыми лигандами в реакциях оксигенации» (PDF) . Accounts of Chemical Research . 40 (7): 522–531. doi :10.1021/ar700027f. PMID 17469792. Архивировано из оригинала (PDF) 15 июня 2021 г. . Получено 22 февраля 2022 г. .
- ^ abcdef Холлеман, Арнольд Ф.; Виберг, Эгон; Виберг, Нильс (1985). "Железо". Lehrbuch der Anorganischen Chemie (на немецком языке) (изд. 91–100). Вальтер де Грюйтер. стр. 1125–46. ISBN 3-11-007511-3.
- ^ Рейфф, Уильям Майкл; Лонг, Гэри Дж. (1984). «Мессбауэровская спектроскопия и координационная химия железа». Мессбауэровская спектроскопия в применении к неорганической химии . Springer. стр. 245–83. ISBN 978-0-306-41647-7.
- ^ Уэр, Майк (1999). «Введение в монохром». Цианотипия: история, наука и искусство фотографической печати в берлинской лазури . NMSI Trading Ltd. стр. 11–19. ISBN 978-1-900747-07-3.
- ^ Гмелин, Леопольд (1852). «Ртуть и железо». Справочник по химии . Т. 6. Кавендишское общество. С. 128–29.
- ^ abc Гринвуд и Эрншоу 1997, стр. 1079.
- ^ abcd Гринвуд и Эрншоу 1997, стр. 1082–84.
- ^ Зигфрид Поль, Ульрих Бирбах, Вольфганг Саак; «FeI3SC(NMe2)2, нейтральный тиомочевинный комплекс иодида железа(III)», Angewandte Chemie International Edition на английском языке (1989) 28 (6), 776-777. https://doi.org/10.1002/anie.198907761
- ^ Николас А. Барнс, Стивен М. Годфри, Николас Хо, Чарльз А. МакОлифф, Робин Г. Притчард; «Простой синтез редкого примера комплекса иодида железа (III), [FeI3(AsMe3)2], из реакции Me3AsI2 с неактивированным железным порошком», Polyhedron (2013) 55, 67-72. https://doi.org/10.1016/j.poly.2013.02.066
- ^ abcd Гринвуд и Эрншоу 1997, стр. 1088–91.
- ^ ab Greenwood & Earnshaw 1997, стр. 1091–97.
- ^ Clausen, CA; Good, ML (1968). «Стабилизация аниона гексахлорферрата(III) катионом метиламмония». Неорганическая химия . 7 (12): 2662–63. doi :10.1021/ic50070a047.
- ^ Джеймс, Б.Д.; Бакалова, М.; Лизеганга, Дж.; Рейфф, В.М.; Хоклесс, Д.К.Р.; Скелтон, Б.В.; Уайт, А.Х. (1996). "Гексахлороферрат(III)-анион, стабилизированный в водородно-связанных упаковочных расположениях. Сравнение рентгеновских кристаллических структур и низкотемпературного магнетизма тетракис(метиламмоний) гексахлороферрата(III)-хлорида (I) и тетракис(гексаметилендиаммоний) гексахлороферрата(III)-тетрахлорида (II) ". Inorganica Chimica Acta . 247 (2): 169–74. doi :10.1016/0020-1693(95)04955-X.
- ^ Giannoccaro, P.; Sacco, A. (1977). "Bis[Ethylenebis(Diphenylphosphine)]-Hydridoiron Complexes". Неорганические синтезы . Т. 17. С. 69–72. doi :10.1002/9780470132487.ch19. ISBN 978-0-470-13248-7.
- ^ Ли, Дж.; Юнг, Г.; Ли, СВ (1998). «Структура транс-хлоргидридобис(дифенилфосфиноэтана)железа(II)». Bull. Korean Chem. Soc . 19 (2): 267–69. doi :10.1007/BF02698412. S2CID 35665289.
- ^ Этиго, Такуя; Кимата, Мицуёси (2008). «Исследования рентгеновской дифракции и спектроскопии на монокристаллах гумбольдтина и линдбергита: слабый эффект Яна–Теллера иона Fe 2+ ». Phys. Chem. Minerals . 35 (8): 467–75. Bibcode :2008PCM....35..467E. doi :10.1007/s00269-008-0241-7. S2CID 98739882.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press . С. 1282–86. ISBN 978-0-08-022057-4..
- ^ Kealy, TJ; Pauson, PL (1951). «Новый тип железоорганического соединения». Nature . 168 (4285): 1039–40. Bibcode : 1951Natur.168.1039K. doi : 10.1038/1681039b0. S2CID 4181383.
- ^ Миллер, SA; Теббот, Дж.А.; Тремейн, Дж. Ф. (1952). «114. Дициклопентадиенилирон». Дж. Хим. Соц. : 632–635. дои : 10.1039/JR9520000632.
- ^ Уилкинсон, Г .; Розенблюм, М.; Уайтинг, М.К.; Вудворд, Р.Б. (1952). «Структура бис-циклопентадиенила железа». J. Am. Chem. Soc. 74 (8): 2125–2126. doi :10.1021/ja01128a527.
- ^ Окуда, Джун (28 декабря 2016 г.). «Ферроцен – 65 лет спустя». Европейский журнал неорганической химии . 2017 (2): 217–219. doi : 10.1002/ejic.201601323 . ISSN 1434-1948.
- ↑ Гринвуд и Эрншоу 1997, стр. 1104.
- ^ Буллок, Р. М. (11 сентября 2007 г.). «Железный катализатор для гидрирования кетонов в мягких условиях». Angew. Chem. Int. Ed. 46 (39): 7360–63. doi : 10.1002/anie.200703053 . PMID 17847139.
- ↑ Уикс 1968, стр. 4.
- ^ ab Weeks 1968, стр. 29.
- ^ abc Weeks 1968, стр. 31.
- ^ Бьоркман, Джудит Кингстон (1973). «Метеоры и метеориты на древнем Ближнем Востоке». Метеоритика . 8 (2): 91–132. Bibcode : 1973Metic...8...91B. doi : 10.1111/j.1945-5100.1973.tb00146.x.
- ^ Комелли, Даниэла; д'Орацио, Массимо; Фолько, Луиджи; Эль-Халваги, Махмуд; Фриззи, Томмазо; Альберти, Роберто; Капогроссо, Валентина; Эльнаггар, Абдельразек; Хасан, Хала; Невин, Остин; Порчелли, Франко; Рашед, Мохамед Дж; Валентини, Джанлука (2016). «Метеоритное происхождение лезвия железного кинжала Тутанхамона». Метеоритика и планетология . 51 (7): 1301–09. Бибкод : 2016M&PS...51.1301C. дои : 10.1111/maps.12664 .
- ^ Уолш, Деклан (2 июня 2016 г.). «Исследователи говорят, что кинжал Тутанхамона сделан из «железа с неба»» . The New York Times . Архивировано из оригинала 3 января 2022 г. Получено 4 июня 2016 г. состав
лезвия из железа, никеля и кобальта приблизительно соответствовал метеориту, упавшему на севере Египта. Результат «убедительно свидетельствует о внеземном происхождении»
- ^ Юр, Эндрю (1843). Technisches wörterbuch или Handbuch der Gewerbskunde ... : Bearb. nach Словарь искусства, производства и шахт доктора Эндрю Юра (на немецком языке). Г. Хаазе. п. 492.
- ^ abcd Weeks 1968, стр. 32.
- ^ Макнатт, Паула (1990 1). Ковка Израиля: железная технология, символизм и традиция в древнем обществе. A&C Black.
- ^ Тевари, Ракеш. «Истоки обработки железа в Индии: новые свидетельства с равнины Центральной Ганга и Восточных Виндхья» (PDF) . Государственный археологический департамент . Получено 23 мая 2010 г. .
- ^ Photos, E. (1989). «Вопрос метеоритного и выплавленного богатого никелем железа: археологические свидетельства и экспериментальные результаты». World Archaeology . 20 (3). Taylor & Francis, Ltd.: 403–21. doi : 10.1080/00438243.1989.9980081. JSTOR 124562.
- ^ Muhly, James D. (2003). «Металлообработка/горное дело в Леванте». В Lake, Richard Winona (ред.). Near Eastern Archaeology IN: Eisenbrauns . Т. 180. С. 174–83.
- ^ Витцель, Майкл (2001), «Автохтонные арийцы? Свидетельства из древнеиндийских и иранских текстов», в Electronic Journal of Vedic Studies (EJVS) 7-3, стр. 1–93
- ↑ Weeks, стр. 33, цитирует Cline, Walter (1937) «Горное дело и металлургия в негритянской Африке», George Banta Publishing Co., Menasha, Wis., стр. 17–23.
- ^ Ридерер, Йозеф; Вартке, Ральф-Б. (2009) «Железо», Канчик, Юбер; Шнайдер, Хельмут (ред.): New Pauly Brill , Brill.
- ^ Сойер, Ральф Д. и Сойер, Мэй-чунь (1993). Семь классических военных произведений Древнего Китая. Боулдер: Westview. ISBN 0-465-00304-4 . стр. 10.
- ^ Пиготт, Винсент С. (1999). Археометаллургия азиатского Старого Света . Филадельфия: Музей археологии и антропологии Пенсильванского университета. ISBN 0-924171-34-0 , стр. 8.
- ^ Голас, Питер Дж. (1999). Наука и цивилизация в Китае: Том 5, Химия и химическая технология, Часть 13, Горное дело. Cambridge University Press. С. 152. ISBN 978-0-521-58000-7.
самая ранняя доменная печь, обнаруженная в Китае, датируется примерно первым веком нашей эры.
- ^ Пиготт, Винсент С. (1999). Археометаллургия азиатского Старого Света . Филадельфия: Музей археологии и антропологии Пенсильванского университета. ISBN 0-924171-34-0 , стр. 191.
- ↑ Наступление века стали. Архив Брилла. 1961. С. 54.
- ^ Мотт, РА (2014). «Сухая и мокрая пудинговая обработка». Труды Общества Ньюкомена . 49 : 156–57. doi :10.1179/tns.1977.011.
- ^ Вагнер, Дональд Б. (2003). «Китайские доменные печи с 10 по 14 век» (PDF) . Историческая металлургия . 37 (1): 25–37. Архивировано из оригинала (PDF) 7 января 2018 года . Получено 7 января 2018 года .Первоначально опубликовано в Wagner, Donald B. (2001). «Китайские доменные печи с 10 по 14 век». West Asian Science, Technology, and Medicine . 18 : 41–74. doi :10.1163/26669323-01801008.
- ^ Джанничедда, Энрико (2007): «Производство металла в поздней античности», в книге « Технологии в переходный период 300–650 гг. н. э. » Лаван, Л.; Занини, Э. и Сарантис, А. (ред.), Брилл, Лейден; ISBN 90-04-16549-5 , стр. 200.
- ^ abcdefg Биддл, Верн; Паркер, Грегори. Химия, точность и проектирование . A Beka Book, Inc.
- ^ Вагнер, Дональд Б. (1993). Железо и сталь в Древнем Китае . Brill. стр. 335–340. ISBN 978-90-04-09632-5.
- ^ abcd Гринвуд и Эрншоу 1997, стр. 1072.
- ^ Шифельбуш, Г. (1986) Путешествие по железной дороге: индустриализация и восприятие времени и пространства в XIX веке. Оксфорд: Берг.
- ^ Шпорл, Джозеф С. Краткая история производства чугуна и стали Архивировано 2 июня 2010 г. в Wayback Machine . Колледж Святого Ансельма
- ^ Enghag, Per (8 января 2008 г.). Энциклопедия элементов: Технические данные – История – Обработка – Применение. John Wiley & Sons. С. 190–91. ISBN 978-3-527-61234-5.
- ^ Уитакер, Роберт Д. (1975). «Историческая заметка о сохранении массы». Журнал химического образования . 52 (10): 658. Bibcode : 1975JChEd..52..658W. doi : 10.1021/ed052p658.
- ^ Фонтенроуз, Джозеф (1974). «Работа, справедливость и пять веков Гесиода». Классическая филология . 69 (1): 1–16. doi :10.1086/366027. JSTOR 268960. S2CID 161808359.
- ^ Шмидт, Ева (1981) Der preußische Eisenkunstguss. (Искусство прусского чугуна) Technik, Geschichte, Werke, Künstler . Верлаг Манн, Берлин, ISBN 3-7861-1130-8
- ^ Люкс, Х. (1963) «Металлическое железо» в Справочнике по препаративной неорганической химии , 2-е изд. Г. Брауэр (ред.), Academic Press, Нью-Йорк. Т. 2. С. 1490–91.
- ^ Ежегодник статистики по стали 2010. Всемирная ассоциация стали
- ^ abcdefg Greenwood & Earnshaw 1997, стр. 1073.
- ^ Ван, Пэн; Райберг, Мортен; Ян, И; Фэн, Куйшуан; Кара, Сами; Хаушильд, Майкл; Чэнь, Вэй-Цян (6 апреля 2021 г.). «Стагнация эффективности в мировом производстве стали требует совместных усилий по смягчению последствий со стороны предложения и спроса». Nature Communications . 12 (1): 2066. Bibcode :2021NatCo..12.2066W. doi :10.1038/s41467-021-22245-6. ISSN 2041-1723. PMC 8024266 . PMID 33824307.
- ^ Сун Инсин (1637): Энциклопедия Тяньгун Кайу .
- ^ Верховен, Дж. Д. (1975) Основы физической металлургии , Wiley, Нью-Йорк, стр. 326
- ^ Allanore, Antoine; Yin, Lan; Sadoway, Donald R. (2013). «Новый анодный материал для выделения кислорода при электролизе расплавленных оксидов». Nature . 497 (7449): 353–356. Bibcode :2013Natur.497..353A. doi :10.1038/nature12134. hdl : 1721.1/82073 . ISSN 0028-0836. PMID 23657254.
- ^ Wiencke, Jan; Lavelaine, Hervé; Panteix, Pierre-Jean; Petitjean, Carine; Rapin, Christophe (2018). «Электролиз железа в расплавленном оксидном электролите». Журнал прикладной электрохимии . 48 (1): 115–126. doi : 10.1007/s10800-017-1143-5 . ISSN 0021-891X.
- ^ Фань, Чжиюань; Фридман, С. Хулио (2021). «Низкоуглеродное производство железа и стали: технологические возможности, экономическая оценка и политика». Джоуль . 5 (4): 829–862. Bibcode :2021Joule...5..829F. doi : 10.1016/j.joule.2021.02.018 .
- ^ Галлуччи, Мария (7 сентября 2023 г.). «Boston Metal получает большой импульс финансирования для производства зеленой стали». Canary Media . Rocky Mountain Institute . Получено 11 марта 2024 г.
- ^ ab Kohl, Walter H. (1995). Справочник по материалам и методам для вакуумных приборов. Springer. С. 164–67. ISBN 1-56396-387-6.
- ^ ab Kuhn, Howard; Medlin, Dana; et al., ред. (2000). ASM Handbook – Механические испытания и оценка (PDF) . Том 8. ASM International. стр. 275. ISBN 0-87170-389-0. Архивировано из оригинала (PDF) 9 февраля 2019 г. . Получено 22 февраля 2022 г. .
- ↑ Гринвуд и Эрншоу 1997, стр. 1070–71.
- ^ "Таблица преобразования твердости". Maryland Metrics. Архивировано из оригинала 18 июня 2015 года . Получено 23 мая 2010 года .
- ^ Такаджи, Кусакава; Тошикацу, Отани (1964). «Свойства различных чистых железа: исследование чистого железа I». Тецу-то-Хагане . 50 (1): 42–47. дои : 10.2355/tetsutohagane1955.50.1_42 .
- ^ Рагхаван, В. (2004). Материаловедение и инженерия. PHI Learning Pvt. Ltd. стр. 218. ISBN 81-203-2455-2.
- ^ Мартин, Джон Уилсон (2007). Краткая энциклопедия структуры материалов. Elsevier. С. 183. ISBN 978-0-08-045127-5.
- ^ ab Camp, James McIntyre; Francis, Charles Blaine (1920). Изготовление, формовка и обработка стали. Питтсбург: Carnegie Steel Company. С. 173–74. ISBN 1-147-64423-3.
- ^ ab Смит, Уильям Ф.; Хашеми, Джавад (2006), Основы материаловедения и инженерии (4-е изд.), McGraw-Hill, стр. 431, ISBN 0-07-295358-6.
- ^ ab "Классификация углеродистых и низколегированных сталей". Архивировано из оригинала 2 января 2011 г. Получено 5 января 2008 г.
- ^ "HSLA Steel". 15 ноября 2002 г. Архивировано из оригинала 30 декабря 2009 г. Получено 11 октября 2008 г.
- ^ Оберг, Э. и др. (1996). Справочник по машиностроению (25-е изд.). Нью-Йорк: Industrial Press. С. 440–42. Bibcode : 1984msh..book.....R.
- ^ Rokni, Sayed H.; Cossairt, J. Donald; Liu, James C. (январь 2008 г.). "Radiation Shielding at High-Energy Electron and Proton Accelerators" (PDF) . Получено 6 августа 2016 г. .
- ^ abc Гринвуд и Эрншоу 1997, стр. 1076.
- ^ Фюрстнер, Алоис (2016). «Железный катализ в органическом синтезе: критическая оценка того, что нужно, чтобы сделать этот базовый металл чемпионом многозадачности». ACS Central Science . 2 (11): 778–789. doi :10.1021/acscentsci.6b00272. PMC 5140022 . PMID 27981231.
- ^ Буллок, Р. Моррис и др. (2020). «Использование проекта природы для расширения катализа с помощью распространенных на Земле металлов». Science . 369 (6505): eabc3183. doi :10.1126/science.abc3183. PMC 7875315 . PMID 32792370.
- ^ Коласински, Курт В. (2002). «Где важны гетерогенные реакции». Наука о поверхности: основы катализа и нанонауки . John Wiley and Sons. стр. 15–16. ISBN 978-0-471-49244-3.
- ^ Маккетта, Джон Дж. (1989). «Нитробензол и нитротолуол». Энциклопедия химической обработки и проектирования: Том 31 – Трубопроводы для транспортировки сжиженного природного газа и природного бензина в морские технологические установки: сплавы с высокими эксплуатационными характеристиками . CRC Press. С. 166–67. ISBN 978-0-8247-2481-8.
- ^ abc Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael (2000). "Соединения железа". Энциклопедия промышленной химии Ульмана . doi :10.1002/14356007.a14_591. ISBN 3-527-30673-0.
- ^ Страуд, Роберт (1933). Болезни канареек . Canary Publishers Company. стр. 203. ISBN 978-1-4465-4656-7.
- ^ Всемирная организация здравоохранения (2021). Примерный список основных лекарственных средств Всемирной организации здравоохранения: 22-й список (2021) . Женева: Всемирная организация здравоохранения. hdl : 10665/345533 . WHO/MHP/HPS/EML/2021.02.
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. (2013). «Железный металлом в эукариотических организмах». В Banci, Lucia (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том 12. Springer. стр. 241–78. doi :10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. PMC 3924584 . PMID 23595675.электронная книга ISBN 978-94-007-5561-1
- ^ Йи, Гереон М.; Толман, Уильям Б. (2015). «Комплексы переходных металлов и активация диоксида кремния». В Питере М. Х. Кронеке; Марте Э. Сосе Торрес (ред.). Поддержание жизни на планете Земля: металлоферменты, осваивающие диоксид кремния и другие жевательные газы . Ионы металлов в науках о жизни. Том 15. Springer. стр. 131–204. doi :10.1007/978-3-319-12415-5_5. ISBN 978-3-319-12414-8. PMID 25707468.
- ^ abcdefghijklmnop Гринвуд и Эрншоу 1997, стр. 1098–104.
- ^ Липпард, С. Дж.; Берг, Дж. М. (1994). Принципы бионеорганической химии . Mill Valley: University Science Books. ISBN 0-935702-73-3.
- ^ Кикучи, Г.; Йошида, Т.; Ногучи, М. (2005). «Гем-оксигеназа и деградация гема». Biochemical and Biophysical Research Communications . 338 (1): 558–67. doi :10.1016/j.bbrc.2005.08.020. PMID 16115609.
- ^ "Содержание томов в серии "Ионы металлов в науках о жизни". Металлы, микробы и минералы - биогеохимическая сторона жизни . De Gruyter. 2021. стр. xxv–xlvi. doi :10.1515/9783110589771-006. ISBN 9783110589771. S2CID 196704759.
- ^ Neilands, JB (1995). «Сидерофоры: структура и функция микробных соединений транспорта железа». Журнал биологической химии . 270 (45): 26723–26. doi : 10.1074/jbc.270.45.26723 . PMID 7592901.
- ^ Neilands, JB (1981). «Микробные соединения железа». Annual Review of Biochemistry . 50 (1): 715–31. doi :10.1146/annurev.bi.50.070181.003435. PMID 6455965.
- ^ Boukhalfa, Hakim; Crumbliss, Alvin L. (2002). «Химические аспекты опосредованного сидерофорами транспорта железа». BioMetals . 15 (4): 325–39. doi :10.1023/A:1020218608266. PMID 12405526. S2CID 19697776.
- ^ Нанами, М.; Оокавара, Т.; Отаки, Й.; Ито, К.; Моригучи, Р.; Миягава, К.; Хасуике, Й.; Изуми, М.; Эгучи, Х.; Сузуки, К.; Наканиши, Т. (2005). «Секвестрация железа, вызванная фактором некроза опухоли-α, и окислительный стресс в эндотелиальных клетках человека». Артериосклероз, тромбоз и сосудистая биология . 25 (12): 2495–501. doi : 10.1161/01.ATV.0000190610.63878.20 . PMID 16224057.
- ^ Руо, Трейси А. (2003). «Как млекопитающие получают и распределяют железо, необходимое для метаболизма на основе кислорода». PLOS Biology . 1 (3): e9. doi : 10.1371/journal.pbio.0000079 . PMC 300689. PMID 14691550 .
- ^ Boon EM, Downs A, Marcey D. "Предлагаемый механизм каталазы". Каталаза: H 2 O 2 : H 2 O 2 Oxidoreductase: Catalase Structural Tutorial . Получено 11 февраля 2007 г.
- ^ Boyington JC, Gaffney BJ, Amzel LM (1993). «Трехмерная структура 15-липоксигеназы арахидоновой кислоты». Science . 260 (5113): 1482–86. Bibcode :1993Sci...260.1482B. doi :10.1126/science.8502991. PMID 8502991.
- ^ Gray, NK; Hentze, MW (август 1994). «Железный регуляторный белок предотвращает связывание комплекса предварительной инициации трансляции 43S с мРНК ферритина и eALAS». EMBO J . 13 (16): 3882–91. doi :10.1002/j.1460-2075.1994.tb06699.x. PMC 395301 . PMID 8070415.
- ^ Грегори Б. Васкес; Синьхуа Цзи; Клара Фронтичелли; Гэри Л. Джиллиланд (1998). «Человеческий карбоксигемоглобин при разрешении 2,2 Å: сравнение структуры и растворителей гемоглобинов в R-состоянии, R2-состоянии и T-состоянии». Acta Crystallogr. D . 54 (3): 355–66. Bibcode :1998AcCrD..54..355V. doi : 10.1107/S0907444997012250 . PMID 9761903.
- ^ Сандерсон, К (2017). «Железная хватка мидий вдохновляет на создание прочного и эластичного полимера». Новости химии и машиностроения . 95 (44). Американское химическое общество: 8. doi :10.1021/cen-09544-notw3 . Получено 2 ноября 2017 г.
- ^ Агентство по стандартам пищевых продуктов – Питайтесь хорошо, будьте здоровы – Дефицит железа Архивировано 8 августа 2006 г. на Wayback Machine . Eatwell.gov.uk (5 марта 2012 г.). Получено 27 июня 2012 г.
- ^ Хоппе, М.; Хултен, Л.; Холлберг, Л. (2005). «Относительная биодоступность у людей порошков элементарного железа для использования в обогащении продуктов питания». Европейский журнал питания . 45 (1): 37–44. doi :10.1007/s00394-005-0560-0. PMID 15864409. S2CID 42983904.
- ^ Пинеда, О.; Эшмид, HD (2001). «Эффективность лечения железодефицитной анемии у младенцев и детей младшего возраста с помощью хелата бисглицината железа». Nutrition . 17 (5): 381–4. doi :10.1016/S0899-9007(01)00519-6. PMID 11377130.
- ^ Эшмид, Х. ДеУэйн (1989).Беседы о хелатировании и минеральном питании. Издательство Keats. ISBN 0-87983-501-X.
- ^ Группа по микроэлементам Института медицины (США) (2001). "Железо" (PDF) . Диетические рекомендуемые нормы потребления витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и железа . National Academy Press. стр. 290–393. ISBN 0-309-07279-4. PMID 25057538. Архивировано из оригинала (PDF) 9 сентября 2017 г. . Получено 9 марта 2017 г. .
- ^ «Обзор рекомендуемых значений диетического питания для населения ЕС, разработанный Группой EFSA по диетическим продуктам, питанию и аллергиям» (PDF) . Европейское агентство по безопасности пищевых продуктов . 2017.
- ^ «Верхние допустимые уровни потребления витаминов и минералов» (PDF) . Европейское агентство по безопасности пищевых продуктов. 2006.
- ^ "Железодефицитная анемия". MediResource. Архивировано из оригинала 16 декабря 2008 г. Получено 17 декабря 2008 г.
- ^ Milman, N. (1996). «Сывороточный ферритин у датчан: исследования статуса железа с младенчества до старости, во время донорства крови и беременности». Международный журнал гематологии . 63 (2): 103–35. doi : 10.1016/0925-5710(95)00426-2 . PMID 8867722.
- ^ «Федеральный регистр, 27 мая 2016 г. Маркировка пищевых продуктов: Пересмотр этикеток с информацией о пищевой ценности и пищевых добавках. Страница FR 33982» (PDF) .
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)". База данных этикеток диетических добавок (DSLD) . Архивировано из оригинала 7 апреля 2020 г. . Получено 16 мая 2020 г. .
- ^ Центры по контролю и профилактике заболеваний (2002). «Дефицит железа – США, 1999–2000». MMWR . 51 (40): 897–99. PMID 12418542.
- ^ Hider, Robert C.; Kong, Xiaole (2013). "Глава 8. Железо: Эффект перегрузки и дефицита". В Astrid Sigel, Helmut Sigel и Roland KO Sigel (ред.). Взаимосвязи между ионами основных металлов и болезнями человека . Ионы металлов в науках о жизни. Том 13. Springer. стр. 229–94. doi :10.1007/978-94-007-7500-8_8. ISBN 978-94-007-7499-5. PMID 24470094.
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. (2013). «Железный металлом в эукариотических организмах». В Banci, Lucia (ред.). Металломика и клетка . Ионы металлов в науках о жизни. Том 12. Springer. стр. 241–78. doi :10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. PMC 3924584 . PMID 23595675.электронная книга ISBN 978-94-007-5561-1
- ^ Центры CDC по контролю и профилактике заболеваний (3 апреля 1998 г.). «Рекомендации по профилактике и контролю дефицита железа в Соединенных Штатах». Еженедельный отчет о заболеваемости и смертности . 47 (RR3): 1. Получено 12 августа 2014 г.
- ^ Центры по контролю и профилактике заболеваний. "Железо и дефицит железа" . Получено 12 августа 2014 г.
- ^ Youdim, MB; Ben-Shachar, D.; Yehuda, S. (сентябрь 1989 г.). «Предполагаемые биологические механизмы влияния дефицита железа на биохимию мозга и поведение». The American Journal of Clinical Nutrition . 50 (3 Suppl): 607–615, обсуждение 615–617. doi : 10.1093/ajcn/50.3.607 . ISSN 0002-9165. PMID 2773840.
- ^ Эриксон, К. М.; Пинеро, Д. Д.; Коннор, Дж. Р.; Бирд, Дж. Л. (октябрь 1997 г.). «Региональные концентрации железа, ферритина и трансферрина в мозге при дефиците железа и восполнении запасов железа у развивающихся крыс». Журнал питания . 127 (10): 2030–2038. doi : 10.1093/jn/127.10.2030 . ISSN 0022-3166. PMID 9311961.
- ^ Унгер, Эрика Л.; Бьянко, Лора Э.; Джонс, Байрон К.; Аллен, Ричард П.; Эрли, Кристофер Дж. (ноябрь 2014 г.). «Влияние низкого содержания железа в мозге и обратимость на динамику дофамина в полосатом теле». Экспериментальная неврология . 261 : 462–468. doi :10.1016/j.expneurol.2014.06.023. PMC 4318655. PMID 24999026 .
- ^ Уорд, Роберта Дж.; Зукка, Фабио А.; Дуйн, Джефф Х.; Крайтон, Роберт Р.; Зекка, Луиджи (октябрь 2014 г.). «Роль железа в старении мозга и нейродегенеративных расстройствах». The Lancet. Неврология . 13 (10): 1045–1060. doi :10.1016/S1474-4422(14)70117-6. ISSN 1474-4465. PMC 5672917. PMID 25231526 .
- ^ Pino, Jessica MV; da Luz, HM; Antunes, Hanna KM; Giampá, Sara Q. de Campos; Martins, Vilma R.; Lee, Kil S. (17 мая 2017 г.). «Диета с ограничением железа влияет на уровень ферритина в мозге, метаболизм дофамина и клеточный прионный белок в зависимости от региона». Frontiers in Molecular Neuroscience . 10 : 145. doi : 10.3389/fnmol.2017.00145 . ISSN 1662-5099. PMC 5434142. PMID 28567002 .
- ^ Бирд, Джон; Эриксон, Кит М.; Джонс, Байрон К. (1 апреля 2003 г.). «Неонатальный дефицит железа приводит к необратимым изменениям функции дофамина у крыс». Журнал питания . 133 (4): 1174–1179. doi : 10.1093/jn/133.4.1174 . ISSN 0022-3166. PMID 12672939.
- ^ Доминик Дж. Хэр; Кей Л. Дабл (апрель 2016 г.). «Железо и дофамин: токсичная пара». Мозг . 139 (4): 1026–1035. doi : 10.1093/brain/aww022 . PMID 26962053.
- ^ Рамзи С. Котран; Винай Кумар; Такер Коллинз; Стэнли Леонард Роббинс (1999). Патологическая основа болезни Роббинса. Сондерс. ISBN 978-0-7216-7335-6. Получено 27 июня 2012 г.
- ^ Ganz T (август 2003 г.). «Гепцидин, ключевой регулятор метаболизма железа и медиатор анемии воспаления». Кровь . 102 (3): 783–8. doi : 10.1182/blood-2003-03-0672 . PMID 12663437. S2CID 28909635.
- ^ Дурупт, С.; Дюрье, И.; Нове-Жоссеран, Р.; Бенчариф, Л.; Руссе, Х.; Виталь Дюран, Д. (2000). «Наследственный гемохроматоз». Преподобный МедИнтерн . 21 (11): 961–71. дои : 10.1016/S0248-8663(00)00252-6. ПМИД 11109593.
- ^ ab Cheney, K.; Gumbiner, C.; Benson, B.; Tenenbein, M. (1995). «Выживание после тяжелого отравления железом, леченного прерывистыми инфузиями дефероксамина». J Toxicol Clin Toxicol . 33 (1): 61–66. doi :10.3109/15563659509020217. PMID 7837315.
- ^ ab "Токсичность, Железо". Medscape . Получено 23 мая 2010 г.
- ^ Диетические рекомендуемые нормы потребления (DRI): Рекомендуемые нормы потребления для отдельных лиц (PDF) , Совет по продовольствию и питанию, Институт медицины, Национальные академии, 2004, архивировано из оригинала (PDF) 14 марта 2013 г. , извлечено 9 июня 2009 г.
- ^ Тененбейн, М. (1996). «Преимущества парентерального дефероксамина при остром отравлении железом». J Toxicol Clin Toxicol . 34 (5): 485–89. doi :10.3109/15563659609028005. PMID 8800185.
- ^ Wu H, Wu T, Xu X, Wang J, Wang J (май 2011 г.). «Токсичность железа у мышей с внутримозговым кровоизлиянием, вызванным коллагеназой». J Cereb Blood Flow Metab . 31 (5): 1243–50. doi :10.1038/jcbfm.2010.209. PMC 3099628. PMID 21102602 .
- ^ Robberecht, Harry; et al. (2020). «Статус магния, железа, цинка, меди и селена при синдроме дефицита внимания и гиперактивности (СДВГ)». Molecules . 25 (19): 4440. doi : 10.3390/molecules25194440 . PMC 7583976 . PMID 32992575.
- ^ Сото-Инсуга, В. и др. (2013). «[Роль железа в лечении синдрома дефицита внимания и гиперактивности]». An Pediatr (Barc) . 79 (4): 230–235. doi :10.1016/j.anpedi.2013.02.008. PMID 23582950.
- ^ Донфранческо, Ренато; Паризи, Паскуале; Ванакор, Никола; Мартинес, Франческа; Сарджентини, Витторио; Кортезе, Самуэле (май 2013 г.). «Железо и СДВГ: время выйти за рамки уровня сывороточного ферритина». Журнал расстройств внимания . 17 (4): 347–357. дои : 10.1177/1087054711430712. ISSN 1087-0547. PMID 22290693. S2CID 22445593.
- ^ Thévenod, Frank (2018). «Глава 15. Железо и его роль в защите от рака: обоюдоострый меч». В Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland KO (ред.). Металлопрепараты: разработка и действие противораковых агентов . Ионы металлов в науках о жизни 18. Том 18. Берлин: de Gruyter GmbH. стр. 437–67. doi :10.1515/9783110470734-021. PMID 29394034.
- ^ ab Beguin, Y; Aapro, M; Ludwig, H; Mizzen, L; Osterborg, A (2014). «Эпидемиологические и неклинические исследования, изучающие эффекты железа в канцерогенезе — критический обзор». Критические обзоры в онкологии/гематологии . 89 (1): 1–15. doi : 10.1016/j.critrevonc.2013.10.008 . PMID 24275533.
- ^ Морель, Ф. М. М., Хадсон, Р. Дж. М. и Прайс, Н. М. (1991). Ограничение продуктивности следовыми металлами в море. Лимнология и океанография, 36(8), 1742-1755. doi :10.4319/lo.1991.36.8.1742
- ^ Brezezinski, MA, Baines, SB, Balch, WM, Beucher, CP, Chai, F., Dugdale, RC, Krause, JW, Landry, MR, Marchi, A., Measures, CI, Nelson, DM, Parker, AE, Poulton, AJ, Selph, KE, Strutton, PG, Taylor, AG, & Twining, BS(2011). Совместное ограничение диатомовых водорослей железом и кремниевой кислотой в экваториальной части Тихого океана. Исследования глубоководных районов, часть II: Тематические исследования в океанографии, 58(3-4), 493-511. doi :10.1016/j.dsr2.2010.08.005
- ^ Field, EK, Kato, S., Findlay, AJ, MacDonald, DJ, Chiu, BK, Luther, GW, & Chan, CS (2016). Планктонные морские окислители железа стимулируют минерализацию железа в условиях низкого содержания кислорода. Geobiology, 14(5), 499-508. doi :10.1111/gbi.12189
- ^ Уэллс, М. Л., Прайс, Н. М. и Бруланд, К. В. (1995). Химия железа в морской воде и ее связь с фитопланктоном: отчет о семинаре. Marine Chemistry, 48(2), 157-182. doi :10.1016/0304-4203(94)00055-I
- ^ Ланнузель Д., Ванкоппенолле М., ван дер Мерве П., де Йонг Дж., Майнерс К.М., Гротти М., Нишиоска Дж. и Шеманн. (2016). Железо в морском льду: обзор и новые идеи. Элемента: Наука об антропоцене, 4 000130. doi :10.12952/journal.elementa.000130
- ^ Raiswell, R. 2011. Перенос железа с континентов в открытый океан: цикл старения–омоложения. Elements, 7(2), 101–106. doi :10.2113/gselements.7.2.101
- ^ Tagliabue, A., Bopp, L., Aumont, O., & Arrigo, KR (2009). Влияние света и температуры на морской цикл железа: от теоретического к глобальному моделированию. Глобальные биогеохимические циклы, 23. doi :10.1029/2008GB003214
Библиография
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- Weeks, Mary Elvira ; Leichester, Henry M. (1968). «Элементы, известные древним». Открытие элементов . Easton, PA: Journal of Chemical Education. стр. 29–40. ISBN 0-7661-3872-0. LCCN 68-15217.
Дальнейшее чтение
- HR Schubert, История британской металлургической промышленности... до 1775 г. н. э. (Routledge, Лондон, 1957)
- RF Tylecote, История металлургии (Институт материалов, Лондон, 1992).
- RF Tylecote, «Железо в промышленной революции» в J. Day и RF Tylecote, Промышленная революция в металлах (Институт материалов, 1991), 200–60.
Внешние ссылки
- Это стихия – железо
- Железо в Периодической таблице видео (Ноттингемский университет)
- Металлургия для неметаллургов
- Железо от JB Calvert





![Китайская иллюстрация XVII века, изображающая рабочих у доменной печи, выплавляющих кованое железо из чугуна[122]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8c/Chinese_Fining_and_Blast_Furnace.jpg/440px-Chinese_Fining_and_Blast_Furnace.jpg)

_(cropped).jpg/440px-Geography_of_Ohio_-_DPLA_-_aaba7b3295ff6973b6fd1e23e33cde14_(page_111)_(cropped).jpg)





