Хлорид натрия
 Кристаллы хлорида натрия в виде галита | |
 Кристаллическая структура с натрием фиолетового цвета и хлоридом зеленого цвета [1] | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид натрия | |
Другие имена
| |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| 3534976 | |
| ЧЭБИ | |
| ChEMBL | |
| ChemSpider | |
| Информационная карта ECHA | 100.028.726 |
| Номер ЕС |
|
| 13673 | |
| КЕГГ | |
| МеШ | Натрий+хлорид |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| NaCl | |
| Молярная масса | 58,443 г/моль [2] |
| Появление | Бесцветные кубические кристаллы [2] |
| Запах | Без запаха |
| Плотность | 2,17 г/см 3 [2] |
| Температура плавления | 800,7 °C (1,473.3 °F; 1,073.8 K) [2] |
| Точка кипения | 1465 °C (2669 °F; 1738 K) [2] |
| 360 г/л (25°C) [2] | |
| Растворимость в аммиаке | 21,5 г/л |
| Растворимость в метаноле | 14,9 г/л |
| −30,2·10 −6 см 3 /моль [3] | |
Показатель преломления ( nD ) | 1,5441 (при 589 нм) [4] |
| Структура [5] | |
| Гранецентрированная кубическая ( см. текст ), cF8 | |
| Фм 3 м (№ 225) | |
а = 564,02 вечера | |
Формульные единицы ( Z ) | 4 |
| октаэдрический при Na + октаэдрический при Cl − | |
| Термохимия [6] | |
Теплоемкость ( С ) | 50,5 Дж/(К·моль) |
Стандартная молярная энтропия ( S ⦵ 298 ) | 72,10 Дж/(К·моль) |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −411,120 кДж/моль |
| Фармакология | |
| A12CA01 ( ВОЗ ) B05CB01 ( ВОЗ ), B05XA03 ( ВОЗ ), S01XA03 ( ВОЗ ) | |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 3 г/кг (перорально, крысы) [7] |
| Родственные соединения | |
Другие анионы | Фторид натрия Бромид натрия Йодид натрия Астатид натрия |
Другие катионы | Хлорид лития Хлорид калия Хлорид рубидия Хлорид цезия Хлорид франция |
| Страница дополнительных данных | |
| Хлорид натрия (страница данных) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид натрия / ˌ s oʊ d i ə m ˈ k l ɔːr aɪ d / , [8] обычно известный как пищевая соль , является ионным соединением с химической формулой NaCl , представляющим собой соотношение ионов натрия и хлора 1:1 . Он прозрачный или полупрозрачный, хрупкий, гигроскопичный и встречается в виде минерала галита . В своей съедобной форме он обычно используется в качестве приправы и пищевого консерванта . Большие количества хлорида натрия используются во многих промышленных процессах, и он является основным источником соединений натрия и хлора, используемых в качестве сырья для дальнейшего химического синтеза . Другое важное применение хлорида натрия - борьба с обледенением дорог в морозную погоду.
Использует
Помимо привычного бытового использования соли, более распространенными сферами ее применения являются производство приблизительно 250 миллионов тонн соли в год (данные за 2008 год), а именно производство химикатов и борьба с обледенением. [9]
Химические функции
Соль используется, прямо или косвенно, в производстве многих химикатов, которые потребляют большую часть мирового производства. [10]
Хлор-щелочная промышленность
Это отправная точка для хлорщелочного процесса , промышленного процесса производства хлора и гидроксида натрия , согласно химическому уравнению
Этот электролиз проводится либо в ртутной ячейке, либо в диафрагменной ячейке, либо в мембранной ячейке. Каждая из них использует свой метод для отделения хлора от гидроксида натрия. Другие технологии находятся в стадии разработки из-за высокого потребления энергии электролизом, в результате чего небольшие улучшения эффективности могут иметь большую экономическую отдачу. Некоторые области применения хлора включают производство термопластиков ПВХ , дезинфицирующих средств и растворителей.
Гидроксид натрия широко используется во многих отраслях промышленности, включая производство бумаги, мыла, алюминия и т. д.
Содовая промышленность
Хлорид натрия используется в процессе Сольве для производства карбоната натрия и хлорида кальция . Карбонат натрия, в свою очередь, используется для производства стекла , бикарбоната натрия и красителей , а также множества других химикатов. В процессе Мангейма хлорид натрия используется для производства сульфата натрия и соляной кислоты .
Различные промышленные применения
Хлорид натрия широко используется, поэтому даже относительно небольшие приложения могут потреблять огромные количества. В разведке нефти и газа соль является важным компонентом буровых растворов при бурении скважин. [11] Она используется для флокуляции и увеличения плотности бурового раствора для преодоления высокого давления газа в скважине. Всякий раз, когда бур достигает соляного пласта, соль добавляется в буровой раствор для насыщения раствора, чтобы минимизировать растворение в соляном пласте. [9] Соль также используется для ускорения отверждения бетона в зацементированных обсадных колоннах. [10]
В текстильной промышленности и крашении соль используется в качестве солевого ополаскивателя для отделения органических загрязнений, [12] для содействия «высаливанию» осадков красителей и для смешивания с концентрированными красителями для повышения выхода в красильных ваннах и придания цветам более четких очертаний. Одна из ее основных функций — обеспечение положительного заряда ионов для содействия поглощению отрицательно заряженных ионов красителей. [10]
В целлюлозно-бумажной промышленности он применяется для производства хлората натрия , который затем реагирует с серной кислотой и восстановителем, таким как метанол, для производства диоксида хлора — отбеливающего химиката , широко используемого для отбеливания древесной массы .
При дублении и обработке кожи в шкуры животных добавляют соль, чтобы подавить микробную активность на нижней стороне шкур и привлечь влагу обратно в шкуры. [10]
В производстве резины соль используется для производства буны , неопрена и белых резиновых типов. Соляной раствор и серная кислота используются для коагуляции эмульгированного латекса, изготовленного из хлорированного бутадиена . [10] [9]
Соль также добавляется для укрепления почвы и обеспечения прочности основания, на котором строятся автомагистрали. Соль действует, чтобы минимизировать эффекты смещения, вызванные в подповерхности изменениями влажности и транспортной нагрузки. [10]
Умягчение воды
Жесткая вода содержит ионы кальция и магния, которые мешают действию мыла и способствуют образованию накипи или пленки щелочных минеральных отложений в бытовом и промышленном оборудовании и трубах. Коммерческие и бытовые водоумягчающие установки используют ионообменные смолы для удаления ионов, вызывающих жесткость. Эти смолы генерируются и регенерируются с использованием хлорида натрия. [10] [9]
Соль для посыпки дорог
Второе основное применение соли — это борьба с обледенением и предотвращение обледенения дорог, как в песочницах , так и с помощью транспортных средств зимней службы . В ожидании снегопада дороги оптимально «обрабатываются против обледенения» рассолом (концентрированным раствором соли в воде), который предотвращает сцепление между снегом и льдом на дороге. Эта процедура устраняет необходимость в интенсивном использовании соли после снегопада. Для борьбы с обледенением используются смеси рассола и соли, иногда с дополнительными агентами, такими как хлорид кальция и/или хлорид магния . Использование соли или рассола становится неэффективным ниже −10 °C (14 °F).

Соль для борьбы с обледенением в Соединенном Королевстве в основном поступает из единственной шахты в Уинсфорде в Чешире . Перед распределением ее смешивают с <100 ppm ферроцианида натрия в качестве антислеживающего агента , что позволяет каменной соли свободно вытекать из посыпающих песком транспортных средств, несмотря на то, что она была складирована перед использованием. В последние годы эта добавка также использовалась в поваренной соли. Другие добавки использовались в дорожной соли для снижения общих затрат. Например, в США побочный углеводный раствор от переработки сахарной свеклы смешивался с каменной солью и прилипал к дорожным покрытиям примерно на 40% лучше, чем просто рассыпная каменная соль. Поскольку она оставалась на дороге дольше, обработку не приходилось повторять несколько раз, что экономило время и деньги. [10]
В технических терминах физической химии минимальная температура замерзания смеси воды и соли составляет −21,12 °C (−6,02 °F) для 23,31% по весу соли. Замерзание вблизи этой концентрации, однако, происходит настолько медленно, что эвтектическая точка −22,4 °C (−8,3 °F) может быть достигнута при содержании соли около 25% по весу. [13]
Воздействие на окружающую среду
Дорожная соль попадает в пресноводные водоемы и может нанести вред водным растениям и животным, нарушая их способность к осморегуляции . [14] Вездесущность соли в прибрежных районах создает проблему при нанесении любого покрытия , поскольку захваченные соли вызывают большие проблемы с адгезией. Военно-морские власти и судостроители контролируют концентрацию соли на поверхностях во время строительства. Максимальная концентрация соли на поверхностях зависит от власти и применения. В основном используется регламент IMO , который устанавливает уровни соли максимум 50 мг/м 2 растворимых солей, измеряемых как хлорид натрия. Эти измерения проводятся с помощью теста Бресле . Засоление (повышение солености, также известное как синдром засоления пресной воды ) и последующее повышенное выщелачивание металлов являются постоянной проблемой по всей Северной Америке и европейским пресным водным путям. [15]
При борьбе с обледенением шоссе соль ассоциируется с коррозией мостовых настилов, автомобилей, арматурных стержней и проволоки, а также незащищенных стальных конструкций, используемых в дорожном строительстве. Поверхностный сток , распыление транспортных средств и переносимая ветром соль также влияют на почву, придорожную растительность и местные поверхностные и грунтовые воды. Хотя доказательства экологической нагрузки соли были обнаружены во время пикового использования, весенние дожди и оттепели обычно снижают концентрацию натрия в районе, где применялась соль. [10] Исследование 2009 года показало, что примерно 70% дорожной соли, применяемой в районе метро Миннеаполис-Сент-Пол, удерживается в местном водоразделе. [16]
Замена
Некоторые агентства заменяют дорожную соль пивом , патокой и свекольным соком. [17] Авиакомпании используют больше гликоля и сахара , а не солевых растворов для борьбы с обледенением . [18]
Пищевая промышленность и сельское хозяйство
Соль добавляется в пищу производителем или потребителем в качестве усилителя вкуса, консерванта, связующего вещества, добавки для контроля ферментации , агента для контроля текстуры и проявителя цвета. Потребление соли в пищевой промышленности подразделяется в порядке убывания потребления на другие виды переработки пищевых продуктов, упаковку мяса, консервирование , выпечку, молочные продукты и продукты переработки зерна. Соль добавляется для улучшения цвета бекона, ветчины и других переработанных мясных продуктов. Как консервант, соль подавляет рост бактерий. Соль действует как связующее вещество в колбасах, образуя связующий гель, состоящий из мяса, жира и влаги. Соль также действует как усилитель вкуса и как тендеризатор . [10]
Он используется как дешевый и безопасный осушитель из-за своих гигроскопических свойств, что делает соление эффективным методом сохранения продуктов питания исторически; соль вытягивает воду из бактерий посредством осмотического давления , не давая им размножаться, что является основным источником порчи продуктов. Несмотря на то, что доступны более эффективные осушители, немногие из них безопасны для употребления человеком. Многие микроорганизмы не могут жить в соленой среде: вода вытягивается из их клеток посредством осмоса . По этой причине соль используется для сохранения некоторых продуктов, таких как бекон, рыба или капуста.
Во многих молочных производствах соль добавляется в сыр в качестве агента, контролирующего цвет, ферментацию и текстуру. Молочный подсектор включает компании, которые производят сливочное масло, сгущенное и выпаренное молоко, замороженные десерты, мороженое, натуральный и плавленый сыр и специальные молочные продукты. В консервировании соль в первую очередь добавляется как усилитель вкуса и консервант . Она также используется как носитель для других ингредиентов, обезвоживающий агент, ингибитор ферментов и тендеризатор. В выпечке соль добавляется для контроля скорости ферментации в тесте для хлеба. Она также используется для укрепления глютена (эластичного комплекса белок-вода в некоторых видах теста) и как усилитель вкуса, например, в качестве начинки для хлебобулочных изделий. Категория пищевой промышленности также включает продукты из зерновых мельниц. Эти продукты состоят из помола муки и риса и производства зерновых завтраков и смешанной или приготовленной муки. Соль также используется в качестве приправы, например, в картофельных чипсах, кренделях и корме для кошек и собак. [10]
Хлорид натрия используется в ветеринарии как рвотный агент. Он дается в виде теплого насыщенного раствора. Рвоту также можно вызвать путем помещения в глотку небольшого количества простой соли или солевых кристаллов.
Лекарство
Хлорид натрия используется вместе с водой как один из основных растворов для внутривенной терапии . Назальный спрей часто содержит солевой раствор.
Хлорид натрия также доступен в форме пероральных таблеток и принимается для лечения низкого уровня натрия. [19]
Пожаротушение

Хлорид натрия является основным огнетушащим веществом в порошковых огнетушителях , которые используются при возгорании горючих металлов, таких как магний, цирконий, титан и литий (огнетушители класса D). Соль образует корку, исключающую кислород, которая подавляет огонь. [20]
Очищающее средство
По крайней мере со времен Средневековья люди использовали соль в качестве очищающего средства, натирая ею поверхности в доме. Она также используется во многих марках шампуня , зубной пасты и, как правило, для удаления льда с подъездных путей и участков льда.
Инфракрасная оптика
Кристаллы хлорида натрия имеют коэффициент пропускания не менее 90% (через 1 мм) для инфракрасного света с длинами волн в диапазоне 0,2–18 мкм . [21] Они использовались в оптических компонентах, таких как окна и линзы, где в этом спектральном диапазоне существовало мало непоглощающих альтернатив. Несмотря на свою дешевизну, кристаллы NaCl мягкие и гигроскопичные — при воздействии воды в окружающем воздухе они постепенно покрываются «инеем». Это ограничивает применение NaCl сухими средами, вакуумно-герметичными областями или краткосрочным использованием, таким как прототипирование. Материалы, которые механически прочнее и менее чувствительны к влаге, такие как цинк-селенидные и халькогенидные стекла , более широко используются, чем NaCl.
Химия

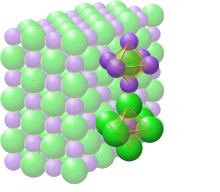
Твердый хлорид натрия
В твердом хлориде натрия каждый ион окружен шестью ионами противоположного заряда, как и ожидалось по электростатическим причинам. Окружающие ионы расположены в вершинах правильного октаэдра . На языке плотной упаковки более крупные ионы хлорида (размером 167 пм [22] ) расположены в кубическом массиве, тогда как более мелкие ионы натрия (116 пм [22] ) заполняют все кубические промежутки (октаэдрические пустоты) между ними. Эта же базовая структура встречается во многих других соединениях и обычно известна как структура NaCl или кристаллическая структура каменной соли. Ее можно представить как гранецентрированную кубическую (ГЦК) решетку с двухатомным базисом или как две взаимопроникающие гранецентрированные кубические решетки. Первый атом расположен в каждой точке решетки, а второй атом расположен на полпути между точками решетки вдоль края элементарной ячейки ГЦК.
Твердый хлорид натрия имеет температуру плавления 801 °C, а жидкий хлорид натрия кипит при 1465 °C. Видеоизображение в реальном времени с атомным разрешением позволяет визуализировать начальную стадию зарождения кристаллов хлорида натрия. [23]
Теплопроводность хлорида натрия в зависимости от температуры имеет максимум 2,03 Вт/(см·К) при 8 К (−265,15 °C; −445,27 °F) и уменьшается до 0,069 при 314 К (41 °C; 106 °F). Она также уменьшается с легированием . [ 24]

Из холодных (ниже точки замерзания) растворов соль кристаллизуется с гидратной водой в виде гидрогалита (дигидрата NaCl·2H2O ) . [ 26]
В 2023 году было обнаружено, что под давлением хлорид натрия может образовывать гидраты NaCl·8,5H 2 O и NaCl·13H 2 O. [27]
Водные растворы

Притяжение между ионами Na + и Cl− в твердом теле настолько сильное, что только сильнополярные растворители, такие как вода, хорошо растворяют NaCl.
При растворении в воде каркас хлорида натрия распадается, поскольку ионы Na + и Cl − оказываются окруженными полярными молекулами воды. Эти растворы состоят из металлического аквакомплекса с формулой [Na(H 2 O) 8 ] + , с расстоянием Na–O 250 пм . Ионы хлорида также сильно сольватированы, каждый из них окружен в среднем шестью молекулами воды. [28] Растворы хлорида натрия имеют совсем другие свойства, чем чистая вода. Эвтектическая точка составляет -21,12 °C (-6,02 °F) для 23,31% массовой доли соли, а температура кипения насыщенного раствора соли составляет около 108,7 °C (227,7 °F). [13]
pH растворов хлорида натрия
pH раствора хлорида натрия остается ≈7 из-за чрезвычайно слабой основности иона Cl − , который является сопряженным основанием сильной кислоты HCl. Другими словами, NaCl не оказывает влияния на pH системы [29] в разбавленных растворах, где эффекты ионной силы и коэффициентов активности пренебрежимо малы.
| Растворимость NaCl (г NaCl / 1 кг растворителя при 25 °C (77 °F)) [30] | |
|---|---|
| Вода | 360 |
| формамид | 94 |
| Глицерин | 83 |
| Пропиленгликоль | 71 |
| Муравьиная кислота | 52 |
| Жидкий аммиак | 30.2 |
| Метанол | 14 |
| этанол | 0,65 |
| Диметилформамид | 0,4 |
| Пропан-1-ол | 0,124 |
| Сульфолан | 0,05 |
| Бутан-1-ол | 0,05 |
| Пропан-2-ол | 0,03 |
| Пентан-1-ол | 0,018 |
| Ацетонитрил | 0,003 |
| Ацетон | 0,00042 |
Стехиометрические и структурные варианты
Поваренная соль имеет молярное соотношение натрия и хлора 1:1. В 2013 году были обнаружены соединения натрия и хлорида с различной стехиометрией ; было предсказано пять новых соединений (например, Na 3 Cl, Na 2 Cl, Na 3 Cl 2 , NaCl 3 и NaCl 7 ). Существование некоторых из них было экспериментально подтверждено при высоких давлениях и других условиях: кубический и орторомбический NaCl 3 , двумерный металлический тетрагональный Na 3 Cl и экзотический гексагональный NaCl. [31] Это указывает на то, что соединения, нарушающие химическую интуицию, возможны в простых системах в условиях, отличных от условий окружающей среды. [32]
Происшествие
Соль содержится в земной коре в виде минерала галита (каменной соли), а небольшое ее количество существует в виде взвешенных частиц морской соли в атмосфере. [33] Эти частицы являются доминирующими ядрами конденсации облаков далеко в море, что позволяет образовывать облака в в остальном незагрязненном воздухе . [34]
Производство
В настоящее время соль массово производится путем испарения морской воды или рассола из соляных скважин и соляных озер . Добыча каменной соли также является основным источником. Китай является основным мировым поставщиком соли. [10] В 2017 году мировое производство оценивалось в 280 миллионов тонн , причем пятью крупнейшими производителями (в миллионах тонн) были Китай (68,0), США (43,0), Индия (26,0), Германия (13,0) и Канада (13,0). [35] Соль также является побочным продуктом добычи калия .
- Соляные курганы, Салар де Уюни , Боливия .
Смотрите также
- Биосалинность
- Пищевая соль (поваренная соль)
- Галит , минеральная форма хлорида натрия
- Влияние соли на здоровье
- Соленость
- Посыпание земли солью
- отравление солью
Ссылки
- ^ "Кристалл хлорида натрия (NaCl)". PhysicsOpenLab . Получено 23 августа 2021 г. .
- ^ abcdef Хейнс, 4.89
- ^ Хейнс, 4.135
- ^ Хейнс, 10.241
- ^ Хейнс, 4.148
- ^ Хейнс, 5.8
- ^ Такер, Р. К.; Хейгеле, М. А. (1971). «Сравнительная острая пероральная токсичность пестицидов для шести видов птиц». Токсикология и прикладная фармакология . 20 (1): 57–65. Bibcode :1971ToxAP..20...57T. doi :10.1016/0041-008x(71)90088-3. ISSN 0041-008X. PMID 5110827.
- ^ Уэллс, Джон С. (2008), Словарь произношения Longman (3-е изд.), Longman, стр. 143 и 755, ISBN 9781405881180
- ^ abcd Вестфаль, Гисберт и др. (2002) «Хлорид натрия» в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Вайнхайм doi :10.1002/14356007.a24_317.pub4.
- ^ abcdefghijkl Костик, Деннис С. (октябрь 2010 г.). "Соль" (PDF) . Геологическая служба США, Ежегодник полезных ископаемых за 2008 г.
- ^ Caenn, Ryen; Darley, HCH; Gray, George Robert; Gray, George Robert (2011). Состав и свойства буровых и заканчивающих жидкостей (6-е изд.). Амстердам; Бостон, Массачусетс: Gulf Professional Pub. ISBN 978-0-12-383858-2.
- ^ Partal, Recep; Basturk, Irfan; Murat Hocaoglu, Selda; Baban, Ahmet; Yilmaz, Ecem (2022). «Восстановление воды и повторно используемого солевого раствора из рассола обратного осмоса в текстильной промышленности: исследование случая». Водные ресурсы и промышленность . 27 : 100174. Bibcode : 2022WRI....2700174P. doi : 10.1016/j.wri.2022.100174 .
- ^ ab Elvers, B. et al. (ред.) (1991) Энциклопедия промышленной химии Ульмана , 5-е изд. Т. A24, Wiley, стр. 319, ISBN 978-3-527-20124-2 .
- ^ Rastogi, Nina Shen (16 февраля 2010 г.). «Salting the Earth». Slate . ISSN 1091-2339 . Получено 11 марта 2023 г. .
- ^ «Более соленые водные пути создают опасные «химические коктейли»». phys.org .
- ^ «Большая часть дорожной соли попадает в озера и реки». www.sciencedaily.com . Университет Миннесоты. 20 февраля 2009 г. Получено 27 сентября 2015 г.
- ^ Кейси, Майкл. «Обращение к свекольному соку и пиву для устранения опасности дорожной соли». phys.org .
- ^ "Предостережения EASA по органической солевой противообледенительной жидкости". MRO Network . 9 декабря 2016 г.
- ^ "Хлорид натрия для перорального раствора". Клиника Кливленда . Получено 9 марта 2024 г.
- ^ Багот, Кит; Субботин, Николас; Калберер, Дженнифер (ноябрь 2006 г.). «Оценка нового жидкого огнетушащего вещества для тушения пожаров горючих металлов» (PDF) . Федеральное управление гражданской авиации . Министерство транспорта США . Получено 1 мая 2024 г. .
- ^ Уэйнант, Рональд В.; Эдигер, Марвуд Н. (2000). "Глава 11: Оптические материалы: видимые и инфракрасные". Справочник по электрооптике. Нью-Йорк: McGraw-Hill Professional Publishing. стр. 11.20. ISBN 0-07-068716-1.
- ^ ab RD Shannon (1976). «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallogr A. 32 ( 5): 751–767. Bibcode :1976AcCrA..32..751S. doi :10.1107/S0567739476001551.
- ^ Накамуро, Такаюки; Сакакибара, Масая; Нада, Хироки; Харано, Кодзи; Накамура, Эйичи (2021). «Уловить момент выхода кристаллического ядра из беспорядка». Журнал Американского химического общества . 143 (4): 1763–1767. дои : 10.1021/jacs.0c12100 . ПМИД 33475359.
- ^ Сирдешмукх, Динкер Б.; Сирдешмукх, Лалита и Субхадра, КГ (2001). Галогениды щелочных металлов: справочник по физическим свойствам. Springer. стр. 65, 68. ISBN 978-3-540-42180-1.
- ^ Клеве, Б.; Педерсен (1974). «Кристаллическая структура дигидрата хлорида натрия». Acta Crystallogr . B30 (10): 2363–2371. Bibcode : 1974AcCrB..30.2363K. doi : 10.1107/S0567740874007138.
- ^ Фазовая диаграмма вода-NaCl. Лид, CRC Handbook of Chemistry and Physics, 86-е изд. (2005-2006), CRC страницы 8-71, 8-116
- ^ Вашингтонский университет. «Недавно обнаруженная форма соленого льда может существовать на поверхности внеземных лун». Phys.org.
- ^ Линкольн, С.Ф.; Риченс, Д.Т. и Сайкс, А.Г. (2003) «Акваионы металлов» Комплексная координационная химия II Том 1, стр. 515–555. doi :10.1016/B0-08-043748-6/01055-0.
- ^ "Кислотные, основные и нейтральные соли". Flinn Scientific Chem Fax . 2016. Получено 18 сентября 2018.
Нейтрализация сильной кислоты и сильного основания дает нейтральную соль.
- ^ Берджесс, Дж. (1978). Ионы металлов в растворе . Нью-Йорк: Эллис Хорвуд. ISBN 978-0-85312-027-8.
- ^ Тихомирова, КА; Тантардини, К.; Суханова, ЕВ; Попов, ЗИ; Евлашин, СА; Тархов, МА; Жданов, ВЛ (2020). «Экзотическая двумерная структура: первый случай гексагонального NaCl». The Journal of Physical Chemistry Letters . 11 (10): 3821–3827. doi :10.1021/acs.jpclett.0c00874. PMID 32330050. S2CID 216130640.
- ^ Чжан, В.; Оганов А.Р.; Гончаров А.Ф.; Чжу, К.; Бульфельфель, SE; Ляхов, АО; Ставру, Э.; Сомаязулу, М.; Прокопенко В.Б.; Конопкова, З. (2013). «Неожиданная стабильная стехиометрия хлоридов натрия». Наука . 342 (6165): 1502–1505. arXiv : 1310.7674 . Бибкод : 2013Sci...342.1502Z. дои : 10.1126/science.1244989. PMID 24357316. S2CID 15298372.
- ^ Финлейсон-Питтс, Барбара Дж.; Хеммингер, Джон К. (1 декабря 2000 г.). «Физическая химия частиц морской соли в воздухе и их компонентов». Журнал физической химии A. 104 ( 49): 11463–11477. Bibcode : 2000JPCA..10411463F. doi : 10.1021/jp002968n. ISSN 1089-5639.
- ^ Мейсон, Б. Дж. (2006). «Роль частиц морской соли как ядер конденсации облаков над удаленными океанами». Ежеквартальный журнал Королевского метеорологического общества . 127 (576): 2023–32. Bibcode : 2001QJRMS.127.2023M. doi : 10.1002/qj.49712757609. S2CID 121846285.
- ^ Болен, Уоллес П. (январь 2018 г.). "Соль" (PDF) . Геологическая служба США, Обзоры полезных ископаемых за 2018 г.
 В данной статье использованы материалы из общедоступного источника Salt (PDF) . Геологическая служба США .
В данной статье использованы материалы из общедоступного источника Salt (PDF) . Геологическая служба США .
Цитируемые источники
- Хейнс, Уильям М., ред. (2011). CRC Handbook of Chemistry and Physics (92-е изд.). CRC Press . ISBN 978-1439855119.
Внешние ссылки
- Статистика и информация Геологической службы США Солт
- «Использование соли и песка для зимнего содержания дорог». Road Management Journal . Декабрь 1997 г. Архивировано из оригинала 21 сентября 2016 г. Получено 13 февраля 2007 г.
- Калькуляторы: поверхностное натяжение, плотность, молярность и моляльность водного раствора NaCl (и других солей)
- JtBaker Паспорт безопасности




![{\displaystyle {\ce {2 NaCl + 2 H2O ->[электролиз] Cl2 + H2 + 2 NaOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6175336b0ecf3b2032d6a60ac2a534b10e6f61f3)




