генная терапия
| Часть серии статей о |
| Генная инженерия |
|---|
 |
| Генетически модифицированные организмы |
| История и регулирование |
| Процесс |
| Приложения |
| Споры |
Генная терапия — это медицинская технология , целью которой является достижение терапевтического эффекта посредством манипулирования экспрессией генов или посредством изменения биологических свойств живых клеток. [1] [2] [3]
Первая попытка модификации ДНК человека была предпринята в 1980 году Мартином Клайном , но первый успешный перенос генов в ядро человека, одобренный Национальным институтом здравоохранения , был выполнен в мае 1989 года. [4] Первое терапевтическое использование переноса генов, а также первая прямая вставка ДНК человека в ядерный геном были выполнены Френчем Андерсоном в исследовании, начавшемся в сентябре 1990 года. В период с 1989 года по декабрь 2018 года было проведено более 2900 клинических испытаний, более половины из которых находились в фазе I. [ 5] В 2003 году гендицин стал первым генным препаратом, получившим одобрение регулирующих органов. С тех пор были одобрены дополнительные генно-терапевтические препараты, такие как alipogene tiparvovec (2012), Strimvelis (2016), tisagenlecleucel ( 2017), voretigene neparvovec (2017), patisiran (2018), onasemnogene abeparvovec (2019), idecabtagene vicleucel (2021), nadofaragene firadenovec , valoctocogene roxaparvovec и etranacogene dezaparvovec (все 2022). Большинство этих подходов используют аденоассоциированные вирусы (AAV) и лентивирусы для выполнения вставок генов in vivo и ex vivo соответственно. AAV характеризуются стабилизацией вирусного капсида , более низкой иммуногенностью, способностью трансдуцировать как делящиеся, так и неделящиеся клетки, потенциалом для интеграции в определенный участок и достижения долгосрочной экспрессии при лечении in vivo. [6] Подходы ASO / siRNA, такие как те, которые применяются Alnylam и Ionis Pharmaceuticals, требуют невирусных систем доставки и используют альтернативные механизмы для транспортировки в клетки печени с помощью транспортеров GalNAc .
Не все медицинские процедуры, которые вносят изменения в генетический состав пациента, можно считать генной терапией. Было обнаружено, что трансплантация костного мозга и трансплантация органов в целом вводят чужеродную ДНК в пациентов. [7]
Фон
Генная терапия была впервые концептуализирована в 1960-х годах, когда начали исследовать возможность добавления новых генетических функций к клеткам млекопитающих . Было протестировано несколько методов, включая инъекцию генов с помощью микропипетки непосредственно в живую клетку млекопитающего и воздействие на клетки осадка ДНК , содержащего нужные гены. Ученые предположили, что вирус также может быть использован в качестве транспортного средства или вектора для доставки новых генов в клетки.
Одним из первых ученых, сообщивших об успешном прямом включении функциональной ДНК в клетку млекопитающего, была биохимик доктор Лоррейн Марквардт Краус (6 сентября 1922 г. – 1 июля 2016 г.) [8] из Центра медицинских наук Университета Теннесси в Мемфисе, штат Теннесси . В 1961 году ей удалось генетически изменить гемоглобин клеток костного мозга , взятых у пациента с серповидноклеточной анемией . Она сделала это, инкубируя клетки пациента в культуре тканей с ДНК , извлеченной у донора с нормальным гемоглобином . В 1968 году исследователи Теодор Фридман , Джей Сигмиллер и Джон Субак-Шарп из Национальных институтов здравоохранения (NIH), Бетесда, США, успешно исправили генетические дефекты, связанные с синдромом Леша-Найхана , изнурительным неврологическим заболеванием , путем добавления чужеродной ДНК к культивируемым клеткам, собранным у пациентов, страдающих этим заболеванием. [9]
Первая попытка генной терапии, не увенчавшаяся успехом (а также первый случай медицинской пересадки чужеродных генов человеку, не считая трансплантации органов ), была предпринята генетиком Мартином Клайном из Калифорнийского университета в Лос-Анджелесе, штат Калифорния , США , 10 июля 1980 года. [10] [11] Клайн утверждал, что один из генов у его пациентов оставался активным шесть месяцев спустя, хотя он никогда не публиковал эти данные и не проверял их. [12]
После обширных исследований на животных в течение 1980-х годов и испытания маркировки бактериальных генов на людях в 1989 году, первая генная терапия, широко признанная успешной, была продемонстрирована в испытании, которое началось 14 сентября 1990 года, когда Ашанти ДеСилва проходила лечение от ADA - SCID . [13]
Первое соматическое лечение, вызвавшее постоянное генетическое изменение, было начато в 1993 году. [14] Целью было излечение злокачественных опухолей мозга с помощью рекомбинантной ДНК для переноса гена, делающего опухолевые клетки чувствительными к препарату, который, в свою очередь, заставлял бы опухолевые клетки погибать. [15]
Полимеры либо транслируются в белки , либо мешают экспрессии целевого гена , либо, возможно, корректируют генетические мутации . Наиболее распространенная форма использует ДНК , которая кодирует функциональный терапевтический ген для замены мутировавшего гена. Молекула полимера упакована в « вектор », который переносит молекулу внутрь клеток. [ необходима медицинская цитата ]
Ранние клинические неудачи привели к отказу от генной терапии. Клинические успехи с 2006 года вновь привлекли внимание исследователей, хотя по состоянию на 2014 год [обновлять]это все еще был в значительной степени экспериментальный метод. [16] К ним относятся лечение заболеваний сетчатки врожденный амавроз Лебера [17] [18] [19] [20] и хориоидеремия , [21] Х-сцепленный SCID , [22] ADA-SCID, [23] [24] адренолейкодистрофия , [25] хронический лимфоцитарный лейкоз (ХЛЛ), [26] острый лимфоцитарный лейкоз (ОЛЛ), [27] множественная миелома , [28] гемофилия , [24] и болезнь Паркинсона . [29] В период с 2013 по апрель 2014 года американские компании инвестировали более 600 миллионов долларов в эту область. [30]
Первая коммерческая генная терапия, Гендицин , была одобрена в Китае в 2003 году для лечения некоторых видов рака. [31] В 2011 году Неоваскулген был зарегистрирован в России как первый в своем классе генотерапевтический препарат для лечения заболеваний периферических артерий , включая критическую ишемию конечностей . [32] В 2012 году алипоген типарвовек , лечение редкого наследственного заболевания , дефицита липопротеинлипазы , стал первым лечением, одобренным для клинического использования в Европейском союзе или Соединенных Штатах после его одобрения Европейской комиссией . [16] [33]
После ранних достижений в генной инженерии бактерий, клеток и мелких животных ученые начали думать о том, как применить это в медицине. Были рассмотрены два основных подхода — замена или разрушение дефектных генов. [34] Ученые сосредоточились на заболеваниях, вызванных дефектами одного гена, таких как муковисцидоз , гемофилия, мышечная дистрофия , талассемия и серповидноклеточная анемия . Алипоген типарвовец лечит одно из таких заболеваний, вызванное дефектом липопротеинлипазы . [33]
ДНК должна быть введена, достигнуть поврежденных клеток, войти в клетку и либо экспрессировать, либо разрушить белок. [35] Были исследованы многочисленные методы доставки. Первоначальный подход включал ДНК в сконструированный вирус для доставки ДНК в хромосому . [36] [37] Также были исследованы подходы с использованием голой ДНК , особенно в контексте разработки вакцин . [38]
В целом, усилия были сосредоточены на введении гена, который вызывает экспрессию необходимого белка. В последнее время более глубокое понимание функции нуклеазы привело к более прямому редактированию ДНК с использованием таких методов, как нуклеазы с цинковыми пальцами и CRISPR . Вектор включает гены в хромосомы. Затем экспрессированные нуклеазы выключают и заменяют гены в хромосоме. По состоянию на 2014 год [обновлять]эти подходы включают удаление клеток у пациентов, редактирование хромосомы и возврат трансформированных клеток пациентам. [39]
Редактирование генов — потенциальный подход к изменению генома человека для лечения генетических заболеваний, [40] вирусных заболеваний, [41] и рака. [42] [43] По состоянию на 2020 год [обновлять]эти подходы изучаются в клинических испытаниях. [44] [45]
Классификация
Широта определения
В 1986 году на встрече в Институте медицины генная терапия была определена как добавление или замена гена в целевом типе клеток. В том же году FDA объявило, что имеет юрисдикцию для одобрения «генной терапии», не давая определения термину. В 1993 году FDA добавило очень широкое определение любого лечения, которое «изменяет или манипулирует экспрессией генетического материала или изменяет биологические свойства живых клеток». В 2018 году это определение было сужено до «продуктов, которые опосредуют свои эффекты путем транскрипции или трансляции перенесенного генетического материала или путем специфического изменения генетических последовательностей хозяина (человека)». [46]
В 2018 году в журнале Journal of Law and the Biosciences Шерков и др. выступили за более узкое определение генной терапии, чем у FDA, в свете новой технологии, которая будет включать любое лечение, которое намеренно и навсегда модифицирует геном клетки, при этом определение генома будет включать эписомы вне ядра, но исключать изменения, вызванные эписомами, которые теряются с течением времени. Это определение также исключит введение клеток, которые не получены от самого пациента, но будет включать подходы ex vivo и не будет зависеть от используемого вектора. [46]
Во время пандемии COVID-19 некоторые ученые настаивали на том, что вакцины мРНК для COVID не были генной терапией, чтобы предотвратить распространение неверной информации о том, что вакцина может изменить ДНК, другие ученые утверждали, что вакцины были генной терапией, потому что они вводили генетический материал в клетку. [47] Проверяющие факты , такие как Full Fact , [48] Reuters , [49] PolitiFact , [50] и FactCheck.org [51] заявили, что называть вакцины генной терапией было неправильно. Ведущий подкаста Джо Роган подвергся критике за то, что назвал вакцины мРНК генной терапией, как и британский политик Эндрю Бриджен , а проверяющий факты Full Fact призвал исключить Бриджена из консервативной партии за это и другие заявления. [52] [53]
Гены присутствуют или добавлены
Генная терапия инкапсулирует множество форм добавления различных нуклеиновых кислот в клетку. Генная аугментация добавляет новый ген, кодирующий белок, в клетку. Одной из форм генной аугментации является генная заместительная терапия , лечение моногенных рецессивных заболеваний, при которых один ген не функционирует, и добавляется дополнительный функциональный ген. Для заболеваний, вызванных несколькими генами или доминантным геном, более подходящими являются подходы подавления генов или редактирования генов, но добавление генов , форма генной аугментации, при которой добавляется новый ген, может улучшить функцию клеток, не изменяя гены, вызывающие заболевание. [54] : 117
Типы клеток
Генную терапию можно разделить на два типа в зависимости от типа клеток, на которые она воздействует: соматическая и генная терапия зародышевых клеток.
В соматической клеточной генной терапии (SCGT) терапевтические гены переносятся в любую клетку, кроме гаметы , зародышевой клетки , гаметоцита или недифференцированной стволовой клетки . Любые такие изменения влияют только на отдельного пациента и не наследуются потомством . Соматическая генная терапия представляет собой основные фундаментальные и клинические исследования, в которых терапевтическая ДНК (либо интегрированная в геном , либо как внешняя эписома или плазмида ) используется для лечения заболеваний. [55] В настоящее время [ когда? ] в США проводится более 600 клинических испытаний с использованием SCGT. Большинство из них сосредоточены на тяжелых генетических расстройствах, включая иммунодефициты , гемофилию , талассемию и кистозный фиброз . Такие нарушения одного гена являются хорошими кандидатами для соматической клеточной терапии. Полная коррекция генетического расстройства или замена нескольких генов пока невозможны. Только несколько испытаний находятся на продвинутых стадиях. [56] [ требуется обновление ]
В генной терапии зародышевой линии (GGT) зародышевые клетки ( сперматозоиды или яйцеклетки ) модифицируются путем введения функциональных генов в их геномы. Модификация зародышевой клетки приводит к тому, что все клетки организма содержат модифицированный ген. Таким образом, изменение является наследственным и передается последующим поколениям. Австралия, Канада, Германия, Израиль, Швейцария и Нидерланды [57] запрещают применение GGT на людях по техническим и этическим причинам, включая недостаточные знания о возможных рисках для будущих поколений [57] и более высокие риски по сравнению с SCGT. [58] В США нет федеральных мер контроля, специально касающихся генетической модификации человека (помимо правил FDA для терапии в целом). [57] [59] [60] [61]
Терапия in vivo против ex vivo

В генной терапии in vivo пациенту вводят вектор (обычно вирус), который затем достигает желаемого биологического эффекта, передавая генетический материал (например, для недостающего белка) в клетки пациента. В генной терапии ex vivo , такой как терапия CAR-T , собственные клетки пациента (аутологичные) или здоровые донорские клетки (аллогенные) модифицируются вне организма (отсюда ex vivo ) с использованием вектора для экспрессии определенного белка, такого как химерный антигенный рецептор. [62]
Генная терапия in vivo считается более простой, поскольку она не требует сбора митотических клеток. Однако генная терапия ex vivo лучше переносится и меньше связана с тяжелыми иммунными реакциями. [63] Смерть Джесси Гелсингера в ходе испытания аденовирусного векторного лечения дефицита орнитинтранскарбамилазы из-за системной воспалительной реакции привела к временной остановке испытаний генной терапии в Соединенных Штатах. [64] По состоянию на 2021 год как in vivo[обновлять] , так и ex vivo терапия считаются безопасными. [65]
Редактирование генов

Концепция генной терапии заключается в исправлении генетической проблемы в ее источнике. Если, например, мутация в определенном гене вызывает выработку дисфункционального белка, приводящего (обычно рецессивно) к наследственному заболеванию, генная терапия может быть использована для доставки копии этого гена, которая не содержит вредоносной мутации и, таким образом, производит функциональный белок. Эта стратегия называется генной заместительной терапией и может быть использована для лечения наследственных заболеваний сетчатки. [17] [66]
Хотя концепция заместительной генной терапии в основном подходит для рецессивных заболеваний, были предложены новые стратегии, которые способны лечить также состояния с доминантным типом наследования.
- Внедрение редактирования генов CRISPR открыло новые двери для его применения и использования в генной терапии, поскольку вместо чистой замены гена он позволяет исправить определенный генетический дефект. [40] Решения медицинских препятствий, такие как искоренение резервуаров латентного вируса иммунодефицита человека ( ВИЧ ) и исправление мутации, вызывающей серповидноклеточную анемию, могут стать доступными в качестве терапевтического варианта в будущем. [67] [68] [69]
- Протезная генная терапия направлена на то, чтобы клетки организма могли взять на себя функции, которые они физиологически не выполняют. Одним из примеров является так называемая генная терапия восстановления зрения, которая направлена на восстановление зрения у пациентов с терминальными стадиями заболеваний сетчатки. [70] [71] При терминальных стадиях заболеваний сетчатки фоторецепторы, как основные светочувствительные клетки сетчатки, необратимо утрачиваются. С помощью протезной генной терапии светочувствительные белки доставляются в оставшиеся клетки сетчатки, чтобы сделать их светочувствительными и тем самым дать им возможность передавать зрительную информацию в мозг.
In vivo системы редактирования генов с использованием CRISPR использовались в исследованиях на мышах для лечения рака и оказались эффективными в уменьшении опухолей. [72] : 18 In vitro система CRISPR использовалась для лечения опухолей рака ВПЧ. Векторы на основе аденоассоциированного вируса и лентивируса были направлены на введение генома для системы CRISPR. [72] : 6
Векторы
Доставка ДНК в клетки может быть осуществлена несколькими методами . Два основных класса — это рекомбинантные вирусы (иногда называемые биологическими наночастицами или вирусными векторами) и голая ДНК или комплексы ДНК (невирусные методы). [73]
Вирусы
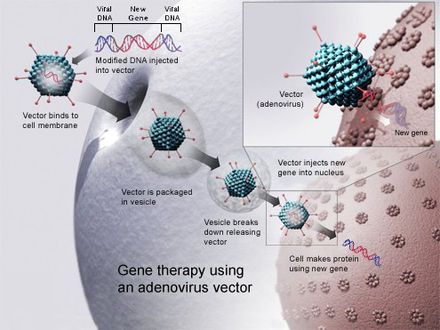
Для репликации вирусы вводят свой генетический материал в клетку- хозяина , обманывая клеточный аппарат хозяина, заставляя его использовать его в качестве чертежей для вирусных белков. [54] : 39 Ретровирусы идут на шаг дальше, копируя свой генетический материал в ядерный геном клетки-хозяина. Ученые используют это, заменяя часть генетического материала вируса терапевтической ДНК или РНК. [54] : 40 [74] Подобно генетическому материалу (ДНК или РНК) в вирусах, терапевтический генетический материал может быть разработан так, чтобы просто служить временным чертежом, который деградирует естественным образом, как в неинтегративных векторах , или проникать в ядро хозяина, становясь постоянной частью ядерной ДНК хозяина в инфицированных клетках. [54] : 50
Для генной терапии человека использовался ряд вирусов, включая такие вирусы, как лентивирус , аденовирусы , вирус простого герпеса , вирус коровьей оспы и аденоассоциированный вирус . [5]
Векторы вируса аденовируса (Ad) временно изменяют генетическую экспрессию клетки с помощью генетического материала, который не интегрирован в ДНК клетки-хозяина. [75] : 5 По состоянию на 2017 год такие векторы использовались в 20% испытаний генной терапии. [74] : 10 Векторы аденовируса в основном используются в лечении рака и новых генетических вакцинах, таких как вакцина против Эболы , вакцины, используемые в клинических испытаниях для ВИЧ и SARS-CoV-2 , или вакцины против рака . [75] : 5
Лентивирусные векторы на основе лентивируса , ретровируса , могут модифицировать ядерный геном клетки для постоянной экспрессии гена, хотя векторы могут быть модифицированы для предотвращения интеграции. [54] : 40,50 Ретровирусы использовались в 18% испытаний до 2018 года. [74] : 10 Libmeldy — это лечение метахроматической лейкодистрофии стволовыми клетками ex vivo , в котором используется лентивирусный вектор, и которое было одобрено Европейским медицинским агентством в 2020 году. [76]
Аденоассоциированный вирус (AAV) — это вирус, который не способен передаваться между клетками, если клетка не инфицирована другим вирусом, вирусом-помощником. Аденовирус и вирусы герпеса действуют как вирусы-помощники для AAV. AAV сохраняется внутри клетки за пределами ядерного генома клетки в течение длительного периода времени за счет образования конкатемеров , в основном организованных в виде эписом . [77] : 4 Генетический материал из векторов AAV интегрируется в ядерный геном клетки-хозяина с низкой частотой и, вероятно, опосредовано ДНК-модифицирующими ферментами клетки-хозяина. [78] : 2647 Животные модели предполагают, что интеграция генетического материала AAV в ядерный геном клетки-хозяина может вызвать гепатоцеллюлярную карциному , форму рака печени . [78] Несколько исследуемых агентов AAV были исследованы при лечении влажной возрастной макулярной дегенерации как интравитреальным , так и субретинальным подходами в качестве потенциального применения генной терапии AAV для лечения заболеваний человека. [79] [80]
Невирусный
Этот раздел нуждается в дополнительных цитатах для проверки . ( Апрель 2021 г. ) |
Невирусные векторы для генной терапии [81] имеют определенные преимущества по сравнению с вирусными методами, такими как крупномасштабное производство и низкая иммуногенность хозяина . Однако невирусные методы изначально обеспечивали более низкие уровни трансфекции и экспрессии генов , и, таким образом, более низкую терапевтическую эффективность. Новые технологии обещают решение этих проблем с появлением более специфичного для клеток таргетирования и контроля субклеточного трафика.
Методы невирусной генной терапии включают инъекцию голой ДНК, электропорацию , генную пушку , сонопорацию , магнитофекцию , использование олигонуклеотидов , липоплексов, дендримеров и неорганических наночастиц. Эти терапевтические средства могут вводиться напрямую или через обогащение каркаса . [82] [83]
Более поздние подходы, например, те, которые реализуются такими компаниями, как Ligandal, предлагают возможность создания технологий таргетинга на клетки для различных методов генной терапии, включая РНК, ДНК и инструменты редактирования генов, такие как CRISPR. Другие компании, такие как Arbutus Biopharma и Arcturus Therapeutics , предлагают невирусные, не нацеленные на клетки подходы, которые в основном демонстрируют трофизм печени. В последние годы такие стартапы, как Sixfold Bio, GenEdit и Spotlight Therapeutics, начали решать проблему невирусной доставки генов. Невирусные методы предлагают возможность повторного дозирования и большую приспособляемость генетических полезных нагрузок, которые в будущем с большей вероятностью возьмут верх над вирусными системами доставки.
Такие компании, как Editas Medicine , Intellia Therapeutics , CRISPR Therapeutics , Casebia, Cellectis , Precision Biosciences , bluebird bio , Excision BioTherapeutics и Sangamo разработали невирусные методы редактирования генов, однако часто все еще используют вирусы для доставки материала для вставки генов после геномного расщепления управляемыми нуклеазами . Эти компании сосредоточены на редактировании генов и по-прежнему сталкиваются с серьезными препятствиями при доставке.
Компании BioNTech , Moderna Therapeutics и CureVac сосредоточены на доставке полезных грузов мРНК , что неизбежно представляет собой проблемы доставки, не связанные с вирусами.
Компании Alnylam , Dicerna Pharmaceuticals и Ionis Pharmaceuticals сосредоточены на доставке siRNA (антисмысловых олигонуклеотидов) для подавления генов, что также требует использования невирусных систем доставки.
В академическом контексте ряд лабораторий работают над доставкой ПЭГилированных частиц, которые образуют короны сывороточных белков и в основном демонстрируют поглощение, опосредованное рецепторами ЛПНП, в клетках in vivo . [84]
Уход
Рак
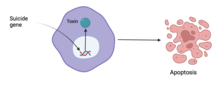
Были попытки лечить рак с помощью генной терапии. По состоянию на 2017 год 65% испытаний генной терапии были направлены на лечение рака. [74] : 7
Векторы аденовируса полезны для некоторых видов генной терапии рака, поскольку аденовирус может временно вставлять генетический материал в клетку, не изменяя при этом ядерный геном клетки. Эти векторы могут использоваться для добавления антигенов к раковым клеткам, вызывающим иммунный ответ, или для предотвращения ангиогенеза путем экспрессии определенных белков. [85] : 5 Вектор аденовируса используется в коммерческих продуктах Gendicine и Oncorine . [85] : 10 Другой коммерческий продукт, Rexin G , использует вектор на основе ретровируса и избирательно связывается с рецепторами, которые более выражены в опухолях. [85] : 10
Один из подходов, генная терапия самоубийства , работает путем введения генов, кодирующих ферменты, которые заставят раковую клетку умереть. Другой подход заключается в использовании онколитических вирусов , таких как Онкорин, [86] : 165 , которые являются вирусами, которые избирательно размножаются в раковых клетках, оставляя другие клетки нетронутыми. [87] : 6 [88] : 280
мРНК была предложена в качестве невирусного вектора для генной терапии рака, который временно изменит функцию раковой клетки, чтобы создавать антигены или убивать раковые клетки, и было проведено несколько испытаний. [89]
Afamitresgene autoleucel , продаваемый под торговой маркой Tecelra, является аутологичной Т-клеточной иммунотерапией, используемой для лечения синовиальной саркомы . Это генная терапия Т-клеточного рецептора (TCR). [90] Это первая одобренная FDA клеточная терапия с использованием искусственно созданных клеток для лечения солидной опухоли. [91] Он использует самоинактивирующийся лентивирусный вектор для экспрессии Т-клеточного рецептора, специфичного для MAGE-A4, антигена, ассоциированного с меланомой. [ необходима медицинская цитата ]
Генетические заболевания
Были предложены и изучаются подходы генной терапии для замены дефектного гена здоровым геном для лечения некоторых генетических заболеваний. По состоянию на 2017 год 11,1% клинических испытаний генной терапии были направлены на моногенные заболевания. [74] : 9
Такие заболевания, как серповидноклеточная анемия , вызванные аутосомно-рецессивными нарушениями , при которых нормальный фенотип человека или функция клеток могут быть восстановлены в клетках, имеющих заболевание, с помощью нормальной копии мутировавшего гена, могут быть хорошими кандидатами для лечения генной терапией. [92] [93] Риски и преимущества, связанные с генной терапией серповидноклеточной анемии, неизвестны. [93]
Генная терапия использовалась в глазу . Глаз особенно подходит для векторов аденоассоциированного вируса . Voretigene neparvovec — это одобренная генная терапия для лечения наследственной оптической нейропатии Лебера . [94] : 1354 alipogene tiparvovec , лечение панкреатита, вызванного генетическим заболеванием, и Zolgensma для лечения спинальной мышечной атрофии — оба используют вектор аденоассоциированного вируса. [78] : 2647
Инфекционные заболевания
По состоянию на 2017 год 7% испытаний генной терапии были направлены на инфекционные заболевания. 69,2% испытаний были направлены на ВИЧ , 11% — на гепатит B или C и 7,1% — на малярию . [74]
Список генных терапий для лечения заболеваний
Некоторые методы генной терапии одобрены Управлением по контролю за продуктами и лекарствами США (FDA), Европейским агентством по лекарственным средствам (EMA) и разрешены к применению в России и Китае.
| ГОСТИНИЦА | Название бренда | Тип | Производитель | Цель | Одобрено Управлением по контролю за продуктами и лекарствами США (FDA) | Европейское агентство по лекарственным средствам (EMA) получило разрешение |
|---|---|---|---|---|---|---|
| афамитресген аутолейцел | Тесельра | Экс витро | Адаптиммунный | синовиальная саркома | Август 2024 [90] | |
| алипоген типарвовек | Глибера | В естественных условиях | Кьези Фармацевтичи | дефицит липопротеинлипазы | Изъято | |
| атидарсаген аутотемцель | Либмелди, Ленмелди ( Ген арилсульфатазы А, кодирующий аутологичные клетки CD34+ ) | Экс витро | Садовая терапия | метахроматическая лейкодистрофия | Март 2024 г. [95] | Декабрь 2020 [96] |
| аутологичный CD34+ | Стримвелис | Дефицит аденозиндезаминазы (ADA-SCID) | Май 2016 г. | |||
| аксикабтаген цилолеуцел | Йескарта | Экс витро | Кайт фарма | крупноклеточная В-клеточная лимфома | Октябрь 2017 г. | Август 2018 г. |
| беремагене геперпавек | Вьювек | В естественных условиях | Кристалл Биотех | буллезный дистрофический эпидермолиз (БЭБ) | Май 2023 [97] | |
| бетибеглогенный аутотемцель | Зинтегло | бета-талассемия | Август 2022 г. [98] | Май 2019 г. | ||
| брексукабтаген аутолейцел | Текартус | Экс витро | Кайт Фарма | мантийноклеточная лимфома и острый лимфобластный лейкоз | Июль 2020 [99] [100] | Декабрь 2020 [101] |
| камбиогенплазмид | Неоваскулген | фактор роста эндотелия сосудов заболевание периферических артерий | ||||
| деландистроген моксепарвовец | Элевидис | В естественных условиях | Катализатор | мышечная дистрофия Дюшенна | Июнь 2023 г. [102] | |
| эливальдоген аутотемцель | Скайсона | церебральная адренолейкодистрофия | Июль 2021 г. | |||
| exagamglogene аутотемцель | Касгеви | Экс виво | Вертекс Фармасьютикалс | серповидно-клеточная анемия | Декабрь 2023 г. [103] | |
| гендицин | плоскоклеточный рак головы и шеи | |||||
| идекабтаген виклеуцел | Абекма | Экс виво | Селджен | множественная миелома | Март 2021 г. [104] | |
| лизокабтаген маралейцел | Брейанзи | Экс виво | Juno Терапевтика | В-клеточная лимфома | Февраль 2021 г. [105] | |
| ловотибеглогенный аутотемцель | Лифгения | Экс виво | Биография Bluebird | серповидно-клеточная анемия | Декабрь 2023 г. [106] | |
| надофараген фираденовец | Адстиладрин | Ферринг Фармасьютикалс | Неинвазивный рак мочевого пузыря с высоким риском, вызванный бациллой Кальметта-Герена (БЦЖ), с карциномой in situ (CIS) | Да [107] | ||
| обекабтаген аутолейцел | Аукацил | Аутолус Терапевтика | острый лимфобластный лейкоз | Ноябрь 2024 [108] [109] | ||
| онасемноген абепарвовец | Золгенсма | В естественных условиях | Генная терапия Novartis | спинальная мышечная атрофия тип I | Май 2019 [110] | Март 2020 [111] |
| талимоген лахерпарепвек | Имлигик | В естественных условиях | Амджен | меланома | Октябрь 2015 г. [112] | Декабрь 2015 [113] |
| тисагенлеклеуцел | Кимрия | В-клеточный лимфобластный лейкоз | Август 2018 г. | |||
| валоктокоген роксапарвовец | Роктавианский | БиоМарин Интернешнл Лимитед | гемофилия А | Август 2022 г. [114] [115] [116] | ||
| воретиген непарвовец | Люкстурна | В естественных условиях | Спарк Терапевтика | биаллельная мутация RPE65, ассоциированная с врожденным амаврозом Лебера | Декабрь 2017 [117] | Ноябрь 2018 [118] |
Побочные эффекты, противопоказания и препятствия к применению
Некоторые из нерешенных проблем включают в себя:
- Нецелевые эффекты – Возможность нежелательных, вероятно, вредных изменений в геноме представляет собой серьезное препятствие для широкого внедрения этой технологии. [119] Улучшение специфичности ферментов gRNA и Cas представляет собой жизнеспособное решение этой проблемы, а также усовершенствование метода доставки CRISPR. [120] Вероятно, что различные заболевания получат пользу от различных методов доставки.
- Кратковременная природа – Прежде чем генная терапия сможет стать постоянным лекарством от состояния, терапевтическая ДНК, введенная в целевые клетки, должна оставаться функциональной, а клетки, содержащие терапевтическую ДНК, должны быть стабильными. Проблемы с интеграцией терапевтической ДНК в ядерный геном и быстро делящаяся природа многих клеток не позволяют ей достичь долгосрочных преимуществ. Пациентам требуется несколько курсов лечения.
- Иммунный ответ – Каждый раз, когда в ткани человека попадает инородный объект, иммунная система стимулируется для атаки на захватчика. Стимулирование иммунной системы таким образом, что снижается эффективность генной терапии, возможно. Усиленный ответ иммунной системы на вирусы, которые она видела раньше, снижает эффективность повторных обработок.
- Проблемы с вирусными векторами. Вирусные векторы несут в себе риски токсичности, воспалительных реакций, а также проблем с контролем генов и нацеливанием.
- Мультигенные заболевания. Некоторые распространенные заболевания, такие как болезни сердца , гипертония , болезнь Альцгеймера , артрит и диабет , обусловлены изменениями в нескольких генах, что затрудняет генную терапию.
- Некоторые методы лечения могут нарушать барьер Вейсмана (между сомой и зародышевой линией), защищающий яички, потенциально изменяя зародышевую линию, что противоречит правилам в странах, запрещающим последнюю практику. [121]
- Инсерционный мутагенез – если ДНК интегрирована в чувствительное место в геноме, например, в ген-супрессор опухоли , терапия может вызвать опухоль . Это произошло в клинических испытаниях для пациентов с тяжелым комбинированным иммунодефицитом, сцепленным с Х-хромосомой (X-SCID), у которых гемопоэтические стволовые клетки были трансдуцированы корректирующим трансгеном с использованием ретровируса , и это привело к развитию Т-клеточного лейкоза у 3 из 20 пациентов. [122] [123] Одним из возможных решений является добавление функционального гена-супрессора опухоли к ДНК, которая должна быть интегрирована. Это может быть проблематично, поскольку чем длиннее ДНК, тем сложнее ее интегрировать в геномы клеток. [124] Технология CRISPR позволяет исследователям вносить гораздо более точные изменения генома в точных местах. [125]
- Стоимость – например, в 2013 году сообщалось, что алипоген типарвовек (Глибера) при стоимости 1,6 млн долларов на пациента является самым дорогим препаратом в мире. [126] [127]
Летальные исходы
В ходе испытаний генной терапии были зарегистрированы три случая смерти пациентов, что поставило эту область под пристальное внимание. Первым был случай Джесси Гелсингера , который умер в 1999 году из-за реакции иммунного отторжения. [128] [129] Один пациент с X-SCID умер от лейкемии в 2003 году. [13] В 2007 году пациент с ревматоидным артритом умер от инфекции; последующее расследование пришло к выводу, что смерть не была связана с генной терапией. [130]
Правила
Положения, касающиеся генетической модификации, являются частью общих рекомендаций по биомедицинским исследованиям с участием человека. [ необходима цитата ] В этой области нет международных договоров, имеющих обязательную юридическую силу, но существуют рекомендации для национальных законов от различных органов. [ необходима цитата ]
Хельсинкская декларация (Этические принципы медицинских исследований с участием людей) была изменена Генеральной ассамблеей Всемирной медицинской ассоциации в 2008 году. Этот документ содержит принципы, которые врачи и исследователи должны учитывать при привлечении людей в качестве объектов исследования. Заявление об исследованиях генной терапии, инициированное Организацией генома человека (HUGO) в 2001 году, обеспечивает правовую основу для всех стран. Документ HUGO подчеркивает свободу человека и соблюдение прав человека, а также предлагает рекомендации по соматической генной терапии, включая важность признания общественной обеспокоенности по поводу таких исследований. [131]
Соединенные Штаты
Ни одно федеральное законодательство не устанавливает протоколы или ограничения относительно генной инженерии человека. Этот предмет регулируется пересекающимися правилами местных и федеральных агентств, включая Министерство здравоохранения и социальных служб , FDA и Консультативный комитет по рекомбинантной ДНК NIH. Исследователи, ищущие федеральные средства для исследования нового препарата (обычно это касается соматической генной инженерии человека), должны соблюдать международные и федеральные руководящие принципы по защите людей. [132]
NIH выступает в качестве основного регулятора генной терапии для исследований, финансируемых из федерального бюджета. Исследованиям, финансируемым из частных источников, рекомендуется следовать этим правилам. NIH предоставляет финансирование для исследований, которые разрабатывают или улучшают методы генной инженерии, а также для оценки этики и качества текущих исследований. NIH ведет обязательный реестр протоколов исследований генной инженерии человека, который включает все проекты, финансируемые из федерального бюджета. [133]
Консультативный комитет NIH опубликовал набор руководств по генной манипуляции. [134] В руководствах обсуждается безопасность лабораторных исследований, а также подопытные люди и различные типы экспериментов, включающие генетические изменения. Несколько разделов конкретно касаются генной инженерии человека, включая раздел III-C-1. В этом разделе описываются требуемые процессы рассмотрения и другие аспекты при получении одобрения на начало клинических исследований, включающих генетический перенос в человека-пациента. [135] Протокол клинического испытания генной терапии должен быть одобрен Консультативным комитетом по рекомбинантной ДНК NIH до начала любого клинического испытания; это отличается от любого другого вида клинического испытания. [134]
Как и в случае с другими видами лекарств, FDA регулирует качество и безопасность продуктов генной терапии и контролирует, как эти продукты используются в клинической практике. Терапевтическое изменение генома человека подпадает под те же нормативные требования, что и любое другое медицинское лечение. Исследования с участием людей, такие как клинические испытания , должны быть рассмотрены и одобрены FDA и Институциональным наблюдательным советом . [136] [137]
Генный допинг
Спортсмены могут использовать технологии генной терапии для улучшения своих результатов. [138] Генный допинг не известен, но множественная генная терапия может иметь такие эффекты. Кайзер и др. утверждают, что генный допинг может уравнять шансы , если все спортсмены получат равный доступ. Критики утверждают, что любое терапевтическое вмешательство в нетерапевтических/улучшающих целях подрывает этические основы медицины и спорта. [139]
Генетическое улучшение
Генная инженерия может быть использована для лечения болезней, а также для изменения внешнего вида, метаболизма и даже улучшения физических возможностей и умственных способностей, таких как память и интеллект . Этические утверждения о зародышевой инженерии включают убеждения, что каждый плод имеет право оставаться генетически немодифицированным, что родители имеют право генетически модифицировать свое потомство, и что каждый ребенок имеет право родиться свободным от предотвратимых болезней. [140] [141] [142] Для родителей генная инженерия может рассматриваться как еще один метод улучшения ребенка, который можно добавить к диете, физическим упражнениям, образованию, обучению, косметике и пластической хирургии. [143] [144] Другой теоретик утверждает, что моральные соображения ограничивают, но не запрещают зародышевую инженерию. [145]
Выпуск журнала «Биоэтика» за 2020 год был посвящен моральным вопросам, связанным с генной инженерией зародышевых линий у людей. [146]
Возможные схемы регулирования включают полный запрет, предоставление всем или профессиональное саморегулирование. Совет по этическим и судебным вопросам Американской медицинской ассоциации заявил, что «генетические вмешательства для улучшения черт следует считать допустимыми только в строго ограниченных ситуациях: (1) явные и значимые преимущества для плода или ребенка; (2) отсутствие компромисса с другими характеристиками или чертами; и (3) равный доступ к генетической технологии, независимо от дохода или других социально-экономических характеристик». [147]
Еще в начале истории биотехнологии , в 1990 году, были ученые, выступавшие против попыток изменить зародышевую линию человека с помощью этих новых инструментов, [148] и такие опасения сохранялись по мере развития технологий. [149] [150] С появлением новых методов, таких как CRISPR , в марте 2015 года группа ученых призвала ввести всемирный мораторий на клиническое использование технологий редактирования генов для редактирования генома человека таким образом, чтобы его можно было наследовать. [151] [152] [153] [154] В апреле 2015 года исследователи вызвали споры, когда сообщили о результатах фундаментальных исследований по редактированию ДНК нежизнеспособных человеческих эмбрионов с использованием CRISPR. [155] [156] Комитет Американской национальной академии наук и Национальной академии медицины оказал квалифицированную поддержку редактированию генома человека в 2017 году [157] [158] после того, как были найдены ответы на проблемы безопасности и эффективности, «но только для серьезных состояний под строгим надзором». [159]
История
This section may be too long and excessively detailed. (November 2018) |
1970-е и ранее
В 1972 году Фридман и Роблин опубликовали статью в журнале Science под названием «Генная терапия генетических заболеваний человека?». [160] Роджерс (1970) был процитирован за предложение использовать экзогенную хорошую ДНК для замены дефектной ДНК у людей с генетическими дефектами. [161]
1980-е
В 1984 году была разработана система ретровирусных векторов, которая могла эффективно вставлять чужеродные гены в хромосомы млекопитающих. [162]
1990-е
Первое одобренное клиническое исследование генной терапии в США состоялось 14 сентября 1990 года в Национальном институте здравоохранения (NIH) под руководством Уильяма Френча Андерсона . [163] Четырехлетняя Эшанти ДеСильва получила лечение от генетического дефекта, который привел к дефициту аденозиндезаминазы (ADA-SCID), тяжелому дефициту иммунной системы. Дефектный ген клеток крови пациентки был заменен функциональным вариантом. Иммунная система Эшанти была частично восстановлена терапией. Производство недостающего фермента было временно стимулировано, но новые клетки с функциональными генами не были созданы. Она вела нормальную жизнь только благодаря регулярным инъекциям, проводимым каждые два месяца. Эффект был успешным, но временным. [164]
Генная терапия рака была введена в 1992/93 годах (Trojan et al. 1993). [165] Лечение мультиформной глиобластомы , злокачественной опухоли мозга, исход которой всегда летальный, проводилось с использованием вектора, экспрессирующего антисмысловую РНК IGF-I (клиническое исследование одобрено протоколом NIH № 1602 24 ноября 1993 года [166] и FDA в 1994 году). Эта терапия также представляет собой начало иммуногенной терапии рака, лечения, которое оказывается эффективным благодаря противоопухолевому механизму антисмысловой РНК IGF-I, который связан с сильными иммунными и апоптотическими явлениями.
В 1992 году Клаудио Бординон , работая в Университете Вита-Салюте Сан-Раффаэле , выполнил первую процедуру генной терапии с использованием гемопоэтических стволовых клеток в качестве векторов для доставки генов, предназначенных для исправления наследственных заболеваний . [167] В 2002 году эта работа привела к публикации первого успешного лечения генной терапии для ADA-SCID. Успех многоцентрового исследования по лечению детей с SCID ( тяжелый комбинированный иммунодефицит или болезнь «мальчика в пузыре»), проводившегося в 2000 и 2002 годах, был поставлен под сомнение, когда у двух из десяти детей, проходивших лечение в парижском центре исследования, развилось состояние, похожее на лейкемию. Клинические испытания были временно приостановлены в 2002 году, но возобновлены после нормативного обзора протокола в США, Великобритании, Франции, Италии и Германии. [168]
В 1993 году Эндрю Гобеа родился с SCID после пренатального генетического скрининга . Кровь была взята из плаценты и пуповины его матери сразу после рождения, чтобы получить стволовые клетки. Аллель , который кодирует аденозиндезаминазу (ADA), был получен и вставлен в ретровирус. Ретровирусы и стволовые клетки были смешаны, после чего вирусы вставили ген в хромосомы стволовых клеток. Стволовые клетки, содержащие рабочий ген ADA, были введены в кровь Эндрю. Инъекции фермента ADA также делались еженедельно. В течение четырех лет Т-клетки (белые кровяные клетки), вырабатываемые стволовыми клетками, производили ферменты ADA с использованием гена ADA. Через четыре года потребовалось дополнительное лечение. [169]
В 1996 году Луиджи Нальдини и Дидье Троно разработали новый класс векторов генной терапии на основе ВИЧ, способных инфицировать неделящиеся клетки, которые с тех пор широко использовались в клинических и исследовательских целях, став пионерами в области лентивирусных векторов в генной терапии . [170]
Смерть Джесси Гелсингера в 1999 году затруднила исследования генной терапии в США. [171] [172] В результате FDA приостановило несколько клинических испытаний в ожидании переоценки этических и процедурных норм. [173]
2000-е
Модифицированная стратегия генной терапии антисмысловой РНК IGF-I (NIH № 1602) [166] с использованием подхода антисмысловой/тройной спирали анти-IGF-I была зарегистрирована в 2002 году в ходе клинического испытания генной терапии Wiley - № 635 и 636. Подход показал многообещающие результаты при лечении шести различных злокачественных опухолей: глиобластомы , рака печени, толстой кишки, простаты, матки и яичников (совместная научная программа НАТО по генной терапии США, Франции, Польши № LST 980517, проведенная Дж. Трояном) (Троян и др., 2012). Эта терапия антигеном антисмысловой/тройной спирали доказала свою эффективность благодаря механизму, одновременно останавливающему экспрессию IGF-I на уровнях трансляции и транскрипции, усиливающему противоопухолевый иммунный и апоптотический феномены.
2002
Серповидноклеточную анемию можно лечить у мышей. [174] Мыши, которые имеют по сути тот же дефект, который вызывает случаи заболевания у людей, использовали вирусный вектор, чтобы вызвать выработку фетального гемоглобина (HbF), который обычно прекращает вырабатываться вскоре после рождения. У людей использование гидроксимочевины для стимуляции выработки HbF временно облегчает симптомы серповидноклеточной анемии. Исследователи продемонстрировали, что это лечение является более постоянным средством для увеличения терапевтической выработки HbF. [175]
Новый подход генной терапии исправил ошибки в РНК-мессенджере, полученные из дефектных генов. Эта техника имеет потенциал для лечения талассемии , кистозного фиброза и некоторых видов рака. [176]
Исследователи создали липосомы диаметром 25 нанометров, которые могут переносить терапевтическую ДНК через поры в ядерной мембране . [177]
2003
В 2003 году исследовательская группа впервые вставила гены в мозг. Они использовали липосомы, покрытые полимером под названием полиэтиленгликоль , который в отличие от вирусных векторов достаточно мал, чтобы преодолеть гематоэнцефалический барьер . [178]
Короткие фрагменты двухцепочечной РНК (короткие интерферирующие РНК или siRNA ) используются клетками для деградации РНК определенной последовательности. Если siRNA разработана для соответствия РНК, скопированной с дефектного гена, то аномальный белковый продукт этого гена не будет произведен. [179]
Гендицин — это генная терапия рака, которая доставляет ген- супрессор опухолей p53 с помощью сконструированного аденовируса . В 2003 году он был одобрен в Китае для лечения плоскоклеточного рака головы и шеи . [31]
2006
В марте исследователи объявили об успешном использовании генной терапии для лечения двух взрослых пациентов с Х-сцепленной хронической гранулематозной болезнью , болезнью, которая поражает миелоидные клетки и повреждает иммунную систему . Исследование является первым, которое показало, что генная терапия может лечить миелоидную систему. [180]
В мае группа ученых сообщила о способе предотвращения отторжения иммунной системой недавно введенного гена. [181] Подобно трансплантации органов , генная терапия страдает от этой проблемы. Иммунная система обычно распознает новый ген как чужеродный и отвергает клетки, его несущие. В исследовании использовалась недавно обнаруженная сеть генов, регулируемых молекулами, известными как микроРНК . Эта естественная функция выборочно скрывала их терапевтический ген в клетках иммунной системы и защищала его от обнаружения. Мыши, инфицированные геном, содержащим целевую последовательность микроРНК иммунной клетки, не отторгали ген.
В августе ученые успешно вылечили метастатическую меланому у двух пациентов, используя Т-клетки-киллеры, генетически перенацеленные на атаку раковых клеток. [182]
В ноябре исследователи сообщили об использовании VRX496, иммунотерапии на основе генов для лечения ВИЧ , которая использует лентивирусный вектор для доставки антисмыслового гена против оболочки ВИЧ . В клиническом испытании фазы I лечились пять субъектов с хронической ВИЧ-инфекцией, которые не отреагировали по крайней мере на два антиретровирусных режима. Однократная внутривенная инфузия аутологичных Т-клеток CD4 , генетически модифицированных с помощью VRX496, хорошо переносилась. У всех пациентов была стабильная или сниженная вирусная нагрузка; у четырех из пяти пациентов было стабильное или повышенное количество Т-клеток CD4. У всех пяти пациентов был стабильный или повышенный иммунный ответ на антигены ВИЧ и другие патогены . Это была первая оценка лентивирусного вектора, введенного в клиническом испытании на людях в США. [183] [184]
2007
В мае 2007 года исследователи объявили о первом испытании генной терапии для наследственного заболевания сетчатки . Первая операция была проведена на 23-летнем британском мужчине Роберте Джонсоне в начале 2007 года. [185]
2008
Врожденный амавроз Лебера — наследственное заболевание, вызывающее слепоту, вызванное мутациями в гене RPE65 . Результаты небольшого клинического исследования на детях были опубликованы в апреле. [17] Доставка рекомбинантного аденоассоциированного вируса (AAV), несущего RPE65, дала положительные результаты. В мае еще две группы сообщили о положительных результатах в независимых клинических исследованиях с использованием генной терапии для лечения этого состояния. Во всех трех клинических исследованиях у пациентов восстановилось функциональное зрение без явных побочных эффектов. [17] [18] [19] [20]
2009
В сентябре исследователям удалось наделить беличьих обезьян трихроматическим зрением . [186] В ноябре 2009 года исследователи остановили смертельное генетическое заболевание, называемое адренолейкодистрофией, у двух детей, используя вектор лентивируса для доставки функционирующей версии ABCD1 , гена, который мутирует при заболевании. [187]
2010-е
2010
В апрельской статье сообщалось, что генная терапия решает проблему ахроматопсии (дальтонизма) у собак, воздействуя на колбочковые фоторецепторы. Функция колбочек и дневное зрение были восстановлены по крайней мере на 33 месяца у двух молодых особей. Терапия оказалась менее эффективной для старых собак. [188]
В сентябре было объявлено, что 18-летний пациент мужского пола во Франции с большой бета-талассемией был успешно вылечен. [189] Большая бета-талассемия — это наследственное заболевание крови , при котором отсутствует бета-гемоглобин , и пациенты зависят от регулярных пожизненных переливаний крови . [190] Методика использовала лентивирусный вектор для трансдукции гена человеческого β-глобина в очищенную кровь и клетки костного мозга , полученные от пациента в июне 2007 года. [191] Уровень гемоглобина у пациента был стабильным на уровне 9–10 г/дл. Около трети гемоглобина содержало форму, введенную вирусным вектором, и переливания крови не потребовались. [191] [192] Были запланированы дальнейшие клинические испытания. [193] Трансплантация костного мозга является единственным методом лечения талассемии, но 75% пациентов не находят подходящего донора. [192]
Иммуногенная терапия рака с использованием модифицированного антигена, антисмыслового/тройного спирали была введена в Южной Америке в 2010/11 в Университете Ла Сабана, Богота (Этический комитет 14 декабря 2010 г., № P-004-10). Учитывая этический аспект генной диагностики и генной терапии, нацеленной на IGF-I, были вылечены опухоли, экспрессирующие IGF-I, т. е. рак легких и эпидермиса (Trojan et al. 2016). [194] [195]
2011
В 2007 и 2008 годах мужчина ( Тимоти Рэй Браун ) был излечен от ВИЧ путем повторной трансплантации гемопоэтических стволовых клеток (см. также аллогенная трансплантация стволовых клеток , аллогенная трансплантация костного мозга , аллотрансплантация ) с двойной мутацией дельта-32, которая отключает рецептор CCR5 . Это лечение было принято медицинским сообществом в 2011 году. [196] Оно требовало полной абляции существующего костного мозга , что очень изнурительно. [197]
В августе было подтверждено, что двое из трех участников пилотного исследования излечились от хронического лимфолейкоза (ХЛЛ). Терапия использовала генетически модифицированные Т-клетки для атаки клеток, которые экспрессировали белок CD19 для борьбы с болезнью. [26] В 2013 году исследователи объявили, что 26 из 59 пациентов достигли полной ремиссии, а у исходного пациента опухоль не появилась. [198]
Терапия кардиомиоцитов плазмидной ДНК человека HGF изучается как потенциальное лечение ишемической болезни сердца , а также как лечение повреждений, возникающих в сердце после инфаркта миокарда . [199] [200]
В 2011 году Неоваскулген был зарегистрирован в России как первый в своем классе генно-терапевтический препарат для лечения заболеваний периферических артерий , включая критическую ишемию конечностей ; он доставляет ген, кодирующий VEGF . [32] Неоваскулоген — это плазмида , кодирующая промотор ЦМВ и 165-аминокислотную форму VEGF . [201] [202]
2012
В июле FDA одобрило клинические испытания первой фазы на пациентах с большой талассемией в США для 10 участников. [203] Ожидалось, что исследование продлится до 2015 года. [193]
В июле 2012 года Европейское агентство по лекарственным средствам впервые рекомендовало одобрить генную терапию в Европе и США. Лечение использовало Alipogene tiparvovec (Glybera) для компенсации дефицита липопротеинлипазы , который может вызвать тяжелый панкреатит . [204] Рекомендация была одобрена Европейской комиссией в ноябре 2012 года, [16] [33] [205] [206] и коммерческое внедрение началось в конце 2014 года. [207] Ожидалось, что стоимость Alipogene tiparvovec составит около 1,6 миллиона долларов за курс лечения в 2012 году, [208] пересмотренная до 1 миллиона долларов в 2015 году, [209] что сделало его самым дорогим лекарством в мире на тот момент. [210] По состоянию на 2016 год [update], только пациенты, проходившие лечение в клинических испытаниях, и пациент, заплативший полную стоимость лечения, получили препарат. [211]
В декабре 2012 года сообщалось, что 10 из 13 пациентов с множественной миеломой находились в состоянии ремиссии «или очень близко к ней» через три месяца после инъекции лечения с использованием генетически модифицированных Т-клеток для воздействия на белки NY-ESO-1 и LAGE-1, которые существуют только в клетках раковой миеломы. [28]
2013
В марте исследователи сообщили, что трое из пяти взрослых пациентов, у которых был острый лимфоцитарный лейкоз (ОЛЛ), находились в состоянии ремиссии в течение пяти месяцев - двух лет после лечения генетически модифицированными Т-клетками , которые атаковали клетки с генами CD19 на их поверхности, то есть все В-клетки , раковые или нет. Исследователи полагали, что иммунная система пациентов будет производить нормальные Т-клетки и В-клетки через пару месяцев. Им также пересадили костный мозг. У одного пациента случился рецидив, и он умер, а один умер от тромба, не связанного с заболеванием. [27]
После обнадеживающих испытаний фазы I в апреле исследователи объявили, что начинают клинические испытания фазы II (называемые CUPID2 и SERCA-LVAD) на 250 пациентах [212] в нескольких больницах для борьбы с сердечными заболеваниями . Терапия была разработана для повышения уровня SERCA 2, белка в сердечных мышцах, что улучшает мышечную функцию. [213] Управление по контролю за продуктами и лекарствами США (FDA) присвоило этому препарату статус прорывной терапии для ускорения процесса испытаний и одобрения. [214] В 2016 году сообщалось, что в ходе испытания CUPID 2 не было обнаружено никаких улучшений. [215]
В июле исследователи сообщили о многообещающих результатах для шести детей с двумя тяжелыми наследственными заболеваниями, которых лечили частично дезактивированным лентивирусом для замены дефектного гена и через 7–32 месяца. У трех детей была метахроматическая лейкодистрофия , из-за которой дети теряют когнитивные и двигательные навыки. [216] У других детей был синдром Вискотта-Олдрича , из-за которого они уязвимы для инфекции, аутоиммунных заболеваний и рака. [217] Последующие испытания с генной терапией еще у шести детей с синдромом Вискотта-Олдрича также были объявлены многообещающими. [218] [219]
В октябре исследователи сообщили, что двое детей, родившихся с тяжелым комбинированным иммунодефицитом аденозиндезаминазы (ADA-SCID), лечились генетически модифицированными стволовыми клетками 18 месяцев назад, и что их иммунная система показывала признаки полного восстановления. Еще трое детей добились прогресса. [24] В 2014 году еще 18 детей с ADA-SCID были вылечены с помощью генной терапии. [220] У детей с ADA-SCID не функционирует иммунная система, и их иногда называют «детями пузыря». [24]
Также в октябре исследователи сообщили, что в начале 2011 года они лечили шесть человек с гемофилией с помощью аденоассоциированного вируса. Более двух лет спустя все шесть вырабатывали фактор свертывания крови . [24] [221]
2014
В январе исследователи сообщили, что шесть пациентов с хориоидеремией прошли лечение аденоассоциированным вирусом с копией REP1 . В течение периода от шести месяцев до двух лет у всех улучшилось зрение. [66] [222] К 2016 году 32 пациента прошли лечение с положительными результатами, и исследователи надеялись, что лечение будет долгосрочным. [21] Хориоидеремия — это наследственное генетическое заболевание глаз, не имеющее одобренного лечения, приводящее к потере зрения.
В марте исследователи сообщили, что 12 пациентов с ВИЧ прошли лечение с 2009 года в ходе испытания с использованием генетически модифицированного вируса с редкой мутацией ( дефицит CCR5 ), который, как известно, защищает от ВИЧ, и результаты были многообещающими. [223] [224]
Клинические испытания генной терапии серповидноклеточной анемии начались в 2014 году. [225] [226]
В феврале LentiGlobin BB305 , генно-терапевтическое лечение, проходящее клинические испытания для лечения бета-талассемии, получило статус «прорыва» от FDA после того, как нескольким пациентам удалось отказаться от частых переливаний крови, обычно необходимых для лечения этого заболевания. [227]
В марте исследователи доставили рекомбинантный ген , кодирующий широко нейтрализующее антитело , обезьянам, инфицированным обезьяньим ВИЧ ; клетки обезьян вырабатывали антитело , которое очищало их от ВИЧ. Метод называется иммунопрофилактикой путем переноса генов (IGT). Проводились испытания на животных антител к Эболе, малярии, гриппу и гепатиту. [228] [229]
В марте ученые, включая изобретателя CRISPR Дженнифер Дудна , призвали к всемирному мораторию на генную терапию зародышевой линии, написав, что «ученые должны избегать даже попыток, в слабых юрисдикциях, модификации генома зародышевой линии для клинического применения на людях», пока все последствия «не будут обсуждены научными и правительственными организациями». [151] [152] [153] [154]
В декабре ученые ведущих мировых академий призвали ввести мораторий на наследуемое редактирование генома человека , включая те, которые связаны с технологиями CRISPR-Cas9 [230], но при этом фундаментальные исследования, включая редактирование генов эмбрионов, должны продолжаться. [231]
2015
Исследователи успешно вылечили мальчика с буллезным эпидермолизом, используя кожные трансплантаты, выращенные из его собственных клеток кожи, генетически измененных для устранения мутации, вызвавшей его заболевание. [232]
В ноябре исследователи объявили, что они лечили девочку, Лейлу Ричардс, экспериментальным методом с использованием донорских Т-клеток, генетически модифицированных с помощью TALEN для атаки раковых клеток. Спустя год после лечения она все еще была свободна от рака (высокоагрессивная форма острого лимфобластного лейкоза [ОЛЛ]). [233] Дети с высокоагрессивным ОЛЛ обычно имеют очень плохой прогноз, и болезнь Лейлы считалась терминальной до лечения. [234] [235]
2016
В апреле Комитет по лекарственным препаратам для человека Европейского агентства по лекарственным средствам одобрил генотерапевтическое лечение под названием Strimvelis [236] [237] , а Европейская комиссия одобрила его в июне. [238] Это лечение детей, рожденных с дефицитом аденозиндезаминазы и не имеющих функционирующей иммунной системы. Это было второе генотерапевтическое лечение, одобренное в Европе. [239]
В октябре китайские ученые сообщили, что они начали испытание по генетической модификации Т-клеток у 10 взрослых пациентов с раком легких и повторной инъекции модифицированных Т-клеток обратно в их тела для атаки раковых клеток. У Т-клеток был удален белок PD-1 (который останавливает или замедляет иммунный ответ) с помощью CRISPR-Cas9. [240] [241]
Систематический обзор Cochrane 2016 года , рассматривающий данные четырех испытаний по местной генной терапии регулятора трансмембранной проводимости (CFTR) при кистозном фиброзе, не поддерживает ее клиническое использование в виде тумана, вдыхаемого в легкие для лечения пациентов с кистозным фиброзом с легочными инфекциями. В одном из четырех испытаний были обнаружены слабые доказательства того, что терапия переноса гена CFTR на основе липосом может привести к небольшому улучшению дыхания у людей с CF. Эти слабые доказательства недостаточны для того, чтобы дать клиническую рекомендацию для рутинной генной терапии CFTR. [242]
2017
В феврале компания Kite Pharma объявила о результатах клинического испытания CAR-T -клеток у примерно ста человек с прогрессирующей неходжкинской лимфомой . [243]
В марте французские ученые сообщили о клинических исследованиях генной терапии для лечения серповидноклеточной анемии . [244]
В августе FDA одобрило тисагенлеклейцел для лечения острого лимфобластного лейкоза . [245] Тисагенлеклейцел — это адаптивная клеточная терапия для лечения острого лимфобластного лейкоза В-клеток ; Т-клетки у человека с раком извлекаются, генетически модифицируются для создания специфического рецептора Т-клеток (химерного рецептора Т-клеток или «CAR-T»), который реагирует на рак, и вводятся обратно человеку. Т-клетки модифицируются для воздействия на белок CD19 , который распространен на В-клетках. Это первая форма генной терапии, одобренная в Соединенных Штатах. В октябре аналогичная терапия под названием аксикабтаген цилолеуцел была одобрена для лечения неходжкинской лимфомы. [246]
В октябре биофизик и биохакер Джозайя Зайнер заявил, что осуществил первое редактирование генома человека in vivo в форме самостоятельной терапии. [247] [248]
13 ноября ученые-медики, работающие с компанией Sangamo Therapeutics , головной офис которой находится в Ричмонде, Калифорния , объявили о первой в истории терапии редактирования генов внутри тела человека . [249] [250] Лечение, разработанное для постоянной вставки здоровой версии дефектного гена, вызывающего синдром Хантера , было проведено 44-летнему Брайану Маде и является частью первого в мире исследования по постоянному редактированию ДНК внутри тела человека. [251] Успешность вставки гена была позже подтверждена. [252] [253] Клинические испытания, проводимые компанией Sangamo с использованием редактирования генов с использованием нуклеазы цинковых пальцев (ZFN), продолжаются. [254]
В декабре были опубликованы результаты использования аденоассоциированного вируса с фактором свертывания крови VIII для лечения девяти пациентов с гемофилией А. У шести из семи пациентов, получавших высокодозный режим, уровень фактора свертывания крови VIII повысился до нормального уровня. Режимы с низкой и средней дозами не оказали никакого влияния на уровень свертывания крови у пациентов. [255] [256]
В декабре FDA одобрило воретиген непарвовец , первую генную терапию in vivo , для лечения слепоты, вызванной врожденным амаврозом Лебера . [257] Стоимость этого лечения составляет 850 000 долларов США за оба глаза. [258] [259]
2019
В мае FDA одобрило препарат онасемноген абепарвовец (Золгенсма) для лечения спинальной мышечной атрофии у детей младше двух лет. Цена на Золгенсма была установлена в размере 2,125 млн долларов США за дозу, что сделало его самым дорогим препаратом в истории. [260]
В мае EMA одобрило бетабеглогенный аутотемцел (Zynteglo) для лечения бета-талассемии у людей в возрасте двенадцати лет и старше. [261] [262]
В июле компании Allergan и Editas Medicine объявили о проведении клинического испытания фазы I/II препарата AGN-151587 для лечения врожденного амавроза Лебера 10. [263] Это одно из первых исследований терапии редактирования генов человека in vivo на основе CRISPR , где редактирование происходит внутри организма человека. [264] Первая инъекция системы CRISPR-Cas была подтверждена в марте 2020 года. [265]
Exagamglogene autotemcel , терапия редактирования генов человека на основе CRISPR , использовалась для лечения серповидноклеточной анемии и талассемии в клинических испытаниях. [266]
2020-е годы
2020
В мае онасемноген абепарвовец (Золгенсма) был одобрен Европейским союзом для лечения спинальной мышечной атрофии у людей, которые либо имеют клинические симптомы СМА типа 1, либо имеют не более трех копий гена SMN2 , независимо от массы тела или возраста. [267]
В августе Audentes Therapeutics сообщила, что трое из 17 детей с Х-сцепленной миотубулярной миопатией, участвовавших в клиническом испытании генной терапии на основе AAV8 AT132, умерли. Было высказано предположение, что лечение, дозировка которого основана на массе тела, оказывает непропорционально токсическое воздействие на более тяжелых пациентов, поскольку трое умерших пациентов были тяжелее остальных. [268] [269] Испытание было приостановлено на клиническом этапе. [270]
15 октября Комитет по лекарственным препаратам для человека (CHMP) Европейского агентства по лекарственным средствам (EMA) принял положительное заключение, рекомендовав выдать разрешение на продажу лекарственного препарата Libmeldy (аутологичная популяция, обогащенная клетками CD34+, которая содержит гемопоэтические стволовые и прогениторные клетки, трансдуцированные ex vivo с использованием лентивирусного вектора, кодирующего ген человеческой арилсульфатазы A), генная терапия для лечения детей с «поздней инфантильной» (LI) или «ранней ювенильной» (EJ) формами метахроматической лейкодистрофии (MLD). [271] Действующее вещество Libmeldy состоит из собственных стволовых клеток ребенка, которые были модифицированы для содержания рабочих копий гена ARSA. [271] Когда модифицированные клетки вводятся обратно пациенту в виде одноразовой инфузии, ожидается, что клетки начнут вырабатывать фермент ARSA, который разрушает накопление сульфатидов в нервных клетках и других клетках организма пациента. [272] Libmeldy был одобрен для медицинского применения в ЕС в декабре 2020 года. [273]
15 октября французская биотехнологическая компания Lysogene сообщила о смерти пациента, которому был назначен препарат LYS-SAF302 — экспериментальное генное терапевтическое лечение мукополисахаридоза типа IIIA (синдром Санфилиппо типа A). [274]
2021
В мае сообщалось о новом методе с использованием измененной версии ВИЧ в качестве лентивирусного вектора при лечении 50 детей с ADA-SCID , в результате чего у 48 из них были получены положительные результаты [275] [276] [277]. Ожидается, что этот метод будет безопаснее, чем векторы ретровирусов , обычно используемые в предыдущих исследованиях SCID, где обычно наблюдалось развитие лейкемии [278] , и уже использовался в 2019 году, но в меньшей группе с X-SCID. [279] [280] [281] [282]
В июне клиническое исследование на шести пациентах, страдающих транстиретиновым амилоидозом, показало снижение концентрации неправильно свернутого белка транстретина (TTR) в сыворотке крови посредством инактивации гена TTR на основе CRISPR в клетках печени, при этом наблюдалось среднее снижение на 52% и 87% в группах с более низкой и более высокой дозой. Это было сделано in vivo без изъятия клеток у пациента для их редактирования и последующей реинфузии. [283] [284] [285]
В июле были опубликованы результаты небольшого исследования фазы I генной терапии , в котором сообщалось о наблюдении за восстановлением дофамина у семи пациентов в возрасте от 4 до 9 лет, страдающих дефицитом декарбоксилазы ароматических L-аминокислот (дефицит AADC). [286] [287] [288]
2022
В феврале было объявлено о первой в истории генной терапии болезни Тея-Сакса , которая использует аденоассоциированный вирус для доставки правильной инструкции для гена HEXA на клетки мозга, вызывающие заболевание. Только двое детей были частью сострадательного испытания, показавшего улучшения по сравнению с естественным течением болезни и отсутствие побочных эффектов, связанных с вектором . [289] [290] [291]
В мае эладокаген экзупарвовец рекомендован к одобрению Европейской комиссией. [292] [293]
В июле были объявлены результаты кандидата на генную терапию гемофилии B под названием FLT180, который работает с использованием аденоассоциированного вируса (AAV) для восстановления белка фактора свертывания крови IX (FIX); нормальные уровни белка наблюдались при низких дозах терапии, но для снижения риска иммунных реакций, связанных с вектором, потребовалась иммуносупрессия. [294] [295] [296]
В декабре 13-летняя девочка, у которой был диагностирован острый лимфобластный лейкоз Т-клеток, была успешно вылечена в больнице Грейт-Ормонд-стрит (GOSH) в первом задокументированном случае использования терапевтического редактирования генов для этой цели, после шести месяцев экспериментального лечения, когда все попытки других методов лечения потерпели неудачу. Процедура включала перепрограммирование здоровой Т-клетки для уничтожения раковых Т-клеток, чтобы сначала избавить ее от лейкемии, а затем восстановить ее иммунную систему с использованием здоровых иммунных клеток. [297] Команда GOSH использовала редактирование BASE и ранее лечила случай острого лимфобластного лейкоза в 2015 году с помощью TALEN . [235]
2023
В мае 2023 года FDA одобрило препарат беремаген геперпавек для лечения ран у людей с дистрофическим буллезным эпидермолизом (DEB), который применяется в виде местного геля, который доставляет вектор вируса простого герпеса типа 1 (HSV-1), кодирующий ген цепи коллагена типа VII альфа 1 ( COL7A1 ), который дисфункционален у людей, страдающих DEB. В одном исследовании было обнаружено, что 65% ран, обработанных Vyjuvek, полностью закрылись, в то время как только 26% ран, обработанных плацебо, закрылись через 24 недели. [97] Также сообщалось о его использовании в качестве глазных капель для пациента с DEB, у которого была потеря зрения из-за обширного образования волдырей, с хорошими результатами. [298]
В июне 2023 года FDA выдало ускоренное одобрение препарата Элевидис для лечения мышечной дистрофии Дюшенна (МДД) только для мальчиков в возрасте от 4 до 5 лет, поскольку они с большей вероятностью получат пользу от терапии, которая заключается в однократной внутривенной инфузии вируса (вектор AAV rh74), который доставляет функционирующий ген «микродистрофина» (138 кДа ) в мышечные клетки, чтобы он действовал вместо нормального дистрофина (427 кДа), который мутирует при этом заболевании. [102]
В июле 2023 года было сообщено, что был разработан новый метод воздействия на экспрессию генов посредством постоянного тока. [299]
Список генных терапий
- Генная терапия при дальтонизме
- Генная терапия эпилепсии
- Генная терапия остеоартрита
- Генная терапия при болезни Паркинсона
- Генная терапия сетчатки человека
Ссылки
- ^ Kaji EH, Leiden JM (февраль 2001 г.). «Генная и клеточная терапия». JAMA . 285 (5): 545–550. doi : 10.1001/jama.285.5.545 . PMID 11176856.
- ^ Ермак Г (2015). Новые медицинские технологии . World Scientific. ISBN 978-981-4675-81-9.
- ^ «Что такое генная терапия?». Управление по контролю за продуктами и лекарствами США (FDA). 9 декабря 2020 г.
- ^ Rosenberg SA, Aebersold P, Cornetta K, Kasid A, Morgan RA, Moen R и др. (август 1990 г.). «Перенос генов в организм человека — иммунотерапия пациентов с запущенной меланомой с использованием инфильтрирующих опухоль лимфоцитов, модифицированных ретровирусной генной трансдукцией». The New England Journal of Medicine . 323 (9): 570–578. doi : 10.1056/NEJM199008303230904 . PMID 2381442.
- ^ ab "Gene Therapy Clinical Trials Worldwide Database". Журнал генной медицины . Wiley. Июнь 2016 г. Архивировано из оригинала 31 июля 2020 г.
- ^ Gorell E, Nguyen N, Lane A, Siprashvili Z (апрель 2014 г.). «Генная терапия кожных заболеваний». Cold Spring Harbor Perspectives in Medicine . 4 (4): a015149. doi :10.1101/cshperspect.a015149. PMC 3968787. PMID 24692191 .
- ^ Циммер С (16 сентября 2013 г.). «DNA Double Take» . The New York Times . Архивировано из оригинала 2 января 2022 г.
- ^ "Некролог Лоррейн Краус". The Commercial Appeal . Получено 7 июля 2023 г.
- ^ "Генная терапия". WhatIsBiotechnology.org . Фонд образования в области биотехнологий и медицины (Biotechmet) . Получено 7 июля 2023 г. .
- ^ Конгресс США, Управление по оценке технологий (декабрь 1984 г.). Генная терапия человека – справочный документ. DIANE Publishing. ISBN 978-1-4289-2371-3.
- ↑ Sun M (октябрь 1982 г.). «Мартин Клайн проигрывает апелляцию на грант NIH». Science . 218 (4567): 37. Bibcode :1982Sci...218...37S. doi :10.1126/science.7123214. PMID 7123214.
- ^ Lowenstein PR (2008). «Генная терапия неврологических расстройств: новые методы лечения или эксперименты на людях?». В Burley J, Harris J (ред.). Спутник генетики . John Wiley & Sons. ISBN 978-0-470-75637-9.
- ^ ab Sheridan C (февраль 2011 г.). «Генная терапия находит свою нишу». Nature Biotechnology . 29 (2): 121–128. doi :10.1038/nbt.1769. PMID 21301435. S2CID 5063701.
- ^ O'Malley BW, Ledley FD (октябрь 1993 г.). «Соматическая генная терапия. Методы настоящего и будущего». Arch Otolaryngol Head Neck Surg . 119 (10): 1100–7. doi :10.1001/archotol.1993.01880220044007. PMID 8398061.
- ^ Oldfield EH, Ram Z, Culver KW, Blaese RM, DeVroom HL, Anderson WF (февраль 1993 г.). «Генная терапия для лечения опухолей мозга с использованием внутриопухолевой трансдукции гена тимидинкиназы и внутривенного ганцикловира». Human Gene Therapy . 4 (1): 39–69. doi :10.1089/hum.1993.4.1-39. PMID 8384892.
- ^ abc Richards S (6 ноября 2012 г.). «Генная терапия приходит в Европу». The Scientist .
- ^ abcd Магуайр AM, Симонелли Ф., Пирс Э.А., Пью Э.Н., Мингоцци Ф., Бенничелли Дж. и др. (май 2008 г.). «Безопасность и эффективность переноса генов при врожденном амаврозе Лебера». Медицинский журнал Новой Англии . 358 (21): 2240–2248. doi : 10.1056/NEJMoa0802315. ПМЦ 2829748 . ПМИД 18441370.
- ^ ab Simonelli F, Maguire AM, Testa F, Pierce EA, Mingozzi F, Bennicelli JL и др. (март 2010 г.). «Генная терапия врожденного амавроза Лебера безопасна и эффективна в течение 1,5 лет после введения вектора». Molecular Therapy . 18 (3): 643–650. doi :10.1038/mt.2009.277. PMC 2839440 . PMID 19953081.
- ^ ab Cideciyan AV, Hauswirth WW, Aleman TS, Kaushal S, Schwartz SB, Boye SL, Windsor EA, Conlon TJ, Sumaroka A, Roman AJ, Byrne BJ, Jacobson SG (август 2009 г.). «Зрение через 1 год после генной терапии врожденного амавроза Лебера». The New England Journal of Medicine . 361 (7): 725–727. doi :10.1056/NEJMc0903652. PMC 2847775. PMID 19675341 .
- ^ ab Bainbridge JW, Smith AJ, Barker SS, Robbie S, Henderson R, Balaggan K, et al. (май 2008 г.). «Влияние генной терапии на зрительную функцию при врожденном амаврозе Лебера». The New England Journal of Medicine . 358 (21): 2231–2239. doi : 10.1056/NEJMoa0802268. hdl : 10261/271174 . PMID 18441371.
- ^ ab Ghosh P (28 апреля 2016 г.). «Генная терапия обращает вспять потерю зрения и имеет длительный эффект». BBC News Online . Получено 29 апреля 2016 г.
- ^ Фишер А., Хасейн-Бей-Абина С., Каваццана-Кальво М. (июнь 2010 г.). «20 лет генной терапии SCID». Nature Immunology . 11 (6): 457–460. doi :10.1038/ni0610-457. PMID 20485269. S2CID 11300348.
- ^ Ferrua F, Brigida I, Aiuti A (декабрь 2010 г.). «Обновление генной терапии тяжелого комбинированного иммунодефицита с дефицитом аденозиндезаминазы». Current Opinion in Allergy and Clinical Immunology . 10 (6): 551–556. doi :10.1097/ACI.0b013e32833fea85. PMID 20966749. S2CID 205435278.
- ^ abcde Geddes L (30 октября 2013 г.). «Успех 'Bubble kid' возвращает генную терапию на путь истинный». New Scientist . Получено 2 января 2022 г. .
- ^ Cartier N, Aubourg P (июль 2010 г.). «Трансплантация гемопоэтических стволовых клеток и генная терапия гемопоэтических стволовых клеток при Х-сцепленной адренолейкодистрофии». Brain Pathology . 20 (4): 857–862. doi :10.1111/j.1750-3639.2010.00394.x. PMC 8094635. PMID 20626747. S2CID 24182017 .
- ^ ab Ledford H (2011). «Клеточная терапия борется с лейкемией». Nature . doi :10.1038/news.2011.472.
- ^ ab Coghlan A (26 марта 2013 г.). «Генная терапия излечивает лейкемию за восемь дней». The New Scientist . Получено 15 апреля 2013 г.
- ^ ab Coghlan A (11 декабря 2013 г.). «Усиленные иммунные клетки вызывают ремиссию лейкемии». New Scientist . Получено 15 апреля 2013 г.
- ^ LeWitt PA, Rezai AR, Leehey MA, Ojemann SG, Flaherty AW, Eskandar EN и др. (апрель 2011 г.). «Генная терапия AAV2-GAD при прогрессирующей болезни Паркинсона: двойное слепое рандомизированное исследование с фиктивной хирургией». The Lancet. Neurology . 10 (4): 309–319. doi :10.1016/S1474-4422(11)70039-4. PMID 21419704. S2CID 37154043.
- ^ Herper M (26 марта 2014 г.). «Большое возвращение генной терапии». Forbes . Получено 28 апреля 2014 г.
- ^ ab Pearson S, Jia H, Kandachi K (январь 2004 г.). «Китай одобряет первую генную терапию». Nature Biotechnology . 22 (1): 3–4. doi :10.1038/nbt0104-3. PMC 7097065. PMID 14704685 .
- ^ ab "Одобрена генная терапия ЗПА". 6 декабря 2011 г. Получено 5 августа 2015 г.
- ^ abc Gallagher J (2 ноября 2012 г.). «Генная терапия: Glybera одобрена Европейской комиссией». BBC News . Получено 15 декабря 2012 г.
- ^ "Что такое генная терапия?". Genetics Home Reference . 28 марта 2016 г. Архивировано из оригинала 6 апреля 2016 г. Получено 2 января 2022 г.
- ^ "Как работает генная терапия?". Genomics Home Reference . Национальная медицинская библиотека США.
- ^ Pezzoli D, Chiesa R, De Nardo L, Candiani G (сентябрь 2012 г.). «Нам еще предстоит пройти долгий путь, чтобы эффективно доставлять гены!». Journal of Applied Biomaterials & Functional Materials . 10 (2): 82–91. doi :10.5301/JABFM.2012.9707. PMID 23015375. S2CID 6283455.
- ^ Ваннуччи Л., Лай М., Кьюппези Ф., Чеккерини-Нелли Л., Пистелло М. (январь 2013 г.). «Вирусные векторы: взгляд назад и вперед на технологию переноса генов». Новая микробиология . 36 (1): 1–22. ПМИД 23435812.
- ^ Gothelf A, Gehl J (ноябрь 2012 г.). «Что вам всегда нужно было знать о вакцинах ДНК, основанных на электропорации». Human Vaccines & Immunotherapeutics . 8 (11): 1694–1702. doi :10.4161/hv.22062. PMC 3601144. PMID 23111168 .
- ^ Urnov FD, Rebar EJ, Holmes MC, Zhang HS, Gregory PD (сентябрь 2010 г.). «Редактирование генома с помощью сконструированных нуклеаз цинковых пальцев». Nature Reviews Genetics . 11 (9): 636–646. doi :10.1038/nrg2842. PMID 20717154. S2CID 205484701.
- ^ ab Bak RO, Gomez-Ospina N, Porteus MH (август 2018 г.). «Редактирование генов в центре внимания». Trends in Genetics . 34 (8): 600–611. doi :10.1016/j.tig.2018.05.004. PMID 29908711. S2CID 49269023.
- ^ Stone D, Niyonzima N, Jerome KR (сентябрь 2016 г.). «Редактирование генома и следующее поколение противовирусной терапии». Human Genetics . 135 (9): 1071–82. doi :10.1007/s00439-016-1686-2. PMC 5002242 . PMID 27272125.
- ^ Cross D, Burmester JK (сентябрь 2006 г.). «Генная терапия для лечения рака: прошлое, настоящее и будущее». Clinical Medicine & Research . 4 (3): 218–27. doi :10.3121/cmr.4.3.218. PMC 1570487. PMID 16988102 .
- ^ Maeder ML, Gersbach CA (март 2016 г.). «Технологии редактирования генома для генной и клеточной терапии». Молекулярная терапия . 24 (3): 430–46. doi :10.1038/mt.2016.10. PMC 4786923. PMID 26755333 .
- ^ «Тесты показывают, что ученые достигли первого редактирования генов «внутри тела». AP NEWS . 7 февраля 2019 г. Получено 17 ноября 2020 г.
- ^ "Первая доза CRISPR-терапии". Nature Biotechnology . 38 (4): 382. 1 апреля 2020 г. doi : 10.1038/s41587-020-0493-4 . ISSN 1546-1696. PMID 32265555. S2CID 215406440.
- ^ ab Sherkow JS, Zettler PJ, Greely HT (декабрь 2018 г.). «Это „генная терапия“?». Journal of Law and the Biosciences . 5 (3): 786–793. doi :10.1093/jlb/lsy020. PMC 6534757. PMID 31143463 .
- ^ Asaleh A, Zhou J, Rahmanian N (ноябрь 2022 г.). «Письмо редактору: урок на будущее — как семантическая неоднозначность привела к распространению антинаучных взглядов на вакцины мРНК COVID-19». Human Gene Therapy . 33 (21–22): 1213–1216. doi :10.1089/hum.2022.29223.aas (неактивен 1 ноября 2024 г.). PMID 36375123.
{{cite journal}}: CS1 maint: DOI inactive as of November 2024 (link) - ^ "Эндрю Бриджен ошибался, называя мРНК-вакцины генной терапией". Полный факт . 12 января 2023 г. Получено 19 февраля 2023 г.
- ^ "Вакцины Fact Check-mRNA отличаются от генной терапии, которая изменяет гены реципиента". Reuters . 10 августа 2021 г. Получено 19 февраля 2023 г.
- ^ "Джо Роган ложно утверждает, что вакцины мРНК являются "генной терапией"". PolitiFact . Получено 19 февраля 2023 г.
- ^ Спенсер SH (28 июня 2022 г.). «Сайт распространяет старую, развенчанную ложь о вакцинах на основе мРНК от COVID-19». FactCheck.org . Получено 19 февраля 2023 г.
- ^ «Эти эксперты говорят, что Джо Роган «чрезвычайно опасен» для общества — вот почему». The Independent . 2 февраля 2022 г. . Получено 19 февраля 2023 г. .
- ^ «Ложные заявления депутата Эндрю Бриджена ставят жизни под угрозу». Полный факт . 11 января 2023 г. Получено 19 февраля 2023 г.
- ^ abcde Нобрега С, Мендонса Л, Матос Калифорния (2020). Справочник по генной и клеточной терапии. Чам: Спрингер. ISBN 978-3-030-41333-0. OCLC 1163431307.
- ^ Williams DA, Orkin SH (апрель 1986 г.). «Соматическая генная терапия. Текущее состояние и будущие перспективы». Журнал клинических исследований . 77 (4): 1053–6. doi :10.1172/JCI112403. PMC 424438. PMID 3514670 .
- ^ Mavilio F, Ferrari G (июль 2008 г.). «Генетическая модификация соматических стволовых клеток. Прогресс, проблемы и перспективы новой терапевтической технологии». EMBO Reports . 9 (Suppl 1): S64–69. doi :10.1038/embor.2008.81. PMC 3327547. PMID 18578029 .
- ^ abc "Международное право". Центр генетики и государственной политики, Институт биоэтики имени Бермана при Университете Джонса Хопкинса. 2010. Архивировано из оригинала 2 сентября 2014 года.
- ^ Strachnan T, Read AP (2004). Молекулярная генетика человека (3-е изд.). Garland Publishing. стр. 616. ISBN 978-0-8153-4184-0.
- ^ Ханна К (2006). «Передача генов зародышевой линии». Национальный институт исследований генома человека.
- ^ "Клонирование человека и генетическая модификация". Ассоциация должностных лиц репродуктивного здоровья. 2013. Архивировано из оригинала 18 июня 2013.
- ^ "Gene Therapy". ama-assn.org . 4 апреля 2014 г. Архивировано из оригинала 15 марта 2015 г. Получено 22 марта 2015 г.
- ^ "Часто задаваемые вопросы о генной и клеточной терапии | ASGCT - Американское общество генной и клеточной терапии | ASGCT - Американское общество генной и клеточной терапии". asgct.org . Получено 23 июля 2021 г. .
- ^ «Оценка клинического успеха генной терапии ex vivo и in vivo». Журнал молодых исследователей . Январь 2009 г. Получено 23 июля 2021 г.
- ^ "Проблемы генной терапии". learn.genetics.utah.edu . Получено 23 июля 2021 г. .
- ^ Mullard A (июнь 2020 г.). «Процесс редактирования генов набирает обороты». Nature Reviews. Drug Discovery . 19 (6): 367–372. doi :10.1038/d41573-020-00096-y. PMID 32415249. S2CID 218657910.
- ^ ab MacLaren RE, Groppe M, Barnard AR, Cottriall CL, Tolmachova T, Seymour L, Clark KR, During MJ, Cremers FP, Black GC, Lotery AJ, Downes SM, Webster AR, Seabra MC (март 2014 г.). «Генная терапия сетчатки у пациентов с хороидеремией: начальные результаты клинического исследования фазы 1/2». Lancet . 383 (9923): 1129–1137. doi :10.1016/S0140-6736(13)62117-0. PMC 4171740 . PMID 24439297.
- ^ Dever DP, Bak RO, Reinisch A, Camarena J, Washington G, Nicolas CE и др. (ноябрь 2016 г.). «Нацеливание гена β-глобина CRISPR/Cas9 на гемопоэтические стволовые клетки человека». Nature . 539 (7629): 384–389. Bibcode :2016Natur.539..384D. doi :10.1038/nature20134. PMC 5898607 . PMID 27820943.
- ^ Gupta RM, Musunuru K (октябрь 2014 г.). «Расширение набора инструментов генетического редактирования: ZFN, TALEN и CRISPR-Cas9». Журнал клинических исследований . 124 (10): 4154–61. doi :10.1172/JCI72992. PMC 4191047. PMID 25271723 .
- ^ Sanches-da-Silva GN, Medeiros LF, Lima FM (21 августа 2019 г.). «Потенциальное использование системы CRISPR-Cas для генной терапии ВИЧ-1». International Journal of Genomics . 2019 : 8458263. doi : 10.1155/2019/8458263 . PMC 6721108. PMID 31531340.
- ^ Патент: US7824869B2
- ^ Bi A, Cui J, Ma YP, Olshevskaya E, Pu M, Dizhoor AM, Pan ZH (апрель 2006 г.). «Эктопическая экспрессия родопсина микробного типа восстанавливает зрительные реакции у мышей с дегенерацией фоторецепторов». Neuron . 50 (1): 23–33. doi : 10.1016/j.neuron.2006.02.026 . PMC 1459045 . PMID 16600853.
- ^ ab Song, Xiangrong; Liu, Chao; Wang, Ning; Huang, Hai; He, Siyan; Gong, Changyang; Wei, Yuquan (1 января 2021 г.). «Доставка систем CRISPR/Cas для генной терапии рака и иммунотерапии». Advanced Drug Delivery Reviews . Доставка биомакромолекул для терапевтического редактирования генома. 168 : 158–180. doi :10.1016/j.addr.2020.04.010. ISSN 0169-409X. PMID 32360576. S2CID 218493473.
- ^ Nayerossadat N, Maedeh T, Ali PA (2012). «Вирусные и невирусные системы доставки для доставки генов». Advanced Biomedical Research . 1 (1): 27. doi : 10.4103/2277-9175.98152 . PMC 3507026. PMID 23210086 .
- ^ abcdef Ginn SL, Amaya AK, Alexander IE, Edelstein M, Abedi MR (май 2018 г.). «Клинические испытания генной терапии во всем мире до 2017 г.: обновление». Журнал генной медицины . 20 (5): e3015. doi : 10.1002/jgm.3015 . PMID 29575374. S2CID 4966300.
- ^ ab Bulcha JT, Wang Y, Ma H, Tai PW, Gao G (февраль 2021 г.). «Платформы вирусных векторов в ландшафте генной терапии». Signal Transduction and Targeted Therapy . 6 (1): 53. doi :10.1038/s41392-021-00487-6. PMC 7868676. PMID 33558455 .
- ^ Йенсен, Томас Лет; Гётше, Каспер Рене; Уолдбай, Дэвид PD (2021). «Текущие и будущие перспективы генной терапии редких генетических заболеваний, поражающих мозг и спинной мозг». Frontiers in Molecular Neuroscience . 14 : 695937. doi : 10.3389/fnmol.2021.695937 . ISSN 1662-5099. PMC 8527017. PMID 34690692 .
- ^ Manini A, Abati E, Nuredini A, Corti S, Comi GP (2022). «Генная терапия, опосредованная аденоассоциированным вирусом (AAV) при мышечной дистрофии Дюшенна: проблема персистенции трансгенов». Frontiers in Neurology . 12 : 814174. doi : 10.3389/fneur.2021.814174 . PMC 8797140. PMID 35095747 .
- ^ abc Sabatino DE, Bushman FD, Chandler RJ, Crystal RG, Davidson BL, Dolmetsch R и др. (август 2022 г.). «Оценка состояния науки об интеграции аденоассоциированных вирусов: комплексная перспектива». Молекулярная терапия . 30 (8): 2646–2663. doi :10.1016/j.ymthe.2022.06.004. PMC 9372310. PMID 35690906 .
- ^ Кампокьяро, Пенсильвания; Эйвери, Р.; Браун, DM; Хейер, Дж. С.; Хо, AC; Хаддлстон, С.М.; Яффе, Дж.Дж.; Ханани, AM; Пакола, С.; Пьерамичи, диджей; Вайкофф, CC; Ван Эверен, С. (2024). «Генная терапия неоваскулярной возрастной макулярной дегенерации путем субретинальной доставки RGX-314: исследование фазы 1/2а с увеличением дозы». Ланцет . 403 (10436): 1563–1573. дои : 10.1016/S0140-6736(24)00310-6. ПМИД 38554726.
- ^ Ханани, AM; Бойер, DS; Вайкофф, CC; Регилло, CD; Басби, BG; Пиерамичи, D.; Данциг, CJ; Джундеф, BC; Мейджор-младший, JC; Турпку, A.; Кисс, S. (2024). «Безопасность и эффективность иксоберогена соропарвовека при неоваскулярной возрастной макулярной дегенерации в Соединенных Штатах (OPTIC): проспективное двухлетнее многоцентровое исследование фазы 1». eClinicalMedicine . 67 . doi :10.1016/j.eclinm.2023.102394. PMC 10751837 . PMID 38152412.
- ^ Yin H, Kanasty RL, Eltoukhy AA, Vegas AJ, Dorkin JR, Anderson DG (август 2014 г.). «Невирусные векторы для генной терапии». Nature Reviews. Genetics . 15 (8): 541–555. doi :10.1038/nrg3763. PMID 25022906. S2CID 15273455.
- ^ Красильникова, О.; Якимова, А.; Иванов, С.; Атиакшин, Д.; Костин, А.А.; Сосин, Д.; Шегай, П.; Каприн, АД; Клабуков, И. (2023). «Генно-активированные материалы в регенеративной стоматологии: обзор технологий и результатов исследований». International Journal of Molecular Sciences . 24 (22): 16250. doi : 10.3390/ijms242216250 . ISSN 1422-0067. PMC 10671237 . PMID 38003439.
- ^ Фолдвари, М.; Чен, Д. В.; Нафисси, Н.; Кальдерон, Д.; Нарсинени, Л.; Рафи, А. (2016). «Невирусная генная терапия: достижения и проблемы неинвазивных методов введения». Журнал контролируемого выпуска . 240 : 165–190. doi : 10.1016/j.jconrel.2015.12.012. ISSN 1873-4995. PMID 26686079.
- ^ Bertrand N, Grenier P, Mahmoudi M, Lima EM, Appel EA, Dormont F и др. (октябрь 2017 г.). «Механистическое понимание образования короны белка in vivo на полимерных наночастицах и влияние на фармакокинетику». Nature Communications . 8 (1): 777. Bibcode :2017NatCo...8..777B. doi :10.1038/s41467-017-00600-w. PMC 5626760 . PMID 28974673.
- ^ abc Goswami R, Subramanian G, Silayeva L, Newkirk I, Doctor D, Chawla K и др. (24 апреля 2019 г.). «Генная терапия оставляет порочный круг». Frontiers in Oncology . 9 : 297. doi : 10.3389/fonc.2019.00297 . PMC 6491712. PMID 31069169 .
- ^ Вирт Т., Паркер Н., Юля-Херттуала С. (август 2013 г.). «История генной терапии». Джин . 525 (2): 162–169. дои : 10.1016/j.gene.2013.03.137. ПМИД 23618815.
- ^ Сингх В., Хан Н., Джайандхаран ГР. (май 2022 г.). «Векторная инженерия, стратегии и цели в генной терапии рака». Генная терапия рака . 29 (5): 402–417. doi :10.1038/s41417-021-00331-7. PMID 33859378. S2CID 233258994.
- ^ Anguela XM, High KA (январь 2019 г.). «Вход в современную эру генной терапии». Annual Review of Medicine . 70 (1): 273–288. doi : 10.1146/annurev-med-012017-043332 . PMID 30477394. S2CID 53750215.
- ^ Ван И, Чжан Р, Тан Л, Ян Л (февраль 2022 г.). «Невирусные системы доставки мРНК-вакцин для генной терапии рака». Фармацевтика . 14 (3): 512. doi : 10.3390/pharmaceutics14030512 . PMC 8949480. PMID 35335891.
- ^ ab "FDA выдало ускоренное одобрение на afamitresgene autoleucel для неоперабельной или метастатической синовиальной саркомы". Управление по контролю за продуктами и лекарствами США (FDA) . 2 августа 2024 г. Получено 19 сентября 2024 г.
 В данной статье использован текст из этого источника, находящегося в общественном достоянии .
В данной статье использован текст из этого источника, находящегося в общественном достоянии . - ^ "FDA одобряет первую генную терапию рецепторов Т-клеток для солидных опухолей". AABB News & Resources . 6 августа 2024 г. Получено 19 сентября 2024 г.
- ^ Monga I, Qureshi A, Thakur N, Gupta AK, Kumar M (сентябрь 2017 г.). «ASPsiRNA: ресурс ASP-siRNA, имеющий терапевтический потенциал для генетических заболеваний человека, и алгоритм прогнозирования их ингибирующей эффективности». G3 . 7 (9): 2931–2943. doi : 10.1534/g3.117.044024 . PMC 5592921 . PMID 28696921.
- ^ ab Olowoyeye A, Okwundu CI (ноябрь 2020 г.). "Генная терапия серповидноклеточной анемии". База данных систематических обзоров Cochrane . 2020 (11): CD007652. doi :10.1002/14651858.CD007652.pub7. PMC 8275984. PMID 33251574 .
- ^ Чен В., Ху Ю, Цзюй Д. (август 2020 г.). «Генная терапия нейродегенеративных заболеваний: достижения, идеи и перспективы». Акта Фармасьютика Синика Б. 10 (8): 1347–1359. дои : 10.1016/j.apsb.2020.01.015. ПМЦ 7488363 . ПМИД 32963936.
- ^ «FDA одобряет первую генную терапию для детей с метахроматической лейкодистрофией». Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 9 августа 2024 г.
- ^ "Orchard Therapeutics получает одобрение ЕС на препарат Libmeldy для лечения ранней метахроматической лейкодистрофии (MLD)" (пресс-релиз). Orchard Therapeutics. 21 декабря 2020 г. Получено 23 июля 2021 г. – через GlobeNewswire.
- ^ ab "FDA одобряет первую местную генную терапию для лечения ран у пациентов с дистрофическим буллезным эпидермолизом". Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 19 мая 2023 г. Получено 31 июля 2023 г.
- ^ "FDA одобряет первую клеточную генную терапию для лечения взрослых и детей с бета-талассемией, которым требуются регулярные переливания крови". Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 17 августа 2022 г. Получено 31 августа 2022 г.
- ^ "FDA одобряет первую клеточную генную терапию для взрослых пациентов с рецидивирующим или рефрактерным MCL". Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 24 июля 2020 г. Получено 24 июля 2020 г.
- ^ "FDA одобряет брексукабтаген аутолейцель для рецидивирующего или рефрактерного острого лимфобластного лейкоза из предшественников В-клеток". Управление по контролю за продуктами и лекарствами США (FDA) . 1 октября 2021 г. Получено 2 октября 2021 г.
- ^ "Tecartus". Европейское агентство по лекарственным средствам . 13 октября 2020 г.
- ^ ab "FDA одобряет первую генную терапию для лечения некоторых пациентов с мышечной дистрофией Дюшенна". Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 23 июня 2023 г. Получено 12 июля 2023 г.
- ^ "Casgevy". Управление по контролю за продуктами и лекарствами США (FDA) . 8 декабря 2023 г. Получено 8 декабря 2023 г.
- ^ "Abecma (idecabtagene vicleucel)". Управление по контролю за продуктами и лекарствами США (FDA). 21 апреля 2021 г.
- ^ "Breyanzi (лизокабтаген маралейцел)". Управление по контролю за продуктами и лекарствами США (FDA). 4 марта 2021 г.
- ^ "Lyfgenia". Управление по контролю за продуктами и лекарствами США (FDA) . 8 декабря 2023 г. Архивировано из оригинала 8 декабря 2023 г. Получено 9 декабря 2023 г.
- ^ "FDA одобряет первую генную терапию для лечения рака мочевого пузыря с высоким риском, неинвазивного с мышечной тканью". Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 16 декабря 2022 г. Получено 16 декабря 2022 г.
- ^ "FDA одобряет obecabtagene autoleucel для лечения острого лимфобластного лейкоза". Управление по контролю за продуктами и лекарствами США (FDA) . 8 ноября 2024 г. Получено 10 ноября 2024 г.
 В данной статье использован текст из этого источника, находящегося в общественном достоянии .
В данной статье использован текст из этого источника, находящегося в общественном достоянии . - ^ "Autolus Therapeutics объявляет об одобрении FDA препарата Aucatzyl (obecabtagene autoleucel – obe-cel) для взрослых с рецидивирующим/рефрактерным острым лимфобластным лейкозом B-клеток (r/r B-ALL)" (пресс-релиз). Autolus Therapeutics. 8 ноября 2024 г. Получено 10 ноября 2024 г. – через GlobeNewswire.
- ^ "Золгенсма". Управление по контролю за продуктами и лекарствами США (FDA). 16 марта 2021 г.
- ^ "EMA-approved application for Zolgensma". Aetion (пресс-релиз) . Получено 23 июля 2021 г.
- ^ "FDA одобряет T-VEC для лечения метастатической меланомы". Национальный институт рака . 25 ноября 2015 г. Получено 23 июля 2021 г.
- ^ "Imlygic". Европейское агентство по лекарственным средствам (EMA) . 17 сентября 2018 г.
- ^ "Первая генная терапия для лечения тяжелой гемофилии А". Европейское агентство по лекарственным средствам (EMA) (пресс-релиз). 24 июня 2022 г. Архивировано из оригинала 26 июня 2022 г. Получено 26 июня 2022 г.
- ^ "Roctavian: Pending EC decision". Европейское агентство по лекарственным средствам (EMA) . 23 июня 2022 г. Архивировано из оригинала 26 июня 2022 г. Получено 26 июня 2022 г.
- ^ "Роктавиан". Единый реестр лекарственных средств . 25 августа 2022 г. Получено 6 сентября 2022 г.
- ^ «FDA одобряет новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения». Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 24 марта 2020 г. Получено 23 июля 2021 г.
- ^ "Luxturna". Европейское агентство по лекарственным средствам (EMA) . 24 сентября 2018 г.
- ^ Го, Конгтин; Ма, Сяотэн; Гао, Фэй; Го, Юйсюань (9 марта 2023 г.). «Внецелевые эффекты при редактировании генов CRISPR/Cas9». Frontiers in Bioengineering and Biotechnology . 11 : 1143157. doi : 10.3389/fbioe.2023.1143157 . ISSN 2296-4185. PMC 10034092. PMID 36970624 .
- ^ У, Шао-Шуай; Ли, Цин-Цуй; Инь, Чан-Цин; Сюэ, Вэнь; Сун, Чунь-Цин (15 марта 2020 г.). «Достижения в генной терапии на основе CRISPR/Cas при генетических заболеваниях человека». Theranostics . 10 (10): 4374–4382. doi :10.7150/thno.43360. ISSN 1838-7640. PMC 7150498 . PMID 32292501.
- ^ Кортхоф Г. «Значение обратной связи Стила от сомы к зародышевой линии для генной терапии человека».
- ^ Woods NB, Bottero V, Schmidt M, von Kalle C, Verma IM (апрель 2006 г.). «Генная терапия: терапевтический ген, вызывающий лимфому». Nature . 440 (7088): 1123. Bibcode :2006Natur.440.1123W. doi : 10.1038/4401123a . PMID 16641981. S2CID 4372110.
- ^ Thrasher AJ, Gaspar HB, Baum C, Modlich U, Schambach A, Candotti F, et al. (сентябрь 2006 г.). "Генная терапия: лейкемогенность трансгена X-SCID". Nature . 443 (7109): E5-6, обсуждение E6-7. Bibcode :2006Natur.443E...5T. doi :10.1038/nature05219. PMID 16988659. S2CID 4301764.
- ^ Бак РО, Портеус МХ (июль 2017 г.). «CRISPR-опосредованная интеграция больших генных кассет с использованием донорских векторов AAV». Cell Reports . 20 (3): 750–756. doi :10.1016/j.celrep.2017.06.064. PMC 5568673. PMID 28723575 .
- ^ Rojahn SY (11 февраля 2014 г.). «Геномная хирургия». MIT Technology Review . Архивировано из оригинала 15 февраля 2014 г. Получено 17 февраля 2014 г.
- ^ «Генной терапии нужен герой, чтобы оправдать шумиху». New Scientist . 30 октября 2013 г. Получено 2 января 2022 г.
- ^ Crasto AM (7 июля 2013 г.). «Glybera – самый дорогой препарат в мире и первая одобренная генная терапия на Западе». All About Drugs . Получено 2 ноября 2013 г.
- ^ "Gene Therapy". Национальная лаборатория Оук-Ридж . 20 декабря 2012 г. Архивировано из оригинала 20 декабря 2012 г. Получено 2 января 2022 г.
- ^ Raper SE, Chirmule N, Lee FS, Wivel NA, Bagg A, Gao GP и др. (сентябрь 2003 г.). «Синдром фатальной системной воспалительной реакции у пациента с дефицитом орнитинтранскарбамилазы после переноса аденовирусного гена». Молекулярная генетика и метаболизм . 80 (1–2): 148–58. doi :10.1016/j.ymgme.2003.08.016. PMID 14567964.
- ^ Frank KM, Hogarth DK, Miller JL, Mandal S, Mease PJ, Samulski RJ и др. (Июль 2009 г.). «Исследование причины смерти в исследовании генной терапии». The New England Journal of Medicine . 361 (2): 161–9. doi : 10.1056/NEJMoa0801066 . PMID 19587341.
- ^ Комитет по этике HUGO (апрель 2001 г.). "Заявление об исследованиях генной терапии" (PDF) . Human Genome Organization . Архивировано из оригинала (PDF) 7 сентября 2008 г.
- ^ Isasi RM, Nguyen TM, Knoppers BM (октябрь 2006 г.). "Национальные нормативно-правовые базы в отношении технологий генетической модификации человека (соматическая и зародышевая модификация)" (PDF) . Genetics & Public Policy Center. Архивировано из оригинала (PDF) 17 сентября 2014 г.
- ^ "Главная - Реестр генетического тестирования NIH (GTR) - NCBI". www.ncbi.nlm.nih.gov . Получено 2 мая 2022 г. .
- ^ ab "Руководство NIH по исследованиям с использованием рекомбинантных или синтетических молекул нуклеиновых кислот". Национальные институты здравоохранения США . Апрель 2016 г. Архивировано из оригинала 28 мая 2016 г.
- ^ «Прочитайте отчет Белмонта». HHS.gov . 15 января 2018 г. Получено 2 января 2022 г.
- ^ Управление по контролю за продуктами и лекарствами США (14 октября 1993 г.). «Применение действующих законодательных полномочий к продуктам соматической клеточной терапии и продуктам генной терапии» (PDF) . Федеральный реестр . 58 (197). Архивировано (PDF) из оригинала 21 июня 2009 г.
- ^ «Руководство для промышленности: Руководство по терапии соматическими клетками человека и генной терапии». Управление по контролю за продуктами и лекарствами США (FDA) . 9 июля 2009 г. Архивировано из оригинала 9 июля 2009 г. Получено 2 января 2022 г.
- ^ "WADA Gene Doping". WADA. Архивировано из оригинала 21 ноября 2009 года . Получено 27 сентября 2013 года .
- ^ Kayser B, Mauron A, Miah A (март 2007 г.). «Текущая антидопинговая политика: критическая оценка». BMC Medical Ethics . 8 : 2. doi : 10.1186 /1472-6939-8-2 . PMC 1851967. PMID 17394662.
- ^ Powell R, Buchanan A (февраль 2011 г.). «Разрыв цепей эволюции: перспектива преднамеренной генетической модификации у людей». Журнал медицины и философии . 36 (1): 6–27. doi :10.1093/jmp/jhq057. PMID 21228084.
- ^ Бейлис Ф., Роберт Дж. С. (2004). «Неизбежность технологий генетического улучшения». Биоэтика . 18 (1): 1–26. doi :10.1111/j.1467-8519.2004.00376.x. PMID 15168695.
- ^ Эванс Дж. (2002). Игра в Бога?: Генетическая инженерия человека и рационализация публичных биоэтических дебатов . Издательство Чикагского университета. ISBN 978-0-226-22262-2.
- ^ "Центр этики здравоохранения - Медицинский факультет Университета Миссури - Генная терапия и генная инженерия". ethics.missouri.edu . 3 декабря 2013 г. Архивировано из оригинала 3 декабря 2013 г. Получено 2 января 2022 г.
- ^ Roco MC, Bainbridge WS (2002). «Конвергентные технологии для улучшения производительности человека: интеграция из наномасштаба». Журнал исследований наночастиц . 4 (4): 281–295. Bibcode : 2002JNR.....4..281R. doi : 10.1023/A:1021152023349. S2CID 136290217.
- ^ Allhoff F (март 2005 г.). «Генетическое улучшение зародышевой линии и первичные товары Ролза» (PDF) . Журнал Института этики Кеннеди . 15 (1): 39–56. CiteSeerX 10.1.1.566.171 . doi :10.1353/ken.2005.0007. PMID 15881795. S2CID 14432440. Архивировано (PDF) из оригинала 30 января 2012 г.
- ^ Раниш Р. (январь 2020 г.). «Специальный выпуск: редактирование зародышевой линии человека». Биоэтика . 34 (1): 1–143.
- ^ «Этические вопросы, связанные с пренатальным генетическим тестированием. Совет по этическим и юридическим вопросам, Американская медицинская ассоциация». Архивы семейной медицины . 3 (7): 633–642. Июль 1994. doi :10.1001/archfami.3.7.633. PMID 7921302.
- ^ "Декларация Инуямы: картирование генома человека, генетический скрининг и генная терапия". Совет международных организаций медицинских наук . Архивировано из оригинала 5 августа 2001 г.
- ^ Смит КР, Чан С, Харрис Дж (октябрь 2012 г.). «Генетическая модификация зародышевой линии человека: научные и биоэтические перспективы». Архив медицинских исследований . 43 (7): 491–513. doi :10.1016/j.arcmed.2012.09.003. PMID 23072719.
- ^ Рирдон С. (14 февраля 2017 г.). «Американские научные советники намечают путь к генетически модифицированным младенцам». Nature . doi : 10.1038/nature.2017.21474 .
- ^ ab Wade N (19 марта 2015 г.). «Ученые добиваются запрета метода редактирования генома человека» . The New York Times . Архивировано из оригинала 2 января 2022 г. Получено 20 марта 2015 г.
- ^ ab Pollack A (3 марта 2015 г.). "Мощный новый способ редактирования ДНК" . The New York Times . Архивировано из оригинала 2 января 2022 г. Получено 20 марта 2015 г.
- ^ ab Baltimore D, Berg P, Botchan M, Carroll D, Charo RA, Church G и др. (апрель 2015 г.). «Биотехнология. Благоразумный путь вперед для геномной инженерии и модификации генов зародышевой линии». Science . 348 (6230): 36–38. Bibcode :2015Sci...348...36B. doi :10.1126/science.aab1028. PMC 4394183 . PMID 25791083.
- ^ ab Lanphier E, Urnov F, Haecker SE, Werner M, Smolenski J (март 2015 г.). «Не редактируйте зародышевую линию человека». Nature . 519 (7544): 410–411. Bibcode :2015Natur.519..410L. doi : 10.1038/519410a . PMID 25810189.
- ^ Liang P, Xu Y, Zhang X, Ding C, Huang R, Zhang Z и др. (май 2015 г.). «Редактирование генов с помощью CRISPR/Cas9 в трехъядерных зиготах человека». Protein & Cell . 6 (5): 363–372. doi :10.1007/s13238-015-0153-5. PMC 4417674 . PMID 25894090.
- ^ Kolata G (23 апреля 2015 г.). «Китайские ученые редактируют гены человеческих эмбрионов, вызывая обеспокоенность» . The New York Times . Архивировано из оригинала 2 января 2022 г. Получено 24 апреля 2015 г.
- ^ Harmon A (14 февраля 2017 г.). «Human Gene Editing Receives Science Panel's Support» . The New York Times . ISSN 0362-4331. Архивировано из оригинала 2 января 2022 г. . Получено 17 февраля 2017 г. .
- ^ Комитет по редактированию генов человека: научные, медицинские и этические соображения. «Редактирование генома человека: наука, этика и управление». nationalacademies.org . Национальная академия наук; Национальная академия медицины . Получено 21 февраля 2017 г.
- ^ «Ученые одобряют генную инженерию младенцев». New York Post . Reuters. 14 февраля 2017 г. Получено 17 февраля 2017 г.
- ^ Фридман Т., Роблин Р. (март 1972 г.). «Генная терапия генетических заболеваний человека?». Science . 175 (4025): 949–955. Bibcode :1972Sci...175..949F. doi :10.1126/science.175.4025.949. PMID 5061866. S2CID 19952096.
- ^ Роджерс С., New Scientist 1970, стр. 194
- ^ Cepko CL, Roberts BE, Mulligan RC (июль 1984 г.). «Конструирование и применение высокотрансмиссивного мышиного ретровирусного челночного вектора. Этот вектор используется для проникновения в клетку в организме человека». Cell . 37 (3): 1053–1062. doi :10.1016/0092-8674(84)90440-9. PMID 6331674. S2CID 34544709.
- ^ "Первая генная терапия". Life Sciences Foundation. 21 июня 2011 г. Архивировано из оригинала 28 ноября 2012 г. Получено 7 января 2014 г.
- ^ Blaese RM, Culver KW, Miller AD, Carter CS, Fleisher T, Clerici M и др. (октябрь 1995 г.). «Т-лимфоцит-направленная генная терапия для ADA-SCID: начальные результаты испытаний после 4 лет». Science . 270 (5235): 475–480. Bibcode :1995Sci...270..475B. doi :10.1126/science.270.5235.475. PMID 7570001. S2CID 46339645.
- ^ Trojan J, Johnson TR, Rudin SD, Ilan J, Tykocinski ML, Ilan J (январь 1993 г.). «Лечение и профилактика глиобластомы крыс иммуногенными клетками C6, экспрессирующими антисмысловую РНК инсулиноподобного фактора роста I». Science . 259 (5091): 94–97. Bibcode :1993Sci...259...94T. doi :10.1126/science.8418502. PMID 8418502.
- ^ ab Trojan J, Pan YX, Wei MX, Ly A, Shevelev A, Bierwagen M и др. (2012). «Методология терапии злокачественных опухолей с использованием антигена и IGF-I». Chemotherapy Research and Practice . 2012 : 1–12. doi : 10.1155/2012/721873 . PMC 3287029. PMID 22400112 .
- ^ Эбботт А. (апрель 1992 г.). «Генная терапия. Итальянцы первыми использовали стволовые клетки». Nature . 356 (6369): 465. Bibcode :1992Natur.356..465A. doi : 10.1038/356465a0 . PMID 1560817. S2CID 4319842.
- ^ Cavazzana-Calvo M, Thrasher A, Mavilio F (февраль 2004 г.). «Будущее генной терапии». Nature . 427 (6977): 779–781. Bibcode :2004Natur.427..779C. doi :10.1038/427779a. PMID 14985734. S2CID 4421364.
- ^ Blakeslee S (18 мая 1993 г.). «Лечение болезни «мальчика в пузыре»». The New York Times . ISSN 0362-4331 . Получено 9 февраля 2018 г.
- ^ Нальдини, Луиджи; Блёмер, Ульрике; Галлай, Филипп; Ори, Дэниел; Маллиган, Ричард; Гейдж, Фред Х.; Верма, Индер М.; Троно, Дидье (12 апреля 1996 г.). «Доставка генов in vivo и стабильная трансдукция неделящихся клеток лентивирусным вектором». Наука . 272 (5259): 263–267. Бибкод : 1996Sci...272..263N. дои : 10.1126/science.272.5259.263. ISSN 0036-8075. PMID 8602510. S2CID 18997464.
- ^ Stein R (11 октября 2010 г.). «Первый пациент, прошедший лечение в исследовании стволовых клеток». The Washington Post . Получено 10 ноября 2010 г.
- ^ «Смерть побуждает FDA приостановить исследование генной терапии артрита». Medpage Today. 27 июля 2007 г. Получено 10 ноября 2010 г.
- ^ Stolberg SG (22 января 2000 г.). «Генная терапия в университете приостановлена». The New York Times . Получено 10 ноября 2010 г.
- ^ Wilson JF (18 марта 2002 г.). «Генная терапия на мышах устраняет симптомы серповидноклеточной анемии». The Scientist – Журнал наук о жизни . Получено 17 августа 2010 г.
- ^ «Генная терапия исправляет серповидноклеточную анемию в лабораторных исследованиях». Детская исследовательская больница Св. Иуды . 4 декабря 2008 г. Получено 29 декабря 2012 г. – через ScienceDaily.
- ^ Пенман Д. (11 октября 2002 г.). «Тонкая генная терапия решает проблему заболеваний крови». New Scientist . Получено 17 августа 2010 г.
- ^ "ДНК-наношарики усиливают генную терапию". New Scientist . 12 мая 2002 г. Получено 17 августа 2010 г.
- ^ Анантасвами А. (20 марта 2003 г.). «Скрытые гены проникают в мозг». New Scientist . Получено 17 августа 2010 г.
- ^ Холмс Р. (13 марта 2003 г.). «Генная терапия может выключить болезнь Хантингтона». New Scientist . Получено 17 августа 2010 г.
- ^ Отт МГ, Шмидт М, Шварцвельдер К, Штайн С, Силер У, Кёль У и др. (апрель 2006 г.). «Коррекция Х-сцепленного хронического гранулематозного заболевания с помощью генной терапии, дополненной инсерционной активацией MDS1-EVI1, PRDM16 или SETBP1». Nature Medicine . 12 (4): 401–409. doi :10.1038/nm1393. PMID 16582916. S2CID 7601162.
- ^ Brown BD, Venneri MA, Zingale A, Sergi Sergi L, Naldini L (май 2006 г.). «Эндогенная регуляция микроРНК подавляет экспрессию трансгенов в гемопоэтических линиях и обеспечивает стабильный перенос генов». Nature Medicine . 12 (5): 585–591. doi :10.1038/nm1398. PMID 16633348. S2CID 11114427.
- ^ Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM и др. (октябрь 2006 г.). «Регрессия рака у пациентов после переноса генетически модифицированных лимфоцитов». Science . 314 (5796): 126–129. Bibcode :2006Sci...314..126M. doi :10.1126/science.1129003. PMC 2267026 . PMID 16946036.
- ^ Levine BL, Humeau LM, Boyer J, MacGregor RR, Rebello T, Lu X и др. (ноябрь 2006 г.). «Перенос генов у людей с использованием условно реплицирующегося лентивирусного вектора». Труды Национальной академии наук Соединенных Штатов Америки . 103 (46): 17372–17377. Bibcode : 2006PNAS..10317372L. doi : 10.1073/pnas.0608138103 . PMC 1635018. PMID 17090675 .
- ^ "Penn Medicine представляет данные испытаний генной терапии ВИЧ на CROI 2009". EurekAlert! . 10 февраля 2009 г. Архивировано из оригинала 25 августа 2012 г. Получено 19 ноября 2009 г.
- ^ "Генная терапия — первая в лечении слабого зрения". BBC News . 1 мая 2007 г. Получено 3 мая 2010 г.
- ^ Долгин Э. (2009). «Цветовая слепота, исправленная генной терапией». Nature . doi : 10.1038/news.2009.921 .
- ^ Cartier N, Hacein-Bey-Abina S, Bartholomae CC, Veres G, Schmidt M, Kutschera I и др. (ноябрь 2009 г.). «Генная терапия гемопоэтическими стволовыми клетками с использованием лентивирусного вектора при Х-сцепленной адренолейкодистрофии» (PDF) . Science . 326 (5954): 818–823. Bibcode :2009Sci...326..818C. doi :10.1126/science.1171242. PMID 19892975. S2CID 27783.
- ^ Комароми А.М., Александр Дж.Дж., Роулан Дж.С., Гарсия М.М., Чиодо В.А., Кая А. и др. (июль 2010 г.). «Генная терапия спасает функцию колбочки при врожденной ахроматопсии». Молекулярная генетика человека . 19 (13): 2581–2593. дои : 10.1093/hmg/ddq136. ПМЦ 2883338 . ПМИД 20378608.
- ^ Cavazzana-Calvo M, Payen E, Negre O, Wang G, Hehir K, Fusil F и др. (сентябрь 2010 г.). «Независимость от переливания крови и активация HMGA2 после генной терапии β-талассемии у человека». Nature . 467 (7313): 318–322. Bibcode :2010Natur.467..318C. doi :10.1038/nature09328. PMC 3355472 . PMID 20844535.
- ^ Галанелло Р., Орига Р. (май 2010 г.). "Бета-талассемия". Orphanet Journal of Rare Diseases . 5 : 11. doi : 10.1186/1750-1172-5-11 . PMC 2893117. PMID 20492708 .
- ^ ab Beals JK (16 сентября 2010 г.). «Генная терапия освобождает пациента с бета-талассемией от переливаний крови на 2+ года». MedScape . Получено 15 декабря 2012 г.
- ^ ab Leboulch P (20 марта 2013 г.). «Пятилетний результат лентивирусной генной терапии бета-талассемии у человека, уроки и перспективы». Thalassemia Reports . 3 (1s): 108. doi : 10.4081/thal.2013.s1.e43 .
- ^ ab Номер клинического исследования NCT01639690 для "Большая β-талассемия с аутологичными CD34+ гемопоэтическими клетками-предшественниками, трансдуцированными TNS9.3.55, лентивирусным вектором, кодирующим нормальный человеческий ген β-глобина" на ClinicalTrials.gov
- ^ Троян А, Аристисабал Б.Х., Джей Л.М., Кастильо Т., Пенагос П.Дж., Брисеньо I, Троян Дж. (2016). «Тестирование биомаркера IGF-I в этическом контексте». Adv Modern Oncol Res . 2 (4): 188–200. doi : 10.18282/amor.v2.i4.58 (неактивен с 1 ноября 2024 г.).
{{cite journal}}: CS1 maint: DOI inactive as of November 2024 (link) - ^ Кастильо Т., Троян А., Ногера MC, Джей Л.М., Крейн С., Альварес А. и др. (2016). «Эпистемологический опыт в разработке технологий молекулярной биологии для разработки стратегии иммуногенной терапии». Преподобный Сьен (на испанском языке). 2 (25): 228–240. doi : 10.14483//udistrital.jour.RC.2016.25.a6 .
- ^ Розенберг Т. (27 мая 2011 г.). «Человек, который был излечен от ВИЧ, и что это значит для излечения от СПИДа». Нью-Йорк . Получено 2 января 2022 г.
- ^ «Письма директора: Вспоминая Тимоти Рэя Брауна: поборника исследований в области лечения ВИЧ | Офис исследований СПИДа NIH». www.oar.nih.gov . Получено 26 июня 2022 г. .
- ^ «Генная терапия избавила от рака нескольких пациентов с лейкемией. Будет ли она работать и для других видов рака?». Singularity Hub. 6 января 2014 г. Получено 7 января 2014 г.
- ^ Yang ZJ, Zhang YR, Chen B, Zhang SL, Jia EZ, Wang LS и др. (июль 2009 г.). «Фаза I клинических испытаний внутрикоронарного введения Ad-hHGF для лечения тяжелой ишемической болезни сердца». Molecular Biology Reports . 36 (6): 1323–1329. doi :10.1007/s11033-008-9315-3. PMID 18649012. S2CID 23419866.
- ^ Hahn W, Pyun WB, Kim DS, Yoo WS, Lee SD, Won JH и др. (октябрь 2011 г.). «Усиление кардиопротекторных эффектов путем коэкспрессии двух изоформ фактора роста гепатоцитов из обнаженной плазмидной ДНК в модели ишемической болезни сердца у крыс». Журнал генной медицины . 13 (10): 549–555. doi :10.1002/jgm.1603. PMID 21898720. S2CID 26812780.
- ^ "Неоваскулоген". Eurolab . Получено 4 августа 2015 г.
- ^ Деев Р.В., Бозо И.Ю., Мжаванадзе НД., Воронов ДА., Гавриленко АВ., Червяков Ю.В. и др. (сентябрь 2015 г.). «Внутримышечный перенос гена pCMV-vegf165 — эффективный метод лечения пациентов с хронической ишемией нижних конечностей». Журнал кардиоваскулярной фармакологии и терапии . 20 (5): 473–482. doi :10.1177/1074248415574336. PMID 25770117. S2CID 13443907.
- ^ «О раке: запуск испытаний терапии стволовыми клетками дает надежду пациентам с наследственным заболеванием крови». Memorial Sloan-Kettering Cancer Center. 16 июля 2012 г. Получено 15 декабря 2012 г.
- ^ Pollack A (20 июля 2012 г.). «Европейское агентство рекомендует одобрить генную терапию». The New York Times . Получено 2 января 2022 г.
- ^ "Первая генная терапия одобрена Европейской комиссией". UniQure (пресс-релиз). 2 ноября 2012 г. Архивировано из оригинала 5 ноября 2012 г. Получено 2 января 2022 г.
- ^ "Chiesi и uniQure задерживают запуск Glybera для добавления данных". Биотехнология . The Pharma Letter . 4 августа 2014 г. Получено 28 августа 2014 г.
- ^ Burger L, Hirschler B (26 ноября 2014 г.). «Первый препарат генной терапии установил рекорд цены в миллион евро». Reuters . Получено 30 марта 2015 г.
- ^ Whalen J (2 ноября 2012 г.). «Одобрение генной терапии знаменует собой важную веху» . The Wall Street Journal .
- ^ Morrison C (3 марта 2015 г.). «Установлена цена в 1 миллион долларов для генной терапии Glybera». TradeSecrets . 33 (3): 217–218. doi :10.1038/nbt0315-217. PMID 25748892. S2CID 205266596.
- ^ "Генная терапия одобрена в Европе впервые". Архивировано из оригинала 4 января 2014 года.
- ^ Regalado A (4 мая 2016 г.). «Самое дорогое лекарство в мире — провал». MIT Technology Review .
- ^ Bosely S (30 апреля 2013 г.). «Пионерские испытания генной терапии дают надежду пациентам с заболеваниями сердца». The Guardian . Получено 28 апреля 2014 г.
- ^ "Новости о генной терапии сердца: The Physicians Clinic". thephysiciansclinic.co.uk . 8 сентября 2013 г. Архивировано из оригинала 29 апреля 2014 г. Получено 2 января 2022 г.
- ^ "Celladon получает статус прорывной терапии от FDA для Mydicar, нового, первого в своем классе препарата для лечения сердечной недостаточности". Celladon . 10 июля 2015 г. Архивировано из оригинала 10 июля 2015 г. Получено 2 января 2022 г.
- ^ Фернандес-Руис I (март 2016 г.). «Генная терапия: нет улучшения результатов при генной терапии сердечной недостаточности». Nature Reviews. Кардиология . 13 (3): 122–123. doi :10.1038/nrcardio.2016.14. PMID 26843287. S2CID 205472001.
- ^ Biffi A, Montini E, Lorioli L, Cesani M, Fumagalli F, Plati T и др. (август 2013 г.). «Генная терапия лентивирусными гемопоэтическими стволовыми клетками приносит пользу при метахроматической лейкодистрофии». Science . 341 (6148): 1233158. doi : 10.1126/science.1233158 . PMID 23845948. S2CID 206546808.
- ^ Aiuti A, Biasco L, Scaramuzza S, Ferrua F, Cicalese MP, Baricordi C и др. (август 2013 г.). «Генная терапия лентивирусными гемопоэтическими стволовыми клетками у пациентов с синдромом Вискотта–Олдрича». Science . 341 (6148): 1233151. doi :10.1126/science.1233151. PMC 4375961 . PMID 23845947.
- ^ Галлахер Дж. (21 апреля 2015 г.). «Генная терапия: «Укрощение ВИЧ» используется для лечения болезней». BBC News, Здоровье . Получено 21 апреля 2015 г.
- ^ Malech HL, Ochs HD (апрель 2015 г.). «Начинающаяся эра клинической пользы генной терапии». JAMA . 313 (15): 1522–1523. doi :10.1001/jama.2015.2055. PMID 25898049.
- ^ "Генная терапия для лечения детей с болезнью "пузырькового младенца"". Science Daily . 18 ноября 2014 г.
- ^ «Генная терапия обеспечивает безопасное и долгосрочное облегчение для пациентов с тяжелой формой гемофилии B». Science Daily . 20 ноября 2014 г.
- ^ Beali A (25 января 2014 г.). «Генная терапия восстанавливает зрение у людей с заболеваниями глаз». The New Scientist . Получено 25 января 2014 г.
- ^ Tebas P, Stein D, Tang WW, Frank I, Wang SQ, Lee G и др. (март 2014 г.). «Редактирование гена CCR5 в аутологичных Т-клетках CD4 лиц, инфицированных ВИЧ». The New England Journal of Medicine . 370 (10): 901–910. doi :10.1056/NEJMoa1300662. PMC 4084652. PMID 24597865 .
- ^ Дворский Г (6 марта 2014 г.). «Ученые создают генетически модифицированные клетки, защищающие от ВИЧ». io9, Биотехнология . Получено 6 марта 2014 г.
- ^ Номер клинического исследования NCT02247843 для «Генной терапии стволовыми клетками серповидноклеточной анемии» на ClinicalTrials.gov
- ^ Номер клинического исследования NCT00012545 для «Сбора и хранения стволовых клеток пуповины для лечения серповидноклеточной анемии» на ClinicalTrials.gov
- ^ «Десять вещей из мира бизнеса, которые вы могли пропустить в понедельник». Boston Globe . 3 февраля 2015 г. Получено 13 февраля 2015 г.
- ^ Zimmer C (9 марта 2015 г.). «Защита без вакцины» . The New York Times . Архивировано из оригинала 2 января 2022 г. Получено 30 марта 2015 г.
- ^ Gardner MR, Kattenhorn LM, Kondur HR, von Schaewen M, Dorfman T, Chiang JJ и др. (март 2015 г.). «AAV-экспрессируемый eCD4-Ig обеспечивает надежную защиту от множественных SHIV-вызовов». Nature . 519 (7541): 87–91. Bibcode :2015Natur.519...87G. doi :10.1038/nature14264. PMC 4352131 . PMID 25707797.
- ^ Wade N (3 декабря 2015 г.). «Ученые накладывают мораторий на изменения в геноме человека, которые могут передаваться по наследству» . The New York Times . Архивировано из оригинала 2 января 2022 г. Получено 3 декабря 2015 г.
- ^ Уолш Ф. (3 декабря 2015 г.). «Редактирование генов: приближается ли эра спроектированных людей?». BBC News Health . Получено 31 декабря 2015 г.
- ^ «Генетически измененная кожа спасла мальчика, умирающего от редкой болезни». NPR.org .
- ^ Генри Р. (19 февраля 2017 г.). «Надежды на излечение лейкемии растут, поскольку девочка подвергается генной инженерии» . The Times . Получено 20 февраля 2017 г.
- ↑ Образец I (5 ноября 2015 г.). «Девочка — первая в мире, кого лечат «спроектированными иммунными клетками». The Guardian . Получено 6 ноября 2015 г.
- ^ ab ""Дизайнерские клетки" излечивают рак у годовалого ребенка". BBC News . 5 ноября 2015 г. Получено 11 декабря 2022 г.
- ^ "Summary of opinion1 (initial authorisation) Strimvelis" (PDF) . Европейское агентство по лекарственным средствам . 1 апреля 2016 г. стр. 1–2. Архивировано из оригинала (PDF) 28 января 2018 г. Получено 13 апреля 2016 г.
- ^ Hirscheler B (1 апреля 2016 г.). «Европа дает зеленый свет первой генной терапии для детей». Reuters . Получено 13 апреля 2016 г.
- ^ Reeves R (6 июня 2016 г.). «Вторая генная терапия получает одобрение в Европе». Bionews . Архивировано из оригинала 21 февраля 2017 г. Получено 20 февраля 2017 г.
- ^ Коглан А. (9 апреля 2016 г.). «Генная терапия одобрена». New Scientist . № 3068. С. 8–9.
- ^ Cyranoski D (июль 2016 г.). «Китайские ученые станут пионерами первого испытания CRISPR на людях». Nature . 535 (7613): 476–477. Bibcode :2016Natur.535..476C. doi : 10.1038/nature.2016.20302 . PMID 27466105.
- ^ Bennett J (15 ноября 2016 г.). «Китайские ученые стали первыми, кто использовал редактирование генов CRISPR на людях». Popular Mechanics . Получено 16 ноября 2016 г.
- ^ Lee TW, Southern KW, Perry LA, Penny-Dimri JC, Aslam AA (июнь 2016 г.). Southern KW (ред.). «Местная замена гена регулятора трансмембранной проводимости при кистозном фиброзе для заболевания легких, связанного с кистозным фиброзом». База данных систематических обзоров Cochrane . 2016 (6): CD005599. doi :10.1002/14651858.CD005599.pub5. PMC 8682957. PMID 27314455 .
- ^ Whipple T (1 марта 2017 г.). «Новая генная терапия „уменьшает опухоли, как кубики льда“» . The Times . Получено 1 марта 2017 г.
- ^ Коглан А. (март 2017 г.). «Генная терапия «излечивает» мальчика от заболевания крови, которое поражает миллионы». New Scientist .
- ^ «Одобрение FDA приносит первую генную терапию в Соединенные Штаты» (пресс-релиз). Управление по контролю за продуктами и лекарствами США (FDA). 30 августа 2017 г.
- ^ "FDA одобряет аксикабтаген цилолеуцел для лечения В-крупноклеточной лимфомы". Управление по контролю за продуктами и лекарствами США (FDA) . Получено 5 января 2018 г.
- ^ Zayner J (6 октября 2017 г.). "DIY Human CRISPR Myostatin Knock-Out". Youtube . Архивировано из оригинала 11 ноября 2017 г. Получено 20 мая 2020 г.
- ^ Зайнер Дж. "Первая попытка редактирования генов CRISPR у человека" . Получено 20 мая 2020 г.
- ^ "Эксклюзив AP: американские ученые пробуют первое редактирование генов в организме". AP NEWS . 15 ноября 2017 г. Получено 17 ноября 2020 г.
- ^ Kaiser J (ноябрь 2017 г.). «Человеку ввели инструменты для редактирования генов, чтобы вылечить его инвалидизирующую болезнь. Вот что вам нужно знать». Science . doi : 10.1126/science.aar5098 .
- ↑ Чжан С (15 ноября 2017 г.). «Первый человек, чьи гены были отредактированы внутри его тела». The Atlantic . Получено 17 ноября 2020 г.
- ^ Ledford H (5 сентября 2018 г.). «Первый тест редактирования генов в организме показывает многообещающие результаты». Nature . doi : 10.1038/d41586-018-06195-6 . S2CID 92840885.
- ^ Marchione M (7 февраля 2019 г.). «Тесты показывают, что ученые достигли первого редактирования генов «в организме»». AP News . Получено 7 февраля 2019 г.
- ^ Сотрудники (2 февраля 2019 г.). «Исследование возрастающей дозы редактирования генома с помощью терапевтического препарата SB-913 с цинковым пальцем (ZFN) у субъектов с МПС II». ClinicalTrials.gov . Национальная медицинская библиотека США . Получено 7 февраля 2019 г. .
- ^ Рангараджан С., Уолш Л., Лестер В., Перри Д., Мадан Б., Лаффан М. и др. (декабрь 2017 г.). «Перенос гена AAV5-фактора VIII при тяжелой гемофилии А». Медицинский журнал Новой Англии . 377 (26): 2519–2530. дои : 10.1056/nejmoa1708483 . hdl : 10044/1/57163 . ПМИД 29224506.
- ^ van den Berg HM (декабрь 2017 г.). «Лекарство от гемофилии доступно». The New England Journal of Medicine . 377 (26): 2592–2593. doi :10.1056/nejme1713888. PMID 29224412.
- ^ "FDA одобряет новую генную терапию для лечения пациентов с редкой формой наследственной потери зрения". Управление по контролю за продуктами и лекарствами США (FDA) (пресс-релиз). 19 декабря 2017 г. Получено 20 декабря 2017 г.
- ^ Herper M (2 января 2018 г.). «Spark Therapeutics устанавливает цену на генную терапию, лечащую слепоту, на уровне 850 000 долларов». Forbes . Получено 4 января 2018 г.
- ^ Шеридан К. (19 декабря 2017 г.). «FDA одобрило генную терапию для лечения слепоты в революционный момент для ДНК-медицины». Newsweek . Получено 20 декабря 2017 г.
- ^ Stein R (24 мая 2019 г.). «Новая генная терапия стоимостью 2,1 миллиона долларов — самый дорогой препарат из когда-либо существовавших». NPR . Получено 24 мая 2019 г.
- ^ Tong A (3 июня 2019 г.). «ЕС дал историческое одобрение генной терапии β-талассемии компании Bluebird – теперь расслабьтесь и ждите цену» . Получено 4 июня 2019 г.
- ^ "Zynteglo EPAR". Европейское агентство по лекарственным средствам (EMA) . 25 марта 2019 г. Получено 8 июня 2020 г.Текст был скопирован из этого источника, авторские права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ "Исследование однократной восходящей дозы у участников с LCA10". clinicaltrials.gov . Получено 20 августа 2019 г. .
- ^ "Allergan и Editas Medicine инициируют клиническое исследование фазы 1/2 Brilliance AGN-151587 (EDIT-101) для лечения LCA10". Editas Medicine . Получено 20 августа 2019 г. .
- ^ Ledford H (март 2020 г.). «Лечение CRISPR впервые введено непосредственно в организм». Nature . 579 (7798): 185. Bibcode :2020Natur.579..185L. doi : 10.1038/d41586-020-00655-8 . PMID 32157225.
- ^ Штейн, Роб (29 июля 2019 г.). «Впервые врачи в США используют инструмент CRISPR для лечения пациентов с генетическим заболеванием». NPR . Получено 25 сентября 2024 г.
- ^ "Zolgensma EPAR". Европейское агентство по лекарственным средствам (EMA) . 24 марта 2020 г. Получено 16 октября 2020 г.
- ^ "Audentes Therapeutics представляет обновленную информацию о клиническом исследовании ASPIRO, оценивающем AT132 у пациентов с Х-сцепленной миотубулярной миопатией". Audentes Therapeutics . 10 августа 2020 г. Архивировано из оригинала 27 октября 2020 г. Получено 21 сентября 2020 г.
- ^ "Astellas' Audentes сообщает о третьей смерти в ходе испытания генной терапии". Fierce Biotech . 21 августа 2020 г. Получено 21 сентября 2020 г.
- ^ "Смерти от высокодозной генной терапии AAV". Nature Biotechnology . 38 (8): 910. 1 августа 2020 г. doi : 10.1038/s41587-020-0642-9 . ISSN 1546-1696. PMID 32760031. S2CID 220981004.
- ^ ab "Libmeldy: Pending EC decision". Европейское агентство по лекарственным средствам (EMA) . 16 октября 2020 г. Архивировано из оригинала 17 октября 2020 г. Получено 16 октября 2020 г.Текст был скопирован из этого источника, авторские права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ "Новая генная терапия для лечения редкого генетического заболевания метахроматической лейкодистрофии". Европейское агентство по лекарственным средствам . 16 октября 2020 г. Получено 16 октября 2020 г.Текст был скопирован из этого источника, авторские права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ "Libmeldy EPAR". Европейское агентство по лекарственным средствам (EMA) . 13 октября 2020 г. Получено 22 декабря 2020 г.
- ^ Lysogene (15 октября 2020 г.). "Lysogene предоставляет обновленную информацию о клиническом исследовании AAVance по оценке LYS-SAF302 у пациентов с МПС IIIA – Lysogene". Архивировано из оригинала 17 октября 2020 г. Получено 17 октября 2020 г.
- ^ Кон Д.Б., Бут С., Шоу К.Л., Сюй-Бэйфорд Дж., Гарабедиан Э., Тревизан В. и др. (май 2021 г.). «Аутологичная лентивирусная генная терапия ex vivo при дефиците аденозиндезаминазы». Медицинский журнал Новой Англии . 384 (21): 2002–2013. дои : 10.1056/NEJMoa2027675 . ПМК 8240285 . ПМИД 33974366.
- ^ Marchione M (11 мая 2021 г.). «Вирус СПИДа используется в генной терапии для лечения болезни «пузырькового младенца». Статистика . Получено 19 июля 2021 г.
- ^ «Генная терапия восстанавливает иммунную функцию у детей с редким иммунодефицитом». Национальные институты здравоохранения (NIH) . 11 мая 2021 г. Получено 19 июля 2021 г.
- ^ «Почему генная терапия вызвала лейкемию у некоторых пациентов с синдромом «мальчика в пузыре». ScienceDaily . Получено 19 июля 2021 г. .
- ^ Mamcarz E, Zhou S, Lockey T, Abdelsamed H, Cross SJ, Kang G и др. (апрель 2019 г.). «Лентивирусная генная терапия в сочетании с низкими дозами бусульфана у младенцев с SCID-X1». The New England Journal of Medicine . 380 (16): 1525–1534. doi : 10.1056/NEJMoa1815408 . PMC 6636624. PMID 30995372 .
- ^ "ВИЧ используется для лечения болезни 'bubble boy'". BBC News . 17 апреля 2019 г. Получено 19 июля 2021 г.
- ^ Питтман Дж., Равитц Дж. Д. «Эти ученые, возможно, нашли лекарство от болезни «мальчика в пузыре»». Smithsonian Magazine . Получено 19 июля 2021 г.
- ^ Rohr K (17 апреля 2019 г.). «Генная терапия восстанавливает иммунитет у младенцев с редким иммунодефицитом». Национальные институты здравоохранения (NIH) . Получено 4 июня 2020 г.
- ^ Gillmore JD, Gane E, Taubel J, Kao J, Fontana M, Maitland ML и др. (август 2021 г.). «Редактирование гена CRISPR-Cas9 in vivo при транстиретиновом амилоидозе». The New England Journal of Medicine . 385 (6): 493–502. doi : 10.1056/NEJMoa2107454 . PMID 34215024. S2CID 235722446.
- ^ "Новости: Обновление клинических испытаний: Положительные данные для первой в истории медицины CRISPR in vivo". Медицина CRISPR . Получено 16 декабря 2021 г. .
- ^ "Новости науки, которые сформировали 2021 год: выбор Nature". Nature . Декабрь 2021. doi :10.1038/d41586-021-03734-6. PMID 34907370. S2CID 245144020.
- ^ Pearson TS, Gupta N, San Sebastian W, Imamura-Ching J, Viehoever A, Grijalvo-Perez A и др. (июль 2021 г.). «Генная терапия дефицита декарбоксилазы ароматических L-аминокислот путем прямой доставки AAV2-AADC под контролем МРТ в дофаминергические нейроны среднего мозга». Nature Communications . 12 (1): 4251. Bibcode :2021NatCo..12.4251P. doi :10.1038/s41467-021-24524-8. PMC 8275582 . PMID 34253733.
- ^ Ибрагим М (14 июля 2021 г.). «Генная терапия восстанавливает недостающий дофамин у детей с редким заболеванием мозга». Science . Получено 18 июля 2021 г. .
- ^ «Испытание генной терапии указывает на более широкое окно для изменения течения редкого заболевания». Статистика . 12 июля 2021 г. Получено 18 июля 2021 г.
- ^ Flotte TR, Cataltepe O, Puri A, Batista AR, Moser R, McKenna-Yasek D и др. (февраль 2022 г.). «Генная терапия AAV при болезни Тея-Сакса». Nature Medicine . 28 (2): 251–259. doi :10.1038/s41591-021-01664-4. PMC 10786171 . PMID 35145305. S2CID 246748772.
- ^ Sena-Esteves M (14 февраля 2022 г.). «Первая генная терапия болезни Тея-Сакса успешно проведена двум детям». The Conversation . Получено 7 марта 2022 г.
- ^ «Родители инициируют прорыв в генной терапии для детей с болезнью Тея-Сакса». The Independent . 18 февраля 2022 г. Получено 7 марта 2022 г.
- ^ "Upstaza: Pending EC decision". Европейское агентство по лекарственным средствам . 19 мая 2022 г. Архивировано из оригинала 25 мая 2022 г. Получено 22 мая 2022 г.
- ^ "PTC Therapeutics получает положительное заключение CHMP относительно препарата Upstaza для лечения дефицита AADC". PTC Therapeutics (пресс-релиз). 20 мая 2022 г. Получено 22 мая 2022 г.
- ^ Chowdary P, Shapiro S, Makris M, Evans G, Boyce S, Talks K и др. (Июль 2022 г.). «Фаза 1-2 испытания генной терапии AAVS3 у пациентов с гемофилией B». The New England Journal of Medicine . 387 (3): 237–247. doi : 10.1056/NEJMoa2119913 . PMID 35857660. S2CID 250697905.
- ^ "Новая генная терапия может снизить риск кровотечения у пациентов с гемофилией". ScienceDaily . Получено 3 августа 2022 г.
- ^ "Трансформационная терапия излечивает гемофилию B". BBC News . 21 июля 2022 г. Получено 3 августа 2022 г.
- ^ "Редактирование базы: Революционная терапия излечивает неизлечимый рак девочки". BBC News . 11 декабря 2022 г. . Получено 11 декабря 2022 г. .
- ^ «Генные капли для глаз вернули зрение мальчику. Аналогичное лечение может помочь миллионам». AP News . 24 июля 2023 г. . Получено 31 июля 2023 г. .
- ^ Хуан, Цзиньбо; Сюэ, Шуай; Бухманн, Питер; Тейшейра, Ана Пальма; Фюссенеггер, Мартин (16 августа 2023 г.). «Электрогенетический интерфейс для программирования экспрессии генов млекопитающих с помощью постоянного тока». Природный метаболизм . 5 (8): 1395–1407. дои : 10.1038/s42255-023-00850-7 . ПМЦ 10447240 . ПМИД 37524785.
Дальнейшее чтение
- «Генная терапия: обзор одобренных и разрабатываемых технологий» (PDF) . CADTH (171). Март 2018 г. Архивировано (PDF) из оригинала 19 октября 2018 г.
- Baum C, Düllmann J, Li Z, Fehse B, Meyer J, Williams DA, von Kalle C (март 2003 г.). «Побочные эффекты ретровирусного переноса генов в гемопоэтические стволовые клетки». Blood . 101 (6): 2099–2114. doi :10.1182/blood-2002-07-2314. PMID 12511419. S2CID 8489829.
- Daley J (январь 2020 г.). «Генная терапия наступает: после неудачных попыток препараты, манипулирующие кодом жизни, наконец-то меняют жизни». Scientific American . 322 (1): Нет. doi :10.1038/scientificamerican012020-2SglZYN24KkpjWDUVuCdME. PMID 39014835.
- Гардлик Р., Палфи Р., Ходоси Дж., Лукач Дж., Турна Дж., Челек П. (апрель 2005 г.). «Векторы и системы доставки в генной терапии». Монитор медицинских наук . 11 (4): RA110–121. ПМИД 15795707.
- Horn PA, Morris JC, Neff T, Kiem HP (сентябрь 2004 г.). «Перенос генов стволовых клеток – эффективность и безопасность в исследованиях на крупных животных». Молекулярная терапия . 10 (3): 417–431. doi : 10.1016/j.ymthe.2004.05.017 . PMID 15336643.
- Парамби Д.Г., Альхарби К.С., Кумар Р., Харилал С., Батиха Г.Е., Круз-Мартинс Н., Магди О., Муса А., Панда Д.С., Мэтью Б. (октябрь 2021 г.). «Подход генной терапии с акцентом на факторы роста: теоретические и клинические результаты при нейродегенеративных заболеваниях». Молекулярная нейробиология . 59 (1): 191–233. doi : 10.1007/s12035-021-02555-y. ПМЦ 8518903 . ПМИД 34655056.
- Salmons B, Günzburg WH (апрель 1993 г.). «Нацеливание ретровирусных векторов для генной терапии». Human Gene Therapy . 4 (2): 129–141. doi :10.1089/hum.1993.4.2-129. PMID 8494923.
- Сотрудники (18 ноября 2005 г.). "Генная терапия". Информация о проекте "Геном человека " . Национальная лаборатория Оук-Ридж . Архивировано из оригинала (FAQ) 27 апреля 2006 г. Получено 28 мая 2006 г.
- Tinkov S, Bekeredjian R, Winter G, Coester C (20 ноября 2000 г.). "Полиплексные конъюгированные микропузырьки для улучшенной ультразвуковой направленной генной терапии" (PDF) . Georgia World Congress Center , Atlanta, GA: 2008 AAPS Annual Meeting and Exposition. Архивировано из оригинала (PDF) 7 июля 2012 г. . Получено 26 января 2009 г. .
- Wang H, Shayakhmetov DM, Leege T, Harkey M, Li Q, Papayannopoulou T, Stamatoyannopolous G, Lieber A (сентябрь 2005 г.). «Вектор аденовируса, зависящий от модифицированного капсида и содержащий область контроля локуса бета-глобина, демонстрирует неслучайный паттерн интеграции и допускает стабильную экспрессию генов, специфичную для эритроидов». Journal of Virology . 79 (17): 10999–11013. doi :10.1128/JVI.79.17.10999-11013.2005. PMC 1193620 . PMID 16103151.




