Наследственная оптическая нейропатия Лебера
| Наследственная оптическая нейропатия Лебера | |
|---|---|
| Другие имена | наследственная атрофия зрительного нерва Лебера |
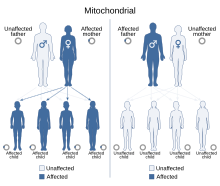 | |
| Наследственная оптическая нейропатия Лебера имеет митохондриальный тип наследования. | |
| Специальность | Офтальмология |
| Частота | 1:30,000 до 1:50,000 |
Наследственная оптическая нейропатия Лебера ( LHON ) — это митохондриально наследуемая (передаваемая от матери к потомству) дегенерация ганглиозных клеток сетчатки (RGC) и их аксонов , которая приводит к острой или подострой потере центрального зрения; она преимущественно поражает взрослых мужчин, и начало заболевания более вероятно у молодых людей. LHON передается только через мать, так как она в первую очередь обусловлена мутациями в митохондриальном (не ядерном) геноме , и только яйцеклетка вносит митохондрии в эмбрион . Мужчины не могут передать заболевание своему потомству. [1] LHON обычно обусловлена одной из трех патогенных точечных мутаций митохондриальной ДНК (мтДНК) . Эти мутации находятся в нуклеотидных позициях 11778 G на A , 3460 G на A и 14484 T на C , соответственно, в генах субъединиц ND4, ND1 и ND6 комплекса I цепи окислительного фосфорилирования в митохондриях.
Признаки и симптомы
Клинически наблюдается острое начало потери зрения, сначала в одном глазу , а затем через несколько недель или месяцев в другом. Начало обычно в молодом возрасте, но сообщается о возрастном диапазоне от 7 до 75 лет. Возраст начала заболевания немного выше у женщин (диапазон 19–55 лет: средний 31,3 года), чем у мужчин (диапазон 15–53 года: средний 24,3). Соотношение мужчин и женщин варьируется в зависимости от мутации: 3:1 для 3460 G>A, 6:1 для 11778 G>A и 8:1 для 14484 T>C. [ необходима цитата ]
Обычно это приводит к очень тяжелой атрофии зрительного нерва и постоянному снижению остроты зрения . Оба глаза поражаются либо одновременно (25% случаев), либо последовательно (75% случаев) со средней задержкой между глазами в 8 недель. Редко поражается только один глаз. В острой стадии, длящейся несколько недель, пораженный глаз демонстрирует отечный вид слоя нервных волокон, особенно в дугообразных пучках, а также увеличенные или телеангиэктатические и извилистые перипапиллярные сосуды (микроангиопатия). Основные признаки видны при осмотре глазного дна , непосредственно перед или после начала потери зрения. На острой стадии также может быть виден зрачковый дефект . Осмотр выявляет снижение остроты зрения, потерю цветового зрения и цекоцентральную скотому при осмотре поля зрения . [ необходима цитата ]
LHON с демиелинизирующими поражениями или LHON Plus
LHON Plus — редкий вариант заболевания, при котором наряду с другими состояниями наблюдается поражение глаз. [2] Его симптомы включают потерю способности мозга контролировать движение мышц, тремор и сердечную аритмию . [3] Многие случаи LHON plus сравнивают с рассеянным склерозом из-за отсутствия мышечного контроля [4] и наличия демиелинизирующих поражений в ЦНС. Таким образом, согласно определению Макдональда, это подтип рассеянного склероза. [5]
Генетика
Наследственная оптическая нейропатия Лебера — это состояние, связанное с изменениями в митохондриальной ДНК . Хотя большая часть ДНК упакована в хромосомы внутри ядра, митохондрии имеют отдельный митохондриальный геном, состоящий из мтДНК.
Мутации в генах MT-ND1 , MT-ND4 , MT-ND4L и MT-ND6 вызывают наследственную оптическую нейропатию Лебера. [6] Эти гены кодируют белок NADH-дегидрогеназы , участвующий в нормальной митохондриальной функции окислительного фосфорилирования . Окислительное фосфорилирование использует серию из четырех больших мультиферментных комплексов, все из которых встроены во внутреннюю митохондриальную мембрану, для преобразования кислорода и простых сахаров в энергию. Мутации в любом из генов нарушают этот процесс, вызывая различные синдромы в зависимости от типа мутации и других факторов. Остается неясным, как эти генетические изменения вызывают гибель клеток в зрительном нерве и приводят к специфическим признакам наследственной оптической нейропатии Лебера. [ необходима цитата ]
Патофизиология
Патология глаза ограничивается слоем ганглиозных клеток сетчатки, особенно макулопапиллярным пучком. Дегенерация очевидна от тел ганглиозных клеток сетчатки до аксональных путей, ведущих к латеральным коленчатым ядрам . Экспериментальные данные показывают нарушение транспорта глутамата и увеличение активных форм кислорода (ROS), вызывающих апоптоз ганглиозных клеток сетчатки. Кроме того, эксперименты показывают, что нормальные, не пораженные LHON ганглиозные клетки сетчатки производят меньше сильного супероксидного радикала , чем другие нормальные нейроны центральной нервной системы. [7] Было показано, что эксперименты с вирусными векторами, которые увеличивают супероксиддисмутазу 2 в цибридах LHON [8] или моделях животных LHON или использование экзогенного глутатиона в цибридах LHON [9], спасают ганглиозные клетки сетчатки, пораженные LHON, от апоптотической гибели. Эти эксперименты могут частично объяснить гибель ганглиозных клеток сетчатки, пораженных LHON, по сравнению с другими нейронами центральной нервной системы, которые также несут митохондрии, пораженные LHON. [ необходима цитата ]
Диагноз
Без известного семейного анамнеза LHON для диагностики обычно требуется нейроофтальмологическое обследование и анализ крови на митохондриальную ДНК. [10] Важно исключить другие возможные причины потери зрения и связанные с ней синдромы, такие как аномалии системы электропроводности сердца. [ необходима ссылка ]
Уход
Прогноз для тех, кто не лечится, почти всегда заключается в продолжении значительной потери зрения в обоих глазах. Регулярные проверки остроты зрения и периметрии с коррекцией рекомендуются для пострадавших людей. Существует эффективное лечение для некоторых случаев LHON, особенно для раннего начала заболевания, [11] и экспериментальные протоколы лечения находятся в разработке. [12] Следует предложить генетическое консультирование . Следует пересмотреть выбор здоровья и образа жизни, особенно в свете токсических и пищевых теорий экспрессии генов. Для сохранения занятости следует использовать помощь со зрительными аппаратами и трудовую реабилитацию. [ необходима цитата ]
Для тех, кто является носителем мутации LHON, доклинические маркеры могут использоваться для мониторинга прогресса. [13] Например, фотография глазного дна может контролировать отек слоя нервных волокон . Оптическая когерентная томография может использоваться для более детального изучения толщины слоя нервных волокон сетчатки. Тестирование зрения на красно-зеленый цвет может обнаружить потери. Контрастная чувствительность может быть снижена. Может быть аномальная электроретинограмма или вызванные зрительные потенциалы . Нейрон-специфические енолазные и аксональные тяжелые цепи нейрофиламентов крови могут предсказать переход в пораженное состояние. [ необходима ссылка ]
Следует избегать приема цианокобаламина (формы витамина B12), поскольку он может привести к слепоте у пациентов с LHON. [14] [15] [16]
Обычно рекомендуется избегать токсинов зрительного нерва, особенно табака и алкоголя. Некоторые рецептурные препараты представляют потенциальный риск, поэтому все препараты следует рассматривать с подозрением и проверять перед использованием лицам, находящимся в группе риска. В частности, этамбутол был замешан в том, что он вызывает потерю зрения у носителей LHON. Фактически, токсические и алиментарные оптические нейропатии могут иметь совпадения с LHON по симптомам, митохондриальным механизмам заболевания и лечению. [17] А когда у пациента с LHON или токсической/алиментарной оптической нейропатией возникает гипертонический криз как возможное осложнение процесса заболевания, нитропруссид (торговое название: Ниприд ) не следует использовать из-за повышенного риска ишемии зрительного нерва в ответ на это антигипертензивное средство . [18]
Идебенон [11] [19] [20] показал в небольшом плацебо-контролируемом исследовании скромную пользу примерно у половины пациентов. Люди, которые с наибольшей вероятностью лучше всего реагировали, были теми, кто лечился на ранней стадии.
α- Токотриенол -хинон, метаболит витамина Е , имел определенный успех в небольших открытых исследованиях по обращению вспять ранней потери зрения. [12] [21]
Различные подходы к лечению прошли ранние испытания или были предложены, но до сих пор ни один из них не дал убедительных доказательств полезности или безопасности для лечения или профилактики, включая бримонидин , [22] миноциклин , [23] куркумин , [24] глутатион , [9] лечение ближним инфракрасным светом , [25] и методы вирусных векторов . [8]
«Экстракорпоральное оплодотворение трех человек» — это экспериментальный метод исследования для предотвращения митохондриальных заболеваний в развивающихся человеческих плодах. На данный момент получены жизнеспособные макаки. Но этические и информационные барьеры остаются до того, как будет установлено использование этого метода на людях. [26]
Идебенон
Идебенон — это короткоцепочечный бензохинон, который взаимодействует с митохондриальной цепью переноса электронов для улучшения клеточного дыхания. При использовании у людей с LHON считается, что он позволяет электронам обходить дисфункциональный комплекс I. [27] Успешное лечение идебеноном первоначально было отмечено у небольшого числа пациентов. [20] [28]
Два крупномасштабных исследования продемонстрировали преимущества идебенона. Исследование Rescue of Hereditary Optic Disease Outpatient Study (RHODOS) оценило эффекты идебенона у 85 пациентов с LHON, которые потеряли зрение в течение предыдущих пяти лет. [11] [29] В этом исследовании группа, принимавшая идебенон по 900 мг в день в течение 24 недель, показала небольшое улучшение остроты зрения по сравнению с группой плацебо, хотя разница не была статистически значимой. Но пациенты, принимавшие идебенон, были защищены от дальнейшей потери зрения, тогда как в группе плацебо наблюдалось устойчивое снижение остроты зрения. Кроме того, люди, принимавшие идебенон, продемонстрировали сохранение цветового зрения и сохранение эффектов идебенона через 30 месяцев после прекращения терапии. [29] [30] Ретроспективный анализ 103 пациентов с LHON, проведенный Карелли и соавторами, основывается на этих результатах. [31] Это исследование показало, что 44 субъекта, которые лечились идебеноном в течение одного года с момента начала потери зрения, имели лучшие результаты, и что эти улучшения сохранялись в течение многих лет. [ необходима цитата ]
Идебенон в сочетании с отказом от курения и ограничением потребления алкоголя является предпочтительным протоколом лечения для людей с LHON. [32] Дозы идебенона назначаются для приема в течение дня, а не все сразу. Например, чтобы достичь дозы 900 мг в день, пациенты принимают по 300 мг три раза в день во время еды. Идебенон является жирорастворимым и может приниматься с умеренным количеством диетического жира в каждом приеме пищи для улучшения усвоения. Пациентам, принимающим идебенон, рекомендуется также принимать витамин С по 500 мг в день, чтобы поддерживать идебенон в его восстановленной форме, [32], поскольку он наиболее активен в этом состоянии. [33]
Заместительная терапия эстрогенами
Было показано, что эстрогены играют защитную роль в патогенезе LHON. Эксперименты с использованием цибридов LHON продемонстрировали, что рецептор эстрогена локализуется в митохондриях, где он напрямую опосредует митохондриальный биогенез. Эстрогены повышают уровень антиоксидантного фермента супероксиддисмутазы 2 и синтеза митохондриальной ДНК. Эти эксперименты помогли объяснить механизм, лежащий в основе более низкой пенетрантности заболевания среди женщин-носителей. [34] [35] [36] Хотя были выдвинуты теории о дополнительных факторах, защитная роль эстрогенов, по-видимому, вносит значительный вклад. [ необходима цитата ]
В дополнение к экспериментальным данным, клинические данные также указывают на защитную роль эстрогенов. Пенетрантность среди женщин-носителей существенно ниже (соотношение мужчин и женщин от 3 до 8 к 1 в зависимости от мутации), в то время как средний возраст начала заболевания значительно выше. Многочисленные серии случаев различных родословных LHON описали женщин-носителей, преобразовавшихся после менопаузы или прекращения заместительной гормональной терапии. [37] [38] Вместе они формируют смещающуюся парадигму в сторону рассмотрения состояний с пониженным эстрогеном, таких как менопауза, как потенциальных триггеров потери зрения, подобных курению или чрезмерному употреблению алкоголя.
Гормонозаместительная терапия (ГЗТ) становится эффективной терапевтической целью для женщин-носителей мутаций. В одном недавнем исследовании случая, когда затронутая женщина преобразовалась после прекращения ГЗТ, идебенон и ГЗТ давались вместе. [37] Острота зрения улучшилась намного быстрее, чем обычно ожидается. Зрение пациентки вернулось к 20/40 и 20/60 с 20/60 и 20/200 в правом и левом глазу соответственно всего через месяц и вернулось к норме через 8 месяцев по сравнению с периодом времени от нескольких месяцев до нескольких лет, наблюдаемым в большинстве случаев. Хотя баланс между рисками и преимуществами ГЗТ остается спорным, решение о начале ГЗТ требует индивидуального подхода, основанного на контексте пациента. Хотя это не применимо для всех женщин в постменопаузе, профилактическую (и терапевтическую) ГЗТ следует рассматривать у всех женщин-носителей известной мутации LHON, учитывая значительный риск потери зрения, связанный с менопаузой. [35] [39] [37]
Эпидемиология
В североевропейской популяции приблизительно один из 9000 человек является носителем одной из трех основных мутаций LHON. [40] [41] Распространенность в Европе составляет от 1:30 000 до 1:50 000.
Мутация LHON ND4 G11778A является основной мутацией в большинстве стран мира, с 70% случаев в Северной Европе и 90% случаев в Азии. Из-за эффекта основателя мутация LHON ND6 T14484C составляет 86% случаев LHON в Квебеке , Канада. [42]
Более 50% мужчин с мутацией и более 85% женщин с мутацией никогда не испытывают потери зрения или связанных с ней медицинских проблем. Конкретный тип мутации может предсказать вероятность пенетрантности , тяжесть заболевания и вероятность восстановления зрения у пораженного. Как правило, женщина, которая имеет гомоплазматическую первичную мутацию LHON, имеет ~40% риск рождения больного сына и ~10% риск рождения больной дочери. [ необходима цитата ]
Дополнительные факторы могут определять, разовьются ли у человека признаки и симптомы этого расстройства. Могут быть задействованы факторы окружающей среды, такие как курение и употребление алкоголя, хотя исследования этих факторов дали противоречивые результаты. Исследователи также изучают, способствуют ли изменения в дополнительных генах, в частности генах на Х-хромосоме, [43] [44] развитию признаков и симптомов. Степень гетероплазмии , процент митохондрий, имеющих мутантные аллели , может играть роль. [45] Модели митохондриальных аллелей, называемые гаплогруппой, также могут влиять на экспрессию мутаций. [46]
История
LHON впервые был описан немецким офтальмологом Теодором Лебером (1840–1917) в 1871 году. [47] В своей статье Лебер описал четыре семьи, в которых у ряда молодых людей произошла резкая потеря зрения на оба глаза либо одновременно, либо последовательно. Первоначально считалось, что это заболевание связано с Х-хромосомой, но впоследствии было показано, что оно митохондриальное. [48] Природа причинной мутации была впервые определена в 1988 году Уоллесом и соавторами, которые обнаружили мутацию гуанина (G) в аденозин (A) в нуклеотидной позиции 11778 в девяти семьях. [49] Эта мутация преобразует высококонсервативный аргинин в гистидин в кодоне 340 в субъединице 4 НАДН-дегидрогеназы комплекса I митохондриальной дыхательной цепи. Две другие мутации, известные как вызывающие это состояние, были идентифицированы в 1991 году (точечная мутация G на A в позиции нуклеотида 3460) [50] и 1992 году ( мутация тимидина (T) на цитозин (C) в позиции нуклеотида 14484). [51] Эти три мутации составляют более 95% случаев: мутация 11778 составляет 50–70% случаев, мутация 14484 — 10–15%, а мутация 3460 — 8–25%.
Исследовать
В настоящее время проводятся клинические испытания на людях в GenSight Biologics (ClinicalTrials.gov # NCT02064569) и Университете Майами (ClinicalTrials.gov # NCT02161380) для изучения безопасности и эффективности митохондриальной генной терапии при LHON. В этих испытаниях участникам, страдающим LHON с мутацией G11778A, в один глаз будет введен вирус, экспрессирующий функциональную версию ND4 — гена, мутировавшего в этом варианте LHON. Ложная инъекция будет введена в другой глаз для сравнения. Предполагается, что введение вирусного вектора может спасти функцию мутантного гена. Предварительные результаты продемонстрировали переносимость инъекций у небольшого числа субъектов. [52]
Stealth BioTherapeutics изучает использование эламипретида (MTP-131), митохондриального защитного агента, в качестве терапии LHON. Эламипретид помогает стабилизировать кардиолипин [53] [54] — важный компонент внутренних мембран митохондрий — и, как было показано, снижает количество вредных активных форм кислорода в моделях животных. [55]
Смотрите также
- Амавроз
- Доминирующая атрофия зрительного нерва
- Глаукома
- Ишемическая оптическая нейропатия
- атрофия зрительного нерва
- Токсическая и пищевая оптическая нейропатия
Ссылки
- ^ Bandelt HJ, Kong QP, Parson W, Salas A (декабрь 2005 г.). «Еще больше доказательств нематеринской наследственности митохондриальной ДНК?». J. Med. Genet . 42 (12): 957– 60. doi :10.1136/jmg.2005.033589. PMC 1735965. PMID 15923271 .
- ^ Nikoskelainen EK, Marttila RJ, Huoponen K, et al. (август 1995). «Leber's "plus": неврологические отклонения у пациентов с наследственной оптической нейропатией Лебера». J. Neurol. Neurosurg. Psychiatry . 59 (2): 160– 4. doi :10.1136/jnnp.59.2.160. PMC 485991. PMID 7629530 .
- ^ сердечная аритмия
- ^ Клиника Майо: Рассеянный склероз
- ^ Дэвид Барджела, Патрик Ф. Чиннери, Митохондрии при нейровоспалении – рассеянный склероз (РС), наследственная оптическая нейропатия Лебера (LHON) и LHON-MS, https://doi.org/10.1016/j.neulet.2017.06.051
- ^ Онлайн Менделевское наследование у человека (OMIM): АТРОФИЯ ЗРИТЕЛЬНОГО НЕРА ЛЕБЕРА - 535000
- ^ Hoegger MJ, Lieven CJ, Levin LA (2008). "Дифференциальное производство супероксида нейрональными митохондриями". BMC Neurosci . 9 : 4. doi : 10.1186/1471-2202-9-4 . PMC 2266764 . PMID 18182110.
- ^ ab Qi X, Sun L, Hauswirth WW, Lewin AS, Guy J (февраль 2007 г.). «Использование митохондриальной антиоксидантной защиты для спасения клеток с мутацией, вызывающей наследственную оптическую нейропатию Лебера». Arch. Ophthalmol . 125 (2): 268– 72. doi : 10.1001/archopht.125.2.268 . PMID 17296905.
- ^ ab Ghelli A, Porcelli AM, Zanna C, Martinuzzi A, Carelli V, Rugolo M (февраль 2008 г.). «Защита от оксидант-индуцированного апоптоза экзогенным глутатионом у цибридов наследственной оптической нейропатии Лебера». Invest. Ophthalmol. Vis. Sci . 49 (2): 671– 6. doi : 10.1167/iovs.07-0880 . PMID 18235013.
- ^ Yu-Wai-Man P, Chinnery PF (23 июня 2016 г.). «Наследственная оптическая нейропатия Лебера». NCBI . Genereviews. PMID 20301353. Получено 25 февраля 2018 г.
- ^ abc Klopstock, T.; Yu-Wai-Man, P.; Dimitriadis, K.; Rouleau, J.; Heck, S.; Bailie, M.; Atawan, A.; Chattopadhyay, S.; Schubert, M.; Garip, A.; Kernt, M.; Petraki, D.; Rummey, C.; Leinonen, M.; Metz, G.; Griffiths, PG; Meier, T.; Chinnery, PF (2011). "Рандомизированное плацебо-контролируемое исследование идебенона при наследственной оптической нейропатии Лебера". Brain . 134 (9): 2677– 2686. doi :10.1093/brain/awr170. ISSN 0006-8950. PMC 3170530 . PMID 21788663.
- ^ ab Shrader, WD; Amagata, A.; Barnes, A.; Enns, GM; Hinman, A.; Jankowski, O.; Kheifets, V.; Komatsuzaki, R.; Lee, E.; Mollard, P.; Murase, K.; Sadun, AA; Thoolen, M.; Wesson, K.; Miller, G. (2011). «Α-Токотриенолхинон модулирует реакцию на окислительный стресс и биохимию старения». Bioorganic & Medicinal Chemistry Letters . 21 (12): 3693– 3698. doi :10.1016/j.bmcl.2011.04.085. PMID 21600768.
- ^ Садун AA, Саломао SR, Березовский A, и др. (2006). «Субклинические носители и конверсии при наследственной оптической нейропатии Лебера: перспективное психофизическое исследование». Trans Am Ophthalmol Soc . 104 : 51–61 . PMC 1809912. PMID 17471325 .
- ^ Оливейра, К. (2019). "Оливейра К. Токсически-метаболические и наследственные оптические невропатии. Continuum (Миннеап, Миннесота). 2019 октябрь; 25(5):1265-1288". Continuum (Миннеаполис, Миннесота) . 25 (5): 1265– 1288. doi : 10.1212/CON.0000000000000769. PMID 31584537. S2CID 203660987.
- ^ Васавада А., Сангхави Д. [Обновлено 3 августа 2020 г.]. StatPearls Publishing (2021). Цианокобаламин. StatPearls. PMID 32310424.
{{cite book}}: CS1 maint: числовые имена: список авторов ( ссылка ) - ^ LHON Canada. "Чего следует избегать" . Получено 21 февраля 2021 г.
- ^ Карелли В., Росс-Сиснерос Ф.Н., Садун А.А. (январь 2004 г.). «Митохондриальная дисфункция как причина оптических нейропатий». Prog Retin Eye Res . 23 (1): 53– 89. doi :10.1016/j.preteyeres.2003.10.003. PMID 14766317. S2CID 15862778.
- ^ Кац, Джейсон; Патель, Четан (2006). Руководство по стационарной медицине Паркленда . Даллас, Техас: FA Davis. стр. 903. ISBN 9780803613973.
- ^ Набор на клиническое исследование идебенона в Ньюкаслском университете, Великобритания http://lhon.ncl.ac.uk
- ^ ab Mashima Y, Kigasawa K, Wakakura M, Oguchi Y (сентябрь 2000 г.). «Сокращают ли идебенон и витаминная терапия время восстановления зрения при наследственной оптической нейропатии Лебера?». J Neuroophthalmol . 20 (3): 166–70 . doi : 10.1097/00041327-200020030-00006 . PMID 11001192. S2CID 22247204.
- ^ Садун, А и др. "EPI-743 изменяет естественное течение прогрессирования наследственной оптической нейропатии Лебера". Встреча AOS. Май 2011 г. Архивировано 04.09.2011 в Wayback Machine
- ^ Newman NJ, Biousse V, David R и др. (сентябрь 2005 г.). «Профилактика поражения второго глаза при наследственной оптической нейропатии Лебера: открытое нерандомизированное многоцентровое исследование местного применения бримонидина». Am. J. Ophthalmol . 140 (3): 407– 15. doi :10.1016/j.ajo.2005.03.058. PMID 16083844.
- ^ Haroon MF, Fatima A, Schöler S, et al. (2007). «Миноциклин, возможный нейропротекторный агент при наследственной оптической нейропатии Лебера (LHON): исследования цибридных клеток, несущих мутацию 11778». Neurobiol Dis . 28 (3): 237– 50. doi :10.1016/j.nbd.2007.07.021. PMID 17822909. S2CID 30986663.
- ^ Набор участников клинического исследования куркурмина на ClinicalTrials.nlm.nih.gov Архивировано 13 февраля 2009 г. на Wayback Machine
- ^ Испытание в ближнем инфракрасном диапазоне в Висконсине. Архивировано 15 мая 2008 г. на Wayback Machine.
- ^ Craven L, Tuppen HA, Greggains GD, Harbottle SJ, Murphy JL, Cree LM, Murdoch AP, Chinnery PF, Taylor RW, Lightowlers RN, Herbert M, Turnbull DM (май 2010 г.). «Перенос пронуклеусов в эмбрионы человека для предотвращения передачи митохондриальной ДНК-болезни». Nature . 465 (7294): 82– 85. Bibcode :2010Natur.465...82C. doi :10.1038/nature08958. PMC 2875160 . PMID 20393463.
- ^ Haefeli RH, Erb M, Gemperli AC, Robay D, Courdier Fruh I, Anklin C, Dallmann R, Gueven N (март 2011 г.). "NQO1-зависимая окислительно-восстановительная цикличность идебенона: влияние на клеточный окислительно-восстановительный потенциал и уровни энергии". PLOS ONE . 6 (3): e17963. Bibcode :2011PLoSO...617963H. doi : 10.1371/journal.pone.0017963 . PMC 3069029 . PMID 21483849.
- ^ Eng, JG; Aggarwal, D.; Sadun, AA (апрель 2009 г.). «Лечение идебеноном пациентов с наследственной оптической нейропатией Лебера». Invest Ophthalmol Vis Sci . 50 (13) . Получено 22 марта 2016 г.
- ^ ab Klopstock T; Metz G; Yu-Wai-Man P; et al. (2013). «Сохранение лечебного эффекта идебенона при наследственной оптической нейропатии Лебера». Brain . 136 (2): e230. doi :10.1093/brain/aws279. PMC 3572931 . PMID 23388409.
- ^ Rudolph, G.; Dimitriadis, K.; Büchner, B.; Heck, S.; Al-Tamami, J.; Seidensticker, F.; Rummey, C.; Leinonen, M.; Meier, T.; Klopstock, T. (март 2013 г.). «Влияние идебенона на цветовое зрение у пациентов с наследственной оптической нейропатией Лебера». J Neuroophthalmol . 33 (1): 30–36 . doi :10.1097/WNO.0b013e318272c643. PMC 3658961. PMID 23263355 .
- ^ Карелли В.; Ла Морджиа С.; Валентино М.Л.; и др. (сентябрь 2011 г.). «Лечение идебеноном наследственной оптической нейропатии Лебера». Мозг . 134 (часть 9): e188. doi : 10.1093/brain/awr180 . PMID 21810891.
- ^ ab Karanjia, R.; Sadun, AA (2015). «Достижения в терапевтических стратегиях наследственной оптической нейропатии Лебера». Мнение экспертов по орфанным препаратам . 3 (12): 1439– 1446. doi :10.1517/21678707.2015.1098531. S2CID 74119548.
- ^ Морденте, А.; Марторана, GE; Минотти, G; Джиардина, B (январь 1998 г.). «Антиоксидантные свойства 2,3-диметокси-5-метил-6-(10-гидроксидецил)-1,4-бензохинона (идебенона)». Chem Res Toxicol . 11 (1): 54– 63. doi :10.1021/tx970136j. PMID 9477226.
- ^ Джордано, К.; Йоммарини, Л; Джордано, Л; Мареска, А; Пизано, А; Валентино, ML; Капорали, Л; Лигуори, Р; Деселье, С; Роберти, М; Фанелли, Ф; Фракассо, Ф; Росс-Сиснерос, ФН; Д'Адамо, П; Хадсон, Дж; Пайл, А; Ю-Вай-Ман, П; Чиннери, ПФ; Зевиани, М; Саломао, СР; Березовский А; Белфорт-младший, Р; Вентура, DF; Мораес, М; Фильо, ММ; Барбони, П; Садун, Ф; Де Негри, А; Садун, А.А.; Танкреди, А; Манчини, М; д'Амати, Дж; Полоса, Польша; Канторе, П; Карелли, В. (2013). «Эффективный митохондриальный биогенез приводит к неполной пенетрантности при наследственной оптической нейропатии Лебера». Мозг . 137 (Pt 2): 335– 353. doi :10.1093/brain/awt343. PMC 3914475 . PMID 24369379.
- ^ Аб Джордано, К.; Монтополи, М; Перли, Э; Орланди, М; Фантен, М; Росс-Сиснерос, ФН Л; Капарротта, Л; Мартинуцци, А; Рагацци, Э; Гелли, А; Садун, А.А.; д'Амати, Дж; Карелли, В. (2011). «Эстрогены улучшают митохондриальную дисфункцию при наследственной оптической невропатии Лебера». Мозг . 134 (Часть 1): 220–234 . doi : 10.1093/brain/awq276. ПМК 3025718 . ПМИД 20943885.
- ^ Пизано, А.; Прециузо, К; Йоммарини, Л; Перли, Э; Грациоли, П; Кампезе, AF; Мареска, А; Монтополи, М; Масуэлли, Л; Садун, А.А.; д'Амати, Дж; Карелли, В; Гелли, AM; Джордано, К. (2015). «Нацеливание на рецептор эстрогена β как профилактическая терапевтическая стратегия при наследственной оптической невропатии Лебера». Молекулярная генетика человека . 24 (24): 6921–6931 . doi : 10.1093/hmg/ddv396 . ПМИД 26410888.
- ^ abc Fantini, M.; Asanad, S; Karanjia, R; Sadun, AA (2019). «Гормональная заместительная терапия при наследственной оптической нейропатии Лебера: ускоренное восстановление зрения in vivo». Журнал текущей офтальмологии . 31 (1): 102–105 . doi : 10.1016/j.joco.2018.10.003 . PMC 6407313. PMID 30899856 .
- ^ Хван, Ти Джей; Каранджиа, Р; Мораес-Фильо, Миннесота; Гейл, Дж; Шоу Тран, Дж.; Чу, скорая помощь; Саломао, СР; Березовский А; Белфорт-младший, Р; Нуньес Мораес, М; Садун, Ф; ДеНегри, AM; Ла Морджиа, К; Барбони, П; Рамос, К.; Чикани, CF; Кирос, Пенсильвания; Карелли, В.; Садун, А.А. (2017). «Естественная история конверсии наследственной оптической невропатии Лебера». Офтальмология . 124 (6): 843–850 . doi :10.1016/j.ophtha.2017.01.002. ПМИД 28196731.
- ^ Хатчинсон, CV; Уокер, JA; Дэвидсон, C (2014). «Эстроген, функция глаза и зрение низкого уровня: обзор». Журнал эндокринологии . 223 (2): R9 – R18 . doi : 10.1530/JOE-14-0349 . PMID 25143633.
- ^ Man PY, Griffiths PG, Brown DT, Howell N, Turnbull DM, Chinnery PF (февраль 2003 г.). «Эпидемиология наследственной оптической нейропатии Лебера на северо-востоке Англии». Am. J. Hum. Genet . 72 (2): 333– 9. doi :10.1086/346066. PMC 379226. PMID 12518276 .
- ^ Пуомила А., Хямяляйнен П., Кивиоя С. и др. (октябрь 2007 г.). «Эпидемиология и пенетрантность наследственной оптической невропатии Лебера в Финляндии». Евро. Дж. Хум. Жене . 15 (10): 1079–89 . doi : 10.1038/sj.ejhg.5201828 . ПМИД 17406640.
- ^ Laberge AM, Jomphe M, Houde L, et al. (2005). «Дочь короля» представила мутацию наследственной оптической нейропатии Лебера T14484C у франкоканадцев». Am. J. Hum. Genet . 77 (2): 313– 7. doi :10.1086/432491. PMC 1224533 . PMID 15954041.
- ^ Хадсон Г., Карелли В., Хорват Р., Зевиани М., Смитс Х.Дж., Чиннери П.Ф. (2007). «Х-инактивационные паттерны у женщин, имеющих мутации мтДНК, вызывающие наследственную оптическую нейропатию Лебера». Mol. Vis . 13 : 2339–43 . PMID 18199976.
- ^ Хадсон Г., Кирс С., Ю Вай Ман П. и др. (декабрь 2005 г.). «Идентификация локуса X-хромосомы и гаплотипа, модулирующего фенотип нарушения митохондриальной ДНК». Am. J. Hum. Genet . 77 (6): 1086– 91. doi :10.1086/498176. PMC 1285165. PMID 16380918 .
- ^ Chinnery PF, Andrews RM, Turnbull DM, Howell NN (январь 2001 г.). «Наследственная оптическая нейропатия Лебера: влияет ли гетероплазмия на наследование и экспрессию мутации митохондриальной ДНК G11778A?». Am. J. Med. Genet . 98 (3): 235– 43. doi :10.1002/1096-8628(20010122)98:3<235::AID-AJMG1086>3.0.CO;2-O. PMID 11169561.
- ^ Хадсон Г., Карелли В., Спруйт Л. и др. (август 2007 г.). «Клиническое проявление наследственной оптической нейропатии Лебера зависит от митохондриальной ДНК–гаплогруппового фона». Am. J. Hum. Genet . 81 (2): 228– 33. doi :10.1086/519394. PMC 1950812. PMID 17668373 .
- ^ Лебер Т. Уебер наследственный и врожденный ангелегте sehnervenleiden (1871) Graefes Arch Clin Exp Ophthalmol. 17: 249–291
- ^ Эриксон РП (май 1972). «Атрофия зрительного нерва Лебера, возможный пример материнской наследственности». Американский журнал генетики человека . 24 (3): 348– 9. PMC 1762279. PMID 5063796 .
- ^ Wallace DC, Singh G, Lott MT, Hodge JA, Schurr TG, Lezza AM, Elsas LJ, Nikoskelainen EK (декабрь 1988 г.). «Мутация митохондриальной ДНК, связанная с наследственной оптической нейропатией Лебера». Science . 242 (4884): 1427– 30. Bibcode :1988Sci...242.1427W. doi :10.1126/science.3201231. PMID 3201231.
- ^ Хуопонен К, Вилкки Дж, Аула П, Никоскелайнен ЕК, Савонтаус МЛ (1991). «Новая мутация мтДНК, связанная с наследственной оптической нейроретинопатией Лебера». Am J Hum Genet . 48 (6): 1147–1153 . PMC 1683111. PMID 1674640 .
- ^ Johns DR, Neufeld MJ, Park RD (1992). «Мутация митохондриальной ДНК ND-6, связанная с наследственной оптической нейропатией Лебера». Biochem Biophys Res Commun . 187 (3): 1551– 1557. doi : 10.1016/0006-291x(92)90479-5 . PMID 1417830.
- ^ Sahel, JA; Uretsky, S.; Combal, JP; Galy, A.; Thomasson, N.; Fitoussi, S.; Corral-Debrinsky, M.; Honnet, G.; Vignal, C. (июнь 2015 г.). «Предварительные результаты безопасности и переносимости интравитреального введения GS010, рекомбинантного аденоассоциированного вирусного вектора серотипа 2 (rAAV2/2), содержащего ген митохондриальной НАДН-дегидрогеназы 4 (ND4) человека дикого типа у пациентов с наследственной оптической нейропатией Лебера (LHON) из-за мутации митохондриальной ДНК G11778A ND4». Invest. Ophthalmol. Vis. Sci . 56 (7): 1088. Получено 22 марта 2016 г.
- ^ Бирк, А.В.; Лю, С.; Сунг, И.; Миллс, В.; Сингх, П.; Уоррен, Дж.Д.; Сешан, С.В.; Парди, Дж.Д.; Сзето, Х.Х. (июль 2013 г.). «Митохондриально-таргетированное соединение SS-31 регенерирует ишемические митохондрии, взаимодействуя с кардиолипином». J Am Soc Nephrol . 24 (8): 1250– 61. doi :10.1681/ASN.2012121216. PMC 3736700. PMID 23813215 .
- ^ Thomas, DA; Stauffer, C.; Zhao, K.; Yang, H.; Sharma, VK; Szeto, HH; Suthanthiran, M. (январь 2007 г.). «Митохондриальное нацеливание с помощью антиоксидантного пептида SS-31 предотвращает деполяризацию митохондрий, снижает апоптоз островковых клеток, увеличивает выход островковых клеток и улучшает посттрансплантационную функцию». J Am Soc Nephrol . 18 (1): 213– 222. doi : 10.1681/asn.2006080825 . PMID 17151329 . Получено 22 марта 2016 г. .
- ^ Brown DA; Hale SL; Baines CP; et al. (январь 2014 г.). «Уменьшение раннего реперфузионного повреждения с помощью пептида, нацеленного на митохондрии, bendavia». J Cardiovasc Pharmacol Ther . 19 (1): 121– 132. doi :10.1177/1074248413508003. PMC 4103197. PMID 24288396.
Дальнейшее чтение
- «Наследственная оптическая нейропатия Лебера». MedlinePlus.gov . Получено 01.01.2025 .
- Kerrison JB, Newman NJ (1997). «Клинический спектр наследственной оптической нейропатии Лебера» (переиздания IFOND) . Clin. Neurosci . 4 (5): 295–301 . PMID 9292259.
- Карелли В., Росс-Сиснерос Ф.Н., Садун А.А. (январь 2004 г.). «Митохондриальная дисфункция как причина оптических нейропатий». Prog Retin Eye Res . 23 (1): 53– 89. doi :10.1016/j.preteyeres.2003.10.003. PMID 14766317. S2CID 15862778.
Внешние ссылки
- Реестр генетического тестирования NCBI