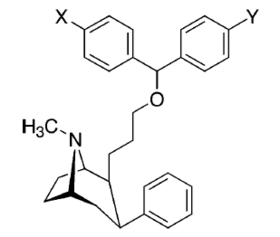
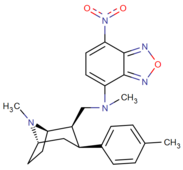
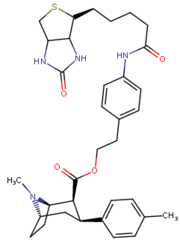
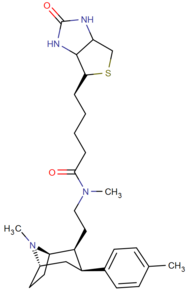
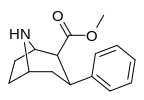
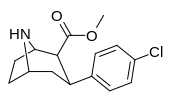
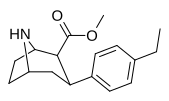
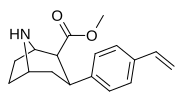
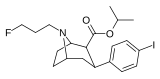
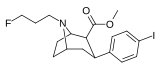
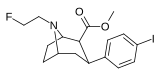
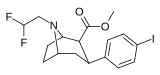
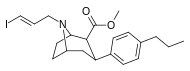
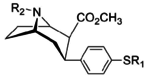
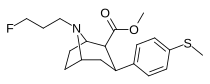
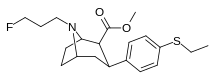
Список фенилтропанов
This article may require cleanup to meet Wikipedia's quality standards. The specific problem is: unencyclopediac details in tables: compound-numbers specific to certain references ("7e", for example). (May 2019) |
Фенилтропаны ( PT ) — это семейство химических соединений, изначально полученных путем структурной модификации кокаина . Главной особенностью, отличающей фенилтропаны от кокаина, является то, что у них отсутствует эфирная функциональность в 3-м положении, заканчивающемся бензолом ; и, таким образом, фенил присоединен непосредственно к тропановому скелету без дополнительного спейсера (отсюда название « фенил »-тропан), который обеспечивал бензоилокси кокаина . Первоначальной целью было искоренить кардиотоксичность , присущую местной анестезирующей «обезболивающей» способности кокаина (поскольку метилированный бензоатный эфир необходим для блокировки натриевых каналов кокаина , которые вызывают местную анестезию), при сохранении стимулирующей функции. [a] Эти соединения представляют множество различных направлений исследований в области терапевтического применения, особенно в лечении наркомании. Применение варьируется в зависимости от их конструкции и взаимосвязи структура-активность , начиная от лечения кокаиновой зависимости и понимания дофаминовой системы вознаграждения в человеческом мозге до лечения болезней Альцгеймера и Паркинсона . (С 2008 года список и перечисление множества типов химических веществ, которые попадают в категорию этого профиля веществ, постоянно дополняются. [2] ) Некоторые фенилтропаны могут даже использоваться в качестве средства, помогающего бросить курить ( ср. RTI-29). Многие из соединений были впервые объяснены в опубликованных материалах Research Triangle Institute и поэтому названы с помощью серийных номеров "RTI" (в этом случае длинная форма - либо RTI-COC- n , для "аналога" 'кокаина', либо конкретно RTI-4229- n из последующих номеров, приведенных ниже в этой статье) [b] Аналогично, ряд других названы в честь фармацевтических компаний Sterling-Winthrop (серийные номера "WIN") и Wake Forest University (серийные номера "WF"). Ниже перечислены многие из класса фенилтропанов, которые были созданы и изучены.

2-Карбоксиметиловые эфиры (фенилметиловыеэкгонины)





Подобно кокаину, фенилтропаны считаются «типичными» или «классическими» (т. е. «подобными кокаину») лигандами насоса обратного захвата DAT, поскольку они стабилизируют «открытую наружу» конформацию на транспортере дофамина; несмотря на чрезвычайное сходство с фенилтропанами, бензтропин и другие таким образом не считаются «подобными кокаину», а вместо этого считаются атипичными ингибиторами, поскольку они стабилизируют то, что считается более обращенным внутрь (закрытым наружу) конформационным состоянием. [5]
Учитывая различия между ПТ и кокаином: разница в длине бензоилокси и фенильной связи, контрастирующая между кокаином и фенилтропанами, приводит к более короткому расстоянию между центроидом ароматического бензола и мостиковым азотом тропана в последних ПТ. Это расстояние находится в масштабе 5,6 Å для фенилтропанов и 7,7 Å для кокаина или аналогов с нетронутым бензоилокси. [c] Способ, которым это устанавливает фенилтропаны в связывающий карман в МАТ, постулируется как одно из возможных объяснений для учета повышенного профиля поведенческой стимуляции ПТ по сравнению с кокаином. [d]
Пробелы внутри таблиц для пропущенных данных обозначаются как « нет данных », « ? », « - » или « — » взаимозаменяемо.
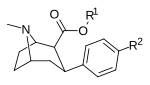
Структура | Краткое название , т.е. тривиальное название ИЮПАК (несистематическое) ( № Сингха ) | R ( пара -замещение) бензола | DA [ 3 H] WIN 35428 IC 50 нМ ( K i нМ) | 5HT [ 3 H]пароксетин IC 50 нМ ( K i нМ) | NE [ 3 H]низоксетин IC 50 нМ ( K i нМ) | селективность 5-HTT/DAT | селективность NET/DAT |
|---|---|---|---|---|---|---|---|
| кокаин (бензоилокситропан) | ЧАС | 102 ± 12 241 ± 18 ɑ | 1045 ± 89 112 ± 2 б | 3298 ± 293 160 ± 15 с | 10.2 0.5 дн. | 32,3 0,7 е | |
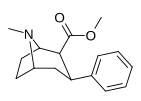 | ( пара -водород)фенилтропан WIN 35,065-2 (β-CPT [e] ) Тропарил 11a | ЧАС | 23 ± 5,0 49,8 ± 2,2 ɑ | 1962 ± 61 173 ± 13 б | 920 ± 73 37,2 ± 5,2 с | 85,3 3,5 дн. | 40,0 0,7 е |
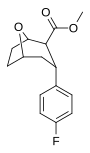
 | пара -фторфенилтропан WIN 35,428 (β-CFT [f] ) 11b | Ф | 14 (15,7 ± 1,4) 22,9 ± 0,4 ɑ | 156 (810 ± 59) 100 ± 13 б | 85 (835 ± 45) 38,6 ± 9,9 с | 51,6 4,4 дн. | 53,2 1,7 е |
 | пара -нитрофенилтропан 11k | НЕТ 2 | 10,1 ± 0,10 | ? | ? | ? | ? |
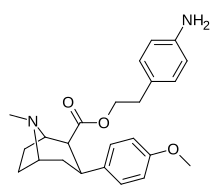
 | пара- аминофенилтропан RTI-29 [6] 11j | NH2 | 9,8 24,8 ± 1,3 г | 5110 | 151 | 521.4 | 15.4 |
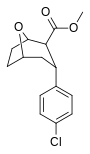
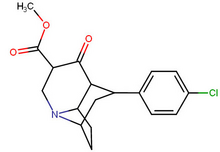
 | пара -хлорфенилтропан RTI-31 11c | Кл | 1,12 ± 0,06 3,68 ± 0,09 ɑ | 44,5 ± 1,3 5,00 ± 0,05 б | 37 ± 2,1 5,86 ± 0,67 с | 39,7 1,3 дн. | 33,0 1,7 е |
 | пара- метилфенилтропан RTI-32 Толпан 11f | Мне | 1,71 ± 0,30 7,02 ± 0,30 ɑ | 240 ± 27 19,38 ± 0,65 б | 60 ± 0,53 е 8,42 ± 1,53 с | 140 2,8 дн. | 35,1 1,2 е |
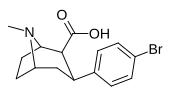
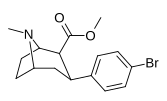 | пара -бромфенилтропан RTI-51 Бромопан 11d | Бр | 1,81 (1,69) ± 0,30 | 10,6 ± 0,24 | 37,4 ± 5,2 | 5.8 | 20.7 |
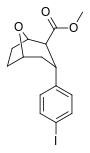
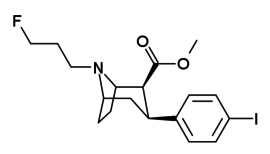
 | пара- иодофенилтропан RTI-55 (β-CIT) Иометопан 11e | я | 1,26 ± 0,04 1,96 ± 0,09 ɑ | 4,21 ± 0,3 1,74 ± 0,23 б | 36 ± 2,7 7,51 ± 0,82 с | 3,3 0,9 дн. | 28,6 3,8 е |
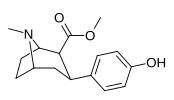 | пара -гидроксифенилтропан 11h | ОЙ | 12,1 ± 0,86 | — | — | — | — |
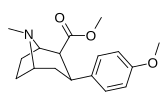 | пара -метоксифенилтропан 11i | ОСН 3 | 8,14 ± 1,3 | — | — | — | — |
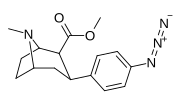 | пара -азидофенилтропан 11л | Н 3 | 2,12 ± 0,13 | — | — | — | — |
 | пара -трифторметилфенилтропан 11м | CF3 | 13,1 ± 2,2 | — | — | — | — |
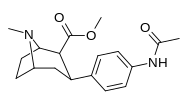 | пара- ацетиламинофенилтропан 11n | NHCOCH3 | 64,2 ± 2,6 | — | — | — | — |
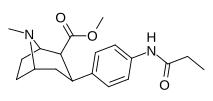 | пара -пропиониламинофенилтропан 11o | NHCOC2H5 | 121 ± 2,7 | — | — | — | — |
 | пара -этоксикарбониламинофенилтропан 11p | NHCO2C3H5 | 316 ± 48 | — | — | — | — |
 | пара -триметилстаннилфенилтропан 11q | Sn( CH3 ) 3 | 144 ± 37 | — | — | — | — |
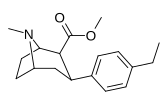 | пара -этилфенилтропан РТИ-83 11г | Эт | 55 ± 2,1 | 28,4 ± 3,8 (2,58 ± 3,5) | 4030 (3910) ± 381 (2360 ± 230) | 0,5 | 73.3 |
 | пара - н -пропилфенилтропан РТИ-282 i 11r | н - С3Н7 | 68,5 ± 7,1 | 70,4 ± 4,1 | 3920 ± 130 | 1.0 | 57.2 |
 | пара -изопропилфенилтропан 11s | СН( СН3 ) 2 | 597 ± 52 | 191 ± 9,5 | 75000 ± 5820 | 0.3 | 126 |
 | пара -винилфенилтропан РТИ-359 11т | СН-СН 2 | 1,24 ± 0,2 | 9,5 ± 0,8 | 78 ± 4,1 | 7.7 | 62.9 |
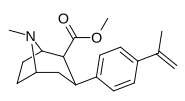 | пара- метилэтенилфенилтропан RTI-283 j 11u | С(= СН2 ) СН3 | 14,4 ± 0,3 | 3,13 ± 0,16 | 1330 ± 333 | 0.2 | 92.4 |
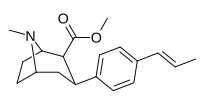 | пара - транс -пропенилфенилтропан RTI-296 i 11v | транс -CH=CHCH 3 | 5,29 ± 0,53 | 11,4 ± 0,28 | 1590 ± 93 | 2.1 | 300 |
 | пара -аллилфенилтропан 11x | СН 2 СН=СН 2 | 32,8 ± 3,1 | 28,4 ± 2,4 | 2480 ± 229 | 0.9 | 75,6 |
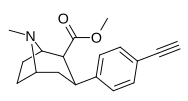 | пара -этинилфенилтропан РТИ-360 11л | С≡СН | 1,2 ± 0,1 | 4,4 ± 0,4 | 83,2 ± 2,8 | 3.7 | 69.3 |
 | пара -пропинилфенилтропан RTI-281 i 11z | С≡ССН 3 | 2,37 ± 0,2 | 15,7 ± 1,5 | 820 ± 46 | 6.6 | 346 |
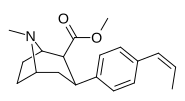 | пара - цис - пропенилфенилтропан RTI-304 11w | цис -СН=СНСН 3 | 15 ± 1,2 | 7,1 ± 0,71 | 2800 к ± 300 | 0,5 | 186,6 тыс. |
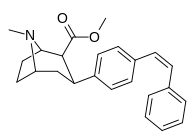 | пара- ( Z )-фенилэтенилфенилтропан | цис-CH=CHPh | 11,7 ± 1,12 | — | — | — | — |
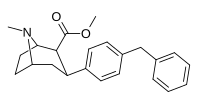 | пара -бензилфенилтропан | -СН 2 -Ф | 526 ± 65 | 7240 ± 390 (658 ± 35) | 6670 ± 377 (606 ± 277) | 13.7 | 12.6 |
 | пара- фенилэтенилфенилтропан | CH 2 ║ -C-Ph | 474 ± 133 | 2710 ± 800 (246 ± 73) | 7060 ± 1760 (4260 ± 1060) | 5.7 | 14.8 |
 | пара- фенилэтилфенилтропан l | -(СН 2 ) 2 -Ф | 5,14 ± 0,63 | 234 ± 26 (21,3 ± 2,4) | 10,8 ± 0,3 (6,50 ± 0,20) | 45,5 | 2.1 |
 | пара- ( E )-фенилэтенилфенилтропан l RTI-436 | транс –CH=CHPh | 3,09 ± 0,75 | 335 ± 150 (30,5 ± 13,6) | 1960 ± 383 (1180 ± 231) | 108.4 | 634.3 |
 | пара -фенилпропилфенилтропан l | -(СН 2 ) 3 -Ф | 351 ± 52 | 1243 ± 381 (113 ± 35) | 14 200 ± 1 800 (8 500 ± 1 100) | 3.5 | 40.4 |
 | пара -фенилпропенилфенилтропан l | -СН=СН-СН 2 -Ф | 15,8 ± 1,31 | 781 ± 258 (71 ± 24) | 1250 ± 100 (759 ± 60) | 49.4 | 79.1 |
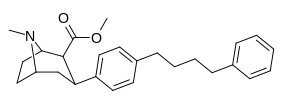 | пара -фенилбутилфенилтропан l | -(СН 2 ) 4 -Ф | 228 ± 21 | 4824 ± 170 (439 ± 16) | 2310 ± 293 (1390 ± 177) | 21.1 | 10.1 |
 | пара -фенилэтинилфенилтропан l RTI-298 [7] | –≡–Ф | 3,7 ± 0,16 | 46,8 ± 5,8 (4,3 ± 0,53) | 347 ± 25 (209 ± 15) | 12.6 | 93,7 |
 | пара- фенилпропинилфенилтропан l [8] | –C≡C-CH 2 Ph | 1,82 ± 0,42 | 13,1 ± 1,7 (1,19 ± 0,42) | 27,4 ± 2,6 (16,5 ± 1,6) | 7.1 | 15 |
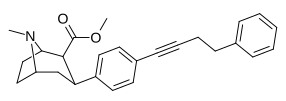 | пара- фенилбутинилфенилтропан l RTI-430 | –C≡C ( CH2 ) 2Ph | 6,28 ± 1,25 | 2180 ± 345 (198 ± 31) | 1470 ± 109 (885 ± 66) | 347.1 | 234 |
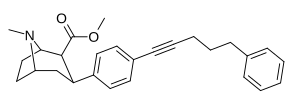 | пара- фенилпентинилфенилтропан l | –C≡C-(CH2 ) 3 - Ph | 300 ± 37 | 1340 ± 232 (122 ± 21) | 4450 ± 637 (2680 ± 384) | 4.46 | 14.8 |
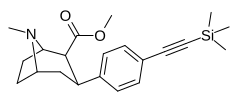 | пара -триметилсилилэтинилфенилтропан [3] | — | — | — | — | — | — |
 | пара -гидроксипропинилфенилтропан [3] | — | — | — | — | — | — |
 | пара -гидроксигексинилфенилтропан l | –C≡C- ( CH2 ) 4OH | 57 ± 4 | 828 ± 29 (75 ± 2,6) | 9500 ± 812 (5720 ± 489) | 14.5 | 166.6 |
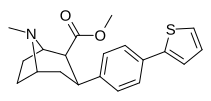
 | пара- (тиофен-3-ил)фенилтропан Таманьян [4] | п - тиофен | 12 | 0,017 | 189 | 0,001416 | 15.7 |
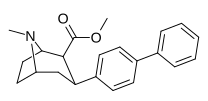 | пара -бифенилтропан 11аа | Ф | 10,3 ± 2,6 f 29,4 ± 3,8 ɑ 15,6 ± 0,6 | 95,8 ± 36 (8,7 ± 3,3) | 1480 ± 269 (892 ± 162) | 6.1 | 94,8 |
 | 3β-2-нафтилтропан RTI-318 11bb | 3β-2- нафтил | 0,51 ± 0,03 3,32 ± 0,08 3,53 ± 0,09 ɑ | 0,80 ± 0,06 (0,07 ± 0,1) | 21,1 ± 1,0 (12,7 ± 0,60) | 1.5 | 41.3 |
 | пара -биметоксифенилтропан 15 | ОСН 2 ОСН 3 ч | — | — | — | — | — |
|
|
|
(4′-Монозамещенные 2,3-тиофенфенил)-тропаны
(3′,4′-Дизамещенные фенил)-тропаны
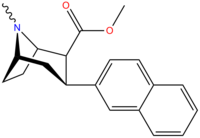
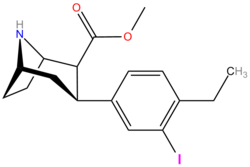

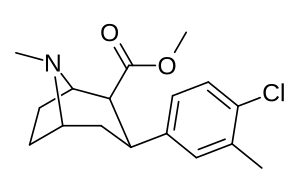
| Соединение (+ имя С. Сингха) | X (4′- пара ) | Y (3′- мета ) | 2 Позиция | конфигурация | 8 | ДА | 5-НТ | СВ |
|---|---|---|---|---|---|---|---|---|
| РТИ-318 11бб | β-нафтил | СО 2 Ме | β,β | НМэ | 0,5 | 0,81 | 20 | |
| Дихлоропан (RTI-111 ɑ ) [10] 17c | Кл | Кл | СО 2 Ме | β,β | НМэ | 0,79 | 3.13 | 18.0 |
| РТИ-88 [перепроверить] 17e | NH2 | я | СО 2 Ме | β,β | НМэ | 1.35 | 1329 г. | 320 с |
| РТИ-97 17д | NH2 | Бр | СО 2 Ме | β,β | НМэ | 3.91 | 181 | 282 |
| РТИ-112 б 17б | Кл | Мне | СО 2 Ме | β,β | НМэ | 0,82 | 10.5 | 36.2 |
| РТИ-96 17а | Ф | Мне | СО 2 Ме | β,β | НМэ | 2.95 | 76 | 520 |
| РТИ-295 | Эт | я | СО 2 Ме | β,β | НМэ | 21.3 | 2.96 | 1349 |
| РТИ-353 (ЭИНТ) | Эт | я | СО 2 Ме | β,β | Нью-Гэмпшир | 331 | 0,69 | 148 |
| РТИ-279 | Мне | я | СО 2 Ме | β,β | Нью-Гэмпшир | 5.98 | 1.06 | 74.3 |
| РТИ-280 | Мне | я | СО 2 Ме | β,β | НМэ | 3.12 | 6.81 | 484 |
| Мельцер [11] | катехол | СО 2 Ме | β,β | НМэ | >100 | ? | ? | |
| Мельцер [11] | ОАс | ОАс | СО 2 Ме | β,β | НМэ | ? | ? | ? |
- ɑ как ·HCl (соль)
- б как ·HCl·2H2O ( соль)
- c Сингх дает обратное значение по отношению к 1,329 для NET и 320 для 5-HT
Сложный | Короткое имя (С. Сингх) | Р 2 | Р 1 | ДА | 5HT | СВ | Селективность 5-HTT/DAT | Селективность NET/DAT |
|---|---|---|---|---|---|---|---|---|
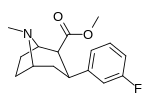 | мета -фторфенилтропан 16а | Ф | ЧАС | 23 ± 7,8 | - | - | - | - |
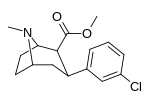 | мета -хлорфенилтропан 16b | Кл | ЧАС | 10,6 ± 1,8 | - | - | - | - |
 | мета -бромфенилтропан 16с | Бр | ЧАС | 7,93 ± 0,08 ɑ | - | - | - | - |
 | мета -иодофенилтропан 16d | я | ЧАС | 26,1 ± 1,7 | - | - | - | - |
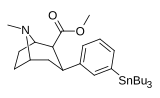 | мета- трибутилстаннилфенилтропан 16e | СнБу 3 | ЧАС | 1100 ± 170 | - | - | - | - |
 | мета -этинилфенилтропан [3] | С≡СН | ЧАС | - | - | - | - | - |
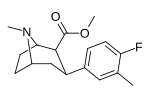 | мета -метил- пара -фторфенилтропан RTI-96 17a | Гл 3 | Ф | 2,95 ± 0,58 | - | - | - | - |
 | мета -метил- пара -хлорфенилтропан RTI-112 c 17b | Гл 3 | Кл | 0,81 ± 0,05 | 10,5 ± 0,05 | 36,2 ± 1,0 | 13.0 | 44,7 |
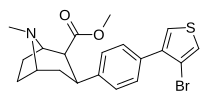
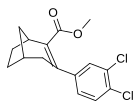
 | мета - пара -дихлорфенилтропан RTI-111 b [10] Дихлоропан 17c | Кл | Кл | 0,79 ± 0,08 б | 3,13 ± 0,36 б | 18,0 ± 0,8 17,96 ± 0,85 ' б' г | 4.0 б | 22,8 б |
 | мета -бром- пара- аминофенилтропан RTI-97 17d | Бр | NH2 | 3,91 ± 0,59 | 181 | 282 | 46.2 | 72.1 |
 | мета -иодо- пара- аминофенилтропан RTI-88 17e | я | NH2 | 1,35 ± 0,11 | 120 ± 4 | 1329 ± 124 | 88.9 | 984 |
 | мета -йод- пара -азидофенилтропан 17f | я | Н 3 | 4,93 ± 0,32 | - | - | - | - |
- ɑ IC 50 определено в хвостатом яванском макаке -путамене
- б как ·HCl (соль)
- c как ·HCl·2H2O ( соль)
- г СВ С
(2′,4′-Дизамещенные фенил)-тропаны
(3′,4′,5′-Трехзамещенныйпара-метоксифенил)-тропаны
Структура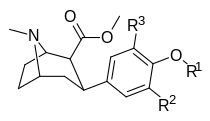 | Краткое название (Все соединения исследованы как соли HCl) | R 2 3′-( мета ) | R 3 5′-(ди- мета ) | О Р 1 4′-( пара ) | DAT IC 50 [ 3 H](соединение №)12 | 5-HTT K i [ 3 H]Пароксетин | NET K i [ 3 H]Низоксетин | Селективность NET/DAT Соотношение K i /IC 50 | Селективность NET/5-HTT Соотношение K i / K i |
|---|---|---|---|---|---|---|---|---|---|
| Кокаин | - | - | - | 89.1 | 95 | 1990 | 22 | 21 | |
| 6 РТИ-112 | - | - | - | 0,82 ± 0,05 | 0,95 ± 0,04 | 21,8 ± 0,6 | 27 | 23 | |
 | 7а 11и | ЧАС | ЧАС | Гл 3 | 6,5 ± 1,3 | 4,3 ± 0,5 | 1110 ± 64 | 171 | 258 |
 | 7б | ЧАС | ЧАС | С2Н5 | 92 ± 8 | 1,7 ± 0,4 | 1690 ± 50 | 18 | 994 |
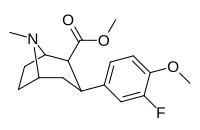 | 7с | Ф | ЧАС | Гл 3 | 16 ± 1 | 4,8 ± 0,5 | 270 ± 50 | 17 | 56 |
 | 7д | Бр | ЧАС | Гл 3 | 47 ± 15 | 3,1 ± 0,1 | 160 ± 20 | 3 | 52 |
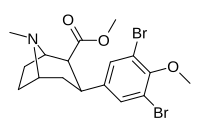 | 7ф | Бр | Бр | Гл 3 | 92 ± 22 | 2,9 ± 0,1 | 4100 ± 400 ɑ | 45 | 1413 |
 | 7е | я | ЧАС | Гл 3 | 170 ± 60 | 3,5 ± 0,4 | 180 ± 20 | 1 | 51 |
 | 7г | я | я | Гл 3 | 1300 ± 200 | 7,5 ± 0,8 | 180 ± 20 | 4 | 667 |
ɑ N=2
(2′,4′,5′-Тризамещенные фенил)-тропаны
2-Карбметокси модифицированный (замененный/замещенный)
Общие 2-карбметокси модификации
2β-заменып-метокси-фенилтропаны
ɑ N=2
2β-карбокси-боковая цепь (п-хлор/йод/метил) фенилтропаны
- ɑ Значение Ki для смещения поглощения [ 3 H]DA.
- б Значение Ki для смещения поглощения [ 3 H]5-HT.
- c Значение Ki для смещения поглощения [ 3 H]NE.
- d Соотношение поглощения [ 3 H]5-HT к поглощению [ 3 H]DA.
- e Соотношение поглощения [ 3 H]NE к поглощению [ 3 H]DA.
Карбоксиарил
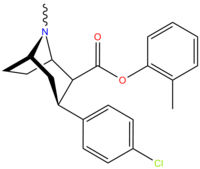


| Сложный | Х | 2 Позиция | конфигурация | 8 | ДА | 5-НТ | СВ |
|---|---|---|---|---|---|---|---|
| РТИ-122 | я | -CO2 Ф | β,β | НМэ | 1.50 | 184 | 3,791 |
| РТИ-113 | Кл | -CO2 Ф | β,β | НМэ | 1.98 | 2,336 | 2,955 |
| РТИ-277 | НЕТ 2 | -CO2 Ф | β,β | НМэ | 5.94 | 2,910 | 5,695 |
| РТИ-120 [перепроверить] | Мне | -CO2 Ф | β,β | НМэ | 3.26 | 24,471 | 5,833 |
| РТИ-116 | Кл | -CO 2 ( п -C 6 H 4 I) | β,β | НМэ | 33 | 1,227 | 968 |
| РТИ-203 | Кл | CO2 ( м - C6H4Me ) | β,β | НМэ | 9.37 | 2153 | 2744 |
| РТИ-204 | Кл | -CO2 ( o - C6H4Me ) | β,β | НМэ | 3.91 | 3,772 | 4,783 |
| РТИ-205 | Мне | -CO 2 ( м -C 6 H 4 Me) | β,β | НМэ | 8.19 | 5,237 | 2,137 |
| РТИ-206 | Кл | -CO 2 ( п -C 6 H 4 Me) | β,β | НМэ | 27.4 | 1,203 | 1,278 |
2-Фенил-3-Фенилтропаны
Карбоксиалкил
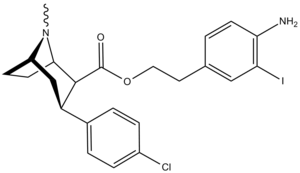
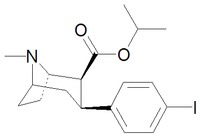
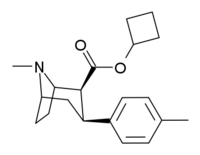
| Код | Х | 2 Позиция | конфигурация | 8 | ДА | 5-НТ | СВ |
|---|---|---|---|---|---|---|---|
| РТИ-77 | Кл | CH 2 C 2 (3-йод- п -анилино) | β,β | НМэ | 2.51 | — | 2247 |
| РТИ-121 ИПСИТ | я | -CO 2 Pr i | β,β | НМэ | 0,43 | 66.8 | 285 |
| РТИ-153 | я | -CO 2 Pr i | β,β | Нью-Гэмпшир | 1.06 | 3.59 | 132 |
| РТИ-191 | я | -CO 2 Pr цикл | β,β | НМэ | 0,61 | 15.5 | 102 |
| РТИ-114 | Кл | -CO 2 Pr i | β,β | НМэ | 1.40 | 1,404 | 778 |
| РТИ-278 | НЕТ 2 | -CO 2 Pr i | β,β | НМэ | 8.14 | 2,147 | 4,095 |
| РТИ-190 | Кл | -CO 2 Pr цикл | β,β | НМэ | 0,96 | 168 | 235 |
| РТИ-193 | Мне | -CO 2 Pr цикл | β,β | НМэ | 1.68 | 1,066 | 644 |
| РТИ-117 | Мне | -CO 2 Pr i | β,β | НМэ | 6.45 | 6,090 | 1,926 |
| РТИ-150 | Мне | -CO 2 Bu цикл | β,β | НМэ | 3.74 | 2,020 | 4,738 |
| РТИ-127 | Мне | -CO2C ( H ) Et2 | β,β | НМэ | 19 | 4500 | 3444 |
| РТИ-338 | этил | -CO2C2Ph | β,β | НМэ | 1104 | 7.41 | 3366 |
Использование циклопропилового эфира, по-видимому, обеспечивает лучшее удержание МАТ , чем выбор изопропилового эфира.
Использование cyc Bu привело к большей селективности DAT , чем гомолог cyc Pr .
2-Алкиловые эфиры и простые эфиры
Эфиры (2-алкил)
Эфиры (2-алкил)
См. гомологи N-десметилпароксетина
Карбоксамиды
Патент США 5,736,123
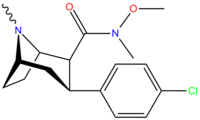
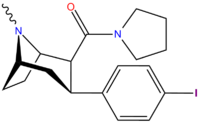

Структура | Код ( С. Сингх # ) | Х | 2 Позиция | конфигурация | 8 | DA [ 3 H]WIN 35428 (IC 50 нМ) | NE [ 3 H]низоксетин | 5-HT [ 3 H]пароксетин (IC 50 нМ) | Селективность 5-HTT/DAT | Селективность NET/DAT |
|---|---|---|---|---|---|---|---|---|---|---|
 | РТИ-106 27б | Кл | КОН(Х)Мне | β,β | НМэ | 12,4 ± 1,17 | 1584 ± 62 | 1313 ± 46 | 106 | 128 |
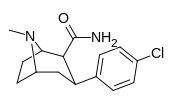 | РТИ-118 27а | Кл | КОНХ 2 | β,β | НМэ | 11,5 ± 1,6 | 4270 ± 359 | 1621 ± 110 | 141 | 371 |
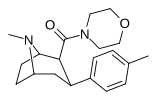 | РТИ-222 29д | Мне | морфолинил | β,β | НМэ | 11,7 ± 0,87 | 23601 ± 1156 | >100К | >8547 | 2017 |
 | РТИ-129 27е | Кл | КОНМЕ 2 | β,β | НМэ | 1,38 ± 0,1 | 942 ± 48 | 1079 ± 102 | 792 | 683 |
 | РТИ-146 27д | Кл | КОННСН2ОН | β,β | НМэ | 2,05 ± 0,23 | 144 ± 3 | 97,8 ± 10 | 47.7 | 70.2 |
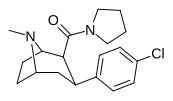 | РТИ-147 27и | Кл | КОН(СН 2 ) 4 | β,β | НМэ | 1,38 ± 0,03 | 3950 ± 72 | 12400 ± 1207 | 8985 | 2862 |
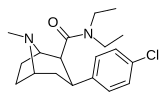 | РТИ-156 | Кл | КОН(СН 2 ) 5 | β,β | НМэ | 6.61 | 5832 | 3468 | ||
 | РТИ-170 | Кл | КОН(Н)СН 2 С≡СН | β,β | НМэ | 16.5 | 1839 | 4827 | ||
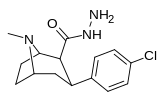 | РТИ-172 | Кл | КОН(Н)NH 2 | β,β | НМэ | 44.1 | 3914 | 3815 | ||
 | РТИ-174 | Кл | КОНХКОМе | β,β | НМэ | 158 | >43К | >125К | ||
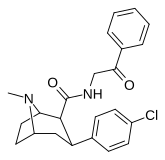 | РТИ-182 | Кл | КОННХ 2 КОФ | β,β | НМэ | 7.79 | 1722 | 827 | ||
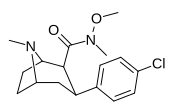 | РТИ-183 ✲ 27 г | Кл | КОН(ОМе)Ме | β,β | НМэ | 0,85 ± 0,06 | 549 ± 18,5 | 724 ± 94 | 852 | 646 |
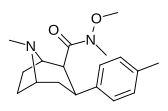 | РТИ-186 29с | Мне | КОН(ОМе)Ме | β,β | НМэ | 2,55 ± 0,43 | 422 ± 26 | 3402 ± 353 | 1334 | 165 |
 | РТИ-198 27ч | Кл | КОН(СН 2 ) 3 | β,β | НМэ | 6,57 ± 0,67 | 990 ± 4,8 | 814 ± 57 | 124 | 151 |
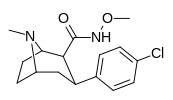 | РТИ-196 27с | Кл | КОНХОМЕ | β,β | НМэ | 10,7 ± 1,25 | 9907 ± 632 | 43700 ± 1960 | 4084 | 926 |
 | РТИ-201 | Кл | КОНХНХКОФ | β,β | НМэ | 91,8 | >20К | >48К | ||
 | РТИ-208 27ж | Кл | КОНО( СН2 ) 3 | β,β | НМэ | 1,47 ± 0,13 | 1083 ± 76 | 2470 ± 56 | 1680 | 737 |
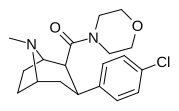 | РТИ-214 27л | Кл | КОН(-СН 2 СН 2 -) 2 О | β,β | НМэ | 2,90 ± 0,3 | 8545 ± 206 | 88769 ± 1855 | 30610 | 2946 |
 | РТИ-215 27ф | Кл | КОНЕТ 2 | β,β | НМэ | 5,48 ± 0,19 | 5532 ± 299 | 9433 ± 770 | 1721 | 1009 |
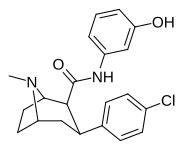 | РТИ-217 | Кл | CONH ( м - C6H4OH ) | β,β | НМэ | 4.78 | >30К | >16К | ||
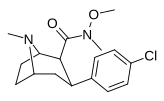 | РТИ-218 ✲ | Кл | КОН(Я)ОМе | β,β | НМэ | 1.19 | 520 | 1911 | ||
 | РТИ-226 27 м | Кл | КОНМеФ | β,β | НМэ | 45,5 ± 3 | 2202 ± 495 | 23610 ± 2128 | 519 | 48.4 |
 | РТИ-227 | я | КОНО( СН2 ) 3 | β,β | НМэ | 0,75 | 446 | 230 | ||
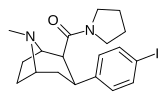 | РТИ-229 [16] 28а | я | КОН(СН 2 ) 4 | β,β | НМэ | 0,37 ± 0,04 | 991 ± 21 | 1728 ± 39 | 4670 | 2678 |
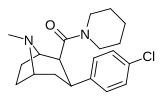 | 27 тыс. | 6,95 ± 1,21 | 1752 ± 202 | 3470 ± 226 | 499 | 252 | ||||
 | 28б | 1,08 ± 0,15 | 103 ± 6,2 | 73,9 ± 8,1 | 68.4 | 95,4 | ||||
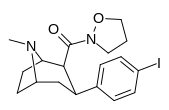 | 28с | 0,75 ± 0,02 | 357 ± 42 | 130 ± 15,8 | 173 | 476 | ||||
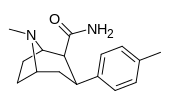 | 29а | 41,8 ± 2,45 | 4398 ± 271 | 6371 ± 374 | 152 | 105 | ||||
 | 29б | 24,7 ± 1,93 | 6222 ± 729 | 33928 ± 2192 | 1374 | 252 |
✲RTI-183 и RTI-218 предполагают возможную ошибку копирования, поскольку разница в «CON(OMe)Me» и «CON(Me)OMe» между метилом и метокси описывается как одно и то же.
Димеры фенилтропанов, связанные с карбоксамидом

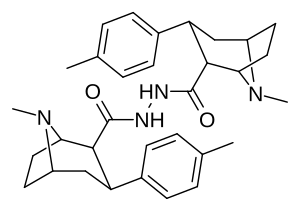
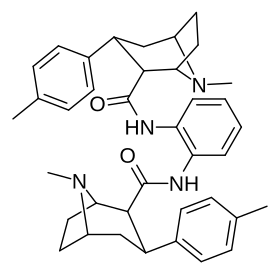
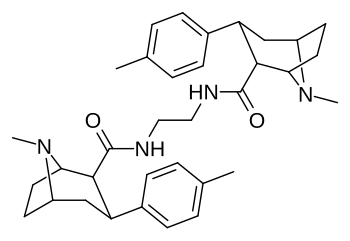

Димеры фенилтропанов, соединенные в их двойной форме с использованием локанта C2, измененного в сторону структурной конфигурации карбоксамида (в отличие от обычного присущего экгонину карбметокси), согласно патенту Фрэнка Айви Кэрролла, включающему такие химические соединения, возможно, запатентованы таким образом из-за того, что они активно задерживаются в качестве пролекарств in vivo . [3]
Гетероциклы
Эти гетероциклы иногда называют « биоизостерическими эквивалентами» более простых эфиров, из которых они получены. Потенциальным недостатком оставления ββ-эфира непрореагировавшим является то, что в дополнение к тому, что он гидролизуется, он также может эпимеризоваться [17] в энергетически более выгодную транс-конфигурацию. Это может произойти и с кокаином.

(модель соединения 34 )
Несколько оксадиазолов содержат одинаковое количество и типы гетероатомов, в то время как их соответствующие связывающие способности демонстрируют разницу в 8×-15×. Это открытие не может быть объяснено их сродством, возникающим из-за водородных связей.
Для исследования возможности электростатических взаимодействий были использованы молекулярные электростатические потенциалы (МЭП) с модельным соединением 34 (замена фенилтропанового фрагмента метильной группой). Сосредоточившись на близости атомов @ позиций A—C, минимумы электростатического потенциала вблизи позиции атома A (Δ V min (A)), рассчитанные с помощью полуэмпирических ( AM1 ) квантово-механических вычислений (наложение гетероциклических и фенильных колец для установления наименьших стерических и конформационных расхождений), обнаружили корреляцию между сродством @ DAT и Δ V min (A): где значения для последнего для 32c = 0, 32g = -4, 32h = -50 и 32i = -63 ккал/моль.
В отличие от этой тенденции, понятно, что все более отрицательная Δ V min коррелирует с увеличением прочности водородных связей, что является противоположной тенденцией для вышеизложенного; это указывает на то, что 2β-заместители (по крайней мере для гетероциклического класса) доминируют за счет электростатических факторов для связывания вместо предполагаемой модели водородных связей для этого заместителя кокаиноподобного связывающего лиганда. [g]
3-Замещенный-изоксазол-5-ил
| Код (SS #) | Х | Р | ДА | СВ | 5HT |
|---|---|---|---|---|---|
| РТИ-165 | Кл | 3-метилизоксазол-5-ил | 0,59 | 181 | 572 |
| РТИ-171 | Мне | 3-метилизоксазол-5-ил | 0,93 | 254 | 3818 |
| РТИ-180 | я | 3-метилизоксазол-5-ил | 0,73 | 67.9 | 36.4 |
| RTI-177 β-CPPIT 32г | Кл | 3-фенилизоксазол-5-ил | 1,28 ± 0,18 | 504 ± 29 | 2420 ± 136 |
| РТИ-176 | Мне | 3-фенилизоксазол-5-ил | 1.58 | 398 | 5110 |
| РТИ-181 | я | 3-фенилизоксазол-5-ил | 2.57 | 868 | 100 |
| РТИ-184 | ЧАС | метил | 43.3 | — | 6208 |
| РТИ-185 | ЧАС | Ф | 285 | — | >12К |
| РТИ-334 | Кл | 3-этилизоксазол-5-ил | 0,50 | 120 | 3086 |
| РТИ-335 | Кл | изопропиловый | 1.19 | 954 | 2318 |
| РТИ-336 | Кл | 3-(4-метилфенил)изоксазол-5-ил | 4.09 | 1714 | 5741 |
| РТИ-337 | Кл | 3-трет-бутил-изоксазол-5-ил | 7.31 | 6321 | 37К |
| РТИ-345 | Кл | п -хлорфенил | 6.42 | 5290 | >76К |
| РТИ-346 | Кл | п -анизил | 1.57 | 762 | 5880 |
| РТИ-347 | Кл | п -фторфенил | 1.86 | 918 | 7257 |
| РТИ-354 | Мне | 3-этилизоксазол-5-ил | 1.62 | 299 | 6400 |
| РТИ-366 | Мне | R = изопропил | 4.5 | 2523 (1550) | 42,900 (3900) |
| РТИ-371 | Мне | п -хлорфенил | 8.74 | >100 тыс. (60 200) | >100К (9090) |
| РТИ-386 | Мне | п -анизил | 3.93 | 756 (450) | 4027 (380) |
| РТИ-387 | Мне | п -фторфенил | 6.45 | 917 (546) | >100К (9400) |
3-Замещенный-1,2,4-оксадиазол

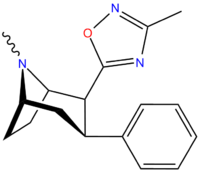
| Структура | Код ( № Сингха ) | Х | Р | DAT (IC 50 нМ ) смещение [H 3 ]WIN 35428 | NET (IC 50 нМ ) [H 3 ]низоксетин | 5-HTT (IC 50 нМ ) [H 3 ]пароксетин | Селективность 5-HTT/DAT | Селективность NET/DAT |
|---|---|---|---|---|---|---|---|---|
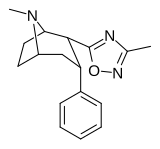 | ααRTI-87 | ЧАС | 3-метил-1,2,4-оксадиазол | 204 | 36К | 30К | ||
 | βαRTI-119 | ЧАС | 3-метил-1,2,4-оксадиазол | 167 | 7К | 41К | ||
 | αβRTI-124 | ЧАС | 3-метил-1,2,4-оксадиазол | 1028 | 71К | 33К | ||
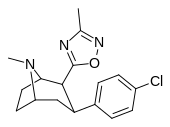 | РТИ-125 (32а) | Кл | 3-метил-1,2,4-оксадиазол | 4,05 ± 0,57 | 363 ± 36 | 2584 ± 800 | 637 | 89,6 |
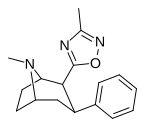 | ββ РТИ-126 [18] (31) | ЧАС | 3-метил-1,2,4-оксадиазол | 100 ± 6 | 7876 ± 551 | 3824 ± 420 | 38.3 | 788 |
 | РТИ-130 (32с) | Кл | 3-фенил-1,2,4-оксадиазол | 1,62 ± 0,02 | 245 ± 13 | 195 ± 5 | 120 | 151 |
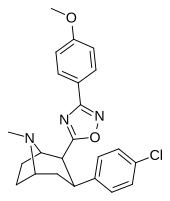 | РТИ-141 (32д) | Кл | 3-( п -анизил)-1,2,4-оксадиазол | 1,81 ± 0,19 | 835 ± 8 | 337 ± 40 | 186 | 461 |
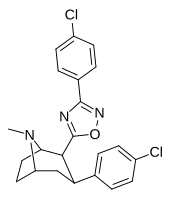 | РТИ-143 (32е) | Кл | 3-( п -хлорфенил)-1,2,4-оксадиазол | 4,06 ± 0,22 | 40270 ± 180 (4069) | 404 ± 56 | 99,5 | 9919 |
 | РТИ-144 (32ф) | Кл | 3-( п -бромфенил)-1,2,4-оксадиазол | 3,44 ± 0,36 | 1825 ± 170 | 106 ± 10 | 30.8 | 532 |
 | βRTI-151 (33) | Мне | 3-фенил-1,2,4-оксадиазол | 2,33 ± 0,26 | 60 ± 2 | 1074 ± 130 | 459 | 25.7 |
 | αРТИ-152 | Мне | 3-фенил-1,2,4-оксадиазол | 494 | — | 1995 | ||
 | РТИ-154 (32б) | Кл | 3-изопропил-1,2,4-оксадиазол | 6,00 ± 0,55 | 135 ± 13 | 3460 ± 250 | 577 | 22.5 |
 | РТИ-155 | Кл | 3-циклопропил-1,2,4-оксадиазол | 3.41 | 177 | 4362 |
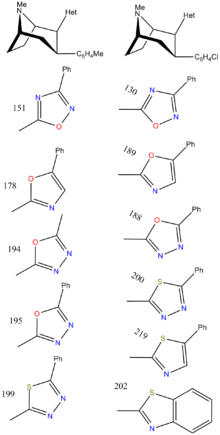

| Структура | Код | Х | 2 Группа | DAT (IC 50 нМ ) смещение [H 3 ]WIN 35428 | NET (IC 50 нМ ) замещение [H 3 ]низоксетина | 5-HTT (IC 50 нМ ) замещение [H 3 ]пароксетина | Селективность 5-HTT/DAT | Селективность NET/DAT |
|---|---|---|---|---|---|---|---|---|
 | РТИ-157 | Мне | тетразол | 1557 | >37К | >43К | ||
 | РТИ-163 | Кл | тетразол | 911 | — | 5456 | ||
 | РТИ-178 | Мне | 5-фенил-оксазол-2-ил | 35.4 | 677 | 1699 | ||
 | РТИ-188 | Кл | 5-фенил-1,3,4-оксадиазол-2-ил | 12.6 | 930 | 3304 | ||
 | РТИ-189 ( 32i ) | Кл | 5-фенил-оксазол-2-ил | 19,7 ± 1,98 | 496 ± 42 | 1120 ± 107 | 56.8 | 25.5 |
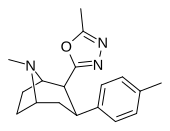 | РТИ-194 | Мне | 5-метил-1,3,4-оксадиазол-2-ил | 4.45 | 253 | 4885 | ||
 | РТИ-195 | Мне | 5-фенил-1,3,4-оксадиазол-2-ил | 47,5 | 1310 | >22,000 | ||
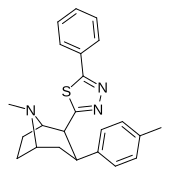 | РТИ-199 | Мне | 5-фенил-1,3,4-тиадиазол-2-ил | 35.9 | >24,000 | >51,000 | ||
 | РТИ-200 | Кл | 5-фенил-1,3,4-тиадиазол-2-ил | 15.3 | 4142 | >18000 | ||
 | РТИ-202 | Кл | бензотиазол-2-ил | 1.37 | 403 | 1119 | ||
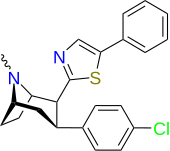 | РТИ-219 | Кл | 5-фенилтиазол-2-ил | 5.71 | 8516 | 10,342 | ||
| РТИ-262 | Кл | 188,2 ± 5,01 | 595,25 ± 5738 | 5207 ± 488 | 316 | 28 | ||
 | РТИ-370 | Мне | 3-( п -крезил)изоксазол-5-ил | 8.74 | 6980 | >100К | ||
 | РТИ-371 | Кл | 3-( п -хлорфенил)изоксазол-5-ил | 13 | >100К | >100К | ||
 | РТИ-436 | Мне | -CH=CHPh [20] | 3.09 | 1960 (1181) | 335 (31) | ||
 | РТИ-470 | Кл | o -Cl-бензотиазол-2-ил | 0,094 | 1590 (994) | 1080 (98) | ||
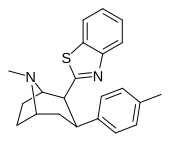 | РТИ-451 | Мне | бензотиазол-2-ил | 1.53 | 476 (287) | 7120 (647) | ||
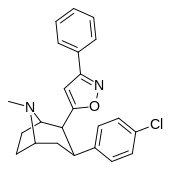 | 32г | 1,28 ± 0,18 | 504 ± 29 | 2420 ± 136 | 1891 | 394 | ||
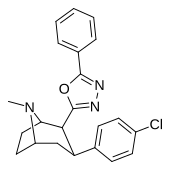 | 32ч | 12,6 ± 10,3 | 929 ± 88 | 330 ± 196 | 262 | 73,7 |

NB Однако существуют и альтернативные способы создания тетразольного кольца; см. схемы синтеза сартановых препаратов. Bu 3 SnN 3 — более мягкий выбор реагента, чем азид водорода ( см. ирбесартан ) .
Ацил (С2-пропаноил)
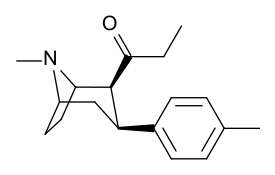
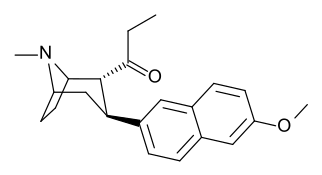

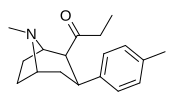
см. ряд фенилтропанов Таманьяна для примеров с метиленовой единицей-спейсером, расщепляющей индол.
| # ( # ) | Х | И | 2 Позиция | конфигурация | 8 | ДА | 5-НТ | СВ |
|---|---|---|---|---|---|---|---|---|
| WF-23 ( 39н ) | β-нафтил | С(О)Эт | β,β | НМэ | 0,115 | 0,394 | Нет данных | |
| WF-31 ПИТ | -Пр я | ЧАС | COET | β,β | НМэ | 615 | 54,5 | Нет данных |
| WF-11 ✲ ПТТ ( 39e ) | Мне | ЧАС | -COEt | β,β | НМэ | 8.2 | 131 | Нет данных |
| WF-25 ( 39а ) | ЧАС | ЧАС | -COEt | β,β | НМэ | 48.3 | 1005 | Нет данных |
| ВФ-33 | 6-МеоБН | С(О)Эт | α,β | НМэ | 0,13 | 2.24 | Нет данных | |
| ✲ Было показано, что соединение WF-11 при постоянном воздействии вызывает биологическую реакцию, противоположную кокаину, а именно снижение экспрессии гена тирозингидроксилазы (вместо повышения, как это наблюдалось в случае хронического приема кокаина) | ||||||||
| Структура | Буквенно-цифровое обозначение С. Сингха (имя) | Р 1 | Р 2 | ДАТ [ 125 I]RTI-55 IC 50 ( нМ ) | 5-HTT [ 3 H]Пароксетин K i ( нМ ) | Избирательность 5-HTT/ДАТ |
|---|---|---|---|---|---|---|
| кокаин | 173 ± 19 | — | — | |||
| Тропарил 11а (WIN 35065-2) | 98,8 ± 12,2 | — | — | |||
 | ВФ-25 39а | С2Н5 | С 6 Н 5 | 48,3 ± 2,8 | 1005 ± 112 | 20.8 |
 | 39б | Гл 3 | С 6 Н 5 | 114 ± 22 | 1364 ± 616 | 12.0 |
 | 39с | С2Н5 | С 6 Н 4 -4-Ф | 15,3 ± 2,8 | 630 ± 67 | 41.2 |
 | 39д | Гл 3 | С 6 Н 4 -4-Ф | 70,8 ± 13 | 857 ± 187 | 12.1 |
 | ВФ-11 39е | С2Н5 | С6Н4-4 - СН3 | 8,2 ± 1,6 | 131 ± 1 | 16.0 |
| (+)-39е | С2Н5 | С6Н4-4 - СН3 | 4,21 ± 0,05 | 74 ± 12 | 17.6 | |
| (-)-39е | С2Н5 | С6Н4-4 - СН3 | 1337 ± 122 | >10000 | — | |
 | 39ф | Гл 3 | С6Н4-4 - СН3 | 9,8 ± 0,5 | 122 ± 22 | 12.4 |
 | 39г | Гл 3 | С6Н4-4 - С2Н5 | 152 ± 24 | 78,2 ± 22 | 0,5 |
 | 39ч | С2Н5 | С6Н4-4 - СН ( СН3 ) 2 | 436 ± 41 | 35,8 ± 4,4 | 0,08 |
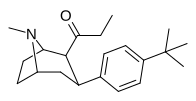 | 39и | С2Н5 | С6Н4-4 - С ( СН3 ) 3 | 2120 ± 630 | 1771 ± 474 | 0.8 |
 | 39ж | С2Н5 | С6Н4-4 - С6Н5 | 2,29 ± 1,08 | 4,31 ± 0,01 | 1.9 |
 | 39 тыс. | С2Н5 | С6Н4-2 - СН3 | 1287 ± 322 | 710000 | >7.8 |
 | 39л | С2Н5 | 1-нафтил | 5,43 ± 1,27 | 20,9 ± 2,9 | 3.8 |
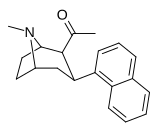 | 39м | Гл 3 | 1-нафтил | 10,1 ± 2,2 | 25,6 ± 5,1 | 2.5 |
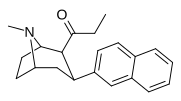 | ВФ-23 39н | С2Н5 | 2-нафтил | 0,115 ± 0,021 | 0,394 ± 0,074 | 3.5 |
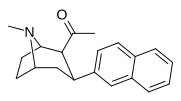 | 39о | Гл 3 | 2-нафтил | 0,28 ± 0,11 | 1,06 ± 0,36 | 3.8 |
 | 39п | С2Н5 | С6Н4-4 - СН ( С2Н5 ) 2 | 270 ± 38 | 540 ± 51 | 2.0 |
 | 39q | С2Н5 | С6Н4-4 - С6Н11 | 320 ± 55 | 97 ± 12 | 0.30 |
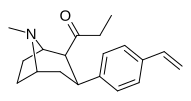 | 39р | С2Н5 | С6Н4-4 - СН = СН2 | 0,90 ± 0,34 | 3,2 ± 1,3 | 3.5 |
 | 39-е | С2Н5 | С6Н4-4 - С ( = СН2 ) СН3 | 7,2 ± 2,1 | 0,82 ± 0,38 | 0.1 |
2β-Ацил-3β-нафтил замещенный
| Структура | Краткое назначение (цифровой код, Davies UB ) С. Сингх | Р | DAT [ 125 H]RTI-55 ɑ IC 50 нМ | SERT [ 3 H]пароксетин b K i nM | NET [ 3 H]низоксетин c K i nM | Соотношение эффективности SERT/DAT | Соотношение эффективности SERT/NET |
|---|---|---|---|---|---|---|---|
 | ВФ-11 (6) | 4′-Ме | 8,2 ± 1,6 | 131 ± 10 | 65 ± 9,2 | 0,06 | 0,5 |
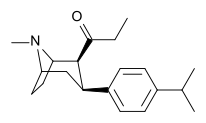 | ВФ-31 (7) | 4′- я Пр | 436 ± 41 | 36 ± 4 | >10,000 | 12 | >250 |
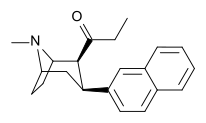 | ВФ-23 (8) | 2-нафталин | 0,12 ± 0,02 | 0,39 ± 0,07 | 2,9 ± 0,5 | 0.3 | 7 |
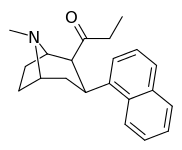 | 2β-ацил-3β-1-нафталин (9а) | 4′-Н | 5,3 ± 1,3 | 21 ± 2,9 | 49 ± 10 | 0.3 | 18 |
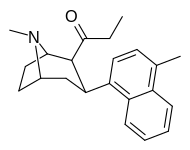 | (9б) | 4′-Ме | 25,1 ± 0,5 | 8,99 ± 1,70 | 163 ± 36 | 3 | 18 |
 | (9с) | 4′-Эт | 75,1 ± 11,9 | 175 ± 25 | 4769 ± 688 | 0,7 | 27 |
 | (9д) | 4′- я Пр | 225 ± 36 | 136 ± 64 | >10,000 | 2 | >73,5 |
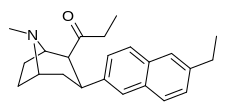 | (10а) | 6′-Эт | 0,15 ± 0,04 | 0,38 ± 0,19 | 27,7 ± 9,6 | 0,4 | 74 |
 | (10б) | 6′- я Пр | 0,39 ± 0,04 | 1,97 ± 0,33 | нет данных | 0.2 | — |
 | (10c е ) | 6′-ОМе | 0,13 ± 0,04 | 2,24 ± 0,34 | нет данных | 0,05 | — |
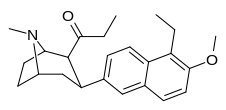 | (10д) | 5′-Эт, 6′-ОМе | 30,8 ± 6,6 | 7,55 ± 1,57 | 3362 ± 148 | 4.1 | 445 |
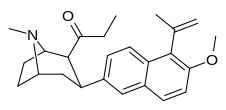 | (10е) | 5′-C(Me)=CH2 , 6′-OMe | 45,0 ± 3,7 | 88,0 ± 13,3 | 2334 ± 378 | 0,5 | 26.5 |
 | (10ф) | 6′-I | 0,35 ± 0,07 | 0,37 ± 0,02 | нет данных | 1.0 | — |
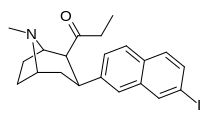 | (10г) | 7′-I | 0,45 ± 0,05 | 0,47 ± 0,02 | нет данных | 0,5 дн. | — |
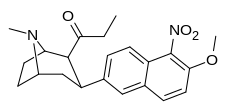 | (10ч) | 5′-NO 2 , 6′-OMe | 148 ± 50 | 15 ± 1,6 | нет данных | 10 | — |
 | (10и) | 5′-I, 6′-OMe | 1,31 ± 0,33 | 2,27 ± 0,31 | 781 ± 181 | 0,6 | 344 |
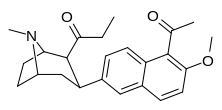 | (10ж) | 5′-COMe, 6′-OMe | 12,6 ± 3,8 | 15,8 ± 1,65 | 498 ± 24 | 0.8 | 32 |
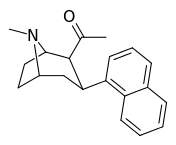 | (11а) | 2β-COCH 3 , 1-нафтил | 10 ± 2,2 | 26 ± 5,1 | 165 ± 40 | 0,4 | 6.3 |
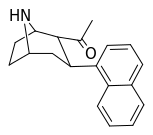 | (11б) | 2α-COCH 3 , 1-нафтил | 97 ± 21 | 217 ± 55 | нет данных | 0,45 | — |
 | (11с) | 2α-COCH 2 CH 3 , 2-нафтил | 2,51 ± 0,82 | 16,4 ± 2,0 | 68,0 ± 10,8 | 0,15 | 4.1 |
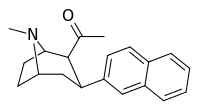 | (11д) | 2β-COCH 3 , 2-нафтил | 1,27 ± 0,15 | 1,06 ± 0,36 | 4,9 ± 1,2 | 1.2 | 4.6 |
 | (11д) | 2β-COCH(CH 3 ) 2 , 2-нафтил | 0,25 ± 0,08 | 2,08 ± 0,80 | 37,6 ± 10,5 | 0,12 | 18.1 |
 | (11ф) 79а | 2β-COCH 2 CH 3 , 2-нафтил, N 8-деметил | 0,03 ± 0,01 | 0,23 ± 0,07 | 2,05 ± 0,9 | 0,13 | 8.9 |
|
|
Восстановление эфира
Примечание: п -фторфенил слабее остальных. RTI-145 — это не перокси , а метилкарбонат .

| Код | Х | 2 Позиция | конфигурация | 8 | ДА | 5-НТ | СВ |
|---|---|---|---|---|---|---|---|
| РТИ-100 | Ф | -СН2ОН | β,β | НМэ | 47 | 4741 | нет данных |
| РТИ-101 | я | -СН2ОН | β,β | НМэ | 2.2 | 26 | нет данных |
| РТИ-99 | Бр | -СН2ОН | β,β | НМэ | 1.49 | 51 | нет данных |
| РТИ-93 | Кл | -СН2ОН | β,β | НМэ | 1.53 | 204 | 43,8 |
| РТИ-105 | Кл | -CH2OAc | β,β | НМэ | 1.60 | 143 | 127 |
| РТИ-123 | Кл | -CH 2 ОБЗ | β,β | НМэ | 1.78 | 3.53 | 393 |
| РТИ-145 | Кл | -CH 2 OCO 2 Me | β,β | НМэ | 9.60 | 2.93 | 1.48 |
2-Алкан/Алкен
a Значение K i для смещения WIN 35428.
b Значение IC 50 .
Необратимая ковалентная (ср.ионные) лиганды C2

Необратимый ( фенилизотиоцианат ) связывающий лиганд ( Murthy, V.; Martin, TJ; Kim, S.; Davies, HML; Childers, SR (2008). «In vivo характеристика нового аналога тропана фенилизотиоцианата в переносчиках моноаминов в мозге крысы». Журнал фармакологии и экспериментальной терапии . 326 (2): 587– 595. doi : 10.1124/jpet.108.138842. PMID 18492949. S2CID 5996473.) [23] RTI-76 : [24] 4′-изотиоцианатофенил (1R,2S,3S,5S)-3-(4-хлорфенил)-8-метил-8-азабицикло[3.2.1]октан-2-карбоксилат . Также известен как: 3β-(п-хлорфенил)тропан-2β-карбоновой кислоты п-изотиоцианатофенилметиловый эфир .
C2 Ацил, N8 фенилизотиоцианат
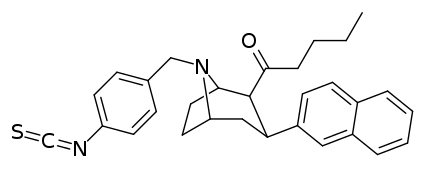
HD-205 (Мерти и др., 2007) [25]
Обратите внимание на контраст между расположением участков ковалентного связывания фенилизотиоцианата по сравнению с p-Isococ , нефенилтропановым аналогом кокаина.
Фенилтропаны на основе бензтропина (гетерозамещенные в положении C2)
| Структура | Сложный | Р | Х | И | [ 3 H]WIN 35,428 @ DAT K i (нМ) | [3H]Citalopram @ SERT Ki (nM) | [3H]Nisoxetine @ NET Ki (nM) | [3H]Pirenzepine @ M1 Ki (nM) |
|---|---|---|---|---|---|---|---|---|
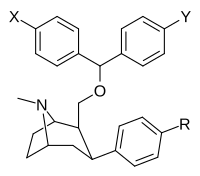 | ||||||||
| 9a | CH3 | H | H | 34 ± 2 | 121 ± 19 | 684 ± 100 | 10,600 ± 1,100 | |
| 9b | F | H | H | 49 ± 12 | — | — | — | |
| 9c | Cl | H | H | 52 ± 2.1 | 147 ± 8 | 1,190 ± 72 | 11,000 ± 1,290 | |
| 9d | CH3 | Cl | H | 80 ± 9 | 443 ± 60 | 4,400 ± 238 | 31,600 ± 4,300 | |
| 9e | F | Cl | H | 112 ± 11 | — | — | — | |
| 9f | Cl | Cl | H | 76 ± 7 | 462 ± 36 | 2,056 ± 236 | 39,900 ± 5,050 | |
| 9g | CH3 | F | F | 62 ± 7 | 233 ± 24 | 1,830 ± 177 | 15,500 ± 1,400 | |
| 9h | F | F | F | 63 ± 13 | — | — | — | |
| 9i | Cl | F | F | 99 ± 18 | 245 ± 16 | 2,890 ± 222 | 16,300 ± 1,300 | |
 | ||||||||
| 10a | CH3 | H | H | 455 ± 36 | 530 ± 72 | 2,609 ± 195 | 12,600 ± 1,790 | |
| 10c | Cl | H | H | 478 ± 72 | 408 ± 16 | 3,998 ± 256 | 11,500 ± 1,720 | |
| 10d | CH3 | Cl | H | 937 ± 84 | 1,001 ± 109 | 22,500 ± 2,821 | 18,200 ± 2,600 | |
| 10f | Cl | Cl | H | 553 ± 106 | 1,293 ± 40 | 5,600 ± 183 | 9,600 ± 600 | |
| 10g | CH3 | F | F | 690 ± 76 | 786 ± 67 | 16,000 ± 637 | 9,700 ± 900 | |
| 10i | Cl | F | F | 250 ± 40 | 724 ± 100 | 52,300 ± 13,600 | 9,930 ± 1,090 | |
 | ||||||||
| 12a | H | H | H | 139 ± 15 | 61 ± 9 | 207 ± 30 | 7,970 ± 631 | |
| 12b | H | Cl | H | 261 ± 19 | 45 ± 3 | — | 24,600 ± 2,930 | |
| 12c | H | F | F | 60 ± 7 | — | — | — |
F&B series (Biotin side-chains etc.)
One patent claims a series of compounds with biotin-related sidechains are pesticides.[18]
| Images of the biotin C2 side-chained phenyltropanes, click to |
|---|
Miscellany (i.e. Misc./Miscellaneous) C2-substituents



C2-truncated/descarboxyl (non-ecgonine w/o 2-position-replacement tropanes)
Aryl-Tropenes
WO 2004113297, Peters, Dan; Olsen, Gunnar M. & Nielsen, Elsebet Oestergaard et al., "Aza-ring derivatives and their use as monoamine neurotransmitter re-uptake inhibitors", published 2004-12-29, assigned to NeuroSearch AS
| Test compound | DA-uptake IC50(μM) | NA-uptake IC50(μM) | 5-HT-uptake IC50(μM) |
|---|---|---|---|
| (+)-3-(4-Chlorophenyl)-8-H-aza-bicyclo[3.2.1]oct-2-ene | 0.26 | 0.028 | 0.010 |
| (+)-3-Napthalen-2-yl-8-azabicyclo[3.2.1]oct-2-ene | 0.058 | 0.013 | 0.00034 |
| (–)-8-Methyl-3-(naphthalen-2-yl)-8-azabicylo[3.2.1]oct-2-ene | 0.034 | 0.018 | 0.00023 |
| Test Compound | DA uptake IC50(μM) | NE uptake IC50(μM) | 5-HT uptake IC50(μM) |
|---|---|---|---|
| (±)-3-(3,4-Dichlorophenyl)-8-methyl-8-azabicyclo[3.2.1]oct-2-ene | 0.079 | 0.026 | 0.0047 |
U.S. patent 2,001,047,028
| Test Compound | DA uptake IC50(μM) | NE uptake IC50(μM) | 5-HT uptake IC50(μM) |
|---|---|---|---|
| (±)-3-(4-cyanophenyl)-8-methyl-8-azabicyclo[3.2.1]oct-2-ene | 18 | 4.9 | 0.047 |
| (±)-3-(4-nitrophenyl)-8-methyl-8-azabicyclo[3.2.1]oct-2-ene | 1.5 | 0.5 | 0.016 |
| (±)-3-(4-trifluoromethoxyphenyl)-8-methyl-8-azabicyclo[3.2.1]oct-2-ene | 22.00 | 8.00 | 0.0036 |
Enantioselective nonstandard configurations (non-2β-,3β-)
β,α Stereochemistry
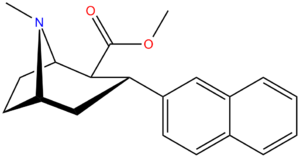

Structure 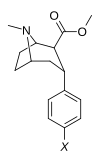 | Compound (RTI #) (S. Singh's #) | X | 2 Group | config | 8 | DAT IC50 (nM) [3H]WIN 35428 | 5-HTT IC50 (nM) [3H]paroxetine | NET IC50 (nM) [3H]nisoxetine | selectivity 5-HTT/DAT | selectivity NET/DAT |
|---|---|---|---|---|---|---|---|---|---|---|
 | RTI-140 20a | H | CO2Me | β,α | NMe | 101 ± 16 | 5,701 ± 721 | 2,076 ± 285 | 56.4 | 20.6 |
 | RTI-352ɑ 20d | I | CO2Me | β,α | NMe | 2.86 ± 0.16 | 64.9 ± 1.97 | 52.4 ± 4.9 | 22.8 | 18.4 |
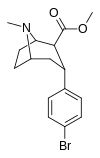 | RTI-549 | Br | CO2Me | β,α | NMe | — | — | — | — | — |
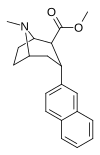 | RTI-319b | 3α-2-naphthyl | CO2Me | β,α | NMe | 1.1 ± 0.09 | 11.4 ± 1.3 | 70.2 ± 6.28 | — | — |
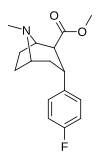 | RTI-286c 20b | F | CO2Me | β,α | NMe | 21 ± 0.57 | 5062 ± 485 | 1231 ± 91 | 241 | 58.6 |
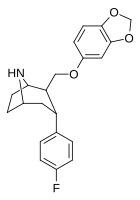 | RTI-274d | F | CH2O(3′,4′-MD-phenyl) | β,α | NH | 3.96 | 5.62 | 14.4 | — | — |
 | RTI-287 | Et | CO2Me | β,α | NMe | 327 | 1687 | 17,819 | — | — |
 | 20c | Cl | CO2Me | β,α | NMe | 2.4 ± 0.2 | 998 ± 120 | 60.1 ± 2.4 | 416 | 25.0 |
 | 20e | Me | CO2Me | β,α | NMe | 10.2 ± 0.08 | 4250 ± 422 | 275 ± 24 | 417 | 27.0 |
 | Bn | CO2Me | β,α | NMe | — | — | — | — | — |
α,β Stereochemistry
CA 2112084

| Compound | DA (μM) | M.E.D. (mg/kg) | Dose (mg/kg) | Activity | Activity |
|---|---|---|---|---|---|
| (2R,3S)-2-(4-chlorophenoxymethyl)-8-methyl-3-(3-chlorophenyl)-8-azabicyclo[3.2.1]octane | 0.39 | <1 | 50 | 0 | 0 |
| (2R,3S)-2-(carboxymethyl)-8-methyl-3-(2-naphthyl)-8-azabicyclo[3.2.1]octane | 0.1 | 1 | 25 | 0 | 0 |
| (2R,3S)-2-(carboxymethyl)-8-methyl-3-(3,4-dichlorophenyl)-8-azabicyclo[3.2.1]octane | 0.016 | 0.25 | 50 | + | +++ |


di-chloro; para- & meta- in tandem (α,β configured phenyltropanes)
U.S. patent 2,001,047,028
| Compound | X | 2 Group | config | 8 | DA | 5-HT | NE |
|---|---|---|---|---|---|---|---|
| Brasofensine | Cl2 | methyl aldoxime | α,β | NMe | — | — | — |
| Tesofensine | Cl2 | ethoxymethyl | α,β | NMe | 65 | 11 | 1.7 |
| NS-2359 (GSK-372,475) | Cl2 | Methoxymethyl | α,β | NH | — | — | — |
fumaric acid salts (of α,β configured phenyltropanes)
WO 2004072075, Peters, Dan; Nielsen, Elsebet Oestergaard & Olsen, Gunnar M. et al., "Novel 8-aza-bicyclo[3.2.1]octane derivatives and their use as monoamine neurotransmitter re-uptake inhibitors", published 2004-08-26, assigned to NeuroSearch AS
| Test Compound | DA uptake IC50(μM) | NE uptake IC50(μM) | 5-HT uptake IC50(μM) |
|---|---|---|---|
| (2R,3S)-2-(2,3-dichlorophenoxymethyl)-8-methyl-3-(3-chlorophenyl)-8-azabicyclo[3.2.1]octane fumaric acid salt | 0.062 | 0.035 | 0.00072 |
| (2R,3S)-2-(Naphthaleneoxymethane)-8-methyl-3-(3-chlorophenyl)-8-azabicyclo[3.2.1]octane fumaric acid salt | 0.062 | 0.15 | 0.0063 |
| (2R,3S)-2-(2,3-dichlorophenoxymethyl)-8-H-3-(3-chlorophenyl)-8-azabicyclo[3.2.1]octane fumaric acid salt | 0.10 | 0.048 | 0.0062 |
| (2R,3S)-2-(Naphthlyloxymethane)-8-H-3-(3-chlorophenyl)-8-azabicyclo[3.2.1]octane fumaric acid salt | 0.088 | 0.051 | 0.013 |
Arene equivalent alterations
η6-3β-(transition metal complexed phenyl)tropanes

21b can be prepared from ferrocenes and perrhenate by a double ligand transfer (DLT) reaction.[28]
Unlike metal complexed PTs created with the intention of making useful radioligands, 21a & 21b were produced seeing as their η6-coordinated moiety dramatically altered the electronic character and reactivity of the benzene ring, as well as such a change adding asymmetrical molecular volume to the otherwise planar arene ring unit of the molecule.[1] (cf. the Dewar–Chatt–Duncanson model). In addition the planar dimension of the transition metal stacked arene becomes delocalized (cf. Bloom and Wheeler.[29]).
21a was twice as potent as both cocaine and troparil in displacement of β-CFT, as well as displaying high & low affinity Ki values in the same manner as those two compounds. Whereas its inhibition of DA uptake showed it as comparably equipotent to cocaine & troparil. 21b by contrast had a one hundredfold decrease in high-affinity site binding compared to cocaine and a potency 10× less for inhibiting DA uptake. Attesting these as true examples relating useful effective applications for bioorganometallic chemistry.

The discrepancy in binding for the two benzene metal chelates is assumed to be due to electrostatic differences rather than their respective size difference. The solid cone angles, measured by the steric parameter (i.e. θ) is θ=131° for Cr(CO)3 whereas Cp*Ru was θ=187° or only 30% larger. The tricarbonyl moiety being considered equivalent to the cyclopenta dienyl (Cp) ligand.[1]

| Structure | Compound # (S. Singh) Systematic name | Ki (nM)ɑ | IC50 (nM) | selectivity binding/uptake |
|---|---|---|---|---|
 | 21ac | 17 ± 15b 224 ± 83 | 418 | 24.6 |
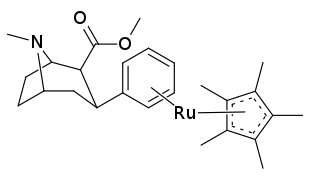 | 21bd | 2280 ± 183 | 3890 | 1.7 |
| Cocaine | 32 ± 5 388 ±221 | 405 | 12.6 | |
| Troparil (11a) | 33 ± 17 314 ± 222 | 373 | 11.3 | |
- ɑThe binding data fit a two-site model better than a one-site model
- bThe Ki value for the one-site model was 124 ± 10 nM
- cIUPAC: [η6-(2β-carbomethoxy-3β-phenyl)tropane]tricarbonylchromium
- dIUPAC: [η5-(pentamethylcyclopentadienyl)]-[η6-(2β-carbomethoxy-3β-phenyl)tropane]ruthenium-(II) triflate
3-(2-thiophene) and 3-(2-furan)

| Code | Compound | DA (μM) | NE (μM) | 5-HT (μM) |
|---|---|---|---|---|
| 1 | (2R,3S)-2-(2,3-Dichlorophenoxymethyl)-8-methyl-3-(2-thienyl)-8-aza-bicyclo[3.2.1]octanefumaric acid salt | 0.30 | 0.0019 | 0.00052 |
| 2 | (2R,3S)-2-(1-Naphthyloxymethyl)-8-methyl-3-(2-thienyl)-8-aza-bicyclo-[3.2.1]octane fumaric acid salt | 0.36 | 0.0036 | 0.00042 |
| 3 | (2R,3S)-2-(2,3-Dichlorophenoxymethyl)-8-methyl-3-(2-furanyl)-8-aza-bicyclo-[3.2.1]octane fumaric acid salt | 0.31 | 0.00090 | 0.00036 |
| 4 | (2R,3S)-2-(1-Naphthyloxymethyl)-8-methyl-3-(2-furanyl)-8-aza-bicyclo-[3.2.1]octane fumaric acid salt | 0.92 | 0.0030 | 0.00053 |
| 5 | (2R,3S)-2-(2,3-Dichlorophenoxymethyl)-8-H-3-(2-thienyl)-8-aza-bicyclo[3.2.1]octane fumaric acid salt | 0.074 | 0.0018 | 0.00074 |
| 6 | (2R,3S)-2-(1-Naphthyloxymethyl)-8-H-3-(2-thienyl)-8-aza-bicyclo[3.2.1]octane fumaric acid salt | 0.19 | 0.0016 | 0.00054 |
Thiophenyltropanes
Diaryl
 |
6/7-tropane position substituted
2β-carbomethoxy 6/7 substituted
- ɑIC50 value for displacement of [H3]mazindol. IC50 for cocaine 288 nM for displacement of [H3]mazindol
3-butyl 6/7 substituted
intermediate 6- & 7-position synthesis modified phenyltropanes
8-tropane (bridgehead) position modified
Nortropanes (N-demethylated)
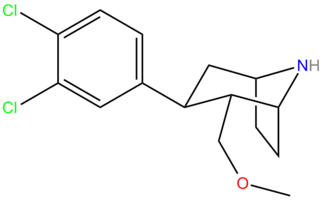
NS2359 (GSK-372,475)
It is well established that electrostatic potential around the para position tends to improve MAT binding. This is believed to also be the case for the meta position, although it is less studied. N-demethylation dramatically potentiates NET and SERT affinity, but the effects of this on DAT binding are insignificant.[33] Of course, this is not always the case. For an interesting exception to this trend, see the Taxil document. There is ample evidence suggesting that N-demethylation of alkaloids occurs naturally in vivo via a biological enzyme. The fact that hydrolysis of the ester leads to inactive metabolites means that this is still the main mode of deactivation for analogues that have an easily metabolised 2-ester substituent. The attached table provides good illustration of the effect of this chemical transformation on MAT binding affinities. N.B. In the case of both nocaine and pethidine, N-demethyl compounds are more toxic and have a decreased seizure threshold.[34]
| Code (S.S. #) | X para (unless position otherwise given inline) | DA | 5HT | NE |
|---|---|---|---|---|
| RTI-142 75b | F | 4.39 | 68.6 | 18.8 |
| RTI-98 75d Norɑ-RTI-55 | I | 0.69 | 0.36 | 11.0 |
| RTI-110 75c | Cl | 0.62 | 4.13 | 5.45 |
| RTI-173 75f | Et | 49.9 | 8.13 | 122 |
| RTI-279 Norɑ-RTI-280 | para-Me meta-I | 5.98 ± 0.48 | 1.06 ± 0.10 | 74.3 ± 3.8 |
| RTI-305 Norɑ-RTI-360/11y | Ethynyl | 1.24 ± 0.11 | 1.59 ± 0.2 | 21.8 ± 1.0 |
| RTI-307 Norɑ-RTI-281/11z | Propynyl | 6.11 ± 0.67 | 3.16 ± 0.33 | 115.6 ± 5.1 |
| RTI-309 Norɑ-11t | Vinyl | 1.73 ± 0.05 | 2.25 ± 0.17 | 14.9 ± 1.18 |
| RTI-330 Norɑ-11s | Isopropyl | 310.2 ± 21 | 15.1 ± 0.97 | — |
| RTI-353 | para-Et meta-I | 330.54 ± 17.12 | 0.69 ± 0.07 | 148.4 ± 9.15 |
ɑThe N-demethylated variant of (i.e. compound code-name after dash)
| N-Me compound code# → N-demethylated derivative compound code # | para-X | [3H]Paroxetine | [3H]WIN 35,428 | [3H]Nisoxetine |
|---|---|---|---|---|
| 11 g→75f | Ethyl | 28.4 → 8.13 | 55 → 49.9 | 4,029 → 122 |
| 11t→75i | Vinyl | 9.5 → 2.25 | 1.24 → 1.73 | 78 → 14.9 |
| 11y→75n | Ethynyl | 4.4 → 1.59 | 1.2 → 1.24 | 83.2 → 21.8 |
| 11r→75 g | 1-Propyl | 70.4 → 26 | 68.5 → 212 | 3,920 → 532 |
| 11v→75k | trans-propenyl | 11.4 → 1.3 | 5.29 → 28.6 | 1,590 → 54 |
| 11w→75l | cis-propenyl | 7.09 → 1.15 | 15 → 31.6 | 2,800 → 147 |
| 11x→75 m | Allyl | 28.4 → 6.2 | 32.8 → 56.5 | 2,480 → 89.7 |
| 11z→75o | 1-Propynyl | 15.7 → 3.16 | 2.37 → 6.11 | 820 → 116 |
| 11s→75h | i-Propyl | 191 → 15.1 | 597 → 310 | 75,000 → ? |
| 11u→75j | 2-Propenyl | 3.13 → 0.6 | 14.4 → 23 | 1,330? → 144 |
| Isomer | 4′ | 3′ | NE | DA | 5HT |
|---|---|---|---|---|---|
| β,β | Me | H | 60 → 7.2 | 1.7 → 0.84 | 240 → 135 |
| β,β | F | H | 835 → 18.8 | 15.7 → 4.4 | 760 → 68.6 |
| β,β | Cl | H | 37 → 5.45 | 1.12 → 0.62 | 45 → 4.13 |
| β,α | Me | H | 270 → 9 | 10.2 → 33.6 | 4250 → 500 |
| β,α | F | H | 1200 → 9.8 | 21 → 32.6 | 5060 → 92.4 |
| β,α | Cl | H | 60 → 5.41 | 2.4 → 3.1 | 998 → 53.3 |
| β,α | F | Me | 148 → 4.23 | 13.7 → 9.38 | 1161 → 69.8 |
| β,α | Me | F | 44.7 → 0.86 | 7.38 → 9 | 1150 → 97.4 |
"Interest in NET selective drugs continues as evidenced by the development of atomoxetine, manifaxine, and reboxetine as new NET selective compounds for treating ADHD and other CNS disorders such as depression" (FIC, et al. 2005).[35]
ɑThese values determined in Cynomolgus monkey caudate-putamenbThe radioligand used for 5-HTT was [3H]citalopram
Paroxetine homologues
See the N-methyl paroxetine homologuescf. di-aryl phenyltropanes for another SSRI approximated hybrid: the fluoxetine based homologue of the phenyltropane class.
N-replaced (S,O,C)
The eight position nitrogen has been found to not be an exclusively necessary functional anchor for binding at the MAT for phenyltropanes and related compounds. Sulfurs, oxygens, and even the removal of any heteroatom, leaving only the carbon skeleton of the structure at the bridged position, still show distinct affinity for the monoamine transporter cocaine-target site and continue to form an ionic bond with a measurable degree of reasonable efficacy.
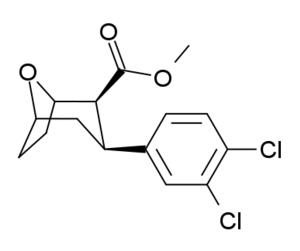
| Compound | X | 2 Group | config | 8 | DA | 5-HT | NE |
| Tropoxane | Cl,Cl | CO2Me | (racemic) β,β | O | 3.3 | 6.5 | No data |
| O-4210[36] | p-F | 3-methyl-5-isoxazole | β,β | S | 7.0 | >1000 | No data |

8-oxa bridgehead replacements
8-carba bridgehead replacements
N-alkyl


| Compound | X | 2 Group | config | 8 | DAT | SERT | NET |
|---|---|---|---|---|---|---|---|
| FP-β-CPPIT | Cl | 3′-phenylisoxazol-5′-yl | β,β | NCH2CH2CH2F | - | - | - |
| FE-β-CPPIT | Cl | (3′-phenylisoxazol-5′-yl) | β,β | NCH2CH2F | - | - | - |
| Altropane (IACFT) | F | CO2Me | β,β | NCH2CH=CHF | - | - | - |
| FECNT[37] | I | CO2Me | β,β | NCH2CH2F | - | - | - |
| RTI-310 U.S. patent 5,736,123 | I | CO2Me | β,β | N-Prn | 1.17 | - | - |
| RTI-311 | I | CO2Me | β,β | NCH2CH=CH2 | 1.79 | - | - |
| RTI-312 U.S. patent 5,736,123 | I | CO2Me | β,β | NBun | 0.76 | - | - |
| RTI-313 U.S. patent 5,736,123 | I | CO2Me | β,β | NCH2CH2CH2F | 1.67 | - | - |
| Ioflupane (FP-CIT) | 123I | CO2Me | β,β | NCH2CH2CH2F | - | - | - |
| PE2I[37] | Me | CO2Me | β,β | NCH2CH=CHI | - | - | - |
| RTI-251 | Cl | CO2Me | β,β | NCH2CO2Et | 1.93 | 10.1 | 114 |
| RTI-252 | Cl | CO2Me | β,β | NCH2CH2CO2Et | 2.56 | 35.2 | 125 |
| RTI-242 | Cl | β,β (bridged) -C(O)CH(CO2Me)CH2N | 7.67 | 227 | 510 | ||
Bi- and tri-cyclic aza compounds and their uses.[38][39]
- ɑIC50 for displacement of [3H]cocaine. IC50 for cocaine = 67.8 ± 8.7 (nM)
- bIC50 values for displacement of [3H]WIN 35428
- cIC50 values for displacement of [3H]citalopram
- dThe standard Ki value for the displacement of [3H]GBR 12935, [3H]paroxetine, and [3H]nisoxetine were 27 ± 2, 3 ± 0.2, and 80 ± 28 nM, respectively, for these experiments
Bridged N-constrained phenyltropanes (fused/tethered)
p-methyl aryl front & back N-bridged phenyltropanes
U.S. patent 6,150,376
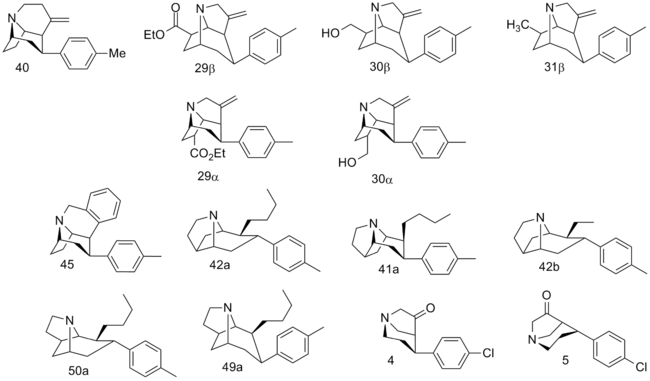

| Compound # (S. Singh's #) | 2β=R | [3H]Mazindol binding | [3H]DA uptake | [3H]5-HT uptake | [3H]NE uptake | selectivity [3H]5-HT/[3H]DA |
|---|---|---|---|---|---|---|
| cocaine | CO2CH3 | 375 ± 68 | 423 ± 147 | 155 ± 40 | 83.3 ± 1.5 | 0.4 |
| (–)-40 (–)-128 | 54.3 ± 10.2 | 60.3 ± 0.4 | 1.76 ± 0.23 | 5.24 ± 0.07 | 0.03 | |
| (+)-40 (+)-128 | 79 ± 19 | 114 ± 28 | 1.48 ± 0.07 | 4.62 ± 0.31 | 0.01 | |
| (±)-40 (±)-128 | 61.7 ± 8.5 | 60.3 ± 0.4 | 2.32 ± 0.23 | 2.69 ± 0.12 | 0.04 | |
| 29β | 620 | 1420 | 8030 | — | — | |
| 30β | 186 | 492 | 97.7 | — | — | |
| 31β | 47.0 | 211 | 28.5 | — | — | |
| 29α | 4140 | 20100 | 3920 | — | — | |
| 30α | 3960 | 8850 | 696 | 1150 | — | |
| 45 129 | 6.86 ± 0.43 | 24.0 ± 1.3 | 1.77 ± 0.04 | 1.06 ± 0.03 | 0.07 | |
| 42a 131a | n-Bu | 4.00 ± 0.07 | 2.23 ± 0.12 | 14.0 ± 0.6 | 2.99 ± 0.17 | 6.3 |
| 41a 130a | n-Bu | 17.2 ± 1.13 | 10.2 ± 1.4 | 78.9 ± 0.9 | 15.0 ± 0.4 | 7.8 |
| 42b 131b | Et | 3.61 ± 0.43 | 11.3 ± 1.1 | 25.7 ± 4.3 | 4.43 ± 0.01 | 2.3 |
| 50a 133a | n-Bu | 149 ± 6 | 149 ± 2 | 810 ± 80 | 51.7 ± 12 | 5.4 |
| 49a 132a | n-Bu | 13.7 ± 0.8 | 14.2 ± 0.1 | 618 ± 87 | 3.84 ± 0.35 | 43.5 |
| (–)-4 | 10500 | 16500 | 1890 | 70900 | — | |
| (+)-4 | 18500 | 27600 | 4630 | 38300 | — | |
| (–)-5 | 9740 | 9050 | 11900 | 4650 | — | |
| (+)-5 | 6770 | 10500 | 25100 | 4530 | — | |
| RTI-4229/Coc-242 | N8/2β-C(O)CH(CO2Me)CH2N para-chloro | — | 7.67 ± 0.31ɑ | 226.54 ± 27.37b | 510.1 ± 51.4c | — |
- ɑValue for displacement of [3H]WIN 35,428 binding @ DAT
- bValue for displacement of [3H]paroxetine binding to SERT
- cValue for displacement of [3H]nisoxetine from NET
Fused tropane-derivatives as neurotransmitter reuptake inhibitors. Singh notes that all bridged derivatives tested displayed 2.5—104 fold higher DAT affinity than cocaine. The ones 2.8—190 fold more potent at DAT also had increased potency at the other two MAT sites (NET & SERT); NET having 1.6—78× increased activity. (+)-128 additionally exhibited 100× greater potency @ SERT, whereas 132a & 133a had 4—5.2× weaker 5-HTT (i.e. SERT) activity. Front-bridged (e.g. 128 & 129) had a better 5-HT/DA reuptake ratio in favor of SERT, while the back-bridged (e.g. 130—133) preferred placement with DAT interaction.[1]U.S. patent 5,998,405
3,4-Cl2 aryl front-bridged phenyltropanes


| Code | Compound | DA (μM) | NE (μM) | 5-HT (μM) |
|---|---|---|---|---|
| 1 | (1 S,2S,4S,7R)-2-(3,4-Dichloro- phenyl)-8-azatricyclo[5.4.0.04,8]- undecan-11 -one O-methyl-oxime | 0.012 | 0.0020 | 0.0033 |
| 2 | (1 S,2S,4S,7R)-2-(3,4-Dichloro- phenyl)-8-azatricyclo[5.4.0.04,8]- undecan-11-one | 0.18 | 0.035 | 0.0075 |
| 3 | (1 S,3S,4S,8R)-3-(3,4-Dichloro-phenyl)-7-azatricyclo[5.3.0.04,8]- decan-5-one O-methyl-oxime | 0.0160 | 0.0009 | 0.0032 |
| 4 | (1 S,2S,4S,7R)-2-(3,4-Dichloro-phenyl)-8-azatricyclo[5.4.0.04,8]- undecan-11-ol | 0.0750 | 0.0041 | 0.0028 |
| 5 | (1 S,3S,4S,8R)-3-(3,4-Dichloro-phenyl)-7-azatricyclo[5.3.0.04,8]- decan-5-one | 0.12 | 0.0052 | 0.0026 |
| 6 | (1 S,3S,4S,8R)-3-(3,4-Dichloro- phenyl)-7-azatricyclo[5.3.0.04,8]-decan-5-ol | 0.25 | 0.0074 | 0.0018 |
| 7 | (1S,3S,4S,8R)-3- (3,4-Dichloro- phenyl)-7-azatricyclo[5.3.0.04,8]dec- 5-yl acetate | 0.21 | 0.0061 | 0.0075 |
| 8 | (1S,3S,4S,8R)-3-(3,4-Dichlorophenyl)-5-methoxy-7- azatricyclo[5.3.0.04,8]decane | 0.022 | 0.0014 | 0.0001 |
- 1-Chloroethyl chloroformate is used to remove N-methyl of trans-aryltropanes.
- 2° amine is reacted with Br(CH2)nCO2Et.
- Base used to abstract proton α- to CO2Et group and complete the tricyclic ring closure step (Dieckmann cyclization).
To make a different type of analog (see Kozikowski patent above)
- Remove N-Me
- Add ɣ-bromo-chloropropane
- Allow for cyclization with K2CO3 base and KI cat.
C2 + C3 (side-chain) fused (carboxylate & benzene conjoined)

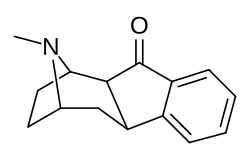
(1R,2S,10R,12S)-15-methyl-15-azatetracyclo(10.2.1.02,10.04,9)pentadeca-4(9),5,7-trien-3-one[3]
C3 to 1′ + 2′ (ortho) tropane locant dual arene bridged
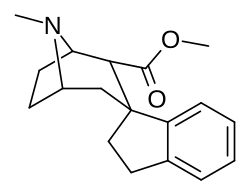
Parent compound of a series of spirocyclic cocaine benzoyl linkage modification analogs created by Suzuki coupling method of ortho-substituted arylboronic acids and an enol-triflate derived from cocaine; which technically has the three methylene length of cocaine analogues as well as the single length which defines the phenyltropane series. Note that the carbomethoxyl group is (due to constraints in synthetic processes used in the creation of this compound) alpha configured; which is not the usual, most prevalent, conformation favored for the PT cocaine-receptor binding pocket of most such sub-type of chemicals. The above and below depictions show attested compounds synthesized, additionally with variations upon the Endo–exo isomerism of their structures.[40]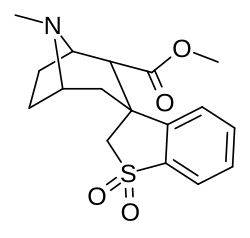
Cycloalkane-ring alterations of the tropane ring system
Azanonane (outer ring extended)
3-Phenyl-9-azabicyclo[3.3.1]nonane derivatives
To better elucidate the binding requirements at MAT, the methylene unit on the tropane was extended by one to create the azanonane analogs.[i] Which are the beginning of classes of modifications that start to become effected by the concerns & influences of macrocyclic stereocontrol.
Despite the loosened flexibility of the ring system, nitrogen constrained variants (such as were created to make the bridged class of phenyltropanes) which might better fit the rigid placement necessary to suit the spatial requirements needed in the binding pocket were not synthesized. Though front-bridged types were synthesized for the piperidine homologues: the trend of equal values for either isomers of that type followed the opposing trend of a smaller and lessened plasticity of the molecule to contend with a rationale for further constraining the pharmacophore within that scope. Instead such findings lend credence to the potential for the efficacy of fusing the nitrogen on an enlarged tropane, as like upon the compounds given below.
Azabornane (outer ring contracted)
3-Phenyl-7-azabicyclo[2.2.1]heptane derivatives
Ring-contracted analogs of phenyltropanes did not permit sufficient penetration of the phenyl into the target binding site on MAT for an affinity in the efficacious range. The distance from the nitrogen to the phenyl centroid for 155a was 4.2 and 155c was 5.0 Å, respectively. (Whereas troparil was 5.6 & compound 20a 5.5 angstroms). However piperidine homologues (discussed below) had comparable potencies.[j]

The non-carboxylic (and DAT substrate, releasing agent) variant of exo-2-phenyl-7-azabicyclo(2.2.1)heptane-1-carboxylic acid (N.B. the carboxy in the latter shares the C1 tropane position with the two carbon nitrogen containing bridge; sharing in the leftmost (R) substitution of the above depiction & unlike the placement on the tropane for either the carbmethoxy or phenyl ring of the azabornane analogues given in this section)
With the carboxy ester function removed the resultant derived compound acts as a DAT substrate drug, thus an amphetaminergic releaser of MAT & VMAT, yet similar to phenyltropanes (that usually are only re-uptake ligands)[41] cf. EXP-561 & BTQ.
Azabornanes with longer substitutions at the 3β-position (benzoyloxys alkylphenyls, carbamoyls etc.) or with the nitrogen in the position it would be on the piperidine homologues (i.e. arrangements of differing locations for the nitrogens being either distal or proximal within the terms required to facilitate the framework of the compound to a correlative proportion, functional for the given moiety), were not synthesized, despite conclusions that the nitrogen to phenyl length was the issue at variance enough to be the interfering factor for the proper binding of the compressed topology of the azabornane. Carroll, however, has listed benzoyloxy azabornanes in patents.[3]
Piperidine homologues (inner two-carbon bridge excised)
Piperidine homologues had comparable affinity & potency spreads to their respective phenyltropane analogues. Without as much of a discrepancy between the differing isomers of the piperidine class with respect to affinity and binding values as had in the phenyltropanes.
p-chloro & related (piperidine homologues of phenyltropanes)
| Structure | Compound # (S. Singh) | X = para- / 4′- Substitution | R = 2-tropane position | DAT (IC50 nM) [H3]WIN 35428 binding displacement | DA (IC50 nM) [H3]DA uptake | Selectivity Uptake/Binding |
|---|---|---|---|---|---|---|
 | ||||||
| Cocaine | H | CO2Me | 102 ± 9 | 239 ± 1 | 2.3 | |
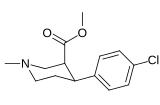 | ||||||
| (±)-166a | Cl | β-CO2CH3 | 53.7 ± 1.9 | 37.8 ± 7.9 | 0.7 | |
| (-)-166a | Cl | β-CO2CH3 | 24.8 ± 1.6 | 85.2 ± 2.6 | 3.4 | |
| (+)-166a | Cl | β-CO2CH3 | 1360 ± 125 | 5090 ± 172 | 3.7 | |
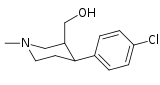 | ||||||
| (-)-167a | Cl | β-CO2OH | 75.3 ± 6.2 | 49.0 ± 3.0 | 0.6 | |
| (+)-167a | Cl | β-CO2OH | 442 ± 32 | — | — | |
 | ||||||
| (-)-168a | Cl | β-CO2OAc | 44.7 ± 10.5 | 62.9 ± 2.7 | 1.4 | |
| (+)-168a | Cl | β-CO2OAc | 928 ± 43 | 2023 ± 82 | 2.2 | |
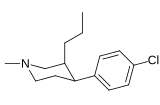 | ||||||
| (-)-169a[42] | Cl | β-n-Pr | 3.0 ± 0.5 | 8.3 ± 0.6 | 2.8 | |
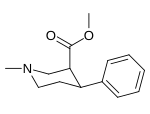 | ||||||
| (-)-170a | H | β-CO2CH3 | 769 ± 19 | — | — | |
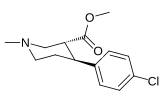 | ||||||
| (±)-166b | Cl | α-CO2CH3 | 197 ± 8 | — | — | |
| (+)-166b | Cl | α-CO2CH3 | 57.3 ± 8.1 | 34.6 ± 3.2 | 0.6 | |
| (-)-166b | Cl | α-CO2CH3 | 653 ± 38 | 195 ± 8 | 0.3 | |
 | ||||||
| (+)-167b | Cl | α-CO2OH | 240 ± 18 | 683 ± 47 | 2.8 | |
 | ||||||
| (+)-168b | Cl | α-CO2OAc | 461 ± 11 | — | — | |
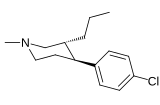 | ||||||
| (+)-169b | Cl | α-n-Pr | 17.2 ± 0.5 | 23.2 ± 2.2 | 1.3 |
Naphthyl & related (piperidine homologues of phenyltropanes)
distal-nitrogen 'dimethylamine' (piperidine-like cyclohexyl homologues of phenyltropanes)
Source:[3]

cf. Fencamfamine
Radiolabeled


| Code | SERT Ki (nM) | NET Ki (nM) | DAT Ki (nM) | Radiolabel | In vivo study | Refs. |
|---|---|---|---|---|---|---|
| 1 | 0.2 | 102.2 | 29.9 | 11C | Non-human primate | [46] |
| 2 | 0.2 | 31.7 | 32.6 | 11C | Non-human primate | [47] |
| 3 | 0.05 | 24 | 3.47 | 123I | Rat | [48] |
| 4 | 0.08 | 28 | 13 | 18F | Non-human primate | [49] |
| 5 | 0.11 | 450 | 22 | 11C | Rat, monkey | [50] |



Transition metal complexes
These compounds include transition metals in their heteroatomic conformation, unlike non-radiolabel intended chelates where their element is chosen for intrinsic affectation to binding and function, these are tagged on by a "tail" (or similar) with a sufficient spacer to remain separated from known binding properties and instead are meant to add radioactivity enough to be easily tracked via observation methods that utilize radioactivity. As for anomalies of binding within the spectrum of the under-written kinds just mentioned: other factors not otherwise considered to account for its relatively lower potency, "compound 89c" is posited to protrude forward at the aryl place on its moiety toward the MAT ligand acceptor site in a manner detrimental to its efficacy. That is considered due to the steric bulk of the eight-position "tail" chelate substituted constituent, overreaching the means by which it was intended to be isolated from binding factors upon a tail, and ultimately nonetheless, interfering with its ability to bind. However, to broach this discrepancy, decreasing of the nitrogen tether at the eight position by a single methylene unit (89d) was shown to bring the potency of the analogous compound to the expected, substantially higher, potency: The N-methyl analog of 89c having an IC50 of 1.09 ± 0.02 @ DAT & 2.47 ± 0.14 nM @ SERT; making 89c upwards of thirty-three times weaker at those MAT uptake sites.[k]
- ɑIUPAC: [2-[[2-[[[3-(4-chlorophenyl)-7-methyl-8-azabicyclo[3,2,1]oct-2-yl]methyl]-(2-mercaptoethyl)amino]ethyl]amino]ethanethiolato-(3—)-N2, N2′, S2, S2′]oxo-[1''R''-(''exo'', ''exo'')]-[99mTc]technetium
- bR- & S- isomer values are Ki (nM) for displacement of [125I]IPT with technetium-99m replaced by rhenium
- cIC50 (nM) values for displacement of [3H]WIN 35428 with ligand tricarbonyltechnetium replaced with rhenium. (IC50 for WIN 35428 were 2.62 ± 1.06 @ high affinity binding & 139 ± 72 @ low affinity binding sites)
- dKi value for displacement of [125I]IPT radioligand.
Select annotations of above
Phenyltropanes can be grouped by "N substitution" "Stereochemistry" "2-substitution" & by the nature of the 3-phenyl group substituent X.
Often this has dramatic effects on selectivity, potency, and duration, also toxicity, since phenyltropanes are highly versatile. For more examples of interesting phenyltropanes, see some of the more recent patents, e.g. U.S. patent 6,329,520, U.S. patent 7,011,813, U.S. patent 6,531,483, and U.S. patent 7,291,737.
Potency in vitro should not be confused with the actual dosage, as pharmacokinetic factors can have a dramatic influence on what proportion of an administered dose actually gets to the target binding sites in the brain, and so a drug that is very potent at binding to the target may nevertheless have only moderate potency in vivo. For example, RTI-336 requires a higher dosage than cocaine. Accordingly, the active dosage of RTI-386 is exceedingly poor despite the relatively high ex vivo DAT binding affinity.
Sister substances
Many molecular drug structures have exceedingly similar pharmarcology to phenyltropanes, yet by certain technicalities do not fit the phenyltropane moniker. These are namely classes of dopaminergic cocaine analogues that are in the piperidine class (a category that includes methylphenidate) or benztropine class (such as Difluoropine: which is extremely close to fitting the criteria of being a phenyltropane.) Whereas other potent DRIs are far removed from being in the phenyltropane structural family, such as Benocyclidine or Vanoxerine.
Most any variant with a tropane locant—3-β (or α) connecting linkage differing from, e.g. longer than, a single methylene unit (i.e. "phenyl"), including alkylphenyls (see the styrene analog, first image given in example below) is more correctly a "cocaine analogue" proper, and not a phenyltropane. Especially if this linkage imparts a sodium channel blocker functionality to the molecule.
See also
References
Citations
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Singh, Satendra (2000). "Chem Inform Abstract: Chemistry, Design, and Structure-Activity Relationship of Cocaine Antagonists" (PDF). ChemInform. 31 (20): no. doi:10.1002/chin.200020238. Mirror hotlink.
- ^ U.S. Patent Application Publication # US 2008/0153870 A1 M. J. Kuhar, et al. Jun. 26, 2008. Research Triangle Institute.
- ^ a b c d e f g h i j U.S. patent 6,479,509
- ^ a b c Tamagnan, Gilles (2005). "Synthesis and monoamine transporter affinity of new 2β-carbomethoxy-3β-[4-(substituted thiophenyl)]phenyltropanes: discovery of a selective SERT antagonist with picomolar potency". Bioorganic & Medicinal Chemistry. 15 (4): 1131–1133. doi:10.1016/j.bmcl.2004.12.014. PMID 15686927.
- ^ Schmitt, K. C.; Rothman, R. B.; Reith, M. E. (Jul 2013). "Nonclassical Pharmacology of the Dopamine Transporter: Atypical Inhibitors, Allosteric Modulators, and Partial Substrates". J Pharmacol Exp Ther. 346 (1): 2–10 Fig. 1. doi:10.1124/jpet.111.191056. PMC 3684841. PMID 23568856.
- ^ U.S. patent 6,479,509 Method of promoting smoking cessation.
- ^ Blough, B. E.; Keverline, K. I.; Nie, Z.; Navarro, H.; Kuhar, M. J.; Carroll, F. I. (2002). "Synthesis and transporter binding properties of 3β-4′-(phenylalkyl, -phenylalkenyl, and -phenylalkynyl)phenyltropane-2β-carboxylic acid methyl esters: evidence of a remote phenyl binding domain on the dopamine transporter". Journal of Medicinal Chemistry. 45 (18): 4029–4037. doi:10.1021/jm020098n. PMID 12190324.
- ^ a b Blough, Bruce E.; Keverline, Kathryn I.; Nie, Zhe; Navarro, Hernán; Kuhar, Michael J.; Carroll, F. Ivy (2002). "Synthesis and Transporter Binding Properties of 3β-[4'-(Phenylalkyl, -phenylalkenyl, and -phenylalkynl)phenyl]tropane-2β-carboxylic Acid Methyl Esters: Evidence of a Remote Phenyl Binding Domain on the Dopamine Transporter". Journal of Medicinal Chemistry. 45 (18): 4029–37. doi:10.1021/jm020098n. PMID 12190324.
- ^ Blough; et al. (Sep 1996). "Synthesis and transporter binding properties of 3β-(4'-alkyl-, 4'-alkenyl-, and 4'-alkynylphenyl)nortropane-2 β-carboxylic acid methyl esters: serotonin transporter selective analogs". J Med Chem. 39 (20): 4027–35. doi:10.1021/jm960409s. PMID 8831768. S2CID 21616809.
- ^ a b Meltzer, P. C.; Liang, A. Y.; Brownell, A. L.; Elmaleh, D. R.; Madras, B. K. (1993). "Substituted 3-phenyltropane analogs of cocaine: Synthesis, inhibition of binding at cocaine recognition sites, and positron emission tomography imaging". Journal of Medicinal Chemistry. 36 (7): 855–62. doi:10.1021/jm00059a010. PMID 8464040.
- ^ a b Meltzer, P. C.; McPhee, M.; Madras, B. K. (2003). "Synthesis and biological activity of 2-Carbomethoxy-3-catechol-8-azabicyclo[3.2.1]octanes". Bioorganic & Medicinal Chemistry Letters. 13 (22): 4133–4137. doi:10.1016/j.bmcl.2003.07.014. PMID 14592523.
- ^ R. H. Kline, Davies, E. Saikali, T. Sexton & S.R. Childers (1993). "Novel 2-substituted cocaine analogs: Binding properties at dopamine transport sites in rat striatum". European Journal of Pharmacology. 244 (1): 93–97. doi:10.1016/0922-4106(93)90063-f. PMID 8420793.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Jin, C; Navarro, H. A.; Carroll, F. I. (2008). "Development of 3-Phenyltropane Analogs with High Affinity for the Dopamine and Serotonin Transporters and Low Affinity for the Norepinephrine Transporter". Journal of Medicinal Chemistry. 51 (24): 8048–8056. doi:10.1021/jm801162z. PMC 2841478. PMID 19053748. Table 1.
- ^ Jin, C; Navarro, H. A.; Carroll, F. I. (2008). "Development of 3-Phenyltropane Analogs with High Affinity for the Dopamine and Serotonin Transporters and Low Affinity for the Norepinephrine Transporter". Journal of Medicinal Chemistry. 51 (24): 8048–8056. doi:10.1021/jm801162z. PMC 2841478. PMID 19053748. Table 2.
- ^ Zhong, Desong; Kotian, Pravin; Wyrick, Christopher D.; Seltzman, Herbert H.; Kepler, John A.; Kuhar, Michael J.; Boja, John W.; Carroll, F. Ivy (1999). "Synthesis of 3β-(4-[125I]iodophenyl)tropane-2-β-pyrrolidine carboxamide ([125I]RTI-229)". Journal of Labelled Compounds and Radiopharmaceuticals. 42 (3): 281–286. doi:10.1002/(SICI)1099-1344(199903)42:3<281::AID-JLCR188>3.0.CO;2-X.
- ^ Carroll, F. I.; Gray; Abraham; Kuzemko; Lewin; Boja; Kuhar (1993). "3-Aryl-2-(3′-substituted-1′,2′,4'-oxadiazol-5′-yl)tropane analogues of cocaine: affinities at the cocaine binding site at the dopamine, serotonin, and norepinephrine transporters". Journal of Medicinal Chemistry. 36 (20): 2886–2890. doi:10.1021/jm00072a007. PMID 8411004.
- ^ a b Methods for controlling invertebrate pests using cocaine receptor binding ligands. U.S. patent 5,935,953
- ^ Carroll, F.; Howard, J.; Howell, L.; Fox, B.; Kuhar, M. (2006). "Development of the dopamine transporter selective RTI-336 as a pharmacotherapy for cocaine abuse". The AAPS Journal. 8 (1): E196 – E203. doi:10.1208/aapsj080124. PMC 2751440. PMID 16584128.
- ^ Carroll, F.; Howard, J.; Howell, L.; Fox, B.; Kuhar, M. (2006). "Development of the dopamine transporter selective RTI-336 as a pharmacotherapy for cocaine abuse". The AAPS Journal. 8 (1): E196 – E203. doi:10.1208/aapsj080124. PMC 2751440. PMID 16584128.
- ^ Davies, Huw M.L; Ren, Pingda; Kong, Norman; Sexton, Tammy; Childers, Steven R (2001). "Synthesis and monoamine transporter affinity of 3β-(4-(2-pyrrolyl)phenyl)-8-azabicyclo[3.2.1]octanes and 3β-(5-Indolyl)-8-azabicyclo[3.2.1]octanes". Bioorganic & Medicinal Chemistry Letters. 11 (4): 487–489. doi:10.1016/S0960-894X(00)00701-0. ISSN 0960-894X. PMID 11229754.
- ^ Davies, H. M.; Gilliatt, V; Kuhn, L. A.; Saikali, E; Ren, P; Hammond, P. S.; Sexton, T; Childers, S. R. (2001). "Synthesis of 2β-Acyl-3β-(substituted naphthyl)-8-azabicyclo[3.2.1]octanes and Their Binding Affinities at Dopamine and Serotonin Transport Sites". Journal of Medicinal Chemistry. 44 (10): 1509–1515. doi:10.1021/jm000363+. PMID 11334561.
- ^ Carroll, F. I.; Gao; Abraham; Lewin; Lew; Patel; Boja; Kuhar (1992). "Probes for the cocaine receptor. Potentially irreversible ligands for the dopamine transporter". Journal of Medicinal Chemistry. 35 (10): 1813–1817. doi:10.1021/jm00088a017. PMID 1588560.
- ^ Wu; Reith, M.; Walker, Q.; Kuhn, C.; Carroll, F.; Garris, P. (2002). "Concurrent autoreceptor-mediated control of dopamine release and uptake during neurotransmission: an in vivo voltammetric study". Journal of Neuroscience. 22 (14): 6272–6281. doi:10.1523/JNEUROSCI.22-14-06272.2002. PMC 6757948. PMID 12122086.
- ^ Murthy, V; Martin, TJ; Kim, S; Davies, HM; Childers, SR (August 2008). "In vivo characterization of a novel phenylisothiocyanate tropane analog at monoamine transporters in rat brain". J. Pharmacol. Exp. Ther. 326 (2): 587–95. doi:10.1124/jpet.108.138842. PMID 18492949. S2CID 5996473.
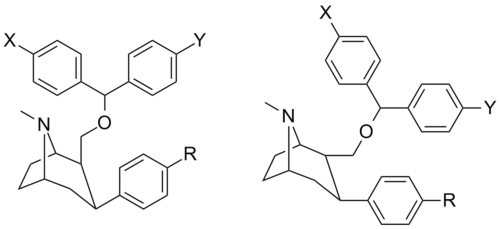
- ^ Xu, L.; Kulkarni, S. S.; Izenwasser, S.; Katz, J. L.; Kopajtic, T.; Lomenzo, S. A.; Newman, A. H.; Trudell, M. L. (2004). "Synthesis and Monoamine Transporter Binding of 2-(Diarylmethoxymethyl)-3β-aryltropane Derivatives". Journal of Medicinal Chemistry. 47 (7): 1676–82. doi:10.1021/jm030430a. PMID 15027858.
- ^ Hong, W. C.; Kopajtic, T. A.; Xu, L.; Lomenzo, S. A.; Jean, B.; Madura, J. D.; Surratt, C. K.; Trudell, M. L.; Katz, J. L. (2016). "2-Substituted 3 -Aryltropane Cocaine Analogs Produce Atypical Effects without Inducing Inward-Facing Dopamine Transporter Conformations". Journal of Pharmacology and Experimental Therapeutics. 356 (3): 624–634. doi:10.1124/jpet.115.230722. ISSN 1521-0103. PMC 4767397. PMID 26769919. nih.gov article (inclu. structural depictions)
- ^ Cesati, RR 3rd; Tamagnan, G; Baldwin, RM; Zoghbi, SS; Innis, RB; Kula, NS; Baldessarini, RJ; Katzenellenbogen, JA (2002). "Synthesis of cyclopentadienyltricarbonyl rhenium phenyltropanes by double ligand transfer: organometallic ligands for the dopamine transporter". Bioconjug Chem. 13 (1): 29–39. doi:10.1021/bc010011x. PMID 11792176.
{{cite journal}}: CS1 maint: numeric names: authors list (link) - ^ Bloom, Jacob W. G.; Wheeler, Steven E. (2011). "Taking the Aromaticity out of Aromatic Interactions". Angew. Chem. 123 (34): 7993–7995. Bibcode:2011AngCh.123.7993B. doi:10.1002/ange.201102982.
- ^ A novel spirocyclic tropanyl-Δ2-isoxazoline derivative enhances citalopram and paroxetine binding to serotonin transporters as well as serotonin uptake. Bioorg Med Chem 2012 Nov 10;20(21):6344-55. Epub 2012 Sep 10.
- ^ Hanna, Mona M. (2007). "Synthesis of some tropane derivatives of anticipated activity on the reuptake of norepinephrine and/or serotonin". Bioorganic. 15 (24): 7765–7772. doi:10.1016/j.bmc.2007.08.055. PMID 17870537.
- ^ Goodman, Mark M. (2003). "Synthesis and Characterization of Iodine-123 Labeled 2β-Carbomethoxy-3β-(4′-((Z)-2-iodoethenyl)phenyl)nortropane. A Ligand for in Vivo Imaging of Serotonin Transporters by Single-Photon-Emission Tomography". Journal of Medicinal Chemistry. 46 (6): 925–935. doi:10.1021/jm0100180. PMID 12620070.
- ^ Blough, B.; Abraham, P.; Lewin, A.; Kuhar, M.; Boja, J.; Carroll, F. (1996). "Synthesis and transporter binding properties of 3β-(4′-alkyl-, 4′-alkenyl-, and 4′-alkynylphenyl)nortropane-2β-carboxylic acid methyl esters: serotonin transporter selective analogs". Journal of Medicinal Chemistry. 39 (20): 4027–4035. doi:10.1021/jm960409s. PMID 8831768. S2CID 21616809.
- ^ Spealman, R. D.; Kelleher, R. T. (Mar 1981). "Self-administration of cocaine derivatives by squirrel monkeys". The Journal of Pharmacology and Experimental Therapeutics. 216 (3): 532–536. ISSN 0022-3565. PMID 7205634.
- ^ Carroll, F.; Tyagi, S.; Blough, B.; Kuhar, M.; Navarro, H. (2005). "Synthesis and monoamine transporter binding properties of 3α-(substituted phenyl)nortropane-2β-carboxylic acid methyl esters. Norepinephrine transporter selective compounds". Journal of Medicinal Chemistry. 48 (11): 3852–3857. doi:10.1021/jm058164j. PMID 15916437.
- ^ Purushotham, M; Sheri, A; Pham-Huu, D. P.; Madras, B. K.; Janowsky, A; Meltzer, P. C. (2011). "The synthesis and biological evaluation of 2-(3-methyl or 3-phenylisoxazol-5-yl)-3-aryl-8-thiabicyclo3.2.1octanes". Bioorganic & Medicinal Chemistry Letters. 21 (1): 48–51. doi:10.1016/j.bmcl.2010.11.076. PMC 3015105. PMID 21146984.
- ^ a b Wu, Xiaoai; Cai, Huawei; Ge, Ran; Li, Lin; Jia, Zhiyun (2015). "Recent Progress of Imaging Agents for Parkinson's Disease". Current Neuropharmacology. 12 (6): 551–563. doi:10.2174/1570159X13666141204221238. ISSN 1570-159X. PMC 4428027. PMID 25977680.
- ^ U.S. patent 6,150,376
- ^ WO 0007994, Kozikowski, Alan P. & Smith, Miles P., "Novel bi- and tri-cyclic aza compounds and their uses", published 2000-02-17, assigned to Georgetown University
- ^ Sakamuri, Sukumar; et al. (2000). "Synthesis of novel spirocyclic cocaine analogs using the Suzuki coupling". Tetrahedron Letters. 41 (13): 2055–2058. doi:10.1016/S0040-4039(00)00113-1.
- ^ exo-2-Phenyl-7-azabicyclo[2.2.1]heptane-1-carboxylic Acid: A New Constrained Proline Analogue. Source: Tetrahedron Letters, Volume 36, Number 39, 25 September 1995, pp. 7123-7126(4)
- ^ Kozikowski, A. P.; Araldi, G. L.; Boja, J.; Meil, W. M.; Johnson, K. M.; Flippen-Anderson, J. L.; George, C.; Saiah, E. (1998). "Chemistry and Pharmacology of the Piperidine-Based Analogues of Cocaine. Identification of Potent DAT Inhibitors Lacking the Tropane Skeleton". Journal of Medicinal Chemistry. 41 (11): 1962–9. CiteSeerX 10.1.1.512.7158. doi:10.1021/jm980028+. PMID 9599245.
- ^ NIH U.S. National Library of Medicine. PubChem CID: 44337825, InChI Key: MHDRABCQAWNSIK-PZORYLMUSA-N
- ^ Further SAR Studies of Piperidine-Based Analogues of Cocaine. 2. Potent Dopamine and Serotonin Reuptake Inhibitors J. Med. Chem. 2000,43,1215-1222
- ^ Napier, Susan; Bingham, Matilda (2009). Transporters as Targets for Drugs. Topics in Medicinal Chemistry. Vol. 4. Bibcode:2009ttd..book.....N. doi:10.1007/978-3-540-87912-1. ISBN 978-3-540-87911-4.
- ^ Stehouwer, Jeffrey S. (2006). "Synthesis, Radiosynthesis, and Biological Evaluation of Carbon-11 Labeled 2β-Carbomethoxy-3β-(3′-(( Z )-2-haloethenyl)phenyl)nortropanes: Candidate Radioligands for in Vivo Imaging of the Serotonin Transporter with Positron Emission Tomography". Journal of Medicinal Chemistry. 49 (23): 6760–6767. doi:10.1021/jm060641q. PMID 17154506.
- ^ Deskus, Jeffrey A. (2007). "Conformationally restricted homotryptamines 3. Indole tetrahydropyridines and cyclohexenylamines as selective serotonin reuptake inhibitors". Bioorganic & Medicinal Chemistry. 17 (11): 3099–3104. doi:10.1016/j.bmcl.2007.03.040. PMID 17391962.
- ^ Schmitz, William D. (2005). "Homotryptamines as potent and selective serotonin reuptake inhibitors (SSRIs)". Bioorganic & Medicinal Chemistry. 15 (6): 1619–1621. doi:10.1016/j.bmcl.2005.01.059. PMID 15745809.
- ^ Plisson, Christophe (2007). "Synthesis and in Vivo Evaluation of Fluorine-18 and Iodine-123 Labeled 2β-Carbo(2-fluoroethoxy)-3β-(4′-(( Z )-2-iodoethenyl)phenyl)nortropane as a Candidate Serotonin Transporter Imaging Agent". Journal of Medicinal Chemistry. 50 (19): 4553–4560. doi:10.1021/jm061303s. PMID 17705359.
- ^ McMahon, C. G.; McMahon, C. N.; Leow, L. J. (2006). "New agents in the treatment of premature ejaculation". Neuropsychiatric Disease and Treatment. 2 (4): 489–503. doi:10.2147/nedt.2006.2.4.489. PMC 2671940. PMID 19412497.
- ^ Leung, K (2004). "N-4-Fluorobut-2-yn-1-yl-2β-carbo-[11C]methoxy-3β-phenyltropane". PMID 22073420.
{{cite journal}}: Cite journal requires|journal=(help) - ^ Stenzinger, W; Blömker, A; Hiddemann, W; de Loo, J (1990). "Treatment of refractory multiple myeloma with the vincristine-adriamycin-dexamethasone (VAD) regimen". Blut. 61 (2–3): 55–9. doi:10.1007/bf02076700. PMID 2207342. S2CID 25860357.
- ^ Ma, S; Cheng, MH; Guthrie, DA; Newman, AH; Bahar, I; Sorkin, A (2017). "Targeting of dopamine transporter to filopodia requires an outward-facing conformation of the transporter". Sci Rep. 7 (1): 5399. Bibcode:2017NatSR...7.5399M. doi:10.1038/s41598-017-05637-x. PMC 5511133. PMID 28710426.
Im-pact indices (exact locations within sources cited) & foot-notations
- ^ [1] ←Page #929 (5th page of article) § II
- ^ Многие из RTI фенилтропанов имеют код " RTI-4229- ××× ", где × — конкретный кодовый номер фенилтропана.
—
например , RTI-55 на самом деле RTI-4229-55 , но для простоты в сокращении приводится просто RTI-55 (следуя тому, как это делается в самой литературе), поскольку предмет в контексте полностью входит в сферу действия кодируемой здесь категории фенилтропана. Иногда (реже) он указывается как RTI-COC- ××× для " производного кокаина
". —
Стоит упомянуть в обозначениях, чтобы объяснить, что другие соединения, совершенно не связанные, могут быть найдены с тем же " RTI- ××× " сокращенным номером назначения. Поэтому следует ожидать, что в различных контекстах соединение или химическое вещество с одинаковым названием вполне может относиться к совершенно другому веществу из другого химического ряда, не аналогичному тем, что рассматриваются в данной теме. - ^ [1] ←Страница № 970 (46-я страница статьи) §B, 10-я строка
- ^ [1] ←Страница № 971 (47-я страница статьи) 1-я ¶, 10-я строка
- ^ Бета ( т.е. 2,3 Rectus ) - Карбметокси- Фенил- Тропан
- ^ Бета ( т.е. 2,3 Rectus ) - Карбметокси- Фторфенил- Тропан
- ^ [1] ←Страница № 940 (16-я страница статьи) под таблицей 8, выше § 4
- ^ [1] ←Страница № 941 (17-я страница статьи) Рисунок 10
- ^ [1] ←Страница № 967 (43-я страница статьи) 2-я колонка
- ^ [1] ←Страница № 967 (43-я страница статьи) 2-я колонка
- ^ [1] ←Страница № 955 (31-я страница статьи) 1-я (левая) колонка, 2-я ¶
Внешние ссылки
- Предварительная патентная заявка США, в которой перечислены примеры соединений, являющихся тропанами, для перспективного использования в исследованиях
- Статья об исследовании аналогов кокаина. Архивировано 22 сентября 2006 г. на Wayback Machine.