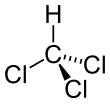
Хлороформ
Вы можете помочь расширить эту статью, переведя текст из соответствующей статьи на турецком языке . (Сентябрь 2024 г.) Нажмите [показать] для получения важных инструкций по переводу.
|
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Трихлорметан | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| Сокращения | Р-20, ТСМ | ||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.000.603 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 1888 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С Н Cl 3 | |||
| Молярная масса | 119,37 г·моль −1 | ||
| Появление | Бесцветная жидкость с высоким показателем преломления. | ||
| Запах | Сладкий, мятный, приятный | ||
| Плотность | 1,564 г/см 3 (−20 °C) 1,489 г/см 3 (25 °C) 1,394 г/см 3 (60 °C) | ||
| Температура плавления | −63,5 °C (−82,3 °F; 209,7 К) | ||
| Точка кипения | 61,15 °C (142,07 °F; 334,30 K) разлагается при 450 °C | ||
| 10,62 г/л (0 °C) 8,09 г/л (20 °C) 7,32 г/л (60 °C) | |||
| Растворимость | Растворим в бензоле. Смешивается с диэтиловым эфиром , маслами , лигроином , спиртом , CCl4 , CS2 . | ||
| Растворимость в ацетоне | ≥ 100 г/л (19 °C) | ||
| Растворимость в диметилсульфоксиде | ≥ 100 г/л (19 °C) | ||
| Давление пара | 0,62 кПа (-40 °C) 7,89 кПа (0 °C) 25,9 кПа (25 °C) 313 кПа (100 °C) 2,26 МПа (200 °C) | ||
Константа закона Генри ( k H ) | 3,67 л·атм/моль (24 °C) | ||
| Кислотность ( pK a ) | 15,7 (20 °С) | ||
| УФ-видимый (λ макс ) | 250 нм, 260 нм, 280 нм | ||
| −59,30·10 −6 см 3 /моль | |||
| Теплопроводность | 0,13 Вт/(м·К) (20 °C) | ||
Показатель преломления ( nD ) | 1,4459 (20 °С) | ||
| Вязкость | 0,563 сП (20 °С) | ||
| Структура | |||
| Тетраэдрический | |||
| 1.15 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 114,25 Дж/(моль·К) | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 202,9 Дж/(моль·К) | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −134,3 кДж/моль | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | −71,1 кДж/моль | ||
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | 473,21 кДж/моль | ||
| Фармакология | |||
| N01AB02 ( ВОЗ ) | |||
| Опасности [9] | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | Разлагается на чрезвычайно токсичный фосген и хлористый водород в присутствии света – возможно канцерогенно – Репродуктивная токсичность – гепатотоксично [3] [4] [5] | ||
| Маркировка СГС : | |||
   | |||
| Опасность | |||
| Х302 , Х315 , Х319 , Х331 , Х336 , Х351 , Х361д , Х372 | |||
| Р201 , Р202 , Р235 , Р260 , Р264 , Р270 , Р271 , Р280 , Р281 , Р301+Р330+Р331 , Р302+Р352 , Р304+Р340 , Р305+Р351+Р338 , Р308+Р313 , Р310 , Р311 , Р314 , Р332+Р313 , Р337+Р313 , Р362 , Р403+Р233 , Р405 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Негорючий | ||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LD 50 ( средняя доза ) | 704 мг/кг (мышь, дермально) [6] | ||
LC 50 ( средняя концентрация ) | 47,702 мг/м 3 (крыса, 4 часа) [7] | ||
LC Lo ( самый низкий опубликованный ) |
| ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (допустимый) | 50 частей на миллион (240 мг/м 3 ) [4] | ||
РЕЛ (рекомендуется) | Ca ST 2 ppm (9,78 мг/м 3 ) [60-минутный] [4] | ||
IDLH (Непосредственная опасность) | 500 частей на миллион [4] [ требуется разъяснение ] | ||
| Паспорт безопасности (SDS) | [1] | ||
| Родственные соединения | |||
Родственные соединения |
| ||
| Страница дополнительных данных | |||
| Хлороформ (страница данных) | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Хлороформ [10] или трихлорметан ( часто сокращенно ТКМ ) — это хлорорганическое соединение с формулой CHCl3 и распространённый растворитель . Это летучая , бесцветная, сладко пахнущая, плотная жидкость, производимая в больших масштабах в качестве предшественника хладагентов и ПТФЭ . [ 11] Хлороформ когда-то использовался в качестве ингаляционного анестетика между 19-м веком и первой половиной 20-го века. [12] [ 13] Он смешивается со многими растворителями, но очень слабо растворяется в воде (всего 8 г/л при 20 °C).
Структура и название
Молекула принимает тетраэдрическую молекулярную геометрию с симметрией C3v . [14] Молекулу хлороформа можно рассматривать как молекулу метана , в которой три атома водорода заменены тремя атомами хлора, в результате чего остается один атом водорода.
Название «хлороформ» представляет собой сочетание слов терхлорид ( третичный хлорид, трихлорид) и формил , устаревшее название метилилиденового радикала (CH), полученного из муравьиной кислоты .
Естественное явление
Многие виды морских водорослей производят хлороформ, и считается, что грибы производят хлороформ в почве. [15] Абиотические процессы также, как полагают, способствуют естественному производству хлороформа в почве, хотя механизм до сих пор неясен. [16]
Хлороформ — летучее органическое соединение. [17]
История
Хлороформ был синтезирован независимо несколькими исследователями около 1831 года :
- Молденхауер, немецкий фармацевт из Франкфурта-на-Одере , по-видимому, получил хлороформ в 1830 году, смешав хлорную известь с этанолом ; однако он принял его за хлорэтер (хлористый эфир, 1,2-дихлорэтан ). [18] [19]
- Сэмюэль Гатри , американский врач из Сакетс-Харбора, штат Нью-Йорк , также, по-видимому, получил хлороформ в 1831 году путем реакции хлорированной извести с этанолом и отметил его анестезирующие свойства; однако он также считал, что приготовил хлорный эфир. [20] [21] [22]
- Юстус фон Либих осуществил щелочное расщепление хлораля . Либих ошибочно утверждает, что эмпирическая формула хлороформа была C2Cl5 и назвал его « Chlorkohlenstoff » ( « хлористый углерод»). [23] [24]
- Эжен Субейран получил это соединение путем воздействия хлорного отбеливателя на этанол и ацетон . [25]
В 1834 году французский химик Жан-Батист Дюма определил эмпирическую формулу хлороформа и назвал его: [26] « Es scheint mir also erweisen, dass die von mir analysirte Substanz, … zur Formel hat: C 2 H 2 Cl 6 . » (Таким образом, мне кажется, что это показывает, что вещество, которое я анализировал …, имеет [свою эмпирическую] формулу: C 2 H 2 Cl 6 .). [Примечание: коэффициенты его эмпирической формулы следует разделить вдвое.] ... « Diess hat mich veranlasst diese Substanz mit dem Namen 'Chloroform' zu belegen. » (Это побудило меня дать этому веществу [т. е. формилхлориду или хлориду муравьиной кислоты] название «хлороформ».)
В 1835 году Дюма получил это вещество путем щелочного расщепления трихлоруксусной кислоты .
В 1842 году Роберт Мортимер Гловер в Лондоне открыл анестезирующие свойства хлороформа на лабораторных животных. [27]
В 1847 году шотландский акушер Джеймс Й. Симпсон первым продемонстрировал анестезирующие свойства хлороформа, предоставленного местным фармацевтом Уильямом Флокхартом из Duncan, Flockhart and company [28] , на людях и помог популяризировать препарат для использования в медицине. [29]
К 1850-м годам хлороформ производился на коммерческой основе. В Британии к 1895 году производилось около 750 000 доз в неделю, [30] используя процедуру Либиха, которая сохраняла свое значение до 1960-х годов. Сегодня хлороформ – вместе с дихлорметаном – получают исключительно и в больших масштабах путем хлорирования метана и хлорметана. [11]
Производство
В промышленности хлороформ получают путем нагревания смеси хлора и либо метилхлорида ( CH 3 Cl ), либо метана ( CH 4 ). [11] При температуре 400–500 °C происходит свободнорадикальное галогенирование , преобразующее эти предшественники в более хлорированные соединения:
Хлороформ подвергается дальнейшему хлорированию с образованием четыреххлористого углерода ( CCl4 ):
- CHCl3 + Cl2 → CCl4 + HCl
Выход этого процесса представляет собой смесь четырех хлорметанов: хлорметана , метиленхлорида (дихлорметана), трихлорметана (хлороформа) и тетрахлорметана (четыреххлористого углерода). Затем их можно разделить путем перегонки . [11]
Хлороформ также может быть получен в небольших масштабах посредством галоформной реакции между ацетоном и гипохлоритом натрия :
- 3 NaOCl + (CH 3 ) 2 CO → CHCl 3 + 2 NaOH + CH 3 COONa
Дейтерохлороформ
Дейтерированный хлороформ является изотопологом хлороформа с одним атомом дейтерия . CDCl 3 является распространенным растворителем, используемым в ЯМР-спектроскопии . Дейтерохлороформ получают путем реакции гексахлорацетона с тяжелой водой . [31] Процесс галоформа в настоящее время устарел для производства обычного хлороформа. Дейтерохлороформ также может быть получен путем реакции дейтерооксида натрия с хлоралгидратом . [32] [33]
Непреднамеренное образование хлороформа
Реакция галоформа может также произойти непреднамеренно в домашних условиях. Раствор гипохлорита натрия ( хлорный отбеливатель ), смешанный с обычными бытовыми жидкостями, такими как ацетон , метилэтилкетон , этанол или изопропиловый спирт , может производить некоторое количество хлороформа, в дополнение к другим соединениям, таким как хлорацетон или дихлорацетон . [ необходима цитата ]
Использует
С точки зрения масштаба наиболее важной является реакция хлороформа с фтористым водородом с образованием монохлордифторметана (HCFC-22), предшественника в производстве политетрафторэтилена ( тефлона ) и других фторполимеров: [11]
- CHCl3 + 2HF → CHClF2 + 2HCl
Реакция проводится в присутствии каталитического количества смешанных галогенидов сурьмы . Хлордифторметан затем преобразуется в тетрафторэтилен , основной предшественник тефлона . [34]
Растворитель
Водород , присоединенный к углероду в хлороформе, участвует в образовании водородных связей, [35] [36] что делает его хорошим растворителем для многих материалов.
Во всем мире хлороформ также используется в пестицидных составах, как растворитель для липидов , каучука , алкалоидов , восков , гуттаперчи и смол , как чистящее средство, как фумигант зерна , в огнетушителях и в резиновой промышленности. [37] [38] CDCl 3 является распространенным растворителем, используемым в ЯМР-спектроскопии . [39]
Хладагент
Хлороформ используется в качестве прекурсора для производства R-22 (хлордифторметана). Это делается путем его реакции с раствором плавиковой кислоты (HF), которая фторирует молекулу CHCl 3 и выделяет соляную кислоту в качестве побочного продукта. [40] До вступления в силу Монреальского протокола большая часть хлороформа, производимого в Соединенных Штатах, использовалась для производства хлордифторметана . Однако его производство остается высоким, поскольку он является ключевым прекурсором ПТФЭ. [41]
Хотя хлороформ обладает такими свойствами, как низкая температура кипения и низкий потенциал глобального потепления, равный всего 31 (по сравнению с 1760 у R-22), что является привлекательными свойствами для хладагента, мало информации, позволяющей предположить, что он широко использовался в качестве хладагента в каких-либо потребительских товарах. [42]
кислота Льюиса
В таких растворителях, как CCl 4 и алканы, хлороформ образует водородные связи с различными основаниями Льюиса. HCCl 3 классифицируется как жесткая кислота , а модель ECW определяет ее кислотные параметры как E A = 1,56 и C A = 0,44.
Реагент
В качестве реагента хлороформ служит источником дихлоркарбенового промежуточного соединения CCl 2 . [43] Он реагирует с водным раствором гидроксида натрия , обычно в присутствии катализатора фазового переноса , с образованием дихлоркарбена , CCl 2 . [44] [45] Этот реагент осуществляет орто-формилирование активированных ароматических колец , таких как фенолы , производя арилальдегиды в реакции, известной как реакция Реймера-Тимана . Альтернативно, карбен может быть захвачен алкеном с образованием производного циклопропана . В реакции присоединения Хараша хлороформ образует свободный радикал •CHCl 2 , который присоединяется к алкенам. [ необходима цитата ]
Анестезирующий

Хлороформ — мощный общий анестетик , эйфориант , анксиолитик и седативное средство при вдыхании или приеме внутрь. Анестезирующие свойства хлороформа были впервые описаны в 1842 году в диссертации Роберта Мортимера Гловера , которая в том году получила Золотую медаль Харвейского общества . [46] [47] Гловер также проводил практические эксперименты на собаках, чтобы доказать свои теории, усовершенствовал их и представил в своей докторской диссертации в Эдинбургском университете летом 1847 года, определив анестезирующие галогенные соединения как «новый порядок ядовитых веществ». [48]
Шотландский акушер Джеймс Янг Симпсон был одним из тех экзаменаторов, которые должны были прочитать диссертацию, но позже утверждал, что никогда ее не читал и пришел к своим собственным выводам независимо. [49] Перкинс-Маквей, среди прочих, выразил сомнения относительно достоверности заявления Симпсона, отметив, что публикации Симпсона по этой теме в 1847 году явно перекликаются с публикациями Гловера, и, будучи одним из экзаменаторов диссертации, Симпсон, вероятно, был осведомлен о содержании исследования Гловера, даже если он уклонился от своих обязанностей экзаменатора. [50] В 1847 и 1848 годах Гловер написал серию горячих писем, обвиняя Симпсона в краже его открытия, которое уже принесло Симпсону значительную известность. [51] Каким бы ни был источник его вдохновения, 4 ноября 1847 года Симпсон утверждал, что он открыл анестезирующие свойства хлороформа у людей. Он и двое его коллег развлекались, пробуя действие различных веществ, и таким образом выявили потенциал хлороформа в медицинских процедурах. [28]

Несколько дней спустя, во время стоматологической процедуры в Эдинбурге , Фрэнсис Броди Имлах стал первым человеком, который применил хлороформ к пациенту в клинических условиях. [52]
В мае 1848 года Роберт Холлидей Ганнинг выступил с докладом в Эдинбургском медико-хирургическом обществе после серии лабораторных экспериментов на кроликах , которые подтвердили выводы Гловера, а также опровергли заявления Симпсона об оригинальности. Лабораторные эксперименты, доказавшие опасность хлороформа, в значительной степени игнорировались. [53]
Использование хлороформа во время хирургических операций быстро распространилось в Европе; например, в 1850-х годах хлороформ использовался врачом Джоном Сноу во время родов последних двух детей королевы Виктории Леопольда и Беатрисы . [54] В Соединенных Штатах хлороформ начал заменять эфир в качестве анестетика в начале 20-го века; [ требуется ссылка ] от него отказались в пользу эфира после открытия его токсичности, особенно его тенденции вызывать фатальные сердечные аритмии, аналогичные тому, что сейчас называют « внезапной смертью нюхача ». Некоторые люди использовали хлороформ в качестве рекреационного наркотика или для попытки самоубийства. [55] Одним из возможных механизмов действия хлороформа является то, что он увеличивает движение ионов калия через определенные типы калиевых каналов в нервных клетках . [56] Хлороформ также можно смешивать с другими анестетиками, такими как эфир, чтобы сделать смесь CE, или эфир и спирт , чтобы сделать смесь ACE . [ требуется ссылка ]
В 1848 году Ханна Гринер, 15-летняя девочка, которой удалили инфицированный ноготь на пальце ноги, умерла после введения анестетика. [57] Ее вскрытие, установившее причину смерти, было проведено Джоном Файфом с помощью Роберта Мортимера Гловера . [27] Несколько физически здоровых пациентов умерли после вдыхания этого вещества. Однако в 1848 году Джон Сноу разработал ингалятор, который регулировал дозировку и таким образом успешно снизил количество смертей. [58]
Противники и сторонники хлороформа расходились во мнениях по вопросу о том, были ли медицинские осложнения вызваны нарушением дыхания или хлороформ оказывал специфическое воздействие на сердце. Между 1864 и 1910 годами многочисленные комиссии в Великобритании изучали хлороформ, но не смогли прийти к каким-либо четким выводам. Только в 1911 году Леви доказал в экспериментах с животными, что хлороформ может вызывать фибрилляцию желудочков. [ необходима цитата ] Несмотря на это, между 1865 и 1920 годами хлороформ использовался в 80–95% всех наркозов, проводимых в Великобритании и немецкоязычных странах. В Германии комплексные исследования уровня смертности во время анестезии были проведены Гурльтом между 1890 и 1897 годами. [ необходима цитата ] В то же время в Великобритании медицинский журнал The Lancet провел анкетирование [59] и составил отчет, в котором подробно описывались многочисленные побочные реакции на анестетики, включая хлороформ. [60] В 1934 году Киллиан собрал все статистические данные, собранные к тому времени, и обнаружил, что вероятность смертельных осложнений при использовании эфира составляла от 1:14 000 до 1:28 000, тогда как при использовании хлороформа эта вероятность составляла от 1:3 000 до 1:6 000. [ необходима цитата ] Развитие газовой анестезии с использованием закиси азота , усовершенствованное оборудование для введения анестетиков и открытие гексобарбитала в 1932 году привели к постепенному упадку наркоза хлороформом. [61]
Последнее зарегистрированное применение хлороформа в качестве анестезии в западном мире датируется 1987 годом, когда последний врач, использовавший его, вышел на пенсию, примерно через 140 лет после его первого использования. [62]
Использование в преступных целях
Хлороформ использовался преступниками для того, чтобы вырубить, ошеломить или убить жертв. Джозеф Харрис был обвинен в 1894 году в использовании хлороформа для ограбления людей. [63] Серийный убийца Х. Х. Холмс использовал передозировку хлороформа, чтобы убить своих жертв женского пола. В сентябре 1900 года хлороформ был замешан в убийстве американского бизнесмена Уильяма Марша Райса . Хлороформ считался фактором в предполагаемом убийстве женщины в 1991 году, когда она задохнулась во сне. [64] В 2002 году 13-летняя Кейси Вуди была усыплена хлороформом, когда ее похитил Дэвид Фуллер, и в то время, когда он держал ее, прежде чем он застрелил ее. [65] В сделке о признании вины 2007 года мужчина признался в использовании электрошокеров и хлороформа для сексуального насилия над несовершеннолетними. [66]
Использование хлороформа в качестве инкапаситирующего агента стало широко признанным, граничащим с клише , благодаря принятию авторами криминальной литературы сюжетов, в которых преступники используют тряпки, пропитанные хлороформом, чтобы лишить жертв сознания. Однако практически невозможно лишить кого-либо сознания, используя хлороформ таким образом. [67] Требуется не менее пяти минут вдыхания хлороформа, чтобы человек потерял сознание. Большинство уголовных дел, связанных с хлороформом, включают совместное введение другого наркотика, такого как алкоголь или диазепам , или соучастие жертвы в его приеме. После того, как человек потерял сознание из-за вдыхания хлороформа, необходимо ввести непрерывный объем, а подбородок необходимо поддерживать, чтобы язык не перекрывал дыхательные пути, — сложная процедура, обычно требующая навыков анестезиолога . В 1865 году, как прямой результат криминальной репутации, которую приобрел хлороформ, медицинский журнал The Lancet предложил «постоянную научную репутацию» любому, кто мог продемонстрировать «мгновенную нечувствительность», т. е. потерю сознания, с помощью хлороформа. [68]
Безопасность
Контакт
Хлороформ образуется как побочный продукт хлорирования воды , наряду с рядом других побочных продуктов дезинфекции , и поэтому он часто присутствует в муниципальной водопроводной воде и плавательных бассейнах. Сообщаемые диапазоны значительно различаются, но, как правило, ниже текущего стандарта здоровья для общего количества тригалометанов (ТГМ) в 100 мкг/л. [69] Однако, если рассматривать его в сочетании с другими тригалометанами, часто присутствующими в питьевой воде, концентрация ТГМ часто превышает рекомендуемый предел воздействия. [70]
Хотя лишь немногие исследования оценивали риски, связанные с воздействием хлороформа через питьевую воду отдельно от других ТГМ, многие исследования показали, что воздействие общей категории ТГМ, включая хлороформ, связано с повышенным риском рака мочевого пузыря или нижних отделов желудочно-кишечного тракта. [71]
Исторически воздействие хлороформа могло быть выше из-за его распространенного использования в качестве анестетика, как ингредиента сиропов от кашля и как компонента табачного дыма , тогда как ДДТ ранее использовался в качестве фумиганта . [72]
Фармакология
Хлороформ хорошо всасывается, метаболизируется и быстро выводится млекопитающими после перорального, ингаляционного или дермального воздействия. Случайное попадание брызг в глаза вызвало раздражение. [37] Длительное дермальное воздействие может привести к развитию язв в результате обезжиривания . Выведение в основном осуществляется через легкие в виде хлороформа и углекислого газа; менее 1% выводится с мочой. [38]
Хлороформ метаболизируется в печени ферментами цитохрома P-450 , путем окисления до трихлорметанола и восстановления до дихлорметильного свободного радикала . Другие метаболиты хлороформа включают соляную кислоту и диглутатионилдитиокарбонат, причем диоксид углерода является преобладающим конечным продуктом метаболизма. [73]
Как и большинство других общих анестетиков и седативно-снотворных препаратов, хлороформ является положительным аллостерическим модулятором рецепторов ГАМК А. [74] Хлороформ вызывает угнетение центральной нервной системы (ЦНС), в конечном итоге вызывая глубокую кому и угнетение дыхательного центра. [73] При попадании внутрь хлороформ вызывает симптомы, похожие на те, которые наблюдаются после вдыхания. Серьезное заболевание последовало за приемом внутрь 7,5 г (0,26 унции). Средняя летальная пероральная доза для взрослого человека оценивается в 45 г (1,6 унции). [37]
Анестезиологическое применение хлороформа было прекращено, поскольку оно вызывало смерть от дыхательной недостаточности и сердечной аритмии. После анестезии, вызванной хлороформом, некоторые пациенты страдали тошнотой , рвотой , гипертермией , желтухой и комой из-за печеночной дисфункции . При вскрытии наблюдались некроз и дегенерация печени. [37] Считается, что гепатотоксичность и нефротоксичность хлороформа в значительной степени обусловлены фосгеном , одним из его метаболитов. [73]
Превращение в фосген
Хлороформ медленно превращается под воздействием ультрафиолетового света и воздуха в чрезвычайно ядовитый газ фосген ( COCl2 ), выделяя при этом HCl . [75]
- 2 CHCl3 + O2 → 2 COCl2 + 2 HCl
Для предотвращения несчастных случаев коммерческий хлороформ стабилизируют этанолом или амиленом , но образцы, которые были восстановлены или высушены, больше не содержат стабилизатора. Амилен оказался неэффективным, а фосген может влиять на аналиты в образцах, липиды и нуклеиновые кислоты, растворенные или извлеченные с помощью хлороформа. [76] Когда этанол используется в качестве стабилизатора для хлороформа, он реагирует с фосгеном (который растворим в хлороформе) с образованием относительно безвредного диэтилкарбонатного эфира:
- 2 СН 3 СН 2 ОН + COCl 2 → CO 3 (СН 2 СН 3 ) 2 + 2 HCl
Фосген и HCl можно удалить из хлороформа промывкой насыщенными водными растворами карбоната , такими как бикарбонат натрия . Эта процедура проста и приводит к получению безвредных продуктов. Фосген реагирует с водой, образуя диоксид углерода и HCl, [77] а карбонатная соль нейтрализует полученную кислоту. [78]
Подозреваемые образцы можно проверить на фосген с помощью фильтровальной бумаги, которая при обработке 5% дифениламином , 5% диметиламинобензальдегидом в этаноле и последующей сушке желтеет в присутствии паров фосгена. [79] Существует несколько колориметрических и флуорометрических реагентов для фосгена, и его также можно количественно определить с помощью масс-спектрометрии . [80]
Регулирование
Согласно монографиям Международного агентства по изучению рака (МАИР), хлороформ, как предполагается, вызывает рак (т.е. он, возможно, канцерогенен , группа 2B по классификации МАИР ). [81]
В Соединенных Штатах он классифицируется как чрезвычайно опасное вещество , как определено в разделе 302 Закона США о планировании действий в чрезвычайных ситуациях и праве общества на информацию (42 USC 11002), и подлежит строгим требованиям отчетности со стороны предприятий, которые производят, хранят или используют его в значительных количествах. [82]
Биоремедиация хлороформа
Некоторые анаэробные бактерии используют хлороформ для дыхания, называемого органогалогенидным дыханием , преобразуя его в дихлорметан . [83] [84]
Галерея
- CHCl 3, измеренный в ходе Advanced Global Atmospheric Gases Experiment (AGAGE) в нижних слоях атмосферы ( тропосфере ) на станциях по всему миру. Содержание указано в виде среднемесячных молярных долей без загрязнения в частях на триллион (ppt).
Смотрите также
Ссылки
- ↑ Грегори, Уильям, Справочник по органической химии (Третье издание, исправленное и значительно расширенное), 1852, стр. 177
- ^ Дэниел Перейра Гарднер, Медицинская химия для студентов и профессионалов: руководство по науке с ее приложениями к токсикологии, физиологии, терапии, гигиене и т. д. (1848), стр. 271
- ^ "Часть 3. Опасности для здоровья" (PDF) . Всемирно согласованная система классификации и маркировки химических веществ (GHS) . Второе пересмотренное издание. Организация Объединенных Наций. Архивировано (PDF) из оригинала 4 марта 2019 г. . Получено 30 сентября 2017 г. .
- ^ abcd Карманный справочник NIOSH по химическим опасностям. "#0127". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Токсичность на PubChem Архивировано 17 августа 2018 г. на Wayback Machine
- ^ Льюис, Ричард Дж. (2012). Опасные свойства промышленных материалов Сакса (12-е изд.). Wiley. ISBN 978-0-470-62325-1.
- ^ "Хлороформ" (PDF) . Агентство по охране окружающей среды . Сентябрь 2016 . Получено 19 февраля 2024 .
- ^ "Хлороформ". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ "PubChem: Безопасность и опасности – Классификация GHS". Национальный центр биотехнологической информации, Национальная медицинская библиотека США. Архивировано из оригинала 17 августа 2018 года . Получено 17 августа 2018 года .
- ^ "Front Matter". Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 661. doi :10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Сохраненные названия «бромоформ» для HCBr 3 , «хлороформ» для HCCl 3 и «йодоформ» для HCl 3 приемлемы в общей номенклатуре. Предпочтительными названиями ИЮПАК являются замещающие названия.
- ^ abcde Россберг, М.; и др. "Хлорированные углеводороды". Энциклопедия промышленной химии Ульмана . Weinheim: Wiley-VCH. doi :10.1002/14356007.a06_233.pub2. ISBN 978-3-527-30673-2.
- ^ "Эфир и хлороформ". Архивировано из оригинала 24 марта 2018 года . Получено 24 апреля 2018 года .
- ^ "Хлороформ [MAK Value Documentation, 2000]". Коллекция MAK по охране труда и технике безопасности = 20–58 . 2012. doi :10.1002/3527600418.mb6766e0014. ISBN 978-3-527-60041-0.
- ^ "Иллюстрированный глоссарий органической химии - Хлороформ". www.chem.ucla.edu . Получено 29 декабря 2022 г. .
- ^ Каппеллетти, М. (2012). «Микробная деградация хлороформа». Прикладная микробиология и биотехнология . 96 (6): 1395– 409. doi :10.1007/s00253-012-4494-1. PMID 23093177. S2CID 12429523.
- ^ Цзяо, Йи и др. (2018). «Выбросы галоидоуглерода из деградировавших лесных водно-болотных угодий в прибрежной Южной Каролине, пострадавших от повышения уровня моря». ACS Earth and Space Chemistry . 2 (10): 955–967 . Bibcode : 2018ESC.....2..955J. doi : 10.1021/acsearthspacechem.8b00044. S2CID 134649348.
- ^ "Полный список ЛОС".
- ^ Молденхауэр (1830). «Verfahren den Spiritus von dem Fuselöl auf leichte Weise zu befreien» [Процедура освобождения этанола из сивушного масла простым способом]. Магазин для аптек . 8 (31): 222–227 . Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- ^ Defalque, Ray J.; Wright, AJ (2000). «Производился ли хлороформ до 1831 года?». Анестезиология . 92 (1): 290– 291. doi : 10.1097/00000542-200001000-00060 . PMID 10638939.
- ^ Гатри, Сэмюэл (1832). «Новый способ приготовления спиртового раствора хлорного эфира». Американский журнал науки и искусств . 21 : 64–65 и 405–408. Архивировано из оригинала 29 июля 2020 г. Получено 6 мая 2016 г.
- ^ Гатри, Оссиан (1887). Мемуары доктора Сэмюэля Гатри и история открытия хлороформа. Чикаго: George K. Hazlitt & Co., стр. 1.
- ^ Stratmann, Linda (2003). "Глава 2". Хлороформ: Поиски забвения . Stroud: Sutton Publishing. ISBN 978-0-7524-9931-4. Архивировано из оригинала 29 июля 2020 . Получено 6 мая 2016 .
- ^ Либих, Юстус фон (1831). «Ueber die Zersetzung des Alkohols durch Chlor» [О разложении спирта хлором]. Аннален дер Физик и Химия . 99 (11): 444. Бибкод : 1831АнП....99..444Л. дои : 10.1002/andp.18310991111. Архивировано из оригинала 10 мая 2017 года . Проверено 6 мая 2016 г.
- ^ Либих, Юстус фон (1832). «Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildendes Gas und Essiggeist entstehen» [О соединениях, которые возникают при реакции хлора со спиртом [этанолом], эфиром [диэтиловым эфиром], нефтеобразующим газом [ этилен] и спирт уксуса [ацетон]]. Аннален дер Физик и Химия . 100 (2): 243–295 . Бибкод : 1832АнП...100..243Л. дои : 10.1002/andp.18321000206.
На страницах 259–265 Либих описывает Chlorkohlenstoff («хлористый углерод», хлороформ), но на странице 264 Либих ошибочно утверждает, что эмпирическая формула хлороформа — C 2 Cl 5 . - ^ Субейран, Эжен (1831). «Исследования некоторых соединений хлора». Annales de Chimie et de Physique . Серия 2. 48 : 113–157 . Архивировано из оригинала 10 мая 2017 года . Проверено 6 мая 2016 г.
- Перепечатано в Субейране, Эжен (1831 г.). «Исследования некоторых соединений хлора». Journal de Pharmacie et des Sciences Accessoires . 17 : 657–672 . Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- Перепечатано в Субейране, Эжен (1832 г.). «Продолжение исследований некоторых соединений хлора». Journal de Pharmacie et des Sciences Accessoires . 18 : 1–24 . Архивировано из оригинала 29 июля 2020 года . Проверено 6 мая 2016 г.
- ^ Дюма, Ж.-Б. (1834 г.). «Récherches rélative à l'action du chrome sur l'alcool» [Опыты по действию хлора на спирт]. L'Institut, Journal Général des Sociétés et Travaux Scientifiques de la France et de l'Étranger . 2 : 106–108 и 112–115.
- Перепечатано в Дюма, Ж.-Б. (1834 г.). «Untersuruchung über die Wirkung des Chlors auf den Alkohol» [Исследование действия хлора на алкоголь]. Аннален дер Физик и Химия . 107 (42): 657–673 . Бибкод : 1834АнП...107..657Д. дои : 10.1002/andp.18341074202. Архивировано из оригинала 10 мая 2017 года . Проверено 12 мая 2016 г.
На стр. 653 Дюма приводит эмпирическую формулу хлороформа:
- "Es scheint mir also erweisen, dass die von mir analysirte Substance, … zur Formel hat: C 2 H 2 Cl 6 ." (Таким образом, мне кажется, что это показывает, что вещество, [которое] было проанализировано мной … имеет [свою эмпирическую] формулу: C 2 H 2 Cl 6 .) [Примечание: коэффициенты его эмпирической формулы должны быть разделены пополам.]
- Затем Дюма отмечает, что простая эмпирическая формула хлороформа напоминает формулу муравьиной кислоты . Более того, если хлороформ кипятить с гидроксидом калия , одним из продуктов является формиат калия . На стр. 654 Дюма называет хлороформ:
- «Diess Hat mich veranlasst diese Substanz mit dem Namen 'Chloroform' zu belegen». (Это побудило меня дать этому веществу название «хлороформ» [т.е. формилхлорид или хлорид муравьиной кислоты].)
- Перепечатано в Дюма, Ж.-Б. (1835). «Ueber die Wirkung des Chlors auf den Alkohol» [О действии хлора на алкоголь]. Аннален дер Аптека . 16 (2): 164–171 . doi :10.1002/jlac.18350160213. Архивировано из оригинала 10 мая 2017 года . Проверено 12 мая 2016 г.
- Перепечатано в Дюма, Ж.-Б. (1834 г.). «Untersuruchung über die Wirkung des Chlors auf den Alkohol» [Исследование действия хлора на алкоголь]. Аннален дер Физик и Химия . 107 (42): 657–673 . Бибкод : 1834АнП...107..657Д. дои : 10.1002/andp.18341074202. Архивировано из оригинала 10 мая 2017 года . Проверено 12 мая 2016 г.
- ^ ab Defalque, RJ; Wright, AJ (2004). «Короткая, трагическая жизнь Роберта М. Гловера» (PDF) . Anaesthesia . 59 (4): 394– 400. doi : 10.1111/j.1365-2044.2004.03671.x . PMID 15023112. S2CID 46428403. Архивировано (PDF) из оригинала 9 марта 2016 г.
- ^ ab Gordon, H. Laing (ноябрь 2002 г.). Сэр Джеймс Янг Симпсон и хлороформ (1811–1870). Minerva Group. стр. 106–109 . ISBN 978-1-4102-0291-8. Архивировано из оригинала 6 мая 2016 . Получено 5 января 2016 .
- ^ "Сэр Джеймс Янг Симпсон". Encyclopaedia Britannica . Архивировано из оригинала 27 июля 2013 года . Получено 23 августа 2013 года .
- ^ Worling, PM (1998). «Дункан и Флокхарт: история двух мужчин и аптеки». Pharmaceutical Historian . 28 (2): 28–33 . PMID 11620310.
- ^ Paulsen, PJ; Cooke, WD (1 сентября 1963 г.). «Подготовка дейтерированных растворителей для спектрометрии ядерного магнитного резонанса». Аналитическая химия . 35 (10): 1560. doi :10.1021/ac60203a072.
- ^ Брейер, Ф. В. (1935). «Хлороформ-d (Дейтериохлороформ)1». Журнал Американского химического общества . 57 (11): 2236– 2237. doi :10.1021/ja01314a058.
- ^ Клугер, Рональд (1964). «Удобное приготовление хлороформа-d1». Журнал органической химии . 29 (7): 2045–2046 . doi :10.1021/jo01030a526.
- ^ "Хлордифторметан | химическое соединение". Encyclopedia Britannica . Архивировано из оригинала 17 июля 2021 г. Получено 8 сентября 2021 г.
- ^ Wiley, GR; Miller, SI (1972). «Термодинамические параметры водородной связи хлороформа с основаниями Льюиса в циклогексане. Исследование протонного магнитного резонанса». Журнал Американского химического общества . 94 (10): 3287– 3293. doi :10.1021/ja00765a001.
- ^ Kwak, K.; Rosenfeld, DE; Chung, JK; Fayer, MD (2008). "Динамика переключения комплекса растворитель-растворитель хлороформа между ацетоном и диметилсульфоксидом - двумерная ИК-спектроскопия химического обмена". The Journal of Physical Chemistry B . 112 (44): 13906– 13915. doi :10.1021/jp806035w. PMC 2646412 . PMID 18855462.
- ^ abcd Хлороформ (PDF) , CICAD , т. 58, Всемирная организация здравоохранения , 2004, архивировано (PDF) из оригинала 31 июля 2020 г.
- ^ ab Leikin, Jerrold B.; Paloucek, Frank P., ред. (2008). "Хлороформ". Справочник по отравлениям и токсикологии (4-е изд.). Informa. стр. 774.
- ^ Фулмер, Грегори Р.; Миллер, Александр Дж. М.; Шерден, Натаниэль Х.; Готтлиб, Хьюго Э.; Нудельман, Абрахам; Штольц, Брайан М.; Берко, Джон Э.; Голдберг, Карен И. (2010). «ЯМР-химические сдвиги следовых примесей: обычные лабораторные растворители, органика и газы в дейтерированных растворителях, имеющие значение для химика-органометалла» (PDF) . Металлоорганические соединения . 29 (9): 2176– 2179. doi :10.1021/om100106e. S2CID 2755004.
- ^ «Хлороформ (CHEBI:35255)».
- ^ «Производство, импорт/экспорт, использование и утилизация» (PDF) . atsdr.cdc.gov . Получено 5 апреля 2023 г. .
- ^ «Хлороформ как загрязняющее вещество». Энциклопедия мировых проблем .
- ^ Сребник, М.; Лалоэ, Э. (2001). "Хлороформ". Энциклопедия реагентов для органического синтеза . Wiley. doi :10.1002/047084289X.rc105. ISBN 978-0-471-93623-7.
- ^ Фогель, Э.; Клюг, В.; Брейер, А. (1988). «1,6-Метано[10]аннулен». Органические синтезы; Собрание томов , т. 6, стр. 731.
- ^ Gokel, GW; Widera, RP; Weber, WP (1988). «Реакция фазового переноса Хофмана с карбиламинами: трет-бутилизоцианид». Органические синтезы; Собрание томов , т. 6, стр. 232.
- ^ Перкинс-Маквей, Мэтью (10 ноября 2023 г.). ««Новый порядок ядовитых веществ»: пересмотр диссертации Роберта М. Гловера о физиологических эффектах соединений брома, хлора и йода». Архивы фармакологии Наунин-Шмидеберга . 397 (5): 3343– 3350. doi : 10.1007/s00210-023-02820-y . PMID 37947840. Получено 27 января 2024 г.
- ↑ Гловер, Роберт М. (1 октября 1842 г.). «О физиологических и медицинских свойствах брома и его соединений; также об аналогиях между физиологическими и медицинскими свойствами этих тел и свойствами хлора и йода с их соответствующими соединениями; эссе на премию Гарвея за 1842 г.». Edinburgh Medical and Surgical Journal . 58 (153): 335–364 . PMC 5789197. PMID 30330609 .
- ^ Перкинс-Маквей, Мэтью (10 ноября 2023 г.). ««Новый порядок ядовитых веществ»: пересмотр диссертации Роберта М. Гловера о физиологических эффектах соединений брома, хлора и йода». Архивы фармакологии Наунин-Шмидеберга . 397 (5): 3343– 3350. doi : 10.1007/s00210-023-02820-y . PMID 37947840. Получено 27 января 2024 г.
- ^ Перкинс-Маквей, Мэтью (10 ноября 2023 г.). ««Новый порядок ядовитых веществ»: пересмотр диссертации Роберта М. Гловера о физиологических эффектах соединений брома, хлора и йода». Архивы фармакологии Наунин-Шмидеберга . 397 (5): 3343– 3350. doi : 10.1007/s00210-023-02820-y . PMID 37947840. Получено 27 января 2024 г.
- ^ Перкинс-Маквей, Мэтью (10 ноября 2023 г.). ««Новый порядок ядовитых веществ»: пересмотр диссертации Роберта М. Гловера о физиологических эффектах соединений брома, хлора и йода». Архивы фармакологии Наунин-Шмидеберга . 397 (5): 3343– 3350. doi : 10.1007/s00210-023-02820-y . PMID 37947840. Получено 27 января 2024 г.
- ^ Перкинс-Маквей, Мэтью (10 ноября 2023 г.). ««Новый порядок ядовитых веществ»: пересмотр диссертации Роберта М. Гловера о физиологических эффектах соединений брома, хлора и йода». Архивы фармакологии Наунин-Шмидеберга . 397 (5): 3343– 3350. doi : 10.1007/s00210-023-02820-y . PMID 37947840. Получено 27 января 2024 г.
- ^ Dingwall (апрель 2004 г.). "Пионерская история: стоматология и Королевский колледж хирургов Эдинбурга" (PDF) . historyofdentistry.co.uk . Архивировано из оригинала (PDF) 1 февраля 2013 г.
- ^ Baillie, TW (2003). «Robert Halliday Gunning and the Victoria Jubilee Prizes» (PDF) . Scottish Medical Journal . 48 (2): 54– 57. doi :10.1177/003693300304800209. PMID 12774598. S2CID 10998512. Архивировано из оригинала (PDF) 22 августа 2016 г. . Получено 18 августа 2016 г. .
- ^ "Анестезия и королева Виктория". ph.ucla.edu . Архивировано из оригинала 16 июля 2012 . Получено 13 августа 2012 .
- ↑ Мартин, Уильям (3 июля 1886 г.). «Случай отравления хлороформом; выздоровление». British Medical Journal . 2 (1331): 16– 17. doi :10.1136/bmj.2.1331.16-a. PMC 2257365. PMID 20751619 .
- ^ Patel, Amanda J.; Honoré, Eric; Lesage, Florian; Fink, Michel; Romey, Georges; Lazdunski, Michel (май 1999). «Ингаляционные анестетики активируют двухпоровые фоновые K + каналы». Nature Neuroscience . 2 (5): 422– 426. doi :10.1038/8084. PMID 10321245. S2CID 23092576.
- ^ Найт, Пол Р. III; Бэкон, Дуглас Р. (2002). «Необъяснимая смерть: Ханна Гринер и хлороформ». Анестезиология . 96 (5): 1250– 1253. doi : 10.1097/00000542-200205000-00030 . PMID 11981167. S2CID 12865865.
- ↑ Сноу, Джон (1858). О хлороформе и других анестетиках, их действии и применении. Лондон: Джон Черчилль. С. 82–85 . Архивировано из оригинала 23 ноября 2015 г.
- ↑ Аноним. (1890). «Исследование смертности под наркозом в журнале Lancet». Lancet . 145 (3472): 612–13 .
- ↑ Аноним. (1893). «Отчет комиссии журнала «Ланцет», назначенной для исследования вопроса применения хлороформа и других анестетиков с клинической точки зрения». Ланцет . 141 (3629): 629–38 .
- ^ Wawersik, J. (1997). «История анестезии хлороформом». Анестезиология и реанимация . 22 (6): 144–152 . PMID 9487785.
- ^ Stratmann, Linda (2003). Хлороформ: Поиски забвения . Stroud: Sutton Publishing. ISBN 978-0-7524-9931-4.
- ^ "Knock-out and Chloroform". The Philadelphia Record . 9 февраля 1894 г. Архивировано из оригинала 20 января 2022 г. Получено 31 марта 2011 г.
- ^ "Пересмотр дела о хлороформе продолжается". Record-Journal . 7 июля 1993 г. Архивировано из оригинала 6 ноября 2021 г. Получено 31 марта 2011 г.
- ^ Кэти Фрай - Arkansas Democrat-Gazette (17 декабря 2003 г.). "Но не забыто". www.arkansasonline.com . Архивировано из оригинала 7 декабря 2021 г. . Получено 7 декабря 2021 г. .
- ^ "Мужчина признался в изнасиловании дочерей друзей". USA Today . 6 ноября 2007 г. Архивировано из оригинала 29 апреля 2011 г. Получено 31 марта 2011 г.
- ^ Payne, JP (июль 1998 г.). «Преступное использование хлороформа». Anaesthesia . 53 (7): 685– 690. doi : 10.1046/j.1365-2044.1998.528-az0572.x . PMID 9771177. S2CID 1718276.
- ^ «Медицинская аннотация: Хлороформ среди воров». The Lancet . 2 (2200): 490– 491. 1865. doi :10.1016/s0140-6736(02)58434-8.
- ^ Nieuwenhuijsen, MJ; Toledano, MB; Elliott, P (8 августа 2000 г.). «Поглощение побочных продуктов дезинфекции хлорированием; обзор и обсуждение его последствий для оценки воздействия в эпидемиологических исследованиях». Журнал анализа воздействия и экологической эпидемиологии . 10 (6 Pt 1): 586–99 . doi : 10.1038/sj.jea.7500139 . PMID 11140442.
- ^ "База данных водопроводной воды EWG: загрязняющие вещества в вашей воде". www.ewg.org . Получено 8 августа 2023 г. .
- ^ «Цели общественного здравоохранения по тригалометанам в питьевой воде» (PDF) . oehha.ca.gov . стр. 93 . Получено 8 августа 2023 г. .
- ^ Yin-Tak Woo, David Y. Lai, Joseph C. Arcos Алифатические и полигалогенированные канцерогены: структурные основы и биология Архивировано 5 июня 2018 г. на Wayback Machine
- ^ abc Fan, Anna M. (2005). «Хлороформ». Энциклопедия токсикологии . Т. 1 (2-е изд.). Elsevier. С. 561–565 .
- ^ Дженкинс, Эндрю; Гринблатт, Эрик П.; Фолкнер, Говард Дж.; Бертаччини, Эдвард; Лайт, Адам; Лин, Одри; Андреасен, Элисон; Винер, Анна; Труделл, Джеймс Р.; Харрисон, Нил Л. (15 марта 2001 г.). «Доказательства общей связывающей полости для трех общих анестетиков в рецепторе ГАМК». Журнал нейронауки . 21 (6): RC136. doi : 10.1523/JNEUROSCI.21-06-j0002.2001 . ISSN 0270-6474. PMC 6762625. PMID 11245705 .
- ^ "Хлороформ и фосген, химическая гигиена и безопасность". Earlham College . Архивировано из оригинала 19 августа 2017 года . Получено 17 августа 2017 года .
- ^ Турк, Эрик (2 марта 1998 г.). "Фосген из хлороформа". Chemical & Engineering News . 76 (9): 6. doi : 10.1021/cen-v076n009.p006 . Архивировано из оригинала 24 июля 2008 г. Получено 13 августа 2012 г.
- ^ "фосген (химическое соединение)". Encyclopaedia Britannica . Архивировано из оригинала 5 июня 2013 . Получено 16 августа 2013 .
- ^ Manogue, WH; Pigford, RL (сентябрь 1960 г.). «Кинетика абсорбции фосгена в воде и водных растворах». Журнал AIChE . 6 (3): 494– 500. Bibcode : 1960AIChE...6..494M. doi : 10.1002/aic.690060329. ISSN 0001-1541.
- ^ "Американское химическое общество: Письма по химической и инженерной безопасности". pubsapp.acs.org . Получено 18 марта 2024 г. .
- ^ Cheng, Xueheng; Gao, Quanyin; Smith, Richard D.; Simanek, Eric E.; Mammen, Mathai; Whitesides, George M. (1996). «Характеристика водородно-связанных агрегатов в хлороформе с помощью масс-спектрометрии с ионизацией электрораспылением». Журнал органической химии . 61 (6): 2204– 2206. doi :10.1021/jo951345g. ISSN 0022-3263. Архивировано из оригинала 31 июля 2022 г.
- ^ "Хлороформ" (PDF) . Получено 5 декабря 2023 г.
- ^ "40 CFR: Приложение A к Части 355 — Список чрезвычайно опасных веществ и их пороговые плановые количества" (PDF) . Свод федеральных правил (ред. от 1 июля 2008 г.). Правительственная типография . Архивировано из оригинала (PDF) 25 февраля 2012 г. . Получено 29 октября 2011 г. .
- ^ Шуйцюань Тан; Элизабет А. Эдвардс (2013). «Идентификация восстановительных дегалогеназ Dehalobacter, катализирующих дехлорирование хлороформа, 1,1,1-трихлорэтана и 1,1-дихлорэтана». Philos Trans R Soc Lond B Biol Sci . 368 (1616): 20120318. doi :10.1098/rstb.2012.0318. PMC 3638459. PMID 23479748 .
- ^ Jugder, Bat-Erdene; Ertan, Haluk; Wong, Yie Kuan; Braidy, Nady; Manefield, Michael; Marquis, Christopher P.; Lee, Matthew (10 августа 2016 г.). «Геномный, транскриптомный и протеомный анализ Dehalobacter UNSWDHB в ответ на хлороформ». Environmental Microbiology Reports . 8 (5): 814– 824. Bibcode : 2016EnvMR...8..814J. doi : 10.1111/1758-2229.12444. ISSN 1758-2229. PMID 27452500.
Внешние ссылки
- Хлороформ «Молекулярный спасатель» – статья в Оксфордском университете, содержащая факты о хлороформе.
- «Применение хлороформа» — короткометражный фильм о применении анестезирующего хлороформа, снятый в 1930-х годах.
- Краткий международный документ по оценке химических веществ 58
- Резюме и оценки МАИР: Том 1 (1972), Том 20 (1979), Дополнение 7 (1987), Том 73 (1999)
- Международная карта химической безопасности 0027
- Карманный справочник NIOSH по химическим опасностям. "#0127". Национальный институт охраны труда и техники безопасности (NIOSH).
- База данных справочных стандартов NIST