Биосинтез
This article has multiple issues. Please help improve it or discuss these issues on the talk page. (Learn how and when to remove these messages)
|
Биосинтез , т. е. химический синтез , происходящий в биологических контекстах, является термином, чаще всего относящимся к многоступенчатым, катализируемым ферментами процессам, где химические вещества, поглощенные как питательные вещества (или ранее преобразованные посредством биосинтеза), служат субстратами ферментов , с преобразованием живым организмом либо в более простые, либо в более сложные продукты . Примерами биосинтетических путей являются пути для производства аминокислот , липидных компонентов мембран и нуклеотидов , а также для производства всех классов биологических макромолекул , а также ацетил-кофермента А , аденозинтрифосфата , никотинамидадениндинуклеотида и других ключевых промежуточных и транзакционных молекул, необходимых для метаболизма . Таким образом, в биосинтезе любой из массива соединений , от простых до сложных, преобразуется в другие соединения, и поэтому он включает как катаболизм , так и анаболизм (создание и разрушение) сложных молекул (включая макромолекулы ). Биосинтетические процессы часто представляются с помощью схем метаболических путей . Конкретный биосинтетический путь может быть расположен в пределах одной клеточной органеллы (например, митохондриальные пути синтеза жирных кислот), в то время как другие включают ферменты, которые расположены в массиве клеточных органелл и структур (например, биосинтез гликозилированных белков клеточной поверхности).
Элементы биосинтеза
Элементы биосинтеза включают: соединения- предшественники , химическую энергию (например, АТФ ) и каталитические ферменты, которым могут потребоваться коферменты (например, НАДН , НАДФН ). Эти элементы создают мономеры , строительные блоки для макромолекул. Некоторые важные биологические макромолекулы включают: белки , которые состоят из мономеров аминокислот , соединенных пептидными связями , и молекулы ДНК , которые состоят из нуклеотидов, соединенных фосфодиэфирными связями .
Свойства химических реакций
Биосинтез происходит в результате ряда химических реакций. Для осуществления этих реакций необходимы следующие элементы: [1]
- Соединения-предшественники : эти соединения являются исходными молекулами или субстратами в реакции. Их также можно рассматривать как реагенты в данном химическом процессе.
- Химическая энергия : химическая энергия может быть найдена в форме молекул с высокой энергией. Эти молекулы необходимы для энергетически невыгодных реакций. Кроме того, гидролиз этих соединений продвигает реакцию вперед. Молекулы с высокой энергией, такие как АТФ , имеют три фосфата . Часто терминальный фосфат отщепляется во время гидролиза и передается другой молекуле.
- Катализаторы : это могут быть, например, ионы металлов или коферменты , они катализируют реакцию, увеличивая ее скорость и снижая энергию активации .
В простейшем смысле реакции, происходящие в биосинтезе, имеют следующий формат: [2]
Вот некоторые вариации этого основного уравнения, которые будут рассмотрены далее более подробно: [3]
- Простые соединения, которые преобразуются в другие соединения, как правило , как часть многошагового пути реакции. Два примера этого типа реакции происходят во время образования нуклеиновых кислот и зарядки тРНК перед трансляцией . Для некоторых из этих шагов требуется химическая энергия:
- Простые соединения, которые преобразуются в другие соединения с помощью кофакторов. Например, синтез фосфолипидов требует ацетил-КоА, в то время как синтез другого мембранного компонента, сфинголипидов , требует НАДН и ФАДН для формирования сфингозинового остова. Общее уравнение для этих примеров:
- Простые соединения, которые объединяются для создания макромолекулы. Например, жирные кислоты объединяются для образования фосфолипидов. В свою очередь, фосфолипиды и холестерин взаимодействуют нековалентно для формирования липидного бислоя . Эту реакцию можно изобразить следующим образом:
Липид

Многие сложные макромолекулы синтезируются по образцу простых, повторяющихся структур. [4] Например, простейшие структуры липидов — это жирные кислоты . Жирные кислоты — это производные углеводородов ; они содержат карбоксильную группу «голова» и углеводородную цепь «хвост». [4] Эти жирные кислоты создают более крупные компоненты, которые, в свою очередь, включают нековалентные взаимодействия для формирования липидного бислоя. [4] Цепи жирных кислот обнаружены в двух основных компонентах мембранных липидов: фосфолипидах и сфинголипидах . Третий основной компонент мембраны, холестерин , не содержит этих жирнокислотных единиц. [5]
Эукариотические фосфолипиды
Основу всех биомембран составляет двухслойная структура фосфолипидов. [6] Молекула фосфолипида является амфипатической ; она содержит гидрофильную полярную головку и гидрофобный неполярный хвост. [4] Фосфолипидные головки взаимодействуют друг с другом и водной средой, в то время как углеводородные хвосты ориентируются в центре, вдали от воды. [7] Эти последние взаимодействия управляют двухслойной структурой, которая действует как барьер для ионов и молекул. [8]
Существуют различные типы фосфолипидов; следовательно, пути их синтеза различаются. Однако первый шаг в синтезе фосфолипидов включает образование фосфатидата или диацилглицерол-3-фосфата в эндоплазматическом ретикулуме и внешней митохондриальной мембране . [7] Путь синтеза приведен ниже:

Путь начинается с глицерол-3-фосфата, который преобразуется в лизофосфатидат посредством добавления цепи жирной кислоты, предоставленной ацил-коферментом А. [ 9] Затем лизофосфатидат преобразуется в фосфатидат посредством добавления другой цепи жирной кислоты, предоставленной вторым ацил-КоА; все эти этапы катализируются ферментом глицерол- фосфатацилтрансферазой . [9] Синтез фосфолипидов продолжается в эндоплазматическом ретикулуме, и путь биосинтеза расходится в зависимости от компонентов конкретного фосфолипида. [9]
Сфинголипиды
Подобно фосфолипидам, эти производные жирных кислот имеют полярную головку и неполярные хвосты. [5] В отличие от фосфолипидов, сфинголипиды имеют сфингозиновый остов. [10] Сфинголипиды существуют в эукариотических клетках и особенно распространены в центральной нервной системе . [7] Например, сфингомиелин является частью миелиновой оболочки нервных волокон. [11]
Сфинголипиды образуются из церамидов , которые состоят из жирнокислотной цепи, присоединенной к аминогруппе остова сфингозина. Эти церамиды синтезируются путем ацилирования сфингозина. [11] Биосинтетический путь сфингозина представлен ниже:

Как показано на рисунке, во время синтеза сфингозина пальмитоил-КоА и серин подвергаются реакции конденсации , которая приводит к образованию 3-дегидросфинганина. [7] Затем этот продукт восстанавливается до дигидросфингозина, который превращается в сфингозин посредством реакции окисления с помощью FAD . [7]
Холестерин
Этот липид принадлежит к классу молекул, называемых стеролами . [5] Стеролы имеют четыре конденсированных кольца и гидроксильную группу . [5] Холестерин является особенно важной молекулой. Он не только служит компонентом липидных мембран, но и является предшественником нескольких стероидных гормонов, включая кортизол , тестостерон и эстроген . [12]
Холестерин синтезируется из ацетил-КоА . [12] Путь показан ниже:

В более общем смысле этот синтез происходит в три этапа, первый из которых происходит в цитоплазме , а второй и третий этапы — в эндоплазматическом ретикулуме. [9] Эти этапы следующие: [12]
- 1. Синтез изопентенилпирофосфата , «строительного блока» холестерина.
- 2. Образование сквалена путем конденсации шести молекул изопентенилфосфата
- 3. Превращение сквалена в холестерин посредством нескольких ферментативных реакций
Нуклеотиды
Биосинтез нуклеотидов включает в себя ферментативно- катализируемые реакции, которые преобразуют субстраты в более сложные продукты. [1] Нуклеотиды являются строительными блоками ДНК и РНК . Нуклеотиды состоят из пятичленного кольца, образованного из сахара рибозы в РНК и сахара дезоксирибозы в ДНК; эти сахара связаны с пуриновым или пиримидиновым основанием с гликозидной связью и фосфатной группой в 5'-положении сахара. [13]
Пуриновые нуклеотиды

Нуклеотиды ДНК аденозин и гуанозин состоят из пуринового основания, присоединенного к рибозному сахару гликозидной связью. В случае нуклеотидов РНК дезоксиаденозина и дезоксигуанозина пуриновые основания присоединены к дезоксирибозному сахару гликозидной связью. Пуриновые основания на нуклеотидах ДНК и РНК синтезируются в двенадцатиступенчатом механизме реакции, присутствующем в большинстве одноклеточных организмов. Высшие эукариоты используют аналогичный механизм реакции в десять стадий реакции. Пуриновые основания синтезируются путем преобразования фосфорибозилпирофосфата (PRPP) в инозинмонофосфат (IMP), который является первым ключевым промежуточным продуктом в биосинтезе пуриновых оснований. [14] Дальнейшая ферментативная модификация IMP производит аденозиновые и гуанозиновые основания нуклеотидов.
- Первым шагом в биосинтезе пурина является реакция конденсации , выполняемая глутамин-PRPP амидотрансферазой . Этот фермент переносит аминогруппу с глутамина на PRPP, образуя 5-фосфорибозиламин . Следующий шаг требует активации глицина путем присоединения фосфатной группы из АТФ .
- GAR-синтетаза [15] осуществляет конденсацию активированного глицина на PRPP, образуя глицинамидрибонуклеотид (GAR).
- GAR-трансформилаза добавляет формильную группу к аминогруппе GAR, образуя формилглицинамидрибонуклеотид (FGAR).
- Амидотрансфераза FGAR [16] катализирует присоединение азотистой группы к FGAR, образуя формилглицинамидинрибонуклеотид (FGAM).
- Циклаза FGAM катализирует замыкание кольца, которое включает удаление молекулы воды, образуя 5-членное имидазольное кольцо 5-аминоимидазолрибонуклеотида (AIR).
- Синтетаза N5-CAIR переносит карбоксильную группу, образуя промежуточный рибонуклеотид N5-карбоксиаминоимидазол (N5-CAIR). [17]
- Мутаза N5-CAIR перестраивает карбоксильную функциональную группу и переносит ее на имидазольное кольцо, образуя карбоксиамино-имидазолрибонуклеотид (CAIR). Двухступенчатый механизм образования CAIR из AIR в основном встречается в одноклеточных организмах. Высшие эукариоты содержат фермент AIR-карбоксилазу [18] , которая переносит карбоксильную группу непосредственно на имидазольное кольцо AIR, образуя CAIR.
- Синтетаза SAICAR образует пептидную связь между аспартатом и добавленной карбоксильной группой имидазольного кольца, образуя рибонуклеотид N-сукцинил-5-аминоимидазол-4-карбоксамида (SAICAR).
- Лиаза SAICAR удаляет углеродный скелет добавленного аспартата, оставляя аминогруппу и образуя 5-аминоимидазол-4-карбоксамид рибонуклеотид (AICAR).
- Трансформилаза AICAR переносит карбонильную группу в AICAR, образуя N-формиламиноимидазол-4-карбоксамид рибонуклеотид (FAICAR).
- На последнем этапе задействован фермент ИМФ-синтаза , который осуществляет замыкание пуринового кольца и образует промежуточное соединение инозинмонофосфат. [5]
Пиримидиновые нуклеотиды

Другие нуклеотидные основания ДНК и РНК, которые связаны с рибозным сахаром через гликозидную связь, это тимин , цитозин и урацил (который встречается только в РНК). Биосинтез уридинмонофосфата включает фермент, который находится во внутренней мембране митохондрий , и многофункциональные ферменты, которые находятся в цитозоле . [19]
- На первом этапе фермент карбамоилфосфатсинтаза соединяет глутамин с CO2 в АТФ-зависимой реакции с образованием карбамоилфосфата .
- Аспартаткарбамоилтрансфераза конденсирует карбамоилфосфат с аспартатом, образуя уридосукцинат.
- Дигидрооротаза осуществляет замыкание кольца — реакцию, в ходе которой теряется вода, образуя дигидрооротат .
- Дигидрооротатдегидрогеназа , расположенная во внутренней мембране митохондрий, [19] окисляет дигидрооротат до оротата .
- Оротатфосфорибозилгидролаза (пирофосфорилаза OMP) конденсирует оротат с PRPP с образованием оротидин-5'-фосфата .
- Декарбоксилаза OMP катализирует превращение оротидин-5'-фосфата в UMP . [20]
После синтеза нуклеотидного основания уридина синтезируются другие основания, цитозин и тимин. Биосинтез цитозина представляет собой двухэтапную реакцию, которая включает преобразование UMP в UTP . Добавление фосфата к UMP катализируется ферментом киназой . Фермент CTP-синтаза катализирует следующий этап реакции: преобразование UTP в CTP путем переноса аминогруппы с глутамина на уридин; это образует цитозиновое основание CTP. [21] Механизм, который изображает реакцию UTP + ATP + глутамин ⇔ CTP + ADP + глутамат, приведен ниже:


Цитозин — это нуклеотид, который присутствует как в ДНК, так и в РНК. Однако урацил содержится только в РНК. Поэтому после синтеза УТФ он должен быть преобразован в дезоксиформу, чтобы быть включенным в ДНК. Это преобразование включает фермент рибонуклеозидтрифосфатредуктазу . Эта реакция, которая удаляет 2'-ОН сахара рибозы для получения дезоксирибозы, не зависит от оснований, присоединенных к сахару. Эта неспецифичность позволяет рибонуклеозидтрифосфатредуктазе преобразовывать все нуклеотидтрифосфаты в дезоксирибонуклеотид по схожему механизму. [21]
В отличие от урацила, основания тимина в основном находятся в ДНК, а не в РНК. Клетки обычно не содержат оснований тимина, которые связаны с рибозными сахарами в РНК, что указывает на то, что клетки синтезируют только тимин, связанный с дезоксирибозой. Фермент тимидилатсинтетаза отвечает за синтез остатков тимина из dUMP в dTMP . Эта реакция переносит метильную группу на основание урацила dUMP, образуя dTMP. [21] Реакция тимидилатсинтетазы, dUMP + 5,10-метилентетрагидрофолат ⇔ dTMP + дигидрофолат, показана справа.
ДНК

Хотя существуют различия между синтезом ДНК у эукариот и прокариот , в следующем разделе обозначены ключевые характеристики репликации ДНК, общие для обоих организмов.
ДНК состоит из нуклеотидов , соединенных фосфодиэфирными связями . [4] Синтез ДНК , происходящий в ядре , является полуконсервативным процессом, что означает, что полученная молекула ДНК содержит исходную цепь из родительской структуры и новую цепь. [22] Синтез ДНК катализируется семейством ДНК-полимераз , которым требуются четыре дезоксинуклеозидтрифосфата, матричная цепь и праймер со свободным 3'OH, в который включаются нуклеотиды. [23]
Для того чтобы произошла репликация ДНК, вилка репликации создается ферментами, называемыми геликазами , которые раскручивают спираль ДНК. [23] Топоизомеразы в вилке репликации удаляют супервитки , вызванные раскручиванием ДНК, а белки, связывающие одноцепочечную ДНК, поддерживают две одноцепочечные матрицы ДНК стабилизированными перед репликацией. [13]
Синтез ДНК инициируется РНК-полимеразой праймазой , которая создает РНК-праймер со свободным 3'OH. [23] Этот праймер прикрепляется к одноцепочечной матрице ДНК, и ДНК-полимераза удлиняет цепь, включая нуклеотиды; ДНК-полимераза также корректирует вновь синтезированную цепь ДНК. [23]
В ходе реакции полимеризации, катализируемой ДНК-полимеразой, происходит нуклеофильная атака 3'ОН растущей цепи на самый внутренний атом фосфора дезоксинуклеозидтрифосфата; это приводит к образованию фосфодиэфирного мостика , который присоединяет новый нуклеотид и высвобождает пирофосфат . [9]
В процессе репликации одновременно создаются два типа нитей: ведущая нить , которая синтезируется непрерывно и растет по направлению к репликационной вилке, и отстающая нить , которая создается прерывисто во фрагментах Оказаки и растет вдали от репликационной вилки. [22] Фрагменты Оказаки ковалентно соединяются ДНК-лигазой , образуя непрерывную нить. [22] Затем, для завершения репликации ДНК, праймеры РНК удаляются, а образовавшиеся пробелы заменяются ДНК и соединяются с помощью ДНК-лигазы. [22]
Аминокислоты
Белок — это полимер, состоящий из аминокислот , соединенных пептидными связями . В природе встречается более 300 аминокислот , из которых только двадцать две, известные как протеиногенные аминокислоты , являются строительными блоками для белка. [24] Только зеленые растения и большинство микробов способны синтезировать все 20 стандартных аминокислот, которые необходимы всем живым видам. Млекопитающие могут синтезировать только десять из двадцати стандартных аминокислот. Другие аминокислоты, валин , метионин , лейцин , изолейцин , фенилаланин , лизин , треонин и триптофан для взрослых и гистидин и аргинин для младенцев, получаются с пищей. [25]
Основная структура аминокислоты

Общая структура стандартных аминокислот включает первичную аминогруппу , карбоксильную группу и функциональную группу, присоединенную к α-углероду . Различные аминокислоты идентифицируются по функциональной группе. В результате трех различных групп, присоединенных к α-углероду, аминокислоты являются асимметричными молекулами . Для всех стандартных аминокислот, за исключением глицина , α-углерод является хиральным центром . В случае глицина α-углерод имеет два атома водорода, таким образом добавляя симметрию этой молекуле. За исключением пролина , все аминокислоты, встречающиеся в жизни, имеют конформацию L-изоформы . Пролин имеет функциональную группу на α-углероде, которая образует кольцо с аминогруппой. [24]

Источник азота
Один из основных шагов в биосинтезе аминокислот включает включение азотной группы в α-углерод. В клетках существует два основных пути включения азотных групп. Один путь включает фермент глутаминоксоглутаратаминотрансферазу (GOGAT), которая удаляет амидную аминогруппу глутамина и переносит ее на 2-оксоглутарат , образуя две молекулы глутамата . В этой реакции катализа глутамин служит источником азота. Изображение, иллюстрирующее эту реакцию, находится справа.
Другой путь включения азота в α-углерод аминокислот включает фермент глутаматдегидрогеназу (GDH). GDH способен переносить аммиак на 2-оксоглутарат и образовывать глутамат. Кроме того, фермент глутаминсинтетаза (GS) способен переносить аммиак на глутамат и синтезировать глутамин, пополняя запасы глутамина. [26]
Семейство аминокислот глутамата
Семейство аминокислот глутамата включает аминокислоты, которые происходят от аминокислоты глутамата. Это семейство включает: глутамат, глутамин , пролин и аргинин . Это семейство также включает аминокислоту лизин , которая происходит от α-кетоглутарата . [27]
Биосинтез глутамата и глутамина является ключевым этапом в ассимиляции азота, обсуждаемой выше. Ферменты GOGAT и GDH катализируют реакции ассимиляции азота .
У бактерий фермент глутамат 5-киназа инициирует биосинтез пролина путем переноса фосфатной группы с АТФ на глутамат. Следующая реакция катализируется ферментом пирролин-5-карбоксилатсинтазой (P5CS), которая катализирует восстановление ϒ-карбоксильной группы L-глутамат 5-фосфата. Это приводит к образованию полуальдегида глутамата, который спонтанно циклизуется в пирролин-5-карбоксилат. Пирролин-5-карбоксилат далее восстанавливается ферментом пирролин-5-карбоксилатредуктазой (P5CR) с образованием аминокислоты пролин. [28]
На первом этапе биосинтеза аргинина в бактериях глутамат ацетилируется путем переноса ацетильной группы из ацетил-КоА в положение N-α; это предотвращает спонтанную циклизацию. Фермент N-ацетилглутаматсинтаза (глутамат N-ацетилтрансфераза) отвечает за катализ этапа ацетилирования. Последующие этапы катализируются ферментами N-ацетилглутаматкиназой , N-ацетил-гамма-глутамилфосфатредуктазой и ацетилорнитин/сукцинилдиаминопимелатаминотрансферазой и дают N-ацетил-L-орнитин. Ацетильная группа ацетилорнитина удаляется ферментом ацетилорнитиназой (AO) или орнитинацетилтрансферазой (OAT), и это дает орнитин . Затем ферменты цитруллин и аргининосукцинат превращают орнитин в аргинин. [29]

Существует два различных пути биосинтеза лизина: путь диаминопимелиновой кислоты и путь α-аминоадипата . Наиболее распространенным из двух синтетических путей является путь диаминопимелиновой кислоты; он состоит из нескольких ферментативных реакций, которые добавляют углеродные группы к аспартату для получения лизина: [30]
- Аспартаткиназа инициирует путь диаминопимелиновой кислоты путем фосфорилирования аспартата и образования аспартилфосфата.
- Аспартатполуальдегиддегидрогеназа катализирует НАДФН -зависимое восстановление аспартилфосфата с образованием аспартатполуальдегида.
- 4-гидрокси-тетрагидродипиколинатсинтаза добавляет пируватную группу к β-аспартил-4-полуальдегиду, а молекула воды удаляется. Это вызывает циклизацию и приводит к образованию (2S,4S)-4-гидрокси-2,3,4,5-тетрагидродипиколината.
- 4-гидрокситетрагидродипиколинатредуктаза катализирует восстановление (2S,4S)-4-гидрокси-2,3,4,5-тетрагидродипиколината с помощью НАДФН с образованием Δ'-пиперидеин-2,6-дикарбоксилата (2,3,4,5-тетрагидродипиколината) и H 2 O.
- Тетрагидродипиколинатацилтрансфераза катализирует реакцию ацетилирования, которая приводит к раскрытию кольца и образованию N-ацетил α-амино-ε-кетопимелата.
- N-сукцинил-α-амино-ε-кетопимелат-глутамат аминотрансаминаза катализирует реакцию трансаминирования, которая удаляет кетогруппу N-ацетил α-амино-ε-кетопимелата и заменяет ее аминогруппой, образуя N-сукцинил-L-диаминопимелат. [31]
- N-ацилдиаминопимелатдеацилаза катализирует деацилирование N-сукцинил-L-диаминопимелата с образованием L,L-диаминопимелата. [32]
- DAP-эпимераза катализирует превращение L,L-диаминопимелата в мезо- форму L,L-диаминопимелата. [33]
- Декарбоксилаза DAP катализирует удаление карбоксильной группы, образуя L-лизин.
Семейство аминокислот серина
Семейство аминокислот серина включает: серин, цистеин и глицин . Большинство микроорганизмов и растений получают серу для синтеза метионина из аминокислоты цистеина. Кроме того, превращение серина в глицин обеспечивает углерод, необходимый для биосинтеза метионина и гистидина . [27]
Во время биосинтеза серина [34] фермент фосфоглицератдегидрогеназа катализирует начальную реакцию, которая окисляет 3-фосфо-D-глицерат с образованием 3-фосфонооксипирувата . [35] Следующая реакция катализируется ферментом фосфосеринаминотрансферазой , которая переносит аминогруппу с глутамата на 3-фосфонооксипируват с образованием L-фосфосерина . [36] Заключительный этап катализируется ферментом фосфосеринфосфатазой , которая дефосфорилирует L-фосфосерин с образованием L-серина . [37]
Существует два известных пути биосинтеза глицина. Организмы, которые используют этанол и ацетат в качестве основного источника углерода, используют гликонеогенный путь для синтеза глицина . Другой путь биосинтеза глицина известен как гликолитический путь. Этот путь преобразует серин, синтезированный из промежуточных продуктов гликолиза , в глицин. В гликолитическом пути фермент серингидроксиметилтрансфераза катализирует расщепление серина с образованием глицина и переносит расщепленную углеродную группу серина на тетрагидрофолат , образуя 5,10-метилентетрагидрофолат . [38]
Биосинтез цистеина представляет собой двухэтапную реакцию, которая включает включение неорганической серы . В микроорганизмах и растениях фермент серинацетилтрансфераза катализирует перенос ацетильной группы с ацетил-КоА на L-серин с образованием O-ацетил-L-серина . [39] Следующий этап реакции, катализируемый ферментом O-ацетилсерин (тиол)лиазой , заменяет ацетильную группу O-ацетил-L-серина на сульфид с образованием цистеина. [40]
Семейство аминокислот аспартата
Семейство аминокислот аспартата включает: треонин , лизин , метионин , изолейцин и аспартат. Лизин и изолейцин считаются частью семейства аспартата, хотя часть их углеродного скелета получена из пирувата . В случае метионина углерод метила получен из серина и группы серы, но в большинстве организмов он получен из цистеина. [27]
Биосинтез аспартата — это одношаговая реакция, катализируемая одним ферментом. Фермент аспартатаминотрансфераза катализирует перенос аминогруппы с аспартата на α-кетоглутарат с образованием глутамата и оксалоацетата . [41] Аспарагин синтезируется путем АТФ-зависимого присоединения аминогруппы к аспартату; аспарагинсинтетаза катализирует присоединение азота из глутамина или растворимого аммиака к аспартату с образованием аспарагина. [42]

Биосинтетический путь диаминопимелиновой кислоты лизина принадлежит к семейству аминокислот аспартата. Этот путь включает девять ферментативно-катализируемых реакций, которые превращают аспартат в лизин. [43]
- Аспартаткиназа катализирует начальный этап пути диаминопимелиновой кислоты, перенося фосфорил из АТФ на карбоксилатную группу аспартата, что приводит к образованию аспартил-β-фосфата. [44]
- Аспартат-полуальдегиддегидрогеназа катализирует реакцию восстановления путем дефосфорилирования аспартил-β-фосфата с образованием аспартат-β-полуальдегида. [45]
- Дигидродипиколинатсинтаза катализирует реакцию конденсации аспартат-β-полуальдегида с пируватом с образованием дигидродипиколиновой кислоты. [46]
- 4-гидрокситетрагидродипиколинатредуктаза катализирует восстановление дигидродипиколиновой кислоты с образованием тетрагидродипиколиновой кислоты. [47]
- Тетрагидродипиколинат N-сукцинилтрансфераза катализирует перенос сукцинильной группы от сукцинил-КоА к тетрагидродипиколиновой кислоте с образованием N-сукцинил-L-2,6-диаминогептандиоата. [48]
- N-сукцинилдиаминопимелатаминотрансфераза катализирует перенос аминогруппы с глутамата на N-сукцинил-L-2,6-диаминогептандиоат с образованием N-сукцинил-L,L-диаминопимелиновой кислоты. [49]
- Сукцинил-диаминопимелатдесукцинилаза катализирует удаление ацильной группы из N-сукцинил-L,L-диаминопимелиновой кислоты с образованием L,L-диаминопимелиновой кислоты. [50]
- Диаминопимелатэпимераза катализирует инверсию α-углерода L,L-диаминопимелиновой кислоты с образованием мезо-диаминопимелиновой кислоты . [51]
- Сиаминопимелатдекарбоксилаза катализирует конечный этап биосинтеза лизина, который удаляет группу диоксида углерода из мезо-диаминопимелиновой кислоты, в результате чего образуется L-лизин. [52]
Белки
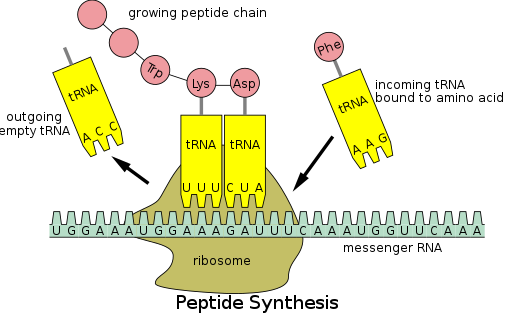

Синтез белка происходит посредством процесса, называемого трансляцией . [53] Во время трансляции генетический материал, называемый мРНК , считывается рибосомами для создания полипептидной цепи белка . [53] Для этого процесса требуется транспортная РНК (тРНК), которая служит адаптером, связывая аминокислоты на одном конце и взаимодействуя с мРНК на другом конце; последнее спаривание между тРНК и мРНК гарантирует, что правильная аминокислота добавляется в цепь. [53] Синтез белка происходит в три фазы: инициация, удлинение и терминация. [13] Прокариотическая ( архейная и бактериальная ) трансляция отличается от эукариотической трансляции ; однако в этом разделе основное внимание будет уделено общим чертам между двумя организмами.
Дополнительный фон
Прежде чем трансляция может начаться, должен произойти процесс связывания определенной аминокислоты с соответствующей ей тРНК. Эта реакция, называемая зарядкой тРНК, катализируется аминоацил-тРНК-синтетазой . [54] Специфическая тРНК-синтетаза отвечает за распознавание и зарядку определенной аминокислоты. [54] Кроме того, этот фермент имеет специальные дискриминаторные области для обеспечения правильного связывания между тРНК и ее родственной аминокислотой. [54] Первым шагом для присоединения аминокислоты к соответствующей ей тРНК является образование аминоацил-АМФ: [54]
Затем следует перенос аминоацильной группы из аминоацил-АМФ в молекулу тРНК. Полученная молекула — аминоацил-тРНК : [54]
Сочетание этих двух этапов, оба из которых катализируются аминоацил-тРНК-синтетазой, приводит к образованию заряженной тРНК, готовой добавлять аминокислоты к растущей полипептидной цепи.
В дополнение к связыванию аминокислоты, тРНК имеет трехнуклеотидную единицу, называемую антикодоном , которая образует пары оснований с определенными триплетами нуклеотидов на мРНК, называемыми кодонами ; кодоны кодируют определенную аминокислоту. [55] Это взаимодействие возможно благодаря рибосоме, которая служит местом синтеза белка. Рибосома имеет три сайта связывания тРНК: аминоацильный сайт (сайт A), пептидильный сайт (сайт P) и сайт выхода (сайт E). [56]
В транскрипте мРНК имеется множество кодонов, и очень часто аминокислота определяется более чем одним кодоном; это явление называется вырожденностью . [57] Всего имеется 64 кодона, 61 из которых кодируют одну из 20 аминокислот, в то время как остальные кодоны определяют обрыв цепи. [57]
Перевод по шагам
Как упоминалось ранее, трансляция происходит в три фазы: инициация, удлинение и терминация.

Шаг 1: Инициация
Завершение фазы инициации зависит от следующих трех событий: [13]
1. Присоединение рибосомы к мРНК
2. Связывание заряженной инициирующей тРНК с P-сайтом рибосомы
3. Правильное выравнивание рибосомы со стартовым кодоном мРНК
Шаг 2: Удлинение
После инициации полипептидная цепь удлиняется посредством взаимодействий антикодон:кодон, при этом рибосома добавляет аминокислоты к полипептидной цепи по одной за раз. Для обеспечения правильного добавления аминокислот необходимо выполнить следующие шаги: [58]
1. Связывание правильной тРНК с сайтом А рибосомы
2. Образование пептидной связи между тРНК в сайте А и полипептидной цепью, присоединенной к тРНК в сайте Р.
3. Транслокация или продвижение комплекса тРНК-мРНК на три нуклеотида
Транслокация «запускает» тРНК на участке E и перемещает тРНК из участка A в участок P, оставляя участок A свободным для входящей тРНК, которая может добавить еще одну аминокислоту.
Шаг 3: Расторжение
Последняя стадия трансляции происходит, когда стоп-кодон попадает на сайт А. [1] Затем происходят следующие шаги:
1. Распознавание кодонов факторами высвобождения , что вызывает гидролиз полипептидной цепи тРНК, расположенной в сайте P [1]
2. Высвобождение полипептидной цепи [57]
3. Диссоциация и «переработка» рибосомы для будущих процессов трансляции [57]
Ниже приведена сводная таблица ключевых игроков в сфере перевода:
| Ключевые игроки в сфере перевода | Стадия перевода | Цель |
|---|---|---|
| тРНК-синтетаза | перед посвящением | Отвечает за зарядку тРНК |
| мРНК | инициация, удлинение, терминация | Шаблон для синтеза белка; содержит области, называемые кодонами, которые кодируют аминокислоты |
| тРНК | инициация, удлинение, терминация | Связывает рибосомы с участками A, P, E; пары оснований антикодона с кодоном мРНК, чтобы гарантировать включение правильной аминокислоты в растущую полипептидную цепь |
| рибосома | инициация, удлинение, терминация | Направляет синтез белка и катализирует образование пептидной связи |
Заболевания, связанные с дефицитом макромолекул

Ошибки в биосинтетических путях могут иметь пагубные последствия, включая неправильное формирование макромолекул или недопроизводство функциональных молекул. Ниже приведены примеры, иллюстрирующие нарушения, возникающие из-за этой неэффективности.
- Семейная гиперхолестеринемия : это расстройство характеризуется отсутствием функциональных рецепторов для ЛПНП . [59] Дефицит в образовании рецепторов ЛПНП может привести к появлению дефектных рецепторов, которые нарушают эндоцитарный путь, препятствуя проникновению ЛПНП в печень и другие клетки. [59] Это вызывает накопление ЛПНП в плазме крови, что приводит к образованию атеросклеротических бляшек , которые сужают артерии и увеличивают риск сердечных приступов. [59]
- Синдром Леша-Нихана : это генетическое заболевание характеризуется членовредительством , умственной отсталостью и подагрой . [60] Оно вызвано отсутствием гипоксантин-гуанин фосфорибозилтрансферазы , которая является необходимым ферментом для образования пуриновых нуклеотидов. [60] Отсутствие фермента снижает уровень необходимых нуклеотидов и вызывает накопление промежуточных продуктов биосинтеза , что приводит к вышеупомянутому необычному поведению. [60]
- Тяжелый комбинированный иммунодефицит (ТКИД) : ТКИД характеризуется потерей Т-клеток . [61] Нехватка этих компонентов иммунной системы увеличивает восприимчивость к инфекционным агентам, поскольку пораженные люди не могут развивать иммунологическую память . [61] Это иммунологическое расстройство возникает из-за дефицита активности аденозиндезаминазы , что вызывает накопление dATP . Эти молекулы dATP затем ингибируют рибонуклеотидредуктазу, что предотвращает синтез ДНК. [61]
- Болезнь Хантингтона : это неврологическое заболевание вызвано ошибками, которые происходят во время синтеза ДНК. [62] Эти ошибки или мутации приводят к экспрессии мутантного белка хантингтина , который содержит повторяющиеся остатки глутамина , которые кодируются расширением тринуклеотидных повторов CAG в гене. [62] Болезнь Хантингтона характеризуется потерей нейронов и глиозом . Симптомы заболевания включают: двигательные расстройства, снижение когнитивных способностей и поведенческие расстройства. [63]
Смотрите также
- Липиды
- Фосфолипидный бислой
- Нуклеотиды
- ДНК
- репликация ДНК
- Протеиногенная аминокислота
- Таблица кодонов
- Простагландин
- Порфирины
- Хлорофиллы и бактериохлорофиллы
- Витамин В12
Ссылки
- ^ abcd Альбертс, Брюс (2008). Молекулярная биология клетки (5-е изд.). Нью-Йорк: Garland Science. ISBN 978-0815341055.
- ^ Zumdahl, Steven S. Zumdahl, Susan A. (2008). Химия (8-е изд.). CA: Cengage Learning. ISBN 978-0547125329.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Воэт, Дональд; Воэт, Джудит Г.; Пратт, Шарлотта В. (2013). Основы биохимии: жизнь на молекулярном уровне (4-е изд.). Хобокен, Нью-Джерси: Уайли. ISBN 978-0470547847.
- ^ abcde Lodish, Harvey; et al. (2007). Молекулярная клеточная биология (6-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0716743668.
- ^ abcde Cox, David L. Nelson, Michael M. (2008). Принципы биохимии Ленингера (5-е изд.). Нью-Йорк: WH Freeman. ISBN 9780716771081.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Ханин, Израиль (2013). Фосфолипиды: биохимические, фармацевтические и аналитические соображения . Springer. ISBN 978-1475713664.
- ^ abcde Вэнс, Деннис Э.; Вэнс, Джин Э. (2008). Биохимия липидов, липопротеинов и мембран (5-е изд.). Амстердам: Elsevier. ISBN 978-0444532190.
- ^ Katsaras, J.; et al. (2001). Липидные бислои: структура и взаимодействия; с 6 таблицами . Berlin [ua]: Springer. ISBN 978-3540675556.
- ^ abcde Страйер, Джереми М. Берг; Джон Л. Тимочко; Луберт (2007). Биохимия (6-е изд., 3-е изд.). Нью-Йорк: Freeman. ISBN 978-0716787242.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Gault, CR; LM Obeid; YA Hannun (2010). «Обзор метаболизма сфинголипидов: от синтеза до распада». Сфинголипиды как сигнальные и регуляторные молекулы . Достижения в экспериментальной медицине и биологии. Том 688. С. 1– 23. doi :10.1007/978-1-4419-6741-1_1. ISBN 978-1-4419-6740-4. PMC 3069696 . PMID 20919643.
- ^ ab Siegel, George J. (1999). Основы нейрохимии: молекулярные, клеточные и медицинские аспекты (6-е изд.). Филадельфия, Пенсильвания. [ua]: Lippincott Williams & Wilkins. ISBN 978-0397518203.
- ^ abc Harris, J. Robin (2010). Связывающие холестерин и транспортные белки холестерина: структура и функция в норме и патологии . Дордрехт: Springer. ISBN 978-9048186211.
- ^ abcd Уотсон, Джеймс Д.; и др. (2007). Молекулярная биология гена (6-е изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс. ISBN 978-0805395921.
- ^ Kappock, TJ; Ealick, SE; Stubbe, J (октябрь 2000 г.). «Модулярная эволюция пути биосинтеза пуринов». Current Opinion in Chemical Biology . 4 (5): 567–72 . doi :10.1016/s1367-5931(00)00133-2. PMID 11006546.
- ^ Sampei, G; Baba, S; Kanagawa, M; Yanai, H; Ishii, T; Kawai, H; Fukai, Y; Ebihara, A; Nakagawa, N; Kawai, G (октябрь 2010 г.). «Кристаллические структуры глицинамидрибонуклеотидсинтетазы, PurD, из термофильных эубактерий». Журнал биохимии . 148 (4): 429–38 . doi :10.1093/jb/mvq088. PMID 20716513.
- ^ Хоскинс, AA; Ананд, R; Иллик, SE; Стаббе, J (17 августа 2004 г.). «Комплекс формилглицинамид рибонуклеотид амидотрансферазы из Bacillus subtilis: образование комплекса, опосредованное метаболитами». Биохимия . 43 (32): 10314–27 . doi :10.1021/bi049127h. PMID 15301530.
- ^ Mueller, EJ; Meyer, E; Rudolph, J; Davisson, VJ; Stubbe, J (1 марта 1994 г.). "N5-карбоксиаминоимидазол рибонуклеотид: доказательства нового промежуточного соединения и двух новых ферментативных активностей в de novo пути биосинтеза пурина Escherichia coli". Biochemistry . 33 (8): 2269– 78. doi :10.1021/bi00174a038. PMID 8117684.
- ^ Firestine, SM; Poon, SW; Mueller, EJ; Stubbe, J; Davisson, VJ (4 октября 1994 г.). «Реакции, катализируемые 5-аминоимидазолрибонуклеотидкарбоксилазами из Escherichia coli и Gallus gallus: случай расходящихся каталитических механизмов». Biochemistry . 33 (39): 11927– 34. doi :10.1021/bi00205a031. PMID 7918411.
- ^ ab Srere, PA (1987). «Комплексы последовательных метаболических ферментов». Annual Review of Biochemistry . 56 (1): 89– 124. doi :10.1146/annurev.bi.56.070187.000513. PMID 2441660.
- ^ Броач, под редакцией Джеффри Н. Стратерна, Элизабет В. Джонс, Джеймс Р. (1981). Молекулярная биология дрожжей Saccharomyces . Колд Спринг Харбор, Нью-Йорк: Лаборатория Колд Спринг Харбор. ISBN 978-0879691394.
{{cite book}}:|first=имеет общее название ( помощь )CS1 maint: multiple names: authors list (link) - ^ abc O'Donovan, GA; Neuhard, J (сентябрь 1970). "Пиримидиновый метаболизм у микроорганизмов". Bacteriological Reviews . 34 (3): 278– 343. doi :10.1128/MMBR.34.3.278-343.1970. PMC 378357 . PMID 4919542.
- ^ abcd Geer, Gerald Karp; ответственный за пересмотр главы 15 Peter van der (2004). Cell and molecular biology : concepts and experimentals (4th ed., Wiley International ed.). Нью-Йорк: J. Wiley & Sons. ISBN 978-0471656654.
{{cite book}}: CS1 maint: multiple names: authors list (link) CS1 maint: numeric names: authors list (link) - ^ abcd Гриффитс, Энтони Дж. Ф. (1999). Современный генетический анализ (2-е печатное издание). Нью-Йорк: Freeman. ISBN 978-0716731184.
- ^ ab Wu, G (май 2009). «Аминокислоты: метаболизм, функции и питание». Аминокислоты . 37 (1): 1– 17. doi :10.1007/s00726-009-0269-0. PMID 19301095. S2CID 1870305.
- ^ Mousdale, DM; Coggins, JR (1991). "Синтез аминокислот". Целевые сайты для действия гербицидов . стр. 29–56 . doi :10.1007/978-1-4899-2433-9_2. ISBN 978-1-4899-2435-3.
- ^ Мифлин, Б. Дж.; Ли, П. Дж. (1977). «Метаболизм аминокислот». Annual Review of Plant Physiology . 28 : 299–329 . doi :10.1146/annurev.pp.28.060177.001503.
- ^ abc Umbarger, HE (1978). «Биосинтез аминокислот и его регуляция». Annual Review of Biochemistry . 47 (1): 532– 606. doi :10.1146/annurev.bi.47.070178.002533. PMID 354503.
- ^ Перес-Ареллано, И; Кармона-Альварес, Ф; Мартинес, АИ; Родригес-Диас, Дж; Сервера, Дж (март 2010 г.). «Пирролин-5-карбоксилатсинтаза и биосинтез пролина: от осмотолерантности до редкого метаболического заболевания». Protein Science . 19 (3): 372– 82. doi :10.1002/pro.340. PMC 2866264 . PMID 20091669.
- ^ Xu, Y; Labedan, B; Glansdorff, N (март 2007). «Удивительный биосинтез аргинина: переоценка энзимологии и эволюции пути у микроорганизмов». Microbiology and Molecular Biology Reviews . 71 (1): 36– 47. doi :10.1128/MMBR.00032-06. PMC 1847373. PMID 17347518 .
- ^ "MetaCyc: Биосинтез L-лизина I".
- ^ PETERKOFSKY, B; GILVARG, C (май 1961). "N-сукцинил-L-диаминопимелин-глутаминовая трансаминаза". Журнал биологической химии . 236 (5): 1432– 8. doi : 10.1016/S0021-9258(18)64192-4 . PMID 13734750.
- ^ KINDLER, SH; GILVARG, C (декабрь 1960 г.). "N-сукцинил-L-2,6-диаминопимелиновая кислота деацилаза". Журнал биологической химии . 235 : 3532– 5. doi : 10.1016/S0021-9258(18)64502-8 . PMID 13756049.
- ^ Борн, TL; Бланшар, JS (октябрь 1999 г.). «Исследования структуры/функции ферментов в диаминопимелатном пути биосинтеза бактериальной клеточной стенки». Current Opinion in Chemical Biology . 3 (5): 607– 13. doi :10.1016/s1367-5931(99)00016-2. PMID 10508663.
- ^ "Escherichia coli K-12 substr. MG1655". биосинтез серина . SRI International . Получено 12 декабря 2013 г.
- ^ Белл, Дж. К.; Грант, Дж. А.; Банашак, Л. Дж. (30 марта 2004 г.). «Мультиконформационные состояния в фосфоглицератдегидрогеназе». Биохимия . 43 (12): 3450– 8. doi :10.1021/bi035462e. PMID 15035616.
- ^ Дубновицкий, AP; Капетаниу, EG; Папагеоргиу, AC (январь 2005 г.). «Адаптация фермента к щелочному pH: атомное разрешение (1,08 A) структуры фосфосеринаминотрансферазы из Bacillus alcalophilus». Protein Science . 14 (1): 97– 110. doi :10.1110/ps.041029805. PMC 2253317 . PMID 15608117.
- ^ Wang, W; Kim, R; Jancarik, J; Yokota, H; Kim, SH (10 января 2001 г.). «Кристаллическая структура фосфосеринфосфатазы из Methanococcus jannaschii, гипертермофила, при разрешении 1,8 А». Structure . 9 (1): 65–71 . doi : 10.1016/s0969-2126(00)00558-x . PMID 11342136.
- ^ Monschau, N; Stahmann, KP; Sahm, H; McNeil, JB; Bognar, AL (1 мая 1997 г.). «Идентификация Saccharomyces cerevisiae GLY1 как треониновой альдолазы: ключевого фермента в биосинтезе глицина». FEMS Microbiology Letters . 150 (1): 55– 60. doi : 10.1111/j.1574-6968.1997.tb10349.x . PMID 9163906.
- ^ Pye, VE; Tingey, AP; Robson, RL; Moody, PC (24 сентября 2004 г.). «Структура и механизм действия серинацетилтрансферазы из Escherichia coli». Журнал биологической химии . 279 (39): 40729–36 . doi : 10.1074/jbc.M403751200 . PMID 15231846.
- ^ Хуан, Б.; Веттинг, М.В.; Родерик, С.Л. (май 2005 г.). «Активный сайт О-ацетилсеринсульфгидрилазы является точкой привязки для образования биферментного комплекса с серинацетилтрансферазой». Журнал бактериологии . 187 (9): 3201– 5. doi :10.1128/JB.187.9.3201-3205.2005. PMC 1082839. PMID 15838047 .
- ^ McPhalen, CA; Vincent, MG; Picot, D; Jansonius, JN ; Lesk, AM; Chothia, C (5 сентября 1992 г.). «Закрытие домена в митохондриальной аспартатаминотрансферазе». Журнал молекулярной биологии . 227 (1): 197– 213. doi :10.1016/0022-2836(92)90691-C. PMID 1522585.
- ^ Larsen, TM; Boehlein, SK; Schuster, SM; Richards, NG; Thoden, JB; Holden, HM; Rayment, I (7 декабря 1999 г.). «Трехмерная структура аспарагинсинтетазы B Escherichia coli: короткий путь от субстрата к продукту». Biochemistry . 38 (49): 16146– 57. CiteSeerX 10.1.1.453.5998 . doi :10.1021/bi9915768. PMID 10587437.
- ^ Velasco, AM; Leguina, JI; Lazcano, A (октябрь 2002 г.). «Молекулярная эволюция путей биосинтеза лизина». Journal of Molecular Evolution . 55 (4): 445–59 . Bibcode : 2002JMolE..55..445V. doi : 10.1007/s00239-002-2340-2. PMID 12355264. S2CID 19460256.
- ^ Котака, М.; Рен, Дж.; Локьер, М.; Хокинс, А. Р.; Стаммерс, Д. К. (20 октября 2006 г.). «Структуры R- и T-состояний аспартокиназы III Escherichia coli. Механизмы аллостерического перехода и ингибирования лизином». Журнал биологической химии . 281 (42): 31544– 52. doi : 10.1074/jbc.M605886200 . PMID 16905770.
- ^ Hadfield, A; Kryger, G; Ouyang, J; Petsko, GA; Ringe, D; Viola, R (18 июня 1999 г.). «Структура аспартат-бета-полуальдегиддегидрогеназы из Escherichia coli, ключевого фермента в семействе аспартата биосинтеза аминокислот». Журнал молекулярной биологии . 289 (4): 991– 1002. doi :10.1006/jmbi.1999.2828. PMID 10369777.
- ^ Mirwaldt, C; Korndörfer, I; Huber, R (10 февраля 1995 г.). «Кристаллическая структура дигидродипиколинатсинтазы из Escherichia coli при разрешении 2,5 А». Журнал молекулярной биологии . 246 (1): 227–39 . doi :10.1006/jmbi.1994.0078. PMID 7853400.
- ^ Cirilli, M; Zheng, R; Scapin, G; Blanchard, JS (16 сентября 2003 г.). «Трехмерные структуры комплексов дигидродипиколинатредуктазы Mycobacterium tuberculosis-NADH-2,6-PDC и -NADPH-2,6-PDC. Структурный и мутагенный анализ ослабленной нуклеотидной специфичности». Биохимия . 42 (36): 10644– 50. doi :10.1021/bi030044v. PMID 12962488.
- ^ Beaman, TW; Binder, DA; Blanchard, JS; Roderick, SL (21 января 1997 г.). "Трехмерная структура тетрагидродипиколината N-сукцинилтрансферазы". Биохимия . 36 (3): 489–94 . doi :10.1021/bi962522q. PMID 9012664.
- ^ Weyand, S; Kefala, G; Weiss, MS (30 марта 2007 г.). «Трехмерная структура N-сукцинилдиаминопимелатаминотрансферазы из Mycobacterium tuberculosis». Журнал молекулярной биологии . 367 (3): 825–38 . doi :10.1016/j.jmb.2007.01.023. PMID 17292400.
- ^ Nocek, BP; Gillner, DM; Fan, Y; Holz, RC; Joachimiak, A (2 апреля 2010 г.). "Структурная основа катализа моно- и диметаллированными формами dapE-кодируемой N-сукцинил-L,L-диаминопимелиновой кислоты десукцинилазы". Журнал молекулярной биологии . 397 (3): 617–26 . doi :10.1016/j.jmb.2010.01.062. PMC 2885003. PMID 20138056 .
- ^ Pillai, B; Cherney, M; Diaper, CM; Sutherland, A; Blanchard, JS; Vederas, JC; James, MN (23 ноября 2007 г.). «Динамика катализа, выявленная из кристаллических структур мутантов диаминопимелатэпимеразы». Biochemical and Biophysical Research Communications . 363 (3): 547–53 . doi :10.1016/j.bbrc.2007.09.012. PMID 17889830.
- ^ Gokulan, K; Rupp, B; Pavelka MS, Jr; Jacobs WR, Jr; Sacchettini, JC (16 мая 2003 г.). «Кристаллическая структура диаминопимелатдекарбоксилазы Mycobacterium tuberculosis, важного фермента в биосинтезе бактериального лизина». Журнал биологической химии . 278 (20): 18588– 96. doi : 10.1074/jbc.M301549200 . PMID 12637582.
- ^ abc Weaver, Robert F. (2005). Молекулярная биология (3-е изд.). Бостон: McGraw-Hill Higher Education. ISBN 978-0-07-284611-9.
- ^ abcde Купер, Джеффри М. (2000). Клетка: молекулярный подход (2-е изд.). Вашингтон (округ Колумбия): ASM Press. ISBN 978-0878931064.
- ^ Джексон, Р. Дж. и др. (февраль 2010 г.). «Механизм инициации эукариотической трансляции и принципы ее регуляции». Молекулярная клеточная биология . 10 (2): 113– 127. doi :10.1038/nrm2838. PMC 4461372. PMID 20094052 .
- ^ Грин, Рэйчел; Гарри Ф. Ноллер; и др. (1997). «Рибосомы и трансляция». Annu. Rev. Biochem . 66 : 679– 716. doi :10.1146/annurev.biochem.66.1.679. PMID 9242921.
- ^ abcd Вайсбах, Герберт; Пестка, Сидней (1977). Молекулярные механизмы биосинтеза белка . Нью-Йорк: Academic Press. ISBN 978-0127442501.
- ^ Frank, J; Haixiao Gao; et al. (сентябрь 2007 г.). «Процесс транслокации мРНК–тРНК». PNAS . 104 (50): 19671– 19678. doi : 10.1073/pnas.0708517104 . PMC 2148355. PMID 18003906 .
- ^ abc Bandeali, Salman J.; Daye, Jad; Virani, Salim S. (30 ноября 2013 г.). «Новые методы лечения семейной гиперхолестеринемии». Current Atherosclerosis Reports . 16 (1): 382. doi :10.1007/s11883-013-0382-0. PMID 24293346. S2CID 8903481.
- ^ abc Kang, Tae Hyuk; Park, Yongjin; Bader, Joel S.; Friedmann, Theodore; Cooney, Austin John (9 октября 2013 г.). «Ген домашнего хозяйства гипоксантин-гуанин-фосфорибозилтрансфераза (HPRT) регулирует множественные пути развития и метаболизма нейронной дифференциации эмбриональных стволовых клеток мышей». PLOS ONE . 8 (10): e74967. Bibcode :2013PLoSO...874967K. doi : 10.1371/journal.pone.0074967 . PMC 3794013 . PMID 24130677.
- ^ abc Уолпорт, Кен Мерфи, Пол Трэверс, Марк (2011). Иммунобиология Джейнвея (8-е изд.). Оксфорд: Тейлор и Фрэнсис. ISBN 978-0815342434.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ ab Hughes, под редакцией Дональда К. Ло, Роберта Э. (2010). Нейробиология болезни Хантингтона: применение в разработке лекарств (2-е изд.). Бока-Ратон: CRC Press/Taylor & Francis Group. ISBN 978-0849390005.
{{cite book}}:|first=имеет общее название ( помощь )CS1 maint: multiple names: authors list (link) - ^ Biglan, Kevin M.; Ross, Christopher A.; Langbehn, Douglas R.; Aylward, Elizabeth H.; Stout, Julie C.; Queller, Sarah; Carlozzi, Noelle E.; Duff, Kevin; Beglinger, Leigh J.; Paulsen, Jane S. (26 июня 2009 г.). «Моторные аномалии у лиц с преманифестной болезнью Хантингтона: исследование PREDICT-HD». Movement Disorders . 24 (12): 1763– 1772. doi :10.1002/mds.22601. PMC 3048804. PMID 19562761 .




![{\displaystyle {\ce {Реагент ->[][фермент] Продукт}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d97fbef58f64fb0b7d05d90fa0a73b05f5919fc8)

![{\displaystyle {\ce {{Предшествующая~молекула}+Кофактор->[][фермент]макромолекула}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b192f25eec9ceebed179bfeb43ae27795f3a91be)




