Валентность (химия)
В химии валентность (написание в США) или валентность (написание в Великобритании) атома является мерой его способности объединяться с другими атомами при образовании химических соединений или молекул . Под валентностью обычно понимают число химических связей , которые обычно образует каждый атом данного химического элемента . Двойные связи считаются двумя связями, тройные — тремя, четверные — четырьмя, пятерные — пятью и шестерные — шестью. В большинстве соединений валентность водорода равна 1, кислорода — 2, азота — 3, а углерода — 4. Валентность не следует путать с родственными понятиями координационного числа , степени окисления или числа валентных электронов для данного атома.
Описание
Валентность — это объединяющая способность атома данного элемента, определяемая числом атомов водорода, с которыми он соединяется. В метане углерод имеет валентность 4; в аммиаке азот имеет валентность 3; в воде кислород имеет валентность 2; а в хлористом водороде хлор имеет валентность 1. Хлор, поскольку он имеет валентность 1, может заменять водород во многих соединениях. Фосфор имеет валентность 3 в фосфине ( PH 3 ) и валентность 5 в пентахлориде фосфора ( PCl 5 ), что показывает, что элемент может проявлять более одной валентности. Структурная формула соединения представляет собой связность атомов, при этом линии, проведенные между двумя атомами, представляют собой связи. [1] В двух таблицах ниже показаны примеры различных соединений, их структурные формулы и валентности для каждого элемента соединения.
| Сложный | H2 Водород | СН4Метан | С3Н8Пропан | C3H6 Пропилен | C2H2 Ацетилен |
|---|---|---|---|---|---|
| Диаграмма |  |  |  |  |  |
| Валентности |
|
|
|
|
|
| Сложный | NH3 Аммиак | NaCN Цианид натрия | PSCl 3 Тиофосфорилхлорид | H 2 S Сероводород | H2SO4 Серная кислота | H 2 S 2 O 6 Дитионовая кислота | Cl 2 O 7 Дихлоргептоксид | XeO 4 Тетроксид ксенона |
|---|---|---|---|---|---|---|---|---|
| Диаграмма |  | 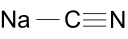 |  |  |  |  |  |  |
| Валентности |
|
|
|
|
|
|
|
|
Определение
Валентность определяется ИЮПАК как : [2]
- Максимальное число одновалентных атомов (первоначально атомов водорода или хлора), которые могут соединяться с атомом рассматриваемого элемента или с его фрагментом, или которые может заменить атом этого элемента.
Альтернативное современное описание: [3]
- Число атомов водорода, которые могут соединяться с элементом в бинарном гидриде, или удвоенное число атомов кислорода, соединяющихся с элементом в его оксиде или оксидах.
Это определение отличается от определения ИЮПАК, поскольку можно сказать, что элемент имеет более одной валентности.
Историческое развитие
Этимология слов valence (множественное число valences ) и valency (множественное число valencies ) восходит к 1425 году, означая «извлечение, приготовление», от латинского valentia «сила, способность», от более раннего valor «ценность, значение», а химическое значение , относящееся к «объединительной силе элемента», зафиксировано с 1884 года, от немецкого Valenz . [4]

Концепция валентности была разработана во второй половине XIX века и помогла успешно объяснить молекулярную структуру неорганических и органических соединений. [1] Поиск глубинных причин валентности привел к появлению современных теорий химической связи, включая теорию кубического атома (1902), структуры Льюиса (1916), теорию валентных связей (1927), молекулярные орбитали (1928), теорию отталкивания электронных пар валентной оболочки (1958) и все передовые методы квантовой химии .
В 1789 году Уильям Хиггинс опубликовал взгляды на то, что он назвал комбинациями «предельных» частиц, которые предвосхитили концепцию валентных связей . [5] Если, например, по Хиггинсу, сила между предельной частицей кислорода и предельной частицей азота была бы 6, то величина силы была бы разделена соответственно, и аналогично для других комбинаций предельных частиц (см. иллюстрацию).
Однако точное начало теории химических валентностей можно проследить до статьи Эдварда Франкленда 1852 года , в которой он объединил старую радикальную теорию с мыслями о химическом сродстве, чтобы показать, что некоторые элементы имеют тенденцию соединяться с другими элементами, образуя соединения, содержащие 3, т. е. в группах из 3 атомов (например, NO 3 , NH 3 , NI 3 и т. д.) или 5, т. е. в группах из 5 атомов (например, NO 5 , NH 4 O , PO 5 и т. д.), эквивалентов присоединенных элементов. По его словам, это тот способ, которым их сродство удовлетворяется наилучшим образом, и, следуя этим примерам и постулатам, он заявляет, насколько очевидно, что [6]
(Здесь) преобладает тенденция или закон, и независимо от характера объединяющихся атомов, объединяющая сила притягивающего элемента, если мне будет позволено так выразиться, всегда удовлетворяется одним и тем же числом этих атомов.
Эта «объединяющая сила» впоследствии была названа квантивалентностью или валентностью (и валентностью американскими химиками). [5] В 1857 году Август Кекуле предложил фиксированные валентности для многих элементов, например, 4 для углерода, и использовал их для предложения структурных формул для многих органических молекул, которые принимаются и сегодня.
Лотар Мейер в своей книге 1864 года « Die modernen Theorien der Chemie » содержал раннюю версию периодической таблицы, содержащей 28 элементов, впервые классифицировал элементы на шесть семейств по их валентности. Работы по организации элементов по атомному весу до тех пор были загнаны в угол из-за широкого использования эквивалентных весов для элементов, а не атомных весов. [7]
Большинство химиков 19 века определяли валентность элемента как число его связей, не различая различные типы валентности или связи. Однако в 1893 году Альфред Вернер описал координационные комплексы переходных металлов , такие как [Co(NH 3 ) 6 ]Cl 3 , в которых он различал главные и второстепенные валентности (нем. «Hauptvalenz» и «Nebenvalenz»), соответствующие современным концепциям степени окисления и координационного числа соответственно.
Для элементов главной группы Ричард Абегг в 1904 году рассмотрел положительные и отрицательные валентности (максимальные и минимальные степени окисления) и предложил правило Абегга, согласно которому их разность часто составляет 8.
Альтернативное определение валентности, разработанное в 1920-х годах и имеющее современных сторонников, отличается в случаях, когда формальный заряд атома не равен нулю. Оно определяет валентность данного атома в ковалентной молекуле как число электронов, которые атом использовал в связывании: [8] [9] [10] [11]
- валентность = число электронов в валентной оболочке свободного атома − число несвязывающих электронов на атоме в молекуле ,
или эквивалентно:
- валентность = число связей + формальный заряд .
В этом соглашении азот в ионе аммония [NH 4 ] + связывается с четырьмя атомами водорода, но он считается пятивалентным, поскольку в образовании связи участвуют все пять валентных электронов азота. [8]
Электроны и валентность
Модель ядерного атома Резерфорда (1911) показала, что внешняя часть атома занята электронами , что предполагает, что электроны ответственны за взаимодействие атомов и образование химических связей. В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов (главной группы) достигать стабильного октета из 8 валентных электронов. По мнению Льюиса, ковалентная связь приводит к октетам путем совместного использования электронов, а ионная связь приводит к октетам путем передачи электронов от одного атома к другому. Термин ковалентность приписывается Ирвингу Ленгмюру , который в 1919 году заявил, что «число пар электронов , которые любой данный атом делит с соседними атомами, называется ковалентностью этого атома». [12] Префикс со- означает «вместе», так что ковалентная связь означает, что атомы разделяют валентность. После этого теперь чаще говорят о ковалентных связях , а не о валентных , которые вышли из употребления в работах более высокого уровня из-за достижений в теории химических связей, но по-прежнему широко используются в элементарных исследованиях, где они обеспечивают эвристическое введение в предмет.
В 1930-х годах Лайнус Полинг предположил, что существуют также полярные ковалентные связи , которые являются промежуточными между ковалентными и ионными, и что степень ионности зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы , в которых элементы основной группы имеют кажущуюся валентность больше максимальной 4, разрешенной правилом октета. Например, в молекуле гексафторида серы ( SF 6 ) Полинг считал, что сера образует 6 истинных двухэлектронных связей с использованием гибридных атомных орбиталей sp 3 d 2 , которые объединяют одну s, три p и две d орбитали. Однако совсем недавно квантово-механические расчеты этой и подобных молекул показали, что роль d-орбиталей в связывании минимальна, и что молекулу SF 6 следует описывать как имеющую 6 полярных ковалентных (частично ионных) связей, образованных только четырьмя орбиталями серы (одной s и тремя p) в соответствии с правилом октета, вместе с шестью орбиталями фтора. [13] Аналогичные расчеты для молекул переходных металлов показывают, что роль p-орбиталей незначительна, так что одной s и пяти d-орбиталей металла достаточно для описания связи. [14]
Общие валентности
Для элементов основных групп периодической системы валентность может варьироваться от 1 до 8.
| Группа | Валентность 1 | Валентность 2 | Валентность 3 | Валентность 4 | Валентность 5 | Валентность 6 | Валентность 7 | Валентность 8 | Типичные валентности |
|---|---|---|---|---|---|---|---|---|---|
| 1 (Я) | NaCl KCl | 1 | |||||||
| 2 (II) | MgCl2CaCl2 | 2 | |||||||
| 13 (III) | InBr TlI | BCl3AlCl3Al2O3 | 3 | ||||||
| 14 (IV) | CO2PbCl2 | CO2CH4SiCl4 | 2 и 4 | ||||||
| 15 (В) | НЕТ | NH3PH3As2O3 | НЕТ 2 | N2O5PCl5 | 3 и 5 | ||||
| 16 (VI) | H2OH2SSCl2 | СО 2 СФ 4 | SO3SF6H2SO4 | 2, 4 и 6 | |||||
| 17 (VII) | HCl ICl | HClO2ClF3 | ClO2 | ЕСЛИ 5 HClO 3 | ЕСЛИ 7 Cl2O7HClO4 | 1, 3, 5 и 7 | |||
| 18 (VIII) | КрФ 2 | XeF 4 | XeO3 | XeO4 | 0, 2, 4, 6 и 8 |
Многие элементы имеют общую валентность, связанную с их положением в периодической таблице, и в настоящее время это рационализируется правилом октета . Греческие/латинские числовые префиксы (моно-/уни-, ди-/би-, три-/тер- и т. д.) используются для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. соответственно. Поливалентность или многовалентность относится к видам , которые не ограничены определенным числом валентных связей . Виды с одним зарядом являются одновалентными (моновалентными). Например, катион Cs + является одновалентным или одновалентным катионом, тогда как катион Ca2 + является двухвалентным катионом, а катион Fe3 + является трехвалентным катионом. В отличие от Cs и Ca, Fe может также существовать в других зарядовых состояниях, в частности 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион. [15] Переходные металлы и металлы справа обычно многовалентны, но не существует простой закономерности, предсказывающей их валентность. [16]
| Валентность | Более распространенное прилагательное‡ | Менее распространенное синонимичное прилагательно凧 |
|---|---|---|
| 0-валентный | нульвалентный | невалентный |
| 1-валентный | одновалентный | одновалентный |
| 2-валентный | двухвалентный | двухвалентный |
| 3-валентный | трехвалентный | трехвалентный |
| 4-валентный | четырехвалентный | четырехвалентный |
| 5-валентный | пятивалентный | пятивалентный, пятивалентный |
| 6-валентный | шестивалентный | сексивалентный |
| 7-валентный | семивалентный | семивалентный |
| 8-валентный | восьмивалентный | — |
| 9-валентный | девятивалентный | — |
| 10-валентный | декавалентный | — |
| 11-валентный | ундекавалентный | — |
| 12-валентный | додекавалентный | — |
| множественный / много / переменный | поливалентный | многовалентный |
| вместе | ковалентный | — |
| не вместе | нековалентный | — |
† Те же прилагательные используются в медицине для обозначения валентности вакцины, с той небольшой разницей, что в последнем смысле квадри- встречается чаще, чем тетра- .
‡ Согласно количеству результатов веб-поиска Google и поисковых корпусов Google Books (по состоянию на 2017 г.).
§ Несколько других форм можно найти в крупных англоязычных корпусах (например, *quintavalent, *quintivalent, *decivalent ), но они не являются общепринятыми формами в английском языке и поэтому не включены в основные словари.
Валентность против степени окисления
Из-за неоднозначности термина валентность [17] в настоящее время предпочтительны другие обозначения. Помимо обозначения лямбда, используемого в номенклатуре неорганической химии ИЮПАК , [18] степень окисления является более четким указанием электронного состояния атомов в молекуле.
Степень окисления атома в молекуле показывает число валентных электронов, которые он приобрел или потерял. [19] В отличие от числа валентности, степень окисления может быть положительной (для электроположительного атома) или отрицательной (для электроотрицательного атома).
Элементы в высокой степени окисления имеют степень окисления выше +4, а также элементы в высокой валентности ( гипервалентные элементы) имеют валентность выше 4. Например, в перхлоратах ClO−4В хлоре имеется 7 валентных связей (таким образом, он семивалентен, другими словами, его валентность равна 7), и он имеет степень окисления +7; в тетраоксиде рутения RuO 4 рутений имеет 8 валентных связей (таким образом, он восьмивалентен, другими словами, его валентность равна 8), и он имеет степень окисления +8.
В некоторых молекулах существует разница между валентностью и степенью окисления для данного атома. Например, в молекуле декафторида дисульфура S 2 F 10 каждый атом серы имеет 6 валентных связей (5 одинарных связей с атомами фтора и 1 одинарную связь с другим атомом серы). Таким образом, каждый атом серы является шестивалентным или имеет валентность 6, но имеет степень окисления +5. В молекуле дикислорода O 2 каждый атом кислорода имеет 2 валентные связи и поэтому является двухвалентным (валентность 2), но имеет степень окисления 0. В ацетилене H−C≡C−H каждый атом углерода имеет 4 валентные связи (1 одинарную связь с атомом водорода и тройную связь с другим атомом углерода ). Каждый атом углерода является четырехвалентным (валентность 4), но имеет степень окисления −1.
Примеры
| Сложный | Формула | Валентность | Степень окисления | Диаграмма |
|---|---|---|---|---|
| Хлористый водород | HCl | Н = 1 Cl = 1 | Н = +1 Сl = −1 | H−Cl |
| Хлорная кислота * | HClO4 | Н = 1 Cl = 7 O = 2 | Н = +1 Cl = +7 O = −2 | 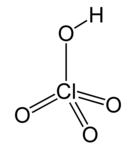 |
| Метан | Гл 4 | С = 4 Н = 1 | С = −4 Н = +1 |  |
| Дихлорметан ** | СН2Сl2 | С = 4 Н = 1 Cl = 1 | С = 0 Н = +1 Сl = −1 |  |
| Оксид железа *** | FeO | Fe = 2 O = 2 | Fe = +2 O = −2 | Fe=O |
| Оксид железа *** | Fe2O3 | Fe = 3 O = 2 | Fe = +3 O = −2 | O=Fe−O−Fe=O |
| Гидрид натрия | НаХ | Na = 1 Н = 1 | Na = +1 Н = −1 | Na−H |
* Перхлорат- ион ClO−4является одновалентным, другими словами, имеет валентность 1.
** Валентности также могут отличаться от абсолютных значений степеней окисления из-за разной полярности связей. Например, в дихлорметане CH 2 Cl 2 углерод имеет валентность 4, но степень окисления 0.
*** Оксиды железа появляются в кристаллической структуре , поэтому типичную молекулу нельзя идентифицировать. В оксиде железа Fe имеет степень окисления +2; в оксиде железа — степень окисления +3.
| Сложный | Формула | Валентность | Степень окисления | Диаграмма |
|---|---|---|---|---|
| Водород | Н 2 | Н = 1 | Н = 0 | Н−Н |
| Хлор | Кл 2 | Кл = 1 | Кл = 0 | Cl−Cl |
| Перекись водорода | Н2О2 | Н = 1 О = 2 | Н = +1 О = −1 |  |
| Гидразин | Н2Н4 | Н = 1 Н = 3 | Н = +1 Н = −2 |  |
| Дисульфур декафторид | С 2 Ж 10 | С = 6 Ж = 1 | С = +5 Ф = −1 |  |
| Дитионовая кислота | H2S2O6 | С = 6 О = 2 Н = 1 | С = +5 О = −2 Н = +1 |  |
| Гексахлорэтан | С2Сl6 | С = 4 Сl = 1 | С = +3 Сl = −1 |  |
| этилен | С2Н4 | С = 4 Н = 1 | С = −2 Н = +1 |  |
| Ацетилен | С2Н2 | С = 4 Н = 1 | С = −1 Н = +1 | Н−С≡С−Н |
| Хлорид ртути(I) | Hg2Cl2 | Hg = 2 Cl = 1 | Hg = +1 Cl = −1 | Cl−Hg−Hg−Cl |
Определение «Максимальное количество облигаций»
Франкленд считал, что валентность (он использовал термин «атомарность») элемента — это единственное значение, которое соответствует максимальному наблюдаемому значению. Число неиспользованных валентностей на атомах того, что сейчас называется p-блочными элементами, обычно четное, и Франкленд предположил, что неиспользованные валентности насыщают друг друга. Например, азот имеет максимальную валентность 5, при образовании аммиака две валентности остаются неприсоединенными; сера имеет максимальную валентность 6, при образовании сероводорода четыре валентности остаются неприсоединенными. [20] [21]
Международный союз теоретической и прикладной химии (ИЮПАК) предпринял несколько попыток прийти к однозначному определению валентности. Текущая версия, принятая в 1994 году: [22]
- Максимальное число одновалентных атомов (первоначально атомов водорода или хлора), которые могут соединяться с атомом рассматриваемого элемента или с фрагментом, или которые может заменить атом этого элемента. [2]
Водород и хлор изначально использовались в качестве примеров одновалентных атомов, поскольку по своей природе они образуют только одну одинарную связь. У водорода есть только один валентный электрон , и он может образовывать только одну связь с атомом, у которого не полностью заполнена внешняя оболочка . У хлора семь валентных электронов , и он может образовывать только одну связь с атомом, который отдает валентный электрон для завершения внешней оболочки хлора. Однако хлор также может иметь степени окисления от +1 до +7 и может образовывать более одной связи, отдавая валентные электроны .
Водород имеет только один валентный электрон, но он может образовывать связи с более чем одним атомом. В бифторид- ионе ( [HF 2 ] − ), например, он образует трехцентровую четырехэлектронную связь с двумя атомами фтора:
- [Ф−ХФ − ↔ Ф − Х−Ф]
Другим примером является трехцентровая двухэлектронная связь в диборане ( B2H6 ) .
Максимальные валентности элементов
Максимальные валентности для элементов основаны на данных из списка степеней окисления элементов . Они показаны цветовым кодом в нижней части таблицы.
| Максимальные валентности элементов | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||
| Группа → | |||||||||||||||||||||
| ↓ Период | |||||||||||||||||||||
| 1 | 1 ЧАС | 2 Он | |||||||||||||||||||
| 2 | 3 Ли | 4 Быть | 5 Б | 6 С | 7 Н | 8 О | 9 Ф | 10 Не | |||||||||||||
| 3 | 11 На | 12 Мг | 13 Эл | 14 Си | 15 П | 16 С | 17 Кл | 18 Ар | |||||||||||||
| 4 | 19 К | 20 Ca | 21 Сц | 22 Ти | 23 В | 24 Кр | 25 Мн | 26 Фе | 27 Ко | 28 Ни | 29 Cu | 30 Zn | 31 Га | 32 Ге | 33 Как | 34 Сэ | 35 Бр | 36 Кр | |||
| 5 | 37 Руб. | 38 Ср | 39 И | 40 Зр | 41 Кол-во | 42 Мо | 43 Тс | 44 Ру | 45 резус-фактор | 46 Пд | 47 Аг | 48 Кд | 49 В | 50 Сн | 51 Сб | 52 Те | 53 я | 54 Хе | |||
| 6 | 55 Cs | 56 Ба |  | 71 Лу | 72 ВЧ | 73 Та | 74 Вт | 75 Повторно | 76 Ос | 77 Ир | 78 Пт | 79 Ау | 80 рт.ст. | 81 Тл | 82 свинец | 83 Би | 84 По | 85 В | 86 Рн | ||
| 7 | 87 Пт | 88 Ра |  | 103 Лр | 104 Рф | 105 Дб | 106 Сг | 107 Бх | 108 Хс | 109 Мт | 110 Дс | 111 Рг | 112 Cn | 113 Нч | 114 Фл | 115 Мак | 116 Ур | 117 Тс | 118 Ог | ||
 | 57 Ла | 58 Се | 59 Пр | 60 нд | 61 ПМ | 62 См | 63 Евросоюз | 64 Б-г | 65 Тб | 66 Дай | 67 Хо | 68 Э-э | 69 Тм | 70 Ыб | |||||||
 | 89 Ас | 90 Чт | 91 Па | 92 У | 93 Нп | 94 Пу | 95 Являюсь | 96 См | 97 Бк | 98 Ср. | 99 Эс | 100 Фм | 101 Мд | 102 Нет | |||||||
| Максимальные валентности основаны на списке степеней окисления элементов. | |||||||||||||||||||||
0123456789Неизвестный Цвет фона показывает максимальную валентность химического элемента. | |||||||||||||||||||||
Смотрите также
Ссылки
- ^ ab Партингтон, Джеймс Риддик (1921). Учебник неорганической химии для студентов университетов (1-е изд.). OL 7221486M.
- ^ ab Определение Золотой книги ИЮПАК : валентность
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Харпер, Дуглас. "валентность". Онлайн-словарь этимологии .
- ^ ab Partington, JR (1989). Краткая история химии . Dover Publications, Inc. ISBN 0-486-65977-1.
- ^ Франкленд, Э. (1852). «О новой серии органических тел, содержащих металлы». Философские труды Лондонского королевского общества . 142 : 417– 444. doi :10.1098/rstl.1852.0020. S2CID 186210604.
- ^ Алан Дж. Рок (1984). Химический атомизм в девятнадцатом веке: от Далтона до Канниццаро . Издательство Университета штата Огайо.
- ^ ab Parkin, Gerard (май 2006 г.). "Валентность, степень окисления и формальный заряд: три связанных, но принципиально разных понятия". Journal of Chemical Education . 83 (5): 791. Bibcode :2006JChEd..83..791P. doi :10.1021/ed083p791. ISSN 0021-9584.
Хотя концепции и определения валентности были уточнены за эти годы, определение, описанное Сиджвиком, остается наиболее полезным и простым для ковалентных молекул: валентность атома в ковалентной молекуле — это просто число электронов, которые атом использовал в связи.
- ^ Сиджвик, Н. В. (1927). Электронная теория валентности . Лондон: Oxford University Press (Clarendon Press). стр. 199.
В целом, наилучшим определением абсолютной валентности, по-видимому, является определение, принятое Гриммом и Зоммерфельдом, согласно которому она численно равна числу электронов атома, «занятых» (beansprucht) присоединением других атомов.
- ^ Гримм, Х.Г.; Зоммерфельд, А (1926). «Über den. Zusammenhang des Abschlusses der Elektronengruppen im Atom mit den chemischen Valenzzahlen». Zeitschrift für Physik . 36 (1): 36–59 . Бибкод : 1926ZPhy...36...36G. дои : 10.1007/bf01383924. S2CID 120248399.
- ^ Смит, Дерек В. (2005). «Валентность, ковалентность, гипервалентность, степень окисления и координационное число». Журнал химического образования . 82 (8): 1202. Bibcode : 2005JChEd..82.1202S. doi : 10.1021/ed082p1202. ISSN 0021-9584.
- ^ Ленгмюр, Ирвинг (1919). «Расположение электронов в атомах и молекулах». Журнал Американского химического общества . 41 (6): 868–934 . doi :10.1021/ja02227a002.
- ^ Магнуссон, Эрик (1990). «Гиперкоординированные молекулы элементов второго ряда: d-функции или d-орбитали?». J. Am. Chem. Soc . 112 (22): 7940– 7951. doi :10.1021/ja00178a014.
- ^ Frenking, Gernot; Shaik, Sason, ред. (Май 2014). "Глава 7: Химическая связь в соединениях переходных металлов". Химическая связь: Химическая связь в периодической таблице . Wiley – VCH. ISBN 978-3-527-33315-8.
- ↑ Merriam-Webster , Несокращенный словарь Merriam-Webster, Merriam-Webster, заархивировано из оригинала 25.05.2020 , извлечено 11.05.2017 .
- ^ "Урок 7: Ионы и их названия". Clackamas Community College . Архивировано из оригинала 21 января 2019 года . Получено 5 февраля 2019 года .
- ^ Бесплатный словарь: валентность
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «Лямбда». doi :10.1351/goldbook.L03418
- ^ IUPAC , Compendium of Chemical Terminology , 2nd ed. («Золотая книга») (1997). Онлайн-исправленная версия: (2006–) «Окислительное состояние». doi :10.1351/goldbook.O04365
- ^ Франкленд, Э. (1870). Конспекты лекций для студентов-химиков (электронная книга Google) (2-е изд.). Дж. Ван Ворст. п. 21.
- ^ Франкланд, Э .; Джепп, Ф. Р. (1885). Неорганическая химия (1-е изд.). С. 75–85 . OL 6994182M.
- ^ Muller, P. (1994). "Глоссарий терминов, используемых в физической органической химии (Рекомендации ИЮПАК 1994 г.)". Pure and Applied Chemistry . 66 (5): 1077–1184 . doi : 10.1351/pac199466051077 . S2CID 195819485.
