- Уровни норэтистерона и этинилэстрадиола в течение 24 часов после однократного приема внутрь 10 мг норэтистерона ацетата у женщин в постменопаузе. [47]
- Уровни норэтистерона и этинилэстрадиола в течение 8 недель после однократной внутримышечной инъекции 200 мг норэтистерона энантата у женщин в пременопаузе. [94]
Норэтистерон
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Норлутин, другие |
| Другие имена | NET; Норэтиндрон; NSC-9564; LG-202; Этинилнортестостерон; Норпрегненинолон; Ангидрогидрокси-норпрогестерон; Этинилэстренолон; 17α-Этинил-19-нортестостерон; 17α-Этинилэстра-4-ен-17β-ол-3-он; 17α-Гидрокси-19-норпрегн-4-ен-20-ин-3-он |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а604034 |
| Данные лицензии |
|
| Пути введения | Через рот |
| Класс наркотиков | Прогестин |
| код АТС | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные | |
| Биодоступность | 47–73% (в среднем 64%) [9] [10] |
| Связывание с белками | 97%: [11] Альбумин : 61%; [11] ГСПГПодсказка Глобулин, связывающий половые гормоны: 36% [11] |
| Метаболизм | В основном CYP3A4 ( печень ); [12] также 5α- / 5β-редуктаза , 3α-Подсказка 3α-гидроксистероиддегидрогеназа/ 3β-HSDПодсказка 3β-гидроксистероиддегидрогеназаи ароматаза |
| Период полувыведения | 5,2–12,8 часов (в среднем 8,0 часов) [9] |
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| ИУФАР/БПС |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| КЕГГ | |
| ЧЭБИ | |
| ChEMBL | |
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.000.619 |
| Химические и физические данные | |
| Формула | С20Н26О2 |
| Молярная масса | 298,426 г·моль −1 |
| 3D модель ( JSmol ) |
|
| Температура плавления | 203–204 °C (397–399 °F) |
| |
| (проверять) | |
Норэтистерон , также известный как норэтиндрон и продаваемый под торговой маркой Норлутин , среди прочего, является прогестиновым препаратом, используемым в противозачаточных таблетках , менопаузальной гормональной терапии и для лечения гинекологических расстройств . [11] [13] Препарат доступен как в низкодозированных, так и в высокодозированных формулах, как отдельно, так и в сочетании с эстрогеном . [13] [14] Он применяется перорально или, как норэтистерона энантат , путем инъекции в мышцу . [11] [13] [15]
Побочные эффекты норэтистерона включают нарушения менструального цикла , головные боли , тошноту , болезненность груди , изменения настроения , угри , повышенный рост волос . [16] [17] Норэтистерон является прогестином или синтетическим прогестагеном , и, следовательно, является агонистом рецептора прогестерона , биологической мишени прогестагенов, таких как прогестерон . [11] [13] Он обладает слабой андрогенной и эстрогенной активностью, в основном при высоких дозировках, и не имеет другой важной гормональной активности. [11] [18]
Норэтистерон был открыт в 1951 году и был одним из первых разработанных прогестинов. [19] [20] [21] Впервые он был представлен для медицинского применения сам по себе в 1957 году и был представлен в сочетании с эстрогеном для использования в качестве противозачаточной таблетки в 1963 году. [21] [22] Иногда его называют прогестином «первого поколения». [23] [24] Подобно дезогестрелу и норгестрелу , норэтистерон доступен в виде «мини-таблетки» только для прогестагена для контроля рождаемости. [25] [26] [27] Норэтистерон широко продается по всему миру. [28] Он доступен как дженерик . [29] В 2022 году он был 135-м наиболее часто назначаемым лекарством в Соединенных Штатах, с более чем 4 миллионами рецептов. [30] [31] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [32]
Медицинское применение
Норэтистерон используется в качестве гормонального контрацептива в сочетании с эстрогеном — обычно этинилэстрадиолом (ЭЭ) — в комбинированных оральных контрацептивах и отдельно в таблетках, содержащих только прогестаген .
Другое медицинское применение норэтистерона — облегчение боли, связанной с эндометриозом . Фактически, 50% пациенток, прошедших медицинское или хирургическое лечение тазовой боли, связанной с эндометриозом, получили пользу от прогестиновой терапии. Это может быть связано с тем, что норэтистерон вызывает пролиферацию эндометрия во время секреторной фазы, что, как было показано, облегчает жалобы на боль в эндометрии. Другой способ, которым норэтистерон может действовать для уменьшения боли в эндометрии, — это ингибирование овуляции . Боль и дискомфорт при эндометриозе усиливаются во время овуляции. [33]
| Состав | Доза | Названия брендов | Использовать |
|---|---|---|---|
| только NET | Низкая (например, 0,35 мг) | Множественный [а] | Оральный контрацептив, содержащий только прогестаген |
| только NET или NETA | Высокая (например, 5 мг, 10 мг) | Множественный [б] | Гинекологические заболевания и другие применения |
| только NETE | Инъекция (например, 200 мг) | Множественный [c] | Инъекционный контрацептив, содержащий только прогестаген |
| NET или NETA с этинилэстрадиолом | Низкая (например, 0,4 мг, 0,5 мг, 0,75 мг, 1 мг, 1,5 мг) | Множественный [д] | Комбинированный оральный контрацептив |
| NET с местранолом | Низкая (например, 1 мг, 2 мг) | Множественный [е] | Комбинированный оральный контрацептив |
| НЕТА с эстрадиолом | Низкая (например, 0,1 мг, 0,5 мг) | Множественный [ф] | Комбинированная менопаузальная гормональная терапия |
| NETE с эстрадиола валератом | Инъекция (например, 50 мг) | Множественный [г] | Комбинированный инъекционный контрацептив |
| Сокращения: NET = Норэтистерон. NETA = Норэтистерона ацетат . NETE = Норэтистерона энантат . Источники: [34] [35] [36] [37] Примечания:
| |||
Противопоказания
Высокие дозы (10 мг/день) норэтистерона связаны с окклюзионной болезнью вен печени , и из-за этого неблагоприятного эффекта норэтистерон не следует назначать пациентам, перенесшим аллогенную трансплантацию костного мозга , поскольку это связано со значительно более низкой выживаемостью в течение одного года после трансплантации. [38] [39]
Побочные эффекты
При дозировках контрацептивов и гормонозаместительной терапии (от 0,35 до 1 мг/день) норэтистерон имеет по существу только прогестагенные побочные эффекты . В большинстве клинических исследований норэтистерона для контрацепции или менопаузальной гормональной терапии препарат сочетался с эстрогеном, и по этой причине трудно определить, какие из побочных эффектов были вызваны норэтистероном, а какие — эстрогеном в таких исследованиях. Однако норэтистерона энантат , внутримышечно вводимое пролекарство норэтистерона, которое используется в качестве контрацептива длительного действия, используется без эстрогена и, следовательно, может использоваться в качестве суррогата норэтистерона с точки зрения понимания его эффектов и переносимости . В клинических исследованиях наиболее распространенным побочным эффектом норэтистерона энантата были нарушения менструального цикла , включая продолжительное кровотечение или кровянистые выделения и аменорею . [38] : 253 Другие побочные эффекты включали периодическое вздутие живота и болезненность груди , оба из которых, как полагают, вызваны задержкой воды и могут быть облегчены диуретиками . [38] : 253 Не было никакой связи с увеличением веса , а артериальное давление , свертываемость крови и толерантность к глюкозе остались в норме. [38] : 253 Однако было отмечено снижение уровня холестерина ЛПВП . [38] : 253
В высоких дозах (от 5 до 60 мг/день), например, используемых при лечении гинекологических заболеваний, норэтистерон может вызывать гипогонадизм из-за своего антигонадотропного действия и может иметь эстрогенные и слабые андрогенные побочные эффекты.
Высокие дозы норэтистерона ацетата (10 мг/день) были связаны с аномальными показателями функции печени , включая значительное повышение уровня печеночных ферментов . [40] [41] [42] Эти печеночные ферменты включали лактатдегидрогеназу и глутаматпируваттрансаминазу . [42] Хотя они были описаны как не имеющие клинической значимости, [42] повышенные уровни печеночных ферментов, связанные с норэтистерона ацетатом, могли помешать его дальнейшей разработке для мужской гормональной контрацепции. [40] [41]
Андрогенный
Из-за своей слабой андрогенной активности норэтистерон может вызывать андрогенные побочные эффекты , такие как акне , гирсутизм и изменения голоса небольшой степени тяжести у некоторых женщин при высоких дозировках (например, от 10 до 40 мг/день). [17] Однако это заметно не относится к комбинированным оральным контрацептивам , которые содержат норэтистерон и ЭЭ. [18] Такие составы содержат низкие дозы норэтистерона (от 0,35 до 1 мг/день) [18] в сочетании с эстрогеном и фактически связаны с улучшением симптомов акне. [43] [44] Соответственно, они фактически одобрены FDAПодсказка Управление по контролю за продуктами и лекарствамидля лечения акне у женщин в Соединенных Штатах. [43] [44] Считается, что улучшение симптомов акне происходит из-за 2-3-кратного увеличения уровня глобулина, связывающего половые гормоны (ГСПГ), и последующего снижения уровня свободного тестостерона, вызванного ЭЭ, что приводит к общему снижению андрогенной сигнализации в организме. [45]
Сальные железы очень чувствительны к андрогенам, а их размер и активность являются потенциальными маркерами андрогенного эффекта. [46] Было обнаружено, что высокая доза 20 мг/день норэтистерона или норэтистерона ацетата значительно стимулирует сальные железы, тогда как более низкие дозы 5 мг/день и 2,5 мг/день норэтистерона и норэтистерона ацетата соответственно не значительно стимулируют выработку кожного сала и, следовательно, считаются лишенными значительной андрогенности. [46] Напротив, было обнаружено, что дозировки норэтистерона от 0,5 до 3 мг/день дозозависимо снижают уровни SHBG (и, следовательно, подавляют выработку SHBG в печени), что является еще одним высокочувствительным маркером андрогенности. [47]
Большое клиническое исследование высоких и очень высоких пероральных доз норэтистерона (от 10 до 40 мг/день), назначаемых в течение длительных периодов времени (от 4 до 35 недель) для предотвращения выкидыша у беременных женщин, показало, что 5,5% женщин испытывали легкие андрогенные побочные эффекты, такие как легкие изменения голоса ( хрипота ), угри и гирсутизм , и что 18,3% младенцев женского пола, рожденных от матерей, показали, в большинстве случаев, лишь незначительную вирилизацию половых органов . [17] Материнские андрогенные симптомы чаще всего возникали у женщин, которые получали дозу норэтистерона 30 мг/день или более в течение 15 недель или дольше. [17] У младенцев женского пола, которые испытали вирилизацию половых органов, единственным проявлением в 86,7% случаев было разнообразное, но почти всегда небольшое увеличение клитора. [17] В остальных 13,3% случаев наблюдалось выраженное увеличение клитора и частичное сращение губно-мошоночных складок . [17] Дозировки, используемые в этих случаях, составляли от 20 до 40 мг/день. [17]
В письме редактору на тему вирилизации, вызванной высокими дозами норэтистерона ацетата у женщин, врач заявил, что они не наблюдали «ни малейшего признака вирилизации» и что «определенно не было ни гирсутизма, ни каких-либо изменений голоса» у 55 женщин с запущенным раком груди, которых они лечили с помощью 30–60 мг/день норэтистерона в течение шести месяцев. [48]
Высокие дозы норэтистерона использовались для подавления менструации у женщин с тяжелой умственной отсталостью , которые были неспособны управлять своими собственными менструациями. [49] [50] Исследование 118 нерожавших женщин, получавших 5 мг/день норэтистерона в течение периода от 2 до 30 месяцев, показало, что препарат был эффективен в создании аменореи у 86% женщин, при этом прорывные кровотечения наблюдались у оставшихся 14%. [49] Побочные эффекты, включая увеличение веса , гирсутизм , акне , головную боль , тошноту и рвоту, по-видимому, не увеличились по частоте, и никаких «беспокоящих побочных эффектов» не было отмечено ни у одной из женщин. [49] [50] Другое исследование 5 мг/день норэтистерона у 132 женщин также не упоминало об андрогенных побочных эффектах. [51] Эти результаты свидетельствуют о небольшом или нулевом риске андрогенных побочных эффектов при приеме норэтистерона в дозировке 5 мг/день. [49] [50] Исследование 194 женщин, получавших 5–15 мг/день норэтистерона ацетата в течение средней продолжительности терапии 13 месяцев для подавления симптомов эндометриоза , не выявило побочных эффектов у 55,2% пациенток, увеличение веса у 16,1%, акне у 9,9%, лабильность настроения у 8,9%, приливы у 8,3% и понижение тембра голоса у двух женщин (1,0%). [52]
Эстрогенный
Норэтистерон является слабо эстрогенным (через преобразование в свой метаболит ЭЭ), и по этой причине было обнаружено, что при высоких дозировках он связан с высокими показателями эстрогенных побочных эффектов, таких как увеличение груди у женщин и гинекомастия у мужчин, а также с улучшением симптомов менопаузы у женщин в постменопаузе. [53] Было высказано предположение, что очень высокие дозировки (например, 40 мг/день, которые иногда используются в клинической практике по различным показаниям) норэтистерона ацетата (и, соответственно, норэтистерона) могут привести к повышенному риску венозной тромбоэмболии (ВТЭ) аналогично высоким дозировкам (выше 50 мкг/день) ЭЭ, и что даже дозы норэтистерона ацетата от 10 до 20 мг, которые соответствуют дозам ЭЭ приблизительно от 20 до 30 мкг/день, могут у некоторых женщин быть связаны с повышенным риском. [54] [55] Исследование также показало, что этинилэстрадиол и норэтистерон оказали большее влияние на факторы коагуляции, когда доза норэтистерона составляла 3 или 4 мг, чем когда она составляла 1 мг. [56] Это могло быть связано с дополнительным этинилэстрадиолом, вырабатываемым более высокими дозами норэтистерона. [56]
Передозировка
Не было сообщений о серьезных побочных эффектах при передозировке норэтистерона, даже у маленьких детей. [8] Таким образом, передозировка обычно не требует лечения. [8] Высокие дозировки до 60 мг/день норэтистерона изучались для длительных периодов лечения без описанных серьезных побочных эффектов. [48]
Взаимодействия
5α-редуктаза играет важную роль в метаболизме норэтистерона, и ингибиторы 5α-редуктазы, такие как финастерид и дутастерид , могут ингибировать его метаболизм. [ требуется ссылка ] Норэтистерон частично метаболизируется посредством гидроксилирования CYP3A4 , а ингибиторы и индукторы CYP3A4 могут значительно изменять циркулирующие уровни норэтистерона. [12] Например, было обнаружено, что индукторы CYP3A4 рифампицин и босентан снижают воздействие норэтистерона на 42% и 23% соответственно, а индукторы CYP3A4 карбамазепин и зверобой также ускоряют клиренс норэтистерона. [12]
Фармакология
Фармакодинамика
Норэтистерон является мощным прогестагеном и слабым андрогеном и эстрогеном . [11] То есть, он является мощным агонистом рецептора прогестерона (PR) и слабым агонистом рецептора андрогена (AR) и рецептора эстрогена (ER). [11] Сам по себе норэтистерон имеет незначительное сродство к ER; его эстрогенная активность обусловлена активным метаболитом , который образуется в очень малых количествах, этинилэстрадиолом (EE), который является очень мощным эстрогеном. [11] Норэтистерон и его метаболиты имеют незначительное сродство к глюкокортикоидному рецептору (GR) и минералокортикоидному рецептору (MR) и, следовательно, не имеют глюкокортикоидной , антиглюкокортикоидной , минералокортикоидной или антиминералокортикоидной активности. [11]
| Сложный | Тип а | PRПодсказка Рецептор прогестерона | АРПодсказка Андрогенный рецептор | ERПодсказка Рецептор эстрогена | ГРПодсказка Глюкокортикоидный рецептор | МИСТЕРПодсказка Минералокортикоидный рецептор | ГСПГПодсказка Глобулин, связывающий половые гормоны | КБГПодсказка Глобулин, связывающий кортикостероиды |
|---|---|---|---|---|---|---|---|---|
| Норэтистерон | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-дигидронорэтистерон | Метаболит | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α,5α-Тетрагидронорэтистерон | Метаболит | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α,5β-Тетрагидронорэтистерон | Метаболит | ? | 0 | 0 | ? | ? | ? | ? |
| 3β,5α-тетрагидронорэтистерон | Метаболит | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| Этинилэстрадиол | Метаболит | 15–25 | 1–3 | 112 | 1–3 | 0 | 0,18 | 0 |
| Норэтистерона ацетат | Пролекарство | 20 | 5 | 1 | 0 | 0 | ? | ? |
| Норэтистерона энантат | Пролекарство | ? | ? | ? | ? | ? | ? | ? |
| Норэтинодрелл | Пролекарство | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| Этинодиол | Пролекарство | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| Диацетат этинодиола | Пролекарство | 1 | 0 | 0 | 0 | 0 | ? | ? |
| Линестренол | Пролекарство | 1 | 1 | 3 | 0 | 0 | ? | ? |
| Примечания: Значения указаны в процентах (%). Контрольными лигандами (100%) для PR были промегестон .Подсказка рецептор прогестерона, метриболон для АРПодсказка андрогенный рецептор, эстрадиол для ERПодсказка эстрогеновый рецептор, дексаметазон для ГРПодсказка глюкокортикоидный рецептор, альдостерон для МРПодсказка минералокортикоидный рецептор, дигидротестостерон для SHBGПодсказка глобулин, связывающий половые гормоны, и кортизол для CBGПодсказка Глобулин, связывающий кортикостероиды. Сноски: a = Активный или неактивный метаболит , пролекарство или ни один из норэтистерона. Источники: см. шаблон. | ||||||||
Прогестагенная активность
Норэтистерон является мощным прогестагеном и связывается с PR с приблизительно 150% сродства прогестерона. [11] Напротив, его родительские соединения, тестостерон , нандролон ( 19 - нортестостерон ) и этистерон ( 17α-этинилтестостерон), имеют 2%, 22% и 44% относительного сродства связывания прогестерона с PR. [57] В отличие от норэтистерона, его основной активный метаболит 5α-дигидронорэтистерон (5α-DHNET), который образуется путем трансформации через 5α-редуктазу , как было обнаружено, обладает как прогестагенной, так и выраженной антипрогестагенной активностью, [58] хотя его сродство к PR значительно снижено по сравнению с норэтистероном и составляет всего 25% от сродства прогестерона. [11] Норэтистерон вызывает схожие изменения в эндометрии и влагалище , такие как трансформация эндометрия , и является аналогичным антигонадотропным , ингибирующим овуляцию и термогенным у женщин по сравнению с прогестероном, что соответствует его прогестагенной активности. [59] [57] [60]
Андрогенная активность
Норэтистерон имеет приблизительно 15% сродства анаболического -андрогенного стероида (ААС) метриболона (R-1881) к АР и, соответственно, является слабоандрогенным. [11] В отличие от норэтистерона, 5α-DHNET, основной метаболит норэтистерона, показывает более высокое сродство к АР, приблизительно 27% сродства метриболона. [11] Однако, хотя 5α-DHNET имеет более высокое сродство к АР, чем норэтистерон, он значительно снизил и фактически почти устранил андрогенную активность по сравнению с норэтистероном в биопробах на грызунах . [61] [62] Аналогичные результаты были получены для этистерона (17α-этинилтестостерона) и его 5α-восстановленного метаболита, тогда как 5α-восстановление усилило как сродство к AR, так и андрогенную активность тестостерона и нандролона (19-нортестостерона) в биопробах на грызунах. [62] Таким образом, по-видимому, этинильная группа норэтистерона в положении C17α ответственна за его потерю андрогенности при 5α-восстановлении. [62]
Было обнаружено, что норэтистерон (от 0,5 до 3 мг/день) дозозависимо снижает уровень циркулирующего SHBG, что является общим свойством андрогенов и обусловлено подавлением печеночной продукции SHBG, опосредованным AR. [47] Препарат также обладает эстрогенной активностью, а эстрогены, как известно, увеличивают выработку SHBG в печени и циркулирующие уровни, поэтому, по-видимому, андрогенная активность норэтистерона преобладает над его эстрогенной активностью в этом отношении. [47]
Норэтистерон в значительной степени (36%) связан с SHBG в кровотоке. [11] Хотя он имеет более низкое сродство к SHBG, чем эндогенные андрогены и эстрогены, [63] норэтистерон может вытеснять тестостерон из SHBG и тем самым повышать уровень свободного тестостерона, и это действие может способствовать его слабым андрогенным эффектам. [64]
Эстрогенная активность

Норэтистерон связывается с ER, ERα и ERβ , с 0,07% и 0,01% относительной аффинности связывания эстрадиола . [65] Из-за этих очень низких относительных аффинностей он по существу неактивен сам по себе как лиганд ER в клинических концентрациях. [11] Однако было обнаружено, что норэтистерон является субстратом для ароматазы и преобразуется в печени в небольшой степени (0,35%) в высокоэффективный эстроген этинилэстрадиол ( ЭЭ), и по этой причине, в отличие от большинства других прогестинов, норэтистерон обладает некоторой эстрогенной активностью. [11] Однако при типичных дозировках норэтистерона, используемых в оральных контрацептивах (от 0,5 до 1 мг), уровни продуцируемого ЭЭ низкие, и было сказано, что они, вероятно, не имеют клинической значимости. [11] Наоборот, дозы 5 и 10 мг норэтистерона, которые используются при лечении гинекологических заболеваний , преобразуются со скоростью 0,7% и 1,0% и производят уровни ЭЭ, которые соответствуют уровням, производимым дозами 30 и 60 мкг ЭЭ соответственно. [9] [11] Уровни ЭЭ, образованные 0,5 и 1 мг норэтистерона, были оценены на основе более высоких доз как соответствующие дозам 2 и 10 мкг ЭЭ соответственно. [9] В высоких дозах норэтистерон может увеличить риск венозной тромбоэмболии из-за метаболизма в ЭЭ. [66]
Нейростероидная активность
Подобно прогестерону и тестостерону , норэтистерон метаболизируется в 3,5-тетрагидрометаболиты . [ 67] Взаимодействуют ли эти метаболиты норэтистерона с рецептором ГАМК А аналогично 3,5-тетрагидрометаболитам прогестерона и тестостерона, таким как аллопрегнанолон и 3α-андростандиол , соответственно, является темой, которая, по-видимому, не была изучена и, следовательно, требует уточнения. [67]
Ингибирование стероидогенеза
Норэтистерон является субстратом и, как известно, ингибитором 5α -редуктазы , с ингибированием 4,4% и 20,1% при 0,1 и 1 мкМ соответственно. [11] Однако терапевтические концентрации норэтистерона находятся в низком наномолярном диапазоне, поэтому это действие может не иметь клинического значения при типичных дозировках. [11]
Было обнаружено, что норэтистерон и его основной активный метаболит 5α-DHNET действуют как необратимые ингибиторы ароматазы (K i = 1,7 мкМ и 9,0 мкМ соответственно). [68] Однако, как и в случае с 5α-редуктазой, требуемые концентрации, вероятно, слишком высоки, чтобы быть клинически значимыми при типичных дозировках. [11] 5α-DHNET был специально оценен и обнаружен как селективный в своем ингибировании ароматазы и не влияет на фермент расщепления боковой цепи холестерина (P450scc), 17α-гидроксилазу / 17,20-лиазу , 21-гидроксилазу или 11β-гидроксилазу . [68] Поскольку он не ароматизируется (и, следовательно, не может быть преобразован в эстрогенный метаболит), в отличие от норэтистерона, 5α-DHNET был предложен в качестве потенциального терапевтического средства при лечении ER-положительного рака молочной железы . [68]
Другие виды деятельности
Норэтистерон является очень слабым ингибитором CYP2C9 и CYP3A4 ( IC50 = 46 мкМ и 51 мкМ соответственно), но эти действия требуют очень высоких концентраций норэтистерона, которые намного превышают терапевтические уровни циркуляции (которые находятся в наномолярном диапазоне) и, следовательно, вероятно , не являются клинически значимыми. [11]
Было обнаружено, что норэтистерон и некоторые из его 5α-восстановленных метаболитов оказывают сосудорасширяющее действие на животных, которое не зависит от рецепторов половых стероидов и, следовательно, по-видимому, имеет негеномный механизм. [69]
Норэтистерон стимулирует пролиферацию клеток рака молочной железы MCF-7 in vitro , действие, которое не зависит от классических PR и вместо этого опосредовано через компонент мембраны рецептора прогестерона-1 (PGRMC1). [70] Некоторые другие прогестины действуют аналогично в этом анализе, тогда как прогестерон действует нейтрально. [70] Неясно, могут ли эти результаты объяснить различные риски рака молочной железы, наблюдаемые при использовании прогестерона и прогестинов в клинических исследованиях . [71]
Антигонадотропные эффекты
Благодаря своей прогестагенной активности норэтистерон подавляет гипоталамо-гипофизарно-гонадную ось (ось HPG) и, следовательно, оказывает антигонадотропное действие. [11] [57] Эстрогенная активность норэтистерона в высоких дозах также, как ожидается, будет способствовать его антигонадотропному действию. [72] Благодаря своим антигонадотропным эффектам норэтистерон подавляет выработку половых гормонов гонадами , подавляет овуляцию у женщин и подавляет сперматогенез у мужчин. [11] [57] [73]
Ингибирующая овуляцию доза как перорального норэтистерона, так и перорального норэтистерона ацетата составляет около 0,5 мг/день у женщин. [11] [74] [75] Однако существуют некоторые противоречивые данные, предполагающие, что для полного ингибирования овуляции могут потребоваться более высокие дозы. [76] Было обнаружено, что внутримышечная инъекция 200 мг норэтистерона энантата предотвращает овуляцию и подавляет уровни эстрадиола , прогестерона , лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) у женщин. [77] [78] [79] [80]
Ранние исследования перорального норэтистерона у мужчин с применением доз от 20 до 50 мг/день наблюдали подавление экскреции 17-кетостероидов , повышенную экскрецию эстрогена (за счет преобразования в этинилэстрадиол ), подавление сперматогенеза, либидо и эректильной функции , а также частоту возникновения гинекомастии . [81] [82] [83] [53] [84] Сообщалось, что доза перорального норэтистерона 25 мг/день в течение 3 недель у мужчин подавляет уровень тестостерона примерно на 70%, до 100-200 нг/дл, в течение 4 или 5 дней, а также подавляет количество сперматозоидов и не оказывает никакого влияния на либидо или эректильную функцию в течение этого короткого периода времени. [85] [86] У здоровых молодых мужчин прием норэтистерона ацетата в одиночку в дозе от 5 до 10 мг/день перорально в течение 2 недель снижал уровень тестостерона с ~527 нг/дл до ~231 нг/дл (–56%). [87]

Было обнаружено, что однократная внутримышечная инъекция 200 мг норэтистерона энантата отдельно или в сочетании с 2 мг эстрадиола валерата вызывает быстрое, сильное и устойчивое снижение уровня гонадотропина и тестостерона в течение одного месяца у мужчин. [73] [89] [90] Также было обнаружено, что внутримышечные инъекции 200 мг норэтистерона энантата один раз в 3 недели подавляют сперматогенез у мужчин. [81] [91] Аналогичным образом было обнаружено, что однократная внутримышечная инъекция 50 мг норэтистерона энантата в сочетании с 5 мг эстрадиола валерата сильно подавляет уровень тестостерона у мужчин. [88] Уровень тестостерона снизился с ~503 нг/дл на исходном уровне до ~30 нг/дл в самой низкой точке (–94%), которая наблюдалась на 7-й день после инъекции. [88]
Фармакокинетика
Фармакокинетика норэтистерона была рассмотрена. [ 11 ] [92]
Поглощение
Пероральная биодоступность норэтистерона составляет от 47 до 73%, при средней пероральной биодоступности 64%. [ 9] [10] Было обнаружено, что микронизация значительно улучшает пероральную биодоступность норэтистерона за счет увеличения кишечной абсорбции и снижения кишечного метаболизма . [11] [93] Было обнаружено, что однократная пероральная доза норэтистерона 2 мг приводит к пиковым циркулирующим уровням препарата 12 нг/мл (40 нмоль/л), тогда как однократная пероральная доза норэтистерона 1 мг в сочетании с 2 мг эстрадиола приводит к пиковым уровням норэтистерона 8,5 нг/мл (29 нмоль/л) через час после введения. [11]
Распределение
Связывание норэтистерона с белками плазмы составляет 97%. [11] Он связывается на 61% с альбумином и на 36% с ГСПГ. [11]
Метаболизм
Метаболизм норэтистерона и его пролекарств в организме человека Метаболические пути, участвующие в метаболизме норэтистерона у людей. Ацетат норэтистерона , энантат норэтистерона , этинодиол , диацетат этинодиола , линестренол , норэтинодрел , квингестанол и ацетат квингестанола являются пролекарствами норэтистерона. Этинилэстрадиол является эстрогенным метаболитом норэтистерона, образуемым ферментами цитохрома P450. Два изомера дигидронорэтистерона и четыре изомера тетрагидронорэтистерона образуются 5α- и 5β -редуктазами и 3α- и 3β-гидроксистероиддегидрогеназами и обладают сниженной или отсутствующей активностью. Норэтистерон и его метаболиты также подвергаются гидроксилированию через ферменты цитохрома P450 и конъюгации через глюкуронирование и сульфатирование в доступных гидроксильных (–OH) группах . Источники : [95] [96] [97] [98] [99] [100] [15] [57] [11] [101] [102] |
Период полувыведения норэтистерона составляет от 5,2 до 12,8 часов, а средний период полувыведения составляет 8,0 часов. [9] Метаболизм норэтистерона очень похож на метаболизм тестостерона (и нандролона) и происходит в основном посредством восстановления двойной связи Δ4 до 5α- и 5β-дигидронорэтистерона, за которым следует восстановление кетогруппы C3 до четырех изомеров 3,5-тетрагидронорэтистерона. [11] Эти превращения катализируются 5α- и 5β-редуктазой и 3α- и 3β-гидроксистероиддегидрогеназой как в печени , так и во внепеченочных тканях , таких как гипофиз , матка , предстательная железа , влагалище и грудь . [103] За исключением 3α,5α- и 3β,5α-тетрагидронорэтистерона, которые имеют значительное сродство к ER и в некоторой степени являются эстрогенными, 3,5-тетрагидрометаболиты норэтистерона неактивны с точки зрения сродства к рецепторам половых стероидов (в частности, PR, AR и ER). [104] [105] [106] Небольшое количество норэтистерона также преобразуется ароматазой в EE. [9] [11] [54] Норэтистерон также метаболизируется в печени посредством гидроксилирования , в основном с помощью CYP3A4 . [12] Некоторая конъюгация (включая глюкуронирование и сульфатирование ) [103] [107] норэтистерона и его метаболитов происходит, несмотря на стерические препятствия со стороны этинильной группы при C17α. [11] Этинильная группа норэтистерона сохраняется примерно в 90% всех его метаболитов. [11]
Норэтистерон используется в противозачаточных таблетках, в отличие от самого прогестерона, потому что он не метаболизируется так быстро, как прогестерон при приеме внутрь. Когда прогестерон принимается внутрь, он быстро метаболизируется в желудочно-кишечном тракте и печени и распадается на множество различных метаболитов. В то время как норэтистерон не так быстро метаболизируется, позволяя норэтистерону присутствовать в больших количествах, что позволяет ему более эффективно конкурировать за места связывания рецепторов прогестерона. [11]
Устранение
Норэтистерон выводится на 33–81% с мочой и на 35–43% с калом . [108]
Химия
Норэтистерон, также известный как 17α-этинил-19-нортестостерон или как 17α-этинилэстра-4-ен-17β-ол-3-он, является синтетическим эстрановым стероидом и производным тестостерона . [ 109 ] [ 36 ] Это , в частности, производное тестостерона, в котором этинильная группа была добавлена в положение C17α, а метильная группа в положении C19 была удалена; следовательно, это комбинированное производное этистерона (17α-этинилтестостерон) и нандролона (19-нортестостерон). [109] [36] Эти модификации приводят к повышению прогестагенной активности и пероральной биодоступности , а также снижению андрогенной / анаболической активности. [110]
Производные
Норэтистерон (НЭТ) является исходным соединением большой группы прогестинов, которая включает большинство прогестинов, известных как производные 19-нортестостерона. [111] Эта группа делится по химической структуре на эстраны (производные норэтистерона) и гонаны (18-метилгонаны или 13β-этилэстраны; производные левоноргестрела ) и включает следующие продаваемые препараты: [112]
|
|
Некоторые из них действуют как пролекарства норэтистерона, включая норэтистерона ацетат , норэтистерона энантат , этинодиол диацетат , линестренол и хингестанола ацетат . [113] [114] [115] Норэтинодрел также может быть пролекарством норэтистерона. [11] [9] Ацетат норэтистерона принимается внутрь, аналогично норэтистерону, тогда как норэтистерона энантат вводится путем инъекции в мышцу . [18]
Не-17α-этинилированный
Прогестины 19-нортестостерона (19-NT), которые технически не являются производными норэтистерона (поскольку у них нет этинильной группы C17α ), но все же тесно связаны с ним (с другими заменами в положениях C17α и/или C16β), включают следующие продаваемые препараты: [109] [36]
- Производные винила (этенила) C17α норгестерон (17α-винил-δ 5(10) -19-NT) и норвинистерон (17α-винил-19-NT)
- Производные аллила C17α аллилестренол (3-декето-17α-аллил-19-NT) и альтреногест (17α-аллил-δ 9,11 -19-NT)
- Производное алкила C17α норметандрон (17α-метил-19-NT)
- C17α цианометильное производное диеногест (17α-цианометил-δ 9 -19-NT)
- Этилпроизводное C16β оксендолон (16β-этил-19-NT)
Многие анаболические стероиды семейства 19-нортестостерона, такие как норетандролон и этилэстренол , также являются мощными прогестагенами, но никогда не продавались как таковые.
Синтез
Химический синтез норэтистерона был опубликован. [109] [92]
Синтез 1

Эстрадиол 3-метиловый эфир ( 1 , EME) частично восстанавливается до 1,5-диена ( 2 ), как это происходит и на первом этапе синтеза нандролона. Затем окисление Оппенауэра преобразует гидроксильную группу C17β в кетонную функциональность ( 3 ). Затем она реагирует с ацетилидом металла в соответствующее этинильное соединение C17α ( 4 ). Гидролиз енольского эфира в мягких условиях приводит непосредственно к ( 5 ), [116] который, по-видимому, является норэтинодрелом (хотя Ледницер в своей книге утверждает, что это «этинодрел» (что может быть синонимом этинодиол ); этинодрел с присоединенным атомом хлора ), перорально активным прогестином. Это прогестагенный компонент первого орального контрацептива , который будет предложен для продажи (т. е. Эновид). Обработка этинил енолового эфира сильной кислотой приводит к образованию норэтистерона ( 6 ). [19]
На практике эти и все другие комбинированные оральные контрацептивы представляют собой смеси 1–2% ЭЭ или местранола и орального прогестина . Было высказано предположение, что открытие необходимости эстрогена в дополнение к прогестину для контрацептивной эффективности связано с присутствием небольшого количества невосстановленного ЭМЭ ( 1 ) в ранних партиях 2. Это, будучи подвергнутым окислению и этинилированию , конечно, привело бы к местранолу ( 3 ). В любом случае, необходимость присутствия эстрогена в смеси в настоящее время хорошо установлена экспериментально.
Синтез 2
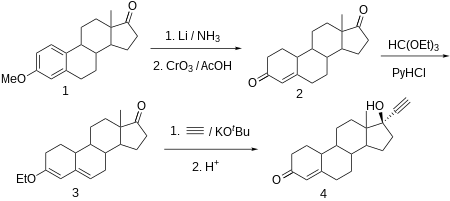
Норэтистерон производится из эстр-4-ен-3,17-диона (боландиона), который в свою очередь синтезируется путем частичного восстановления ароматической области 3-O-метилового эфира эстрона литием в жидком аммиаке и одновременно кетогруппы при C17α до гидроксильной группы, которая затем окисляется обратно до кетогруппы триоксидом хрома в уксусной кислоте . Сопряженный олефин C4-C5 и карбонильная группа при C3 затем преобразуются в диенолэтиловый эфир с использованием этилортоформиата . Полученный продукт этинилируется ацетиленом в присутствии трет-бутоксида калия . После гидрохлоридного гидролиза образовавшегося O-калиевого производного, в ходе которого также гидролизуется еноловый эфир, а оставшаяся двойная связь смещается, получается желаемый норэтистерон.
История
Норэтистерон был впервые синтезирован химиками Луисом Мирамонтесом , Карлом Джерасси и Джорджем Розенкранцем в компании Syntex в Мехико в 1951 году. [19] Он был получен из этистерона и, как было обнаружено, обладал примерно в 20 раз большей активностью в качестве прогестагена по сравнению с ним. [ необходима цитата ] Норэтистерон был первым высокоактивным пероральным прогестагеном , который был синтезирован, и ему предшествовали (как прогестагену) прогестерон (1934), этистерон (1938), 19-норпрогестерон (1944) и 17α-метилпрогестерон (1949), а также нандролон (1950), тогда как норэтинодрел (1952) и норэтандролон (1953) последовали за синтезом норэтистерона. [20] [21] Препарат был представлен как Норлутин в Соединенных Штатах в 1957 году. [22] Норэтистерон впоследствии был объединен с местранолом и продавался как Орто-Новум в Соединенных Штатах в 1963 году. Это был второй прогестин, после норэтинодрела в 1960 году, который использовался в оральных контрацептивах . [21] В 1964 году в Соединенных Штатах появились дополнительные контрацептивные препараты, содержащие норэтистерон в сочетании с местранолом или ЭЭ, такие как Норлестрин и Норинил. [21]
Общество и культура
Общие названия
Норэтистерон — это МННПодсказка Международное непатентованное названиеи БАНПодсказка: одобренное британцами имяпрепарата, в то время как норэтиндрон является его USANПодсказка Соединенные Штаты Принятое название. [109] [36]
Названия брендов
Норэтистерон доступен в Бангладеш как Menogia (ACI), Normens (Renata) и т. д. Норэтистерон (NET), в том числе как норэтистерона ацетат и норэтистерона энантат, продается под многими торговыми марками по всему миру. [36] [28]
Доступность
Соединенные Штаты
Норэтистерон ранее был доступен отдельно в таблетках по 5 мг под торговой маркой Norlutin в Соединенных Штатах, но с тех пор эта формула была прекращена. [35] Тем не менее, норэтистерона ацетат остается доступным отдельно в таблетках по 5 мг под торговой маркой Aygestin в Соединенных Штатах. [35] Это один из немногих неконтрацептивных препаратов, содержащих только прогестаген, который остается доступным в Соединенных Штатах. [35] Другие включают прогестерон , медроксипрогестерона ацетат , мегестрола ацетат и гидроксипрогестерона капроат , а также атипичный агент даназол . [35]
И норэтистерон, и норэтистерона ацетат также доступны в Соединенных Штатах в качестве контрацептивов. [35] Норэтистерон доступен как отдельно (торговые марки Camila, Errin, Heather, Micronor, Nor-QD и другие), так и в сочетании с ЭЭ (Norinyl, Ortho-Novum и другие) или местранолом (Norinyl, Ortho-Novum и другие), в то время как норэтистерона ацетат доступен только в сочетании с ЭЭ (Norlestrin и другие). [35] Норэтистерона энантат недоступен в Соединенных Штатах ни в какой форме. [35] [122] [123]
Исследовать
Норэтистерон, как норэтистерона ацетат и норэтистерона энантат, изучался на предмет использования в качестве потенциального мужского гормонального контрацептива в сочетании с тестостероном у мужчин. [124] [125]
Микросферы норэтистерона длительного действия для внутримышечных инъекций изучались на предмет потенциального использования в качестве средства контроля рождаемости. [126]
Ссылки
- ^ "Product monograph brand safety updates". Health Canada . 6 июня 2024 г. Архивировано из оригинала 29 марта 2024 г. Получено 8 июня 2024 г.
- ^ "Таблетка Камила-норэтиндрон". DailyMed . 1 апреля 2024 г. Получено 29 сентября 2024 г.
- ^ "Emzahh-norethindrone tablet". DailyMed . 10 апреля 2023 г. Получено 29 сентября 2024 г.
- ^ "Таблетки Эррин-норэтиндрон". DailyMed . 1 марта 2024 г. Получено 29 сентября 2024 г.
- ^ "Heather-norethindrone tablet". DailyMed . 31 августа 2021 г. Получено 29 сентября 2024 г.
- ^ "Incassia-norethindrone tablet". DailyMed . 14 сентября 2021 г. Получено 29 сентября 2024 г.
- ^ "Jencycla-norethindrone tablet". DailyMed . 13 декабря 2023 г. Получено 29 сентября 2024 г.
- ^ abc "Таблетки Micronor-norethindrone". DailyMed . 1 апреля 2011 г. Получено 29 сентября 2024 г.
- ^ abcdefgh Stanczyk FZ (сентябрь 2002 г.). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Обзоры в Endocrine & Metabolic Disorders . 3 (3): 211– 24. doi :10.1023/A:1020072325818. PMID 12215716. S2CID 27018468.
- ^ ab Fotherby K (август 1996). «Биодоступность перорально вводимых половых стероидов, используемых в оральной контрацепции и заместительной гормональной терапии». Контрацепция . 54 (2): 59– 69. doi :10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an Kuhl H (август 2005 г.). "Фармакология эстрогенов и прогестагенов: влияние различных путей введения" (PDF) . Climacteric . 8 (Suppl 1): 3– 63. doi :10.1080/13697130500148875. PMID 16112947. S2CID 24616324. Архивировано (PDF) из оригинала 22 августа 2016 г. . Получено 6 сентября 2018 г. .
- ^ abcd Korhonen T, Turpeinen M, Tolonen A, Laine K, Pelkonen O (май 2008 г.). «Идентификация ферментов цитохрома P450 человека, участвующих в in vitro биотрансформации линестренола и норэтиндрона». Журнал стероидной биохимии и молекулярной биологии . 110 ( 1– 2): 56– 66. doi : 10.1016/j.jsbmb.2007.09.025. PMID 18356043. S2CID 10809537.
- ^ abcd Taitel HF, Kafrissen ME (1995). «Норэтиндрон – обзор терапевтических применений». Международный журнал исследований фертильности и менопаузы . 40 (4): 207–23 . PMID 8520623.
- ^ Alden KR, Lowdermilk DL, Cashion MC, Perry SE (2013). Материнство и женское здоровье – Электронная книга. Elsevier Health Sciences. стр. 135–. ISBN 978-0-323-29368-6. Архивировано из оригинала 9 марта 2023 г. . Получено 8 января 2018 г. .
- ^ ab Kuhl H (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Maturitas . 12 (3): 171– 97. doi :10.1016/0378-5122(90)90003-o. PMID 2170822.
- ^ "Aygestin (таблетки норэтиндрона ацетата, USP)" (PDF) . Архивировано (PDF) из оригинала 10 февраля 2017 г. . Получено 11 июля 2024 г. .
- ^ abcdefg Jacobson BD (октябрь 1962 г.). «Опасности терапии норэтиндроном во время беременности». American Journal of Obstetrics and Gynecology . 84 (7): 962– 68. doi :10.1016/0002-9378(62)90075-3. PMID 14450719.
- ^ abcd Рабочая группа МАИР по оценке канцерогенных рисков для человека, Всемирная организация здравоохранения, Международное агентство по изучению рака (2007). Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагенная менопаузальная терапия. Всемирная организация здравоохранения. стр. 417–. ISBN 978-92-832-1291-1. Архивировано из оригинала 10 января 2023 г. . Получено 12 октября 2016 г. .
Норэтистерон и его эфиры ацетата и энантата являются прогестагенами, обладающими слабыми эстрогенными и андрогенными свойствами.
- ^ abcd Djerassi C, Miramontes L, Rosenkranz G, Sondheimer F, Longo LD (январь 2006 г.). "Стероиды LIV. Синтез 19-нор-17альфа-этинилтестостерона и 19-нор-17альфа-метилтестостерона. 1954". American Journal of Obstetrics and Gynecology . 194 (1): 289; обсуждение 290. doi :10.1021/ja01645a010. PMID 16389045.
- ^ ab Shoupe D (2007). Справочник по контрацепции: руководство по практическому управлению. Springer Science & Business Media. стр. 15–. ISBN 978-1-59745-150-5.
- ^ abcde Marks L (2010). Сексуальная химия: история противозачаточных таблеток. Yale University Press. стр. 74, 76. ISBN 978-0-300-16791-7.
- ^ ab William Andrew Publishing (2013). Энциклопедия фармацевтического производства (3-е изд.). Elsevier. стр. 2935–. ISBN 978-0-8155-1856-3.
- ^ Хэтчер РА, Нельсон АЛ (2007). Технология контрацепции. Ardent Media. стр. 195–. ISBN 978-1-59708-001-9. Архивировано из оригинала 10 января 2023 . Получено 8 января 2018 .
- ^ Гунашила С. (2011). Практическое управление гинекологическими проблемами. JP Medical Ltd. стр. 31–. ISBN 978-93-5025-240-6. Архивировано из оригинала 9 марта 2023 г. . Получено 8 января 2018 г. .
- ^ Grimes DA, Lopez LM, O'Brien PA, Raymond EG (ноябрь 2013 г.). "Таблетки только с прогестином для контрацепции". База данных систематических обзоров Cochrane (11): CD007541. doi :10.1002/14651858.CD007541.pub3. PMID 24226383.
- ^ Хуссейн СФ (февраль 2004 г.). «Таблетки, содержащие только прогестоген, и высокое кровяное давление: есть ли связь? Обзор литературы». Контрацепция . 69 (2): 89–97 . doi :10.1016/j.contraception.2003.09.002. PMID 14759612.
- ^ "Opill: Вкладыш в упаковку / Информация о назначении". Drugs.com . Получено 30 сентября 2024 г. .
- ^ ab "Норетистерон". Архивировано из оригинала 15 сентября 2018 года . Получено 8 января 2018 года .
- ^ "Generic Aygestin Availability". Архивировано из оригинала 24 августа 2018 года . Получено 8 января 2018 года .
- ^ "Топ-300 2022 года". ClinCalc . Архивировано из оригинала 30 августа 2024 года . Получено 30 августа 2024 года .
- ^ "Статистика использования препарата Норэтиндрон, США, 2013–2022". ClinCalc . Получено 30 августа 2024 г. .
- ^ Всемирная организация здравоохранения (2023). Выбор и использование основных лекарственных средств 2023: веб-приложение A: Модельный список основных лекарственных средств Всемирной организации здравоохранения: 23-й список . Женева: Всемирная организация здравоохранения. hdl : 10665/371090 . WHO/MHP/HPS/EML/2023.02.
- ^ Kim JJ, Kurita T, Bulun SE (февраль 2013 г.). «Действие прогестерона при раке эндометрия, эндометриозе, фибромиоме матки и раке груди». Endocrine Reviews . 34 (1): 130– 62. doi :10.1210/er.2012-1043. PMC 3565104 . PMID 23303565.
- ^ "Норетистерон". Drugs.com .
- ^ abcdefgh "Drugs@FDA: FDA Approved Drug Products". Управление по контролю за продуктами и лекарствами США. Архивировано из оригинала 16 ноября 2016 г. Получено 27 ноября 2016 г.
- ^ abcdef Index Nominum 2000: Международный каталог лекарств. Тейлор и Фрэнсис. Январь 2000 г., стр. 749–. ISBN 978-3-88763-075-1. Ошибка цитирования: Именованная ссылка «IndexNominum2000» была определена несколько раз с различным содержанием (см. страницу справки ).
- ^ Рабочая группа МАИР по оценке канцерогенных рисков для человека, Международное агентство по изучению рака (1 января 1999 г.). Гормональная контрацепция и постменопаузальная гормональная терапия (PDF) . МАИР. стр. 65. ISBN 978-92-832-1272-0.
- ^ abcde Аронсон Дж. К. (2009). Побочные эффекты эндокринных и метаболических препаратов Мейлера. Elsevier. С. 217, 253, 275 [217]. ISBN 978-0-08-093292-7.
- ^ Hägglund H, Remberger M, Klaesson S, Lönnqvist B, Ljungman P, Ringdén O (декабрь 1998 г.). «Лечение норэтистероном, основной фактор риска веноокклюзионной болезни печени после аллогенной трансплантации костного мозга». Blood . 92 (12): 4568– 72. doi :10.1182/blood.V92.12.4568. PMID 9845522.
- ^ ab Cornia PB, Anawalt BD (ноябрь 2004 г.). «Мужская гормональная контрацепция». Мнение экспертов по новым препаратам . 9 (2): 335– 44. doi :10.1517/14728214.9.2.335. PMID 15571489. S2CID 26886374.
- ^ ab Cornia PB, Anawalt BD (2005). «Мужские гормональные контрацептивы: потенциально патентоспособный и прибыльный продукт». Экспертное мнение о терапевтических патентах . 15 (12): 1727– 37. doi :10.1517/13543776.15.12.1727. ISSN 1354-3776. S2CID 83941717.
- ^ abc Kamischke A, Heuermann T, Krüger K, von Eckardstein S, Schellschmidt I, Rübig A, et al. (Февраль 2002). «Эффективный гормональный мужской контрацептив с использованием тестостерона ундеканоата с пероральными или инъекционными препаратами норэтистерона». Журнал клинической эндокринологии и метаболизма . 87 (2): 530–39 . doi : 10.1210/jcem.87.2.8218 . PMID 11836281.
- ^ ab Junkins-Hopkins JM (март 2010 г.). «Гормональная терапия акне». Журнал Американской академии дерматологии . 62 (3): 486– 88. doi : 10.1016/j.jaad.2009.12.002. PMID 20159314.
- ^ ab Arowojolu AO, Gallo MF, Lopez LM, Grimes DA (июль 2012 г.). Arowojolu AO (ред.). "Комбинированные оральные контрацептивы для лечения акне". База данных систематических обзоров Cochrane (7): CD004425. doi :10.1002/14651858.CD004425.pub6. PMC 11437354. PMID 22786490 .
- ^ van Vloten WA, Sigurdsson V (2004). «Выбор орального контрацептива для лечения акне у женщин». Американский журнал клинической дерматологии . 5 (6): 435– 41. doi :10.2165/00128071-200405060-00008. PMID 15663340. S2CID 9947402.
- ^ ab Pochi PE, Strauss JS (декабрь 1965 г.). «Отсутствие эффекта андрогенов на сальные железы человека при низкой дозировке норэтиндрона». American Journal of Obstetrics and Gynecology . 93 (7): 1002– 04. doi :10.1016/0002-9378(65)90162-6. PMID 5843402.
- ^ abcd Kuhnz W, Heuner A, Hümpel M, Seifert W, Michaelis K (декабрь 1997 г.). "In vivo преобразование норэтистерона и норэтистерона ацетата в этинилэтрадиол у женщин в постменопаузе". Contraception . 56 (6): 379– 85. doi :10.1016/s0010-7824(97)00174-1. PMID 9494772.
- ^ ab Curwen S (1962). "Вирилизация с помощью норэтистерона". BMJ . 1 (5289): 1415. doi :10.1136/bmj.1.5289.1415-a. ISSN 0959-8138. PMC 1958463 .
- ^ abcd Roxburgh DR, West MJ (август 1973). «Использование норэтистерона для подавления менструации у женщин с тяжелой степенью умственной отсталости». The Medical Journal of Australia . 2 (7): 310– 13. doi :10.5694/j.1326-5377.1973.tb128175.x. PMID 4746398. S2CID 204094551. Архивировано из оригинала 20 декабря 2016 г. Получено 6 декабря 2016 г.
- ^ abc Roxburgh DR, West MJ (август 1973). «Использование норэтистерона для подавления менструации у женщин с тяжелой степенью умственной отсталости». The Medical Journal of Australia . 2 (7): 310– 13. doi :10.1097/00006254-197408000-00021. PMID 4746398.
- ^ Board JA (апрель 1965 г.). «Клиническая оценка использования оральных контрацептивов норэтиндрона 5 мг плюс местранол 0,075 мг». Журнал Канадской медицинской ассоциации . 92 (15): 814–17 . PMC 1927985. PMID 14272499 .
- ^ Kaser DJ, Missmer SA, Berry KF, Laufer MR (апрель 2012 г.). «Использование только норэтиндрона ацетата для послеоперационного подавления симптомов эндометриоза». Журнал детской и подростковой гинекологии . 25 (2): 105– 08. doi :10.1016/j.jpag.2011.09.013. PMID 22154396.
- ^ ab Paulsen CA, Leach RB, Lanman J, Goldston N, Maddock WO, Heller CG (октябрь 1962 г.). «Врожденная эстрогенность норэтиндрона и норэтинодрела: сравнение с другими синтетическими прогестинами и прогестероном». Журнал клинической эндокринологии и метаболизма . 22 (10): 1033–39 . doi :10.1210/jcem-22-10-1033. PMID 13942007.
- ^ ab Chu MC, Чжан X, Генцшайн Э, Станчик ФЗ, Лобо РА (июнь 2007 г.). «Образование этинилэстрадиола у женщин при лечении норэтиндрона ацетатом». Журнал клинической эндокринологии и метаболизма . 92 (6): 2205–07 . doi : 10.1210/jc.2007-0044 . ПМИД 17341557.
- ^ Коннолли А., Бриттон АГ. (2017). Здоровье женщин в первичной медицинской помощи. Cambridge University Press. С. 153–. ISBN 978-1-108-16595-2.
- ^ ab Farris M, Bastianelli C, Rosato E, Brosens I, Benagiano G (октябрь 2017 г.). «Фармакодинамика комбинированных эстроген-прогестиновых оральных контрацептивов: 2. влияние на гемостаз». Expert Review of Clinical Pharmacology . 10 (10): 1129– 44. doi :10.1080/17512433.2017.1356718. PMID 28712325. S2CID 205931204.
- ^ abcde Kuhl H (2011). "Фармакология прогестагенов" (PDF) . J Reproduktionsmed Endokrinol . 8 (1): 157– 77. Архивировано (PDF) из оригинала 11 октября 2016 г. . Получено 10 октября 2016 г. .
- ^ Чу Ю.Х., Ли QA, Чжао З.Ф., Чжоу Ю.П., Цао, округ Колумбия (июнь 1985 г.). «[Антипрогестагенное действие 5-альфа-дигидронорэтистерона]». Чжунго Яо Ли Сюэ Бао = Acta Pharmacologica Sinica (на китайском языке). 6 (2): 125–29 . PMID 2934946.
- ^ МакКьюстион LE, Ки JL, Хейс ER (2014). Фармакология: подход к сестринскому процессу, ориентированный на пациента. Elsevier Health Sciences. стр. 846–. ISBN 978-0-323-29348-8.
- ^ Гринблатт РБ (июль 1956 г.). «Прогестагенная активность 17-альфа-этинил-19-нортестостерона». Журнал клинической эндокринологии и метаболизма . 16 (7): 869–75 . doi :10.1210/jcem-16-7-869. PMID 13332050.
- ^ Fragkaki AG, Angelis YS, Koupparis M, Tsantili-Kakoulidou A, Kokotos G, Georgakopoulos C (февраль 2009 г.). «Структурные характеристики анаболических андрогенных стероидов, способствующие связыванию с рецептором андрогенов и их анаболической и андрогенной активности. Прикладные модификации стероидной структуры». Steroids . 74 (2): 172– 97. doi :10.1016/j.steroids.2008.10.016. PMID 19028512. S2CID 41356223.
Многие синтетические стероиды с высокой миотрофной активностью проявляют миотрофно-андрогенную диссоциацию, поскольку из-за изменений, внесенных в структуру кольца A, они, вероятно, не будут субстратами для 5α-редуктаз [85]. 5α-восстановление не всегда усиливает андрогенную активность, несмотря на высокую RBA андрогенов в AR. Это касается норэтистерона (рис. 1, 34), синтетического производного 19-нор-17α-этинилтестостерона, который также подвергается ферментативно-опосредованному 5α-восстановлению и оказывает сильное андрогенное действие на органы-мишени. 5α-восстановленный норэтистерон демонстрирует более высокую степень связывания с AR, но демонстрирует значительно более низкую андрогенную активность, чем неизмененный норэтистерон [102, 103].
- ^ abc Лемус А.Е., Энрикес Дж., Гарсиа Г.А., Грилласка I, Перес-Паласиос Дж. (январь 1997 г.). «5-альфа-восстановление норэтистерона повышает его аффинность связывания с рецепторами андрогенов, но снижает его андрогенную активность». Журнал биохимии стероидов и молекулярной биологии . 60 ( 1–2 ): 121–29 . doi :10.1016/s0960-0760(96)00172-0. PMID 9182866. S2CID 33771349.
- ^ Filshie M, Guillebaud J (2013). Контрацепция: наука и практика. Elsevier Science. стр. 26–. ISBN 978-1-4831-6366-6.
Норэтистерон связывается с ГСПГ с меньшим сродством, чем эндогенные андрогены и эстрогены [...]
- ^ Azziz R (2007). Расстройства, связанные с избытком андрогенов у женщин. Springer Science & Business Media. С. 124–. ISBN 978-1-59745-179-6.
- ^ Kuiper GG, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, et al. (март 1997). "Сравнение специфичности связывания лиганда и распределения транскриптов тканей эстрогеновых рецепторов альфа и бета". Эндокринология . 138 (3): 863–70 . doi : 10.1210/endo.138.3.4979 . PMID 9048584.
- ^ Wiegratz I, Kuhl H (сентябрь 2006 г.). «Метаболические и клинические эффекты прогестагенов». Европейский журнал контрацепции и репродуктивного здоровья . 11 (3): 153– 61. doi : 10.1080/13625180600772741. PMID 17056444. S2CID 27088428.
- ^ ab Giatti S, Melcangi RC, Pesaresi M (август 2016 г.). «Другая сторона прогестинов: эффекты в мозге». Журнал молекулярной эндокринологии . 57 (2): R109–26. doi : 10.1530/JME-16-0061 . PMID 27339142.
- ^ abc Ямамото Т., Тамура Т., Китаваки Дж., Осава Ю., Окада Х. (июнь 1994 г.). «Самоубийственная инактивация ароматазы в плаценте человека и лейомиоме матки 5-альфа-дигидронорэтиндроном, метаболитом норэтиндрона, и его влияние на ферменты, продуцирующие стероиды». Европейский журнал эндокринологии . 130 (6): 634–40 . doi :10.1530/eje.0.1300634. ПМИД 8205267.
- ^ Перуския М, Вильялон СМ, Наваррете Э, Гарсиа Г.А., Перес-Паласиос Г, Лемус А.Э. (август 2003 г.). «Сосудорасширяющий эффект норэтистерона и его 5 альфа-метаболитов: новое негеномное действие». Европейский журнал фармакологии . 475 ( 1–3 ): 161–69 . doi :10.1016/s0014-2999(03)02106-x. ПМИД 12954372.
- ^ ab Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H, et al. (октябрь 2013 г.). «Возможная роль PGRMC1 в развитии рака груди». Climacteric . 16 (5): 509– 13. doi :10.3109/13697137.2013.800038. PMID 23758160. S2CID 29808177.
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - ^ Trabert B, Sherman ME, Kannan N, Stanczyk FZ (апрель 2020 г.). «Прогестерон и рак груди». Endocrine Reviews . 41 (2): 320–44 . doi : 10.1210/endrev/bnz001 . PMC 7156851. PMID 31512725.
- ^ Anderson RA, Baird DT (декабрь 2002 г.). «Мужская контрацепция» (PDF) . Endocrine Reviews . 23 (6): 735– 62. doi : 10.1210/er.2002-0002 . PMID 12466187. Архивировано (PDF) из оригинала 28 августа 2021 г. . Получено 11 декабря 2019 г. .
- ^ ab Kamischke A, Nieschlag E (январь 2004 г.). «Прогресс в направлении гормональной мужской контрацепции». Trends in Pharmacological Sciences . 25 (1): 49– 57. doi :10.1016/j.tips.2003.11.009. PMID 14723979.
- ^ Rudel HW (сентябрь 1968). «Фармакология оральных контрацептивов». Клиническое акушерство и гинекология . 11 (3): 632– 44. doi :10.1097/00003081-196811030-00002. PMID 4878826.
- ^ Stanczyk FZ (ноябрь 2003 г.). «Не все прогестины созданы равными». Steroids . 68 ( 10– 13): 879– 90. doi :10.1016/j.steroids.2003.08.003. PMID 14667980. S2CID 44601264.
- ^ Endrikat J, Gerlinger C, Richard S, Rosenbaum P, Düsterberg B (декабрь 2011 г.). «Дозы прогестинов для ингибирования овуляции: систематический обзор доступной литературы и продаваемых во всем мире препаратов». Contraception . 84 (6): 549–57 . doi :10.1016/j.contraception.2011.04.009. PMID 22078182.
- ^ Shoupe D (1993). "Инъекционные контрацептивы и контрацептивные вагинальные кольца". Контрацепция . Клинические перспективы в акушерстве и гинекологии. Springer. стр. 144–57 . doi :10.1007/978-1-4612-2730-4_13. ISBN 978-1-4612-7645-6. ISSN 0178-0328.
- ^ Weiner E, Johansson ED (апрель 1975). "Уровни норэтиндрона в плазме после внутримышечной инъекции 200 мг норэтиндрона энантата". Contraception . 11 (4): 419–25 . doi :10.1016/0010-7824(75)90004-9. PMID 1122756.
- ^ Fotherby K, Howard G, Shrimanker K, Elder M, Bye PG (декабрь 1977 г.). «Влияние норэтистерона энантата на уровень гонадотропина в сыворотке». Contraception . 16 (6): 591– 604. doi :10.1016/0010-7824(77)90060-9. PMID 606499.
- ^ Goebelsmann U, Stanczyk FZ, Brenner PF, Goebelsmann AE, Gentzschein EK, Mishell DR (март 1979). "Концентрация норэтиндрона (NET) в сыворотке после внутримышечной инъекции энантата NET. Влияние на уровень ЛГ, ФСГ, эстрадиола и прогестерона в сыворотке". Contraception . 19 (3): 283– 313. doi :10.1016/0010-7824(79)90022-2. PMID 572279.
- ^ ab Neumann F, Diallo FA, Hasan SH, Schenck B, Traore I (1976). «Влияние фармацевтических соединений на мужскую фертильность». Andrologia . 8 (3): 203–35 . doi : 10.1111/j.1439-0272.1976.tb02137.x . PMID 793446. S2CID 24859886.
- ^ Heller CG, Laidlaw WM, Harvey HT, Nelson WO (июль 1958). «Влияние прогестагенных соединений на репродуктивные процессы у мужчин». Annals of the New York Academy of Sciences . 71 (5): 649– 65. doi :10.1111/j.1749-6632.1958.tb54641.x. PMID 13583821. S2CID 32637425.
- ^ Heller CG, Moore DJ, Paulsen CA, Nelson WO, Laidlaw WM (декабрь 1959 г.). «Влияние прогестерона и синтетических прогестинов на репродуктивную физиологию нормальных мужчин». Federation Proceedings . 18 : 1057–65 . PMID 14400846. Архивировано из оригинала 18 декабря 2018 г. Получено 11 декабря 2019 г.
- ^ Paulsen CA (март 1965). «Метаболизм прогестина: специальный справочник по эстрогенным путям». Метаболизм . 14 (3): SUPPL:313–19. doi :10.1016/0026-0495(65)90018-1. PMID 14261416.
- ^ Moudgal NR, Suresh R (1995). «Некоторые мысли о разработке химических мужских контрацептивов» (PDF) . Current Science (Бангалор) . 68 (4): 470– 74. ISSN 0011-3891. Архивировано из оригинала (PDF) 11 декабря 2019 г. . Получено 11 декабря 2019 г. .
- ^ Йохонсон Э.Д., Нигрен К.Г. (1973). «Снижение уровня тестостерона в плазме у мужчин с норэтиндроном». Контрацепция . 8 (3): 219–26 . doi :10.1016/0010-7824(73)90032-2. ISSN 0010-7824.
- ^ Zitzmann M, Rohayem J, Raidt J, Kliesch S, Kumar N, Sitruk-Ware R и др. (май 2017 г.). «Влияние различных прогестинов с трансдермальным тестостероном или без него на уровни гонадотропина для неинвазивной гормональной мужской контрацепции: рандомизированное клиническое исследование». Andrology . 5 (3): 516–26 . doi : 10.1111/andr.12328 . PMID 28189123. S2CID 41502711.
- ^ abcd Альварес BD (11 мая 2011 г.). Влияние дозы 50 мг энантато норетистерона и 5 мг валерато эстрадиола на нивелес де тестостерон Total en Hombres Mexicanos Sanos [ Влияние дозы 50 мг норэтистерона энантата и 5 мг эстрадиола валерата на общий уровень тестостерона у здоровых мексиканских мужчин ] (MSc). Национальный политехнический институт Мексики. Архивировано из оригинала 16 сентября 2022 года . Проверено 12 сентября 2022 г.
- ^ Amory JK (2003). «Андрогены и мужская контрацепция». Андрогены в здоровье и болезни . Современная эндокринология. Humana Press. стр. 405–17 . doi :10.1007/978-1-59259-388-0_21. ISBN 978-1-61737-314-5.
- ^ Kamischke A, Diebäcker J, Nieschlag E (сентябрь 2000 г.). «Потенциал норэтистерона энантата для мужской контрацепции: фармакокинетика и подавление функции гипофиза и гонад». Клиническая эндокринология . 53 (3): 351–58 . doi :10.1046/j.1365-2265.2000.01097.x. PMID 10971453. S2CID 70515136.
- ^ Петри Р., Мосс Дж., Сенге Т., Рауш-Штрооман Дж.Г. (1970). «Влияние ацетата ципротерона, энантата норэтистерона и капроната гестонорона на гипофизарно-гонадную ось у мужчин». Über den Einfluß von Cyproteronacetat, Norethisteronönanthat und Gestonoroncapronat auf die Hypophysen -Gonadenachse beim Mann [ Влияние ципротерон-ацетата, норэтистерона-энантата и гестонорона-капроната на гипофизарно-гонадную ось у мужчин ]. Симпозиум der Deutschen Gesellschaft für Endokrinologie в Ульме, 26–28 февраля 1970 г. Springer. стр. 428–30 . doi : 10.1007/978-3-642-80591-2_118. ISBN 9783642805912.
{{cite book}}:|journal=проигнорировано ( помощь ) - ^ ab Die Gestagene. Спрингер-Верлаг. 2013. стр. 13–14 , 283–84 . ISBN. 978-3-642-99941-3. Архивировано из оригинала 10 января 2023 . Получено 19 сентября 2018 .
- ^ Саперштейн С., Эдгрен Р.А., Юнг Д., Мрошчак Э.Дж., Ли Г.Дж., Дорр А. и др. (декабрь 1989 г.). «Фармакокинетика норэтиндрона: влияние размера частиц». Контрацепция . 40 (6): 731–40 . doi :10.1016/0010-7824(89)90075-9. ПМИД 2620531.
- ^ Фридрих С., Берсе М., Кляйн С., Роде Б., Хёхель Дж. (июнь 2018 г.). «Образование этинилэстрадиола in vivo после внутримышечного введения норэтистерона энантата». Журнал клинической фармакологии . 58 (6): 781–89 . doi :10.1002/jcph.1079. PMID 29522253. S2CID 3813229.
- ^ Thijssen JH (1972). «Метаболизм орально активных синтетических прогестагенных соединений». В Tausk M (ред.). Фармакология эндокринной системы и родственные препараты: прогестерон, прогестагенные препараты и противозачаточные средства. Том II. Pergamon Press. С. 217–73 . ISBN 978-0080168128. OCLC 278011135.
- ^ Окада Х (2010). «Рецепторы и механизм действия синтетических прогестагенов». Asia-Oceania Journal of Obstetrics and Gynaecology . 7 (1): 15– 27. doi :10.1111/j.1447-0756.1981.tb00511.x. ISSN 0389-2328.
- ^ Briggs MH (1980). «Сравнительная фармакодинамика и фармакокинетика контрацептивных стероидов у животных и человека: выборочный обзор». Клиническая фармакология и терапия . Palgrave Macmillan UK. стр. 493–518 . doi :10.1007/978-1-349-05952-2_57. ISBN 978-1-349-05954-6.
- ^ Thomas JA, Keenan EJ (1986). «Прогестины и оральные контрацептивы». Принципы эндокринной фармакологии . Springer. стр. 167–96 . doi :10.1007/978-1-4684-5036-1_8. ISBN 978-1-4684-5036-1.
- ^ Orme ML, Back DJ, Breckenridge AM (1983). «Клиническая фармакокинетика оральных контрацептивных стероидов». Clinical Pharmacokinetics . 8 (2): 95– 136. doi :10.2165/00003088-198308020-00001. PMID 6342899. S2CID 43298472.
- ^ Fotherby K (1974). «Метаболизм синтетических стероидов у животных и человека». Acta Endocrinologica. Supplementum . 185 : 119–47 . doi :10.1530/acta.0.075s119. PMID 4206183.
- ^ Kuhl H, Wiegratz I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Climacteric . 10 (4): 344–53 . doi :10.1080/13697130701380434. PMID 17653961. S2CID 20759583.
- ^ Stanczyk FZ, Roy S (июль 1990). «Метаболизм левоноргестрела, норэтиндрона и структурно родственных контрацептивных стероидов». Контрацепция . 42 (1): 67–96 . doi :10.1016/0010-7824(90)90093-B. PMID 2143719.
- ^ ab Schoonen WG, Deckers GH, de Gooijer ME, de Ries R, Kloosterboer HJ (ноябрь 2000 г.). «Гормональные свойства норэтистерона, 7альфа-метил-норэтистерона и их производных». Журнал стероидной биохимии и молекулярной биологии . 74 (4): 213– 22. doi :10.1016/s0960-0760(00)00125-4. PMID 11162927. S2CID 19797254.
[...] несколько моно- и дисульфатированных, а также моно- и диглюкуронидированных метаболитов НЭТ были обнаружены в моче женщин, лечившихся от НЭТ [16,17]. В неконъюгированной форме эти метаболиты NET (или MeNET) представлены 5α- и 5β-восстановленными NET (5α-NET или 5β-NET) и 3α- и 3β-гидрогенизированными 5α-NET и 5β-NET, что приводит к 3α,5α-NET, 3β,5α-NET, 3α,5β-NET и 3β,5β-NET или их соответствующим метаболитам MeNET (рис. 1 и 2). Эти стероидные превращения NET или MeNET могут происходить в печени, а также в гипофизе, эндометрии, простате, влагалище и груди. Ферментами, участвующими в этих метаболических процессах, являются 5α- и 5β-редуктаза, а также 3α- и 3β-гидроксистероиддегидрогеназа (HSD).
- ^ Чавес Б.А., Вильчис Ф., Перес А.Е., Гарсиа Г.А., Грилласка I, Перес-Паласиос Г (январь 1985 г.). «Стереоспецифичность внутриклеточного связывания норэтистерона и его метаболитов с восстановленным А-кольцом». Журнал биохимии стероидов . 22 (1): 121–26 . doi : 10.1016/0022-4731(85)90151-7 . ПМИД 3871879.
- ^ Гарса-Флорес Дж., Вилчис Ф., Гарсиа Г.А., Менхивар М., Перес-Паласиос Г. (июнь 1986 г.). «Уменьшение А-кольца усиливает антигонадотропную активность норэтистерона». Акта Эндокринологика . 112 (2): 278–83 . doi :10.1530/acta.0.1120278. ПМИД 3090814.
- ^ Лемус А.Е., Энрикес Дж., Эрнандес А., Сантильян Р., Перес-Паласиос Г. (февраль 2009 г.). «Биоконверсия норэтистерона, агониста рецептора прогестерона, в агонисты рецепторов эстрогена в остеобластных клетках». Журнал эндокринологии . 200 (2): 199–206 . doi : 10.1677/JOE-08-0166 . ПМИД 19008332.
- ^ Scarsi KK, Darin KM, Chappell CA, Nitz SM, Lamorde M (ноябрь 2016 г.). «Взаимодействие лекарственных средств, эффективность и безопасность гормональных контрацептивов у женщин, живущих с ВИЧ». Drug Safety . 39 (11): 1053– 72. doi :10.1007/s40264-016-0452-7. PMC 5048570 . PMID 27562873.
- ^ ДеГрут ЖЖ (2001). Эндокринология. WB Saunders Co. p. 2617. ИСБН 978-0-7216-7843-6.
- ^ abcde Elks J (2014). Словарь лекарств: химические данные: химические данные, структуры и библиографии. Springer. стр. 886–. ISBN 978-1-4757-2085-3. Архивировано из оригинала 10 января 2023 . Получено 5 октября 2016 .
- ^ Chwalisz K, Surrey E, Stanczyk FZ (июнь 2012 г.). «Гормональный профиль норэтиндрона ацетата: обоснование для прикрытия терапии агонистами гонадотропин-рилизинг-гормона у женщин с эндометриозом». Reproductive Sciences . 19 (6): 563–71 . doi :10.1177/1933719112438061. PMID 22457429. S2CID 2882899.
- ^ Shoupe D, Haseltine FP (2012). Контрацепция. Springer Science & Business Media. стр. 112–. ISBN 978-1-4612-2730-4.
- ^ Райан К.Дж. (1999). Гинекология Кистнера и женское здоровье. Мосби. стр. 292. ISBN 978-0-323-00201-1.
- ^ Hammerstein J (декабрь 1990 г.). «Пролекарства: преимущество или недостаток?». American Journal of Obstetrics and Gynecology . 163 (6 Pt 2): 2198– 203. doi :10.1016/0002-9378(90)90561-K. PMID 2256526.
- ^ Edelman AB, Cherala G, Stanczyk FZ (октябрь 2010 г.). «Метаболизм и фармакокинетика контрацептивных стероидов у женщин с ожирением: обзор». Contraception . 82 (4): 314–23 . doi :10.1016/j.contraception.2010.04.016. PMID 20851224.
- ^ Raynaud JP, Ojasoo T (ноябрь 1986 г.). «Разработка и использование антагонистов половых стероидов». Journal of Steroid Biochemistry . 25 (5B): 811– 33. doi :10.1016/0022-4731(86)90313-4. PMID 3543501.
Подобный андрогенный потенциал присущ норэтистерону и его пролекарствам (норэтистерона ацетат, этинодиол диацетат, линестренол, норэтинодрел, квингестанол [ацетат]).
- ^ ab Frank B. Colton, патент США 2,655,518 (1952, Searle & Co).
- ^ Ringold HJ, Rosenkranz G, Sondheimer F (1956). "Стероиды. LXXX.11-Метил-19-нортестостерон и 1-Метил-17α-этинил-19-нортестостерон". Журнал Американского химического общества . 78 (11): 2477– 79. Bibcode : 1956JAChS..78.2477R. doi : 10.1021/ja01592a037.
- ^ Юбервассер Х., Хойслер К., Кальвода Дж., Мейстре С., Виланд П., Аннер Г. и др. (1963). «19-Норстероид II. Ein einfaches Herstellungsverfahren für 19-Norandrostan-Derivate. über Steroide, 193. Mitteilung». Helvetica Chimica Acta . 46 : 344–52 . doi : 10.1002/hlca.19630460135.
- ^ Онкен Д., Хойблен Д. (январь 1970 г.). «[Этинилированные стероиды]». Die Pharmazie . 25 (1): 3–9 . PMID 4914401.
- ^ Патент США 2,744,122
- ^ Патент США 2,774,777
- ^ Буллоу В. Л. (2001). Энциклопедия контроля рождаемости. ABC-CLIO. С. 145–. ISBN 978-1-57607-181-6. Архивировано из оригинала 10 января 2023 . Получено 27 ноября 2016 .
- ^ Moskowitz EH, Jennings B (1996). Принудительная контрацепция?: Моральные и политические проблемы длительного контроля рождаемости. Georgetown University Press. С. 40–. ISBN 978-1-58901-807-5.
- ^ Nieschlag E (ноябрь 2010 г.). «Клинические испытания мужской гормональной контрацепции» (PDF) . Контрацепция . 82 (5): 457– 70. doi :10.1016/j.contraception.2010.03.020. PMID 20933120. Архивировано (PDF) из оригинала 5 декабря 2020 г. . Получено 28 декабря 2018 г. .
- ^ Нишлаг Э, Бере Х.М., Нишлаг Э., Бере Х.М., Нишлаг С. (2012). Нишлаг Э., Бере Х.М., Нишлаг С. (ред.). «Основная роль тестостерона в гормональной мужской контрацепции». Тестостерон : 470–93 . doi : 10.1017/CBO9781139003353.023. ISBN 9781139003353.
- ^ Бенаджиано Г, Примьеро ФМ (июнь 1983). «Продолжительно действующие контрацептивы. Текущее состояние». Лекарственные средства . 25 (6): 570– 609. doi :10.2165/00003495-198325060-00003. PMID 6223801. S2CID 45898359.
Дальнейшее чтение
- Brogden RN, Speight TM, Avery GS (1973). «Прогестаген-чистые оральные контрацептивы: предварительный отчет о действии и клиническом использовании норгестрела и норэтистерона». Drugs . 6 (3): 169– 81. doi :10.2165/00003495-197306030-00004. PMID 4130566. S2CID 42295736.
- «Норетистерон и норэтистерона ацетат». Монографии МАИР по оценке канцерогенного риска химических веществ для человека . 21 : 441–60 . Декабрь 1979 г. PMID 120838.
- Stanczyk FZ, Roy S (июль 1990). «Метаболизм левоноргестрела, норэтиндрона и структурно родственных контрацептивных стероидов». Контрацепция . 42 (1): 67– 96. doi :10.1016/0010-7824(90)90093-b. PMID 2143719.
- Wiseman LR, McTavish D (март 1994). «Трансдермальный эстрадиол/норэтистерон. Обзор его фармакологических свойств и клинического применения у женщин в постменопаузе». Drugs & Aging . 4 (3): 238–56 . doi :10.2165/00002512-199404030-00006. PMID 8199397. S2CID 68007924.
- Taitel HF, Kafrissen ME (1995). «Норэтиндрон – обзор терапевтических применений». Международный журнал исследований фертильности и менопаузы . 40 (4): 207–23 . PMID 8520623.
- Maier WE, Herman JR (август 2001 г.). «Фармакология и токсикология этинилэстрадиола и норэтиндрона ацетата у экспериментальных животных». Regulatory Toxicology and Pharmacology . 34 (1): 53– 61. doi :10.1006/rtph.2001.1483. PMID 11502156.
- Riis BJ, Lehmann HJ, Christiansen C (октябрь 2002 г.). «Ацетат норэтистерона в сочетании с эстрогеном: воздействие на скелет и другие органы. Обзор». American Journal of Obstetrics and Gynecology . 187 (4): 1101– 16. doi :10.1067/mob.2002.122852. PMID 12389012.
- Draper BH, Morroni C, Hoffman M, Smit J, Beksinska M, Hapgood J, et al. (Июль 2006 г.). «Депо-медроксипрогестерон против норэтистерона энантата для длительной прогестагенной контрацепции». База данных систематических обзоров Cochrane . 2012 (3): CD005214. doi : 10.1002 /14651858.CD005214.pub2. PMC 11491191. PMID 16856087.
- Kuhl H, Wiegratz I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Climacteric . 10 (4): 344–53 . doi :10.1080/13697130701380434. PMID 17653961. S2CID 20759583.
- Casey CL, Murray CA (2008). «Обновление HT: в центре внимания комбинированная терапия эстрадиола/норэтиндрона ацетата». Клинические вмешательства в старение . 3 (1): 9–16 . doi : 10.2147/cia.s1663 . PMC 2544373. PMID 18488874 .
- Paulen ME, Curtis KM (октябрь 2009 г.). «Когда женщина может повторно принимать инъекционные препараты, содержащие только прогестоген — депо медроксипрогестерона ацетат или норэтистерона энантат?». Контрацепция . 80 (4): 391– 408. doi :10.1016/j.contraception.2009.03.023. PMID 19751863.
- Chwalisz K, Surrey E, Stanczyk FZ (июнь 2012 г.). «Гормональный профиль норэтиндрона ацетата: обоснование для прикрытия терапии агонистами гонадотропин-рилизинг-гормона у женщин с эндометриозом». Reproductive Sciences . 19 (6): 563–71 . doi :10.1177/1933719112438061. PMID 22457429. S2CID 2882899.

![Уровни норэтистерона и этинилэстрадиола в течение 24 часов после однократного перорального приема 10 мг норэтистерона ацетата у женщин в постменопаузе.[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png)
![Уровни норэтистерона и этинилэстрадиола в течение 8 недель после однократной внутримышечной инъекции 200 мг норэтистерона энантата у женщин в пременопаузе.[94]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png)

