Асимметричное гидрирование
Асимметричное гидрирование — это химическая реакция, которая добавляет два атома водорода к целевой молекуле (субстрату) с трехмерной пространственной селективностью . Что особенно важно, эта селективность исходит не от самой целевой молекулы, а от других реагентов или катализаторов, присутствующих в реакции. Это позволяет пространственной информации (то, что химики называют хиральностью ) передаваться от одной молекулы к цели, образуя продукт в виде одного энантиомера . Хиральная информация чаще всего содержится в катализаторе, и в этом случае информация в одной молекуле катализатора может передаваться многим молекулам субстрата, усиливая количество присутствующей хиральной информации. Похожие процессы происходят в природе, где хиральная молекула, такая как фермент, может катализировать введение хирального центра, чтобы дать продукт в виде одного энантиомера, такого как аминокислоты , которые необходимы клетке для функционирования. Имитируя этот процесс, химики могут генерировать много новых синтетических молекул, которые взаимодействуют с биологическими системами определенным образом, что приводит к появлению новых фармацевтических агентов и агрохимикатов . Важность асимметричного гидрирования как в академических кругах, так и в промышленности способствовала тому, что двое его пионеров — Уильям Стэндиш Ноулз и Рёдзи Ноёри — были совместно удостоены половины Нобелевской премии по химии 2001 года . [1]
История
В 1956 году было показано, что гетерогенный катализатор, изготовленный из палладия, нанесенного на шелк, осуществляет асимметричное гидрирование. [2] Позднее, в 1968 году, группы Уильяма Ноулза и Леопольда Хорнера независимо друг от друга опубликовали примеры асимметричного гидрирования с использованием гомогенных катализаторов . Хотя эти ранние реакции демонстрировали лишь скромные энантиомерные избытки , они продемонстрировали осуществимость. К 1972 году был достигнут энантиомерный избыток в 90%, и с использованием этой технологии начался первый промышленный синтез препарата от болезни Паркинсона L-DOPA . [3] [4]

Область асимметричного гидрирования продолжала переживать ряд заметных достижений. Анри Каган разработал DIOP , легко приготовляемый C 2 -симметричный дифосфин, который давал высокие ee в определенных реакциях. Рёдзи Ноёри представил катализаторы на основе рутения для асимметричных гидрированных полярных субстратов, таких как кетоны и альдегиды. Роберт Х. Крэбтри продемонстрировал способность соединений иридия катализировать реакции асимметричного гидрирования в 1979 году, изобретя катализатор Крэбтри . [5] В начале 1990-х годов введение лигандов P,N несколькими группами независимо затем еще больше расширило область применения C 2 -симметричных лигандов, хотя они принципиально не превосходят хиральные лиганды, не обладающие вращательной симметрией . [6]
Сегодня асимметричное гидрирование является рутинной методологией в лабораторной и промышленной органической химии. Важность асимметричного гидрирования была признана Нобелевской премией по химии 2001 года, присужденной Уильяму Стэндишу Ноулзу и Рёдзи Ноёри .
Механизм
Асимметричные гидрирования работают по обычным механизмам, используемым для других гидрирований. Это включает механизмы внутренней сферы, механизмы внешней сферы и механизмы метатезиса σ-связей. [7] Тип механизма, используемого катализатором, во многом зависит от лигандов, используемых в системе, что, в свою очередь, приводит к определенным сродствам катализатора к субстрату.
Механизмы внутренней сферы
Так называемый механизм внутренней сферы подразумевает координацию алкена с металлическим центром. [8] Другие характеристики этого механизма включают тенденцию к гомолитическому расщеплению дигидрогена, когда присутствуют более богатые электронами, низковалентные металлы, в то время как бедные электронами, высоковалентные металлы обычно демонстрируют гетеролитическое расщепление дигидрогена с помощью основания. [9]
На схеме ниже показаны целевые механизмы каталитического гидрирования с комплексами родия , которые являются механизмами внутренней сферы. В ненасыщенном механизме образующийся хиральный продукт будет иметь противоположный режим по сравнению с используемым катализатором. В то время как термодинамически благоприятный комплекс между катализатором и субстратом не может подвергаться гидрированию, нестабильный, неблагоприятный комплекс быстро подвергается гидрированию. [10] С другой стороны, дигидридный механизм рассматривает комплекс изначально гидрированным до дигидридной формы. Это впоследствии позволяет координировать двойную связь на незатрудненной стороне. Благодаря вставке и восстановительному элиминированию хиральность продукта соответствует хиральности лиганда. [11]
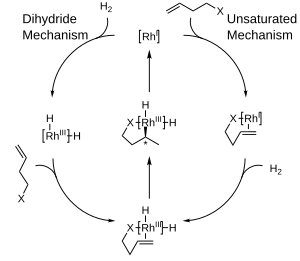
Предпочтительность получения одного энантиомера вместо другого в этих реакциях часто объясняется в терминах стерических взаимодействий между лигандом и прохиральным субстратом. Рассмотрение этих взаимодействий привело к разработке квадрантных диаграмм, где «заблокированные» области обозначены затененным квадратом, в то время как «открытые» области остаются незаполненными. В моделируемой реакции большие группы на входящем олефине будут стремиться ориентироваться, чтобы заполнить открытые области диаграммы, в то время как меньшие группы будут направлены в заблокированные области, и затем подача водорода будет происходить на заднюю поверхность олефина, фиксируя стереохимию . Обратите внимание, что для ясности показана только часть хирального фосфинового лиганда.

Внешние сферические механизмы
Некоторые катализаторы работают по «механизмам внешней сферы», так что субстрат никогда не связывается напрямую с металлом, а взаимодействует с его лигандами, которые часто представляют собой гидрид металла и протонный водород на лиганде. Таким образом, в большинстве случаев дигидроген расщепляется гетеролитически, причем металл действует как кислота Льюиса, а внешнее или внутреннее основание «депротонирует» гидрид. [7]

В качестве примера этого механизма можно рассмотреть систему BINAP-Ru-диамин. Дигалогенидная форма катализатора преобразуется в катализаторы реакцией H 2 в присутствии основания: [12]
- RuCl 2 (BINAP)(диамин) + 2 KOBu-t + 2 H 2 → RuH 2 (BINAP)(диамин) + 2 KCl + 2 HOBu-t
Полученные катализаторы имеют три вида лигандов:
- гидриды, которые переходят на ненасыщенный субстрат
- диамины, которые взаимодействуют с субстратом и активатором основания посредством второй координационной сферы
- дифосфин, который обеспечивает асимметрию.
Катализаторы «класса Нойори» часто называют бифункциональными катализаторами, чтобы подчеркнуть тот факт, что и металл, и лиганд (амин) являются функциональными. [13]
При гидрировании субстратов, содержащих C=O, долгое время предполагалось, что механизм работает посредством шестичленного перициклического переходного состояния /промежуточного продукта, в котором гидридо-рутениевый гидридный центр ( HRu -N H ) взаимодействует с карбонильным субстратом R 2 C = O . [14] Более поздние DFT и экспериментальные исследования показали, что эта модель в значительной степени неверна. Вместо этого аминная основа сильно взаимодействует с базовым активатором, который часто используется в большом избытке. [12] Однако в обоих случаях субстрат не связывается напрямую с металлическим центром, что делает его прекрасным примером механизма внешней сферы.
Металлы
Практические AH используют катализаторы на основе платиновых металлов. [15] [16] [17]
Базовые металлы
Железо является популярной целью исследований для многих каталитических процессов, в основном из-за его низкой стоимости и низкой токсичности по сравнению с другими переходными металлами. [18] Были реализованы методы асимметричного гидрирования с использованием железа, хотя с точки зрения скоростей и селективности они уступают катализаторам на основе драгоценных металлов. [19] В некоторых случаях структурно плохо определенные наночастицы оказались активными частицами in situ , и наблюдаемая скромная селективность может быть результатом их неконтролируемой геометрии. [20]
Классы лигандов
Фосфиновые лиганды
Хиральные фосфиновые лиганды, особенно C 2 -симметричные лиганды , являются источником хиральности в большинстве асимметричных катализаторов гидрирования. Из них лиганд BINAP хорошо известен в результате его применения в асимметричном гидрировании Нойори , за которое он получил Нобелевскую премию . [3]
Хиральные фосфиновые лиганды можно в целом классифицировать как моно- или бидентатные . Их можно дополнительно классифицировать в соответствии с расположением стереогенного центра – фосфора против органических заместителей. Лиганды с элементом симметрии C 2 были особенно популярны, отчасти потому, что присутствие такого элемента резко снижает возможные конформации связывания субстрата с комплексом металл-лиганд (часто приводя к исключительной энантиоселективности). [21]
Монодентатные фосфины
Лиганды типа монофосфина были одними из первых, которые появились в асимметричном гидрировании, например, лиганд CAMP. [22] Продолжение исследований этих типов лигандов изучило как лиганды, связанные с P -алкилом, так и лиганды, связанные с P -гетероатомом, причем лиганды с P -гетероатомом, такие как фосфиты и фосфорамидиты, как правило, достигают более впечатляющих результатов. [23] Структурные классы лигандов, которые были успешными, включают те, которые основаны на бинафтильной структуре MonoPHOS [24] или спирокольцевой системе SiPHOS. [25] Примечательно, что эти монодентатные лиганды могут использоваться в сочетании друг с другом для достижения синергического улучшения энантиоселективности; [26] что невозможно с дифосфиновыми лигандами . [23]
Хиральные дифосфиновые лиганды
Дифосфиновые лиганды получили значительно больше внимания, чем монофосфины, и, возможно, как следствие, имеют гораздо более длинный список достижений. Этот класс включает первый лиганд, достигший высокой селективности ( DIOP ), первый лиганд, который использовался в промышленном асимметричном синтезе ( DIPAMP [27] [28] [4] ) и, вероятно, самый известный хиральный лиганд (BINAP). [3] Хиральные дифосфиновые лиганды теперь повсеместно используются в асимметричном гидрировании.

Лиганды P,N и P,O
Использование лигандов P,N в асимметричном гидрировании можно проследить до симметричного бисоксазолинового лиганда C 2 . [29] Однако эти симметричные лиганды вскоре были вытеснены монооксазолиновыми лигандами , отсутствие симметрии C 2 которых никоим образом не ограничивает их эффективность в асимметричном катализе. [30] Такие лиганды обычно состоят из ахирального азотсодержащего гетероцикла, функционализированного с помощью подвешенного фосфорсодержащего плеча, хотя как точная природа гетероцикла, так и химическое окружение фосфорного центра сильно различались. Ни одна структура не оказалась последовательно эффективной с широким диапазоном субстратов, хотя были установлены некоторые привилегированные структуры (например, архитектура фосфин-оксазолин или PHOX ). [31] [30] [32] Более того, в пределах узко определенного класса субстратов производительность металлических комплексов с хиральными лигандами P,N может близко приближаться к идеальной конверсии и селективности в системах, которые в противном случае было бы очень трудно нацелить. [33] Некоторые комплексы, полученные из хелатирующих лигандов PO, показали многообещающие результаты в гидрировании α,β-ненасыщенных кетонов и эфиров. [34]
Лиганды NHC
Простые лиганды на основе N -гетероциклических карбенов (NHC) оказались непрактичными для асимметричного гидрирования.
Некоторые лиганды C,N объединяют NHC с хиральным оксазолином, образуя хелатирующий лиганд. [35] [36] Лиганды на основе NHC первого типа были получены в виде больших библиотек из реакции меньших библиотек отдельных NHC и оксазолинов. [35] [36] Катализаторы на основе NHC, характеризующиеся громоздким семичленным металлоциклом на иридии, были применены для каталитического гидрирования нефункционализированных олефинов [35] и винилэфирных спиртов с конверсиями и ее в высоких 80-х или 90-х годах. [37] Та же система была применена для синтеза ряда альдольных, [38] вицинальных диметиловых [39] и дезоксиполикетидных [40] мотивов, а также для самих дезоксиполикетидов. [41]
C 2 -симметричные NHC показали себя как очень полезные лиганды для асимметричного гидрирования. [42]
Ациклические субстраты
Субстраты можно классифицировать по их полярности. Среди неполярных субстратов преобладают алкены . Среди полярных субстратов — кетоны , енамины и кетимины .
Неполярные субстраты
[43]
Алкены, которые особенно поддаются асимметричному гидрированию, часто имеют полярную функциональную группу, смежную с местом гидрирования. При отсутствии этой функциональной группы катализ часто приводит к низким ee. Однако для некоторых нефункционализированных олефинов иридий с лигандами на основе P , N оказался эффективным. Субстраты алкенов часто классифицируются в соответствии с их заместителями, например, 1,1-дизамещенные, 1,2-диарилтризамещенные, 1,1,2-триалкил и тетразамещенные олефины. [44] [45] и даже внутри этих классов могут существовать вариации, которые делают различные решения оптимальными. [46]


В противоположность случаю олефинов, асимметричное гидрирование енаминов благоприятствует лигандам дифосфинового типа; отличные результаты были достигнуты с системами на основе как иридия, так и родия. Однако даже лучшие системы часто страдают от низких ee и отсутствия общности. Некоторые енамины ароматических кетонов, полученные из пирролидина, поддаются асимметричному гидрированию с катионными системами фосфонита родия(I), а также с системой I2 и уксусной кислоты со значениями ee обычно выше 90% и потенциально до 99,9%. [47] Похожая система с использованием иридия(I) и очень близкородственного лиганда фосфорамидита эффективна для асимметричного гидрирования енаминов пирролидинового типа, где двойная связь находится внутри кольца: другими словами, дигидропирролов. [48] В обоих случаях энантиоселективность существенно снизилась при увеличении размера кольца с пяти до шести.
Имины и кетоны

Кетоны и имины являются родственными функциональными группами, и эффективные технологии асимметричного гидрирования каждого из них также тесно связаны. Ранние примеры — это рутений-хиральная дифосфин-диаминовая система Нойори. [49] [50]
Для карбонильных и иминных субстратов координация end-on η 1 может конкурировать с модой η 2. Для субстратов, связанных с η 1 , водород-акцепторный углерод удаляется из катализатора и сопротивляется гидрированию. [51]
Системы на основе лиганда иридия/P,N оказались эффективными для некоторых кетонов и иминов. Например, последовательная система для бензильных арилиминов использует лиганд P,N SIPHOX в сочетании с иридием(I) в катионном комплексе для достижения асимметричного гидрирования с ee >90%. [52] Эффективным катализатором для кетонов ( число оборотов (TON) до 4 550 000 и ee до 99,9%) является система иридия(I) с близкородственным тридентатным лигандом . [53]

Катализатор BINAP/диамин-Ru эффективен для асимметричного восстановления как функционализированных, так и простых кетонов [54], а катализатор BINAP/диамин-Ru может катализировать ароматические , гетероароматические и олефиновые кетоны энантиоселективно. [55] Лучшая стереоселективность достигается, когда один заместитель больше другого (см. угол Флиппина-Лоджа ).

Ароматические субстраты
Асимметричное гидрирование ароматических (особенно гетероароматических ) субстратов является очень активной областью текущих исследований. Катализаторы в этой области должны бороться с рядом осложняющих факторов, включая тенденцию высокостабильных ароматических соединений противостоять гидрированию, потенциальные координационные (и, следовательно, отравляющие катализатор) способности как субстрата, так и продукта, а также большое разнообразие в схемах замещения, которые могут присутствовать в любом одном ароматическом кольце. [56] Из этих субстратов наиболее последовательный успех был замечен с азотсодержащими гетероциклами, где ароматическое кольцо часто активируется либо протонированием, либо дальнейшей функционализацией азота (обычно с помощью электроноакцепторной защитной группы). Такие стратегии менее применимы к кислород- и серосодержащим гетероциклам, поскольку они являются и менее основными, и менее нуклеофильными; эта дополнительная трудность может помочь объяснить, почему существует мало эффективных методов их асимметричного гидрирования.
Хинолины, изохинолины и хиноксалины
Существуют две системы для асимметричного гидрирования 2-замещенных хинолинов с изолированными выходами, как правило, более 80%, и значениями ee, как правило, более 90%. Первая — это система иридий(I)/хиральный фосфин/I 2 , впервые описанная Чжоу и др . [57] Хотя первым хиральным фосфином, использованным в этой системе, был MeOBiPhep, более новые итерации были сосредоточены на улучшении характеристик этого лиганда. С этой целью системы используют фосфины (или родственные лиганды) с улучшенной стабильностью на воздухе, [58] пригодностью для вторичной переработки, [58] простотой приготовления, [59] более низкой загрузкой катализатора [60] [61] и потенциальной ролью ахиральных фосфиновых добавок. [62] По состоянию на октябрь 2012 года, по-видимому, не было предложено никакого механизма, хотя были задокументированы как необходимость I 2 или суррогата галогена, так и возможная роль гетероароматического N в содействии реакционной способности. [56]
Вторая — это система органокаталитического переноса гидрирования на основе эфиров Ганча и хиральной кислоты Бренстеда . В этом случае авторы предполагают механизм, в котором изохинолин поочередно протонируется на этапе активации, а затем восстанавливается путем сопряженного присоединения гидрида из эфира Ганча. [63]
Большая часть химии асимметричного гидрирования хиноксалинов тесно связана с химией структурно подобных хинолинов . Эффективные (и действенные) результаты могут быть получены с помощью системы Ir(I)/фосфинит/I 2 [64] и органокаталитической системы на основе эфира Ганца [65], обе из которых похожи на системы, обсуждавшиеся ранее в отношении хинолинов.
Пиридины
Пиридины являются весьма изменчивыми субстратами для асимметричного восстановления (даже по сравнению с другими гетероароматическими соединениями), в том смысле, что пять углеродных центров доступны для дифференциального замещения на начальном кольце. По состоянию на октябрь 2012 года, похоже, не существует метода, который мог бы контролировать все пять, хотя существует по крайней мере один достаточно общий метод.
Наиболее общий метод асимметричного гидрирования пиридина на самом деле является гетерогенным методом, где асимметрия генерируется из хирального оксазолидинона, связанного с положением C2 пиридина. Гидрирование таких функционализированных пиридинов над рядом различных гетерогенных металлических катализаторов дало соответствующий пиперидин с заместителями в положениях C3, C4 и C5 в геометрии all- cis , с высоким выходом и превосходной энантиоселективностью. Вспомогательное вещество оксазолидинон также удобно расщепляется в условиях гидрирования. [66]

Методы, разработанные специально для гидрирования 2-замещенных пиридинов, могут включать асимметричные системы, разработанные для родственных субстратов, таких как 2-замещенные хинолины и хиноксалины. Например, система иридий(I)\хиральный фосфин\I 2 эффективна при асимметричном гидрировании активированных (алкилированных) 2-пиридиний [67] или некоторых циклогексанон-конденсированных пиридинов. [68] Аналогично, хиральный катализ кислотой Бренстеда с эфиром Ганца в качестве источника гидрида эффективен для некоторых 2-алкилпиридинов с дополнительным активирующим замещением. [69]
Индолы и пирролы
Асимметричное гидрирование индолов было установлено с защитой N -Boc . [70]

Система Pd(TFA) 2 /H8-BINAP обеспечивает энантиоселективное цис- гидрирование 2,3- и 2-замещенных индолов. [71] [72]

Подобно поведению индолов, пирролы могут быть преобразованы в пирролидины путем асимметричного гидрирования. [73]

Кислород- и серосодержащие гетероциклы
Асимметричное гидрирование фуранов и бензофуранов является сложной задачей. [74]
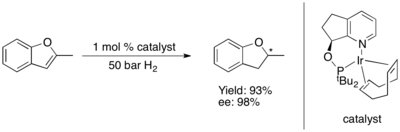
Асимметричное гидрирование тиофенов и бензотиофенов катализируется некоторыми комплексами рутения (II) N -гетероциклических карбенов (NHC). Эта система, по-видимому, обладает превосходной селективностью (ee > 90%) и идеальной диастереоселективностью (все цис ), если субстрат имеет конденсированное (или напрямую связанное) фенильное кольцо, но дает только рацемический продукт во всех других протестированных случаях. [75]

Гетерогенный катализ
Ни один гетерогенный катализатор для асимметрического гидрирования не был коммерциализирован.
Первая асимметричная гидрогенизация была сосредоточена на палладии, нанесенном на шелковую подложку. Алкалоиды хинного дерева использовались в качестве хиральных модификаторов для энантиоселективной гидрогенизации. [76]

Альтернативным методом, который позволяет лучше контролировать структурные и электронные свойства активных каталитических участков, является иммобилизация катализаторов, которые были разработаны для гомогенного катализа на гетерогенной подложке. Ковалентное связывание катализатора с полимером или другим твердым носителем, возможно, является наиболее распространенным, хотя иммобилизация катализатора может также быть достигнута путем адсорбции на поверхности, ионного обмена или даже физической инкапсуляции. Одним из недостатков этого подхода является потенциальная возможность того, что близость носителя изменит поведение катализатора, снижая энантиоселективность реакции. Чтобы избежать этого, катализатор часто связывают с носителем длинным линкером, хотя известны случаи, когда близость носителя может фактически улучшить производительность катализатора. [76]
Окончательный подход включает в себя построение MOF, которые включают хиральные реакционные центры из ряда различных компонентов, потенциально включая хиральные и ахиральные органические лиганды, структурные ионы металлов, каталитически активные ионы металлов и/или предварительно собранные каталитически активные органометаллические ядра. [77] Один из них включал катализаторы на основе рутения . Всего лишь 0,005 мол.% таких катализаторов оказалось достаточно для достижения асимметричного гидрирования арилкетонов, хотя обычные условия включали 0,1 мол.% катализатора и приводили к энантиомерному избытку 90,6–99,2%. [78]

Промышленное применение

Асимметричное гидрирование используется в производстве нескольких лекарственных препаратов, таких как антибактериальный левофлоксин, антибиотик карбапенем и антипсихотическое средство BMS181100. [15] [16] [17]

Исследования Ноулза в области асимметричного гидрирования и его применения в синтезе L-Dopa в промышленных масштабах [4] дали асимметричному гидрированию мощный старт в промышленном мире. Обзор 2001 года показал, что асимметричное гидрирование составило 50% производственных масштабов, 90% пилотных масштабов и 74% лабораторных каталитических, энантиоселективных процессов в промышленности, с оговоркой, что асимметричные каталитические методы в целом еще не получили широкого распространения. [79]
Асимметричное гидрирование заменило методы, основанные на кинетическом разделении, что привело к существенному повышению эффективности процесса. [12] можно увидеть в ряде конкретных случаев, когда, например, Roche Catalysis Group смогла достичь синтеза ( S , S )-Ro 67-8867 с общим выходом 53%, что является резким увеличением по сравнению с 3,5%, достигнутыми в синтезе, основанном на разделении. [80] Синтез мибефрадила компанией Roche был также улучшен путем замены разделения асимметричным гидрированием, что сократило количество стадий на три и увеличило выход ключевого промежуточного продукта до 80% с исходных 70%. [81]
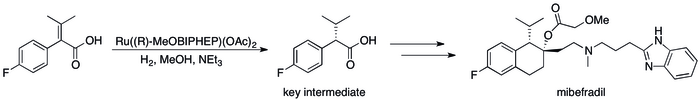
Катализаторы гидрирования, разработанные по методу Нойори, были применены для коммерческого синтеза ряда тонких химикатов. (R)-1,2-пропандиол, предшественник антибактериального левофлоксацина , может быть эффективно синтезирован из гидроксиацетона с использованием асимметричного гидрирования по методу Нойори: [17]

Новые пути фокусируются на гидрогенизации (R)-метиллактата . [ 12]
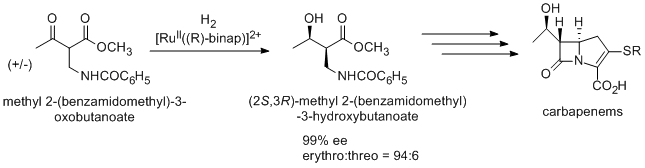
Антибиотик карбапенем также получают с помощью асимметричного гидрирования Нойори через (2S,3R)-метил 2-(бензамидометил)-3-гидроксибутаноат, который синтезируют из рацемического метил 2-(бензамидометил)-3-оксобутаноата методом динамического кинетического разделения .
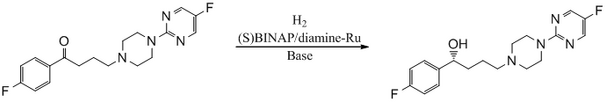
Антипсихотическое средство BMS 181100 синтезировано с использованием катализатора BINAP/диамин-Ru.
Ссылки
- ^ "Нобелевская премия по химии 2001 года". 2001-10-10.
- ^ Akabori, S.; Sakurai, S.; Izumi, Y.; Fujii, Y. (1956). "Асимметричный катализатор". Nature . 178 (4528): 323. Bibcode :1956Natur.178..323A. doi :10.1038/178323b0. PMID 13358737. S2CID 4221816.
- ^ abc Noyori, R. (2003). "Асимметричный катализ: наука и возможности (Нобелевская лекция 2001 г.)". Advanced Synthesis & Catalysis . 345 (12): 15– 41. doi :10.1002/adsc.200390002.
- ^ abc Knowles, WS (2002). "Асимметричные гидрирования (Нобелевская лекция)". Angewandte Chemie International Edition . 41 (12): 1998– 2007. doi :10.1002/1521-3773(20020617)41:12<1998::AID-ANIE1998>3.0.CO;2-8. PMID 19746594.
- ^ Крэбтри, Роберт (1979). «Соединения иридия в катализе». Accounts of Chemical Research . 12 (9): 331– 337. doi :10.1021/ar50141a005.
- ^ Pfaltz, A. (2004). "Асимметричный катализ. Специальная статья. Часть II: Разработка хиральных лигандов для асимметричного катализа: от C2-симметричных P,P- и N,N-лигандов до стерически и электронно несимметричных P,N-лигандов". Труды Национальной академии наук . 101 (16): 5723– 5726. Bibcode : 2004PNAS..101.5723P. doi : 10.1073/pnas.0307152101 . PMC 395974. PMID 15069193 .
- ^ ab de Vries, Johannes G.; Elsevier, Cornelis J., ред. (2006-10-20). Справочник по гомогенной гидрогенизации (1-е изд.). Wiley. doi :10.1002/9783527619382. ISBN 978-3-527-31161-3.
- ^ Гриднев, ИД; Имамото, Т. (2004). «О механизме стереоселекции в Rh-катализируемом асимметричном гидрировании: общий подход к прогнозированию смысла энантиоселективности». Accounts of Chemical Research . 37 (9): 633– 644. doi :10.1021/ar030156e. PMID 15379579.
- ^ Вэнь, Цзялинь; Ван, Фанюань; Чжан, Сюму (2021). «Асимметричное гидрирование, катализируемое комплексами переходных металлов первого ряда». Chemical Society Reviews . 50 (5): 3211– 3237. doi :10.1039/D0CS00082E. ISSN 0306-0012. PMID 33480901.
- ^ Гриднев, Илья Д.; Имамото, Цунео (2004-09-01). «О механизме стереоселекции при Rh-катализируемом асимметричном гидрировании: общий подход к прогнозированию смысла энантиоселективности». Accounts of Chemical Research . 37 (9): 633– 644. doi :10.1021/ar030156e. ISSN 0001-4842. PMID 15379579.
- ^ Имамото, Цунео; Тамура, Кен; Чжан, Чжэньфэн; Хориучи, Юми; Сугия, Масаши; Ёсида, Казухиро; Янагисава, Акира; Гриднев, Илья Д. (2012-01-25). "Жесткие P-хиральные фосфиновые лиганды с трет-бутилметилфосфиновыми группами для асимметричного гидрирования функционализированных алкенов, катализируемого родием". Журнал Американского химического общества . 134 (3): 1754– 1769. Bibcode : 2012JAChS.134.1754I. doi : 10.1021/ja209700j. ISSN 0002-7863. PMID 22192064.
- ^ abcd Dub, Pavel A.; Gordon, John C. (2018). «Роль металл-связанной функциональности N–H в молекулярных катализаторах типа Нойори». Nature Reviews Chemistry . 2 (12): 396– 408. doi :10.1038/s41570-018-0049-z. S2CID 106394152.
- ^ Ноёри, Рёдзи; Масаси Ямакава; Сёхэй Хашигучи (2001-11-01). «Бифункциональный катализ металл-лиганд: неклассический механизм асимметричного переноса водорода между спиртами и карбонильными соединениями». Журнал органической химии . 66 (24): 7931– 7944. doi :10.1021/jo010721w. PMID 11722188.
- ^ Окума, Т.; Оока, Х.; Икария, Т.; Нойори, Р. (1995), «Преимущественное гидрирование альдегидов и кетонов», Журнал Американского химического общества , 117 (41): 10417–10418 , Бибкод : 1995JAChS.11710417O, doi : 10.1021/ja00146a041
- ^ ab Ikariya, T.; Blacker, AJ (2007). "Асимметричное гидрирование кетонов с переносом с использованием молекулярных катализаторов на основе бифункциональных переходных металлов". Accounts of Chemical Research . 40 (12): 1300–1308 . doi :10.1021/ar700134q. PMID 17960897.
- ^ ab Pilkington, C.; Lennon, I. (2003). «Применение асимметричного гидрирования для производства фармацевтических промежуточных продуктов: необходимость разнообразия катализаторов». Синтез . 2003 (11): 1639. doi :10.1055/s-2003-40871.
- ^ abc Noyori, R. (2002), "Асимметричный катализ: наука и возможности (Нобелевская лекция)", Angewandte Chemie International Edition , 41 (12): 2008– 22, doi :10.1002/1521-3773(20020617)41:12<2008::aid-anie2008>3.0.co;2-4, PMID 19746595
- ^ Энталер, С.; Юнге, К.; Беллер, М. (2008). «Устойчивый металлический катализ с железом: от ржавчины до восходящей звезды?». Angewandte Chemie International Edition . 47 (18): 3317– 21. doi :10.1002/anie.200800012. PMID 18412184.
- ^ Михайлин, А.; Лоу, А.Дж.; Моррис, Р.Х. (2009). «Эффективное асимметричное гидрогенизирование кетонов с переносом, катализируемое комплексом железа, содержащим тетрадентатный лиганд P−N−N−P, образованный путем шаблонного синтеза». Журнал Американского химического общества . 131 (4): 1394– 1395. Bibcode : 2009JAChS.131.1394M. doi : 10.1021/ja809493h. PMID 19133772.
- ^ Зонненберг, Дж. Ф.; Кумбс, Н.; Дубе, ПА; Моррис, Р. Х. (2012). «Наночастицы железа, катализирующие асимметричное переносное гидрирование кетонов». Журнал Американского химического общества . 134 (13): 5893– 5899. Bibcode : 2012JAChS.134.5893S. doi : 10.1021/ja211658t. PMID 22448656.
- ^ Уайтселл, Дж. К. (1989). « Симметрия C 2 и асимметричная индукция». Chemical Reviews . 89 (7): 1581– 1590. doi :10.1021/cr00097a012.
- ^ Knowles, WS; Sabacky, MJ; Vineyard, BD (1972). «Каталитическое асимметричное гидрирование». Журнал химического общества, Chemical Communications . 214 (1): 119– 124. doi :10.1039/C39720000010. PMID 4270504.
- ^ ab Jerphagnon, T.; Renaud, JL; Bruneau, C. (2004). "Хиральные монодентатные фосфорные лиганды для асимметричного гидрирования, катализируемого родием". Tetrahedron: Asymmetry . 15 (14): 2101. doi :10.1016/j.tetasy.2004.04.037.
- ^ Ван Ден Берг, М.; Миннаард, Эй Джей; Шудде, Е.П.; Ван Эш, Дж.; Де Врис, AHM; Де Врис, JG; Феринга, Б.Л. (2000). «Высокоэнантиоселективное родий-катализируемое гидрирование с монодентатными лигандами» (PDF) . Журнал Американского химического общества . 122 (46):11539. Бибкод :2000ЯЧС.12211539В. дои : 10.1021/ja002507f. hdl : 11370/3c92d080-f024-45fe-b997-b100634bd612 . S2CID 95403641.
- ^ Fu, Y.; Xie, JH; Hu, AG; Zhou, H.; Wang, LX; Zhou, QL (2002). «Новые монодентатные спирофосфорные лиганды для реакций гидрирования, катализируемых родием». Chemical Communications (5): 480– 481. doi : 10.1039/B109827F. PMID 12120551.
- ^ Reetz, MT; Sell, T.; Meiswinkel, A.; Mehler, G. (2003). «Новый принцип в комбинаторном асимметричном катализе переходных металлов: смеси хиральных монодентатных P-лигандов». Angewandte Chemie International Edition . 42 (7): 790– 3. doi : 10.1002/anie.200390209 . PMID 12596201.
- ^ Vineyard, BD; Knowles, WS; Sabacky, MJ; Bachman, GL; Weinkauff, DJ (1977). "Асимметричное гидрирование. Родиевый хиральный бисфосфиновый катализатор". Журнал Американского химического общества . 99 (18): 5946. Bibcode : 1977JAChS..99.5946V. doi : 10.1021/ja00460a018.
- ^ Knowles, WS; Sabacky, MJ; Vineyard, BD; Weinkauff, DJ (1975). "Асимметричное гидрирование с комплексом родия и хирального бисфосфина". Журнал Американского химического общества . 97 (9): 2567. Bibcode : 1975JAChS..97.2567K. doi : 10.1021/ja00842a058.
- ^ Мюллер, Д.; Умбрихт, Г.; Вебер, Б.; Пфальц, А. (1991). "C 2 -симметричные 4,4',5,5'-тетрагидроби(оксазолы) и 4,4',5,5'-тетрагидро-2,2'-метиленбис[оксазолы] как хиральные лиганды для энантиоселективного катализа. Предварительная связь". Helvetica Chimica Acta . 74 : 232– 240. doi :10.1002/hlca.19910740123.
- ^ ab Helmchen, GN; Pfaltz, A. (2000). "PhosphinooxazolinesA New Class of Versatile, Modular P , N -Ligands for Asymmetric Catalysis". Accounts of Chemical Research . 33 (6): 336– 345. doi :10.1021/ar9900865. PMID 10891051.
- ^ Лайтфут, А.; Шнайдер, П.; Пфальц, А. (1998). «Энантиоселективное гидрирование олефинов с катализаторами на основе иридия-фосфонодигидрооксазола». Angewandte Chemie International Edition . 37 (20): 2897– 2899. doi :10.1002/(SICI)1521-3773(19981102)37:20<2897::AID-ANIE2897>3.0.CO;2-8. PMID 29711115.
- ^ Franzke, A.; Pfaltz, A. (2011). «Цвиттерионные комплексы иридия с P , N -лигандами как катализаторы асимметричного гидрирования алкенов». Химия: Европейский журнал . 17 (15): 4131– 44. doi :10.1002/chem.201003314. PMID 21381140.
- ^ Maurer, F.; Huch, V.; Ullrich, A.; Kazmaier, U. (2012). «Разработка катализаторов для стереоселективного гидрирования α,β-ненасыщенных кетонов». Журнал органической химии . 77 (11): 5139– 5143. doi :10.1021/jo300246c. PMID 22571628.
- ^ Рагео, Д.; Вудманси, Д.Х.; Пугин, Б.Т.; Пфальц, А. (2011). «Комплексы лиганда P,O на основе пролина/иридия как высокоселективные катализаторы: асимметричное гидрирование тризамещенных алкенов». Angewandte Chemie International Edition . 50 (41): 9598– 601. doi :10.1002/anie.201104105. PMID 21882320.
- ^ abc Perry, MC; Cui, X.; Powell, MT; Hou, DR; Reibenspies, JH; Burgess, K. (2003). "Оптически активные комплексы иридия имидазол-2-илиден-оксазолина: получение и использование в асимметричном гидрировании арилалкенов". Журнал Американского химического общества . 125 (1): 113– 123. Bibcode : 2003JAChS.125..113P. doi : 10.1021/ja028142b. PMID 12515512.
- ^ ab Nanchen, S.; Pfaltz, A. (2006). "Синтез и применение хиральных N-гетероциклических карбен-оксазолиновых лигандов: катализируемое иридием энантиоселективное гидрирование". Химия: Европейский журнал . 12 (17): 4550– 8. doi : 10.1002/chem.200501500 . PMID 16557626.
- ^ Чжу, И.; Берджесс, К. (2008). «Асимметричное гидрирование виниловых эфиров, катализируемое иридием». Advanced Synthesis & Catalysis . 350 ( 7–8 ): 979. doi :10.1002/adsc.200700546.
- ^ Чжао, Дж.; Берджесс, К. (2009). «Хироны альдольного типа из асимметричных гидрирований тризамещенных алкенов». Organic Letters . 11 (10): 2053– 2056. doi :10.1021/ol900308w. PMID 19368378.
- ^ Чжао, Дж.; Берджесс, К. (2009). «Синтез вицинальных диметилхиронов асимметричным гидрированием тризамещенных алкенов». Журнал Американского химического общества . 131 (37): 13236– 13237. Bibcode : 2009JAChS.13113236Z. doi : 10.1021/ja905458n. PMID 19719102.
- ^ Чжоу, Дж.; Берджесс, К. (2007). «Α,ω-функционализированные 2,4-диметилпентановые диады и 2,4,6-триметилгептановые триады посредством асимметричного гидрирования». Angewandte Chemie International Edition . 46 (7): 1129– 31. doi :10.1002/anie.200603635. PMID 17200966.
- ^ Zhou, J.; Zhu, Y.; Burgess, K. (2007). "Синтез ( S , R , R , S , R , S )-4,6,8,10,16,18-гексаметилдокозана из Antitrogus parvulus с помощью диастереоселективного гидрирования". Organic Letters . 9 (7): 1391– 1393. doi :10.1021/ol070298z. PMID 17338543.
- ^ Urban, S.; Ortega, N.; Glorius, F. (2011). «Ligand-Controlled Highly Regioselective and Asymmetric Hydrogenation of Quinoxalines Catalyzed by Ruthenium N -Heterocyclic Carbene Complexes». Angewandte Chemie International Edition . 50 (16): 3803– 6. doi :10.1002/anie.201100008. PMID 21442699.
- ^ Cui, X.; Burgess, K. (2005). «Каталитические гомогенные асимметричные гидрирования в значительной степени нефункционализированных алкенов». Chemical Reviews . 105 (9): 3272– 3296. doi :10.1021/cr0500131. PMID 16159153.
- ^ Pàmies, O.; Andersson, PG; Diéguez, M. (2010). «Асимметричное гидрирование минимально функционализированных терминальных олефинов: альтернативная устойчивая и прямая стратегия получения энантиообогащенных углеводородов». Химия: Европейский журнал . 16 (48): 14232– 40. doi :10.1002/chem.201001909. PMID 21140401.
- ^ Woodmansee, DH; Pfaltz, A. (2011). «Асимметричное гидрирование алкенов без координирующих групп». Chemical Communications . 47 (28): 7912– 7916. doi :10.1039/c1cc11430a. PMID 21556431.
- ^ Мазуэла, Дж.; Верендел, Джей Джей; Колл, М.; Шеффнер, Б.Н.; Бёрнер, А.; Андерссон, PG; ПаМис, О.; ДьеГез, М. (2009). «Иридий-фосфит-оксазолиновые катализаторы высокоэнантиоселективного гидрирования терминальных алкенов». Журнал Американского химического общества . 131 (34): 12344–12353 . Бибкод :2009ЯЧС.13112344М. дои : 10.1021/ja904152r. ПМИД 19658416.
- ^ Хоу, GH; Се, JH; Ван, LX; Чжоу, QL (2006). «Высокоэффективное Rh(I)-катализируемое асимметричное гидрирование енаминов с использованием монодентатных спирофосфонитных лигандов». Журнал Американского химического общества . 128 (36): 11774– 11775. Bibcode : 2006JAChS.12811774H. doi : 10.1021/ja0644778. PMID 16953614.
- ^ Хоу, GH; Се, JH; Ян, PC; Чжоу, QL (2009). «Асимметричное гидрирование циклических енаминов, катализируемое иридием». Журнал Американского химического общества . 131 (4): 1366– 1367. Bibcode : 2009JAChS.131.1366H. doi : 10.1021/ja808358r. PMID 19132836.
- ^ Noyori, R.; Ohkuma, T. (2001). «Асимметричный катализ с помощью архитектурной и функциональной молекулярной инженерии: практическое хемо- и стереоселективное гидрирование кетонов». Angewandte Chemie International Edition . 40 (1): 40–73 . doi : 10.1002/1521-3773(20010105)40:1<40::AID-ANIE40>3.0.CO;2-5 . PMID 11169691.
- ^ Hems, WP; Groarke, M.; Zanotti-Gerosa, A.; Grasa, GA (2007). "Комплексы [(Бисфосфин) Ru(II) диамина] в асимметричном гидрировании: расширение сферы применения лиганда диамина". Accounts of Chemical Research . 40 (12): 1340– 1347. doi :10.1021/ar7000233. PMID 17576143.
- ^ Ноёри, Р.; Ямакава, М.; Хашигучи, С. (2001). «Бифункциональный катализ металл-лиганд: неклассический механизм асимметричного переноса водорода между спиртами и карбонильными соединениями». Журнал органической химии . 66 (24): 7931– 7944. doi :10.1021/jo010721w. PMID 11722188.
- ^ Чжу, СФ; Сье, Дж. Б.; Чжан, И. З.; Ли, С.; Чжоу, К. Л. (2006). «Хорошо определенные хиральные спиро-иридий/фосфин-оксазолиновые катионные комплексы для высокоэнантиоселективного гидрирования иминов при давлении окружающей среды». Журнал Американского химического общества . 128 (39): 12886– 12891. Bibcode : 2006JAChS.12812886Z. doi : 10.1021/ja063444p. PMID 17002383.
- ^ Xie, JH; Liu, XY; Xie, JB; Wang, LX; Zhou, QL (2011). «Дополнительная координационная группа приводит к чрезвычайно эффективным хиральным иридиевым катализаторам для асимметричного гидрирования кетонов». Angewandte Chemie International Edition . 50 (32): 7329– 32. doi :10.1002/anie.201102710. PMID 21751315.
- ^ Окума, Т.; Оока, Х.; Ямакава, М.; Икария, Т.; Нойори, Р. (1996), «Стереоселективное гидрирование простых кетонов, катализируемое комплексами рутения (II)», Журнал органической химии , 61 (15): 4872–4873 , doi : 10.1021/jo960997h
- ^ Ноёри, Р.; Охума, Т. (2001), «Асимметричный катализ с помощью архитектурной и функциональной молекулярной инженерии: практическое хемо- и стереоселективное гидрирование кетонов», Angewandte Chemie International Edition , 40 (1): 40–73 , doi : 10.1002/1521-3773(20010105)40:1<40::aid-anie40>3.0.co;2-5 , PMID 11169691
- ^ ab Zhou, YG (2007). "Асимметричное гидрирование гетероароматических соединений". Accounts of Chemical Research . 40 (12): 1357– 1366. CiteSeerX 10.1.1.653.5495 . doi :10.1021/ar700094b. PMID 17896823.
- ^ Ван, ВБ; Лу, СМ; Ян, ПИ; Хан, XW; Чжоу, YG (2003). "Высокоэнантиоселективное иридиевое катализируемое гидрирование гетероароматических соединений, хинолинов". Журнал Американского химического общества . 125 (35): 10536– 10537. Bibcode : 2003JAChS.12510536W. CiteSeerX 10.1.1.651.3119 . doi : 10.1021/ja0353762. PMID 12940733.
- ^ ab Xu, L.; Lam, KH; Ji, J.; Wu, J.; Fan, QH; Lo, WH; Chan, ASC (2005). "Стабильный на воздухе комплекс Ir-(P-Phos) для высокоэнантиоселективного гидрирования хинолинов и их иммобилизация в диметиловом эфире полиэтиленгликоля (DMPEG)". Chemical Communications (11): 1390– 2. doi :10.1039/B416397D. hdl : 10397/8906 . PMID 15756313.
- ^ Lam, KH; Xu, L.; Feng, L.; Fan, QH; Lam, FL; Lo, WH; Chan, ASC (2005). "Высокоэнантиоселективное иридиевое катализируемое гидрирование производных хинолина с использованием хирального фосфинита H8-BINAPO". Advanced Synthesis & Catalysis . 347 (14): 1755. doi :10.1002/adsc.200505130. hdl : 10397/26878 .
- ^ Wang, ZJ; Deng, GJ; Li, Y.; He, YM; Tang, WJ; Fan, QH (2007). «Энантиоселективное гидрирование хинолинов, катализируемое дендримерами с сердцевиной Ir(BINAP): резкое усиление каталитической активности». Organic Letters . 9 (7): 1243– 1246. doi :10.1021/ol0631410. PMID 17328554.
- ^ Qiu, L.; Kwong, FY; Wu, J.; Lam, WH; Chan, S.; Yu, WY; Li, YM; Guo, R.; Zhou, Z.; Chan, ASC (2006). «Новый класс универсальных хирально-мостиковых атропизомерных дифосфиновых лигандов: удивительно эффективные синтезы лигандов и их применение в реакциях высокоэнантиоселективного гидрирования». Журнал Американского химического общества . 128 (17): 5955– 5965. Bibcode : 2006JAChS.128.5955Q. doi : 10.1021/ja0602694. hdl : 10397/60397 . PMID 16637664.
- ^ Reetz, MT; Li, X. (2006). «Асимметричное гидрирование хинолинов, катализируемое иридиевыми комплексами дифосфонитов, полученных из BINOL». Chemical Communications (20): 2159– 60. doi :10.1039/b602320g. PMID 16703140.
- ^ Rueping; Antonchick, A.; Theissmann, T. (2006). «Высокоэнантиоселективная каскадная реакция, катализируемая кислотой Бренстеда: органокаталитическое переносное гидрирование хинолинов и их применение в синтезе алкалоидов». Angewandte Chemie International Edition на английском языке . 45 (22): 3683– 3686. doi :10.1002/anie.200600191. PMID 16639754.
- ^ Tang, W.; Xu, L.; Fan, QH; Wang, J.; Fan, B.; Zhou, Z.; Lam, KH; Chan, ASC (2009). «Асимметричное гидрирование хиноксалинов с дифосфинитными лигандами: практический синтез энантиообогащенных, замещенных тетрагидрохиноксалинов». Angewandte Chemie International Edition . 48 (48): 9135– 8. doi :10.1002/anie.200904518. hdl : 10397/20432 . PMID 19876991.
- ^ Rueping, M.; Tato, F.; Schoepke, FR (2010). «Первое общее, эффективное и высокоэнантиоселективное восстановление хиноксалинов и хиноксалинонов». Химия: Европейский журнал . 16 (9): 2688– 91. doi :10.1002/chem.200902907. PMID 20140920.
- ^ Глориус, Ф.; Спилкамп, Н.; Холле, С.; Годдард, Р.; Леманн, CW (2004). «Эффективное асимметричное гидрирование пиридинов». Angewandte Chemie, международное издание . 43 (21): 2850– 2. doi :10.1002/anie.200453942. ПМИД 15150766.
- ^ Ye, ZS; Chen, MW; Chen, QA; Shi, L.; Duan, Y.; Zhou, YG (2012). «Асимметричное гидрирование солей пиридиния, катализируемое иридием». Angewandte Chemie International Edition . 51 (40): 10181– 4. doi :10.1002/anie.201205187. PMID 22969060.
- ^ Tang, WJ; Tan, J.; Xu, LJ; Lam, KH; Fan, QH; Chan, ASC (2010). "Высокоэнантиоселективное гидрирование производных хинолина и пиридина с катализатором Iridium-(P-Phos)". Advanced Synthesis & Catalysis . 352 (6): 1055. doi :10.1002/adsc.200900870. hdl : 10397/22884 .
- ^ Rueping, M.; Antonchick, AP (2007). «Органокаталитическое энантиоселективное восстановление пиридинов». Angewandte Chemie International Edition . 46 (24): 4562– 5. doi :10.1002/anie.200701158. PMID 17492817.
- ^ Baeza, A.; Pfaltz, A. (2010). "Иридий-катализируемое асимметричное гидрирование N -защищенных индолов". Химия: Европейский журнал . 16 (7): 2036– 9. doi :10.1002/chem.200903105. PMID 20104554.
- ^ Xiao, YC; Wang, C.; Yao, Y.; Sun, J.; Chen, YC (2011). «Прямое асимметричное гидросилилирование индолов: комбинированная активация основанием Льюиса и кислотой Бренстеда». Angewandte Chemie International Edition . 50 (45): 10661– 4. doi :10.1002/anie.201105341. PMID 21932274.
- ^ Дуань, И.; Чен, МВ; Йе, ЗС; Ван, ДС; Чен, КА; Чжоу, ИГ (2011). «Энантиоселективный подход к 2,3-дизамещенным индолинам посредством последовательных тандемных реакций, стимулируемых кислотой Бренстеда/комплексом палладия». Химия: Европейский журнал . 17 (26): 7193– 7. doi :10.1002/chem.201100576. PMID 21567504.
- ^ Wang, DS; Ye, ZS; Chen, QA; Zhou, YG; Yu, CB; Fan, HJ; Duan, Y. (2011). «Высокоэнантиоселективное частичное гидрирование простых пирролов: простой доступ к хиральным 1-пирролинам». Журнал Американского химического общества . 133 (23): 8866– 8869. Bibcode : 2011JAChS.133.8866W. doi : 10.1021/ja203190t. PMID 21591641.
- ^ Ван, DS; Чен, QA; Лу, SM; Чжоу, YG (2012). «Асимметричное гидрирование гетероаренов и аренов». Chemical Reviews . 112 (4): 2557– 2590. doi :10.1021/cr200328h. PMID 22098109.
- ^ Урбан, С.; Бейринг, Б.; Ортега, Н.; Пол, Д.; Глориус, Ф. (2012). «Асимметричное гидрирование тиофенов и бензотиофенов». Журнал Американского химического общества . 134 (37): 15241–15244 . Бибкод :2012ЯЧС.13415241У. дои : 10.1021/ja306622y. ПМИД 22934527.
- ^ аб Хейтбаум, М.; Глориус, Ф.; Эшер, И. (2006). «Асимметричный гетерогенный катализ». Angewandte Chemie, международное издание . 45 (29): 4732–62 . doi :10.1002/anie.200504212. ПМИД 16802397.
- ^ Юн, М.; Шрирамбаладжи, Р.; Ким, К. (2012). «Гомохиральные металл-органические каркасы для асимметричного гетерогенного катализа». Chemical Reviews . 112 (2): 1196– 1231. doi :10.1021/cr2003147. PMID 22084838.
- ^ Ху, А.; Нго, ХЛ; Лин, В. (2003). «Хиральные пористые гибридные твердые тела для практического гетерогенного асимметричного гидрирования ароматических кетонов». Журнал Американского химического общества . 125 (38): 11490– 11491. Bibcode : 2003JAChS.12511490H. doi : 10.1021/ja0348344. PMID 13129339.
- ^ Blaser, HU; Spindler, F.; Studer, M. (2001). «Энантиоселективный катализ в производстве тонких химикатов». Applied Catalysis A: General . 221 ( 1– 2): 119– 143. doi :10.1016/S0926-860X(01)00801-8. PMID 12613584.
- ^ Блазер, Ганс-Ульрих; Федерсель, Ханс-Юрген, ред. (2010). Асимметричный катализ в промышленных масштабах . Вайнхайм: Wiley-VCH. стр. 13–16 . doi : 10.1002/9783527630639. ISBN 978-3-527-63063-9.
- ^ Якобсен, EN; Пфальц, Андреас; Ямамато, Х., ред. (1999). Комплексный асимметричный катализ . Берлин; Нью-Йорк: Springer. стр. 1443–1445 . ISBN 978-3-540-64336-4.
