Неметалл
Эта статья может содержать цитаты , которые не подтверждают текст . Причина указана так: Проверка раздела критериев показала, что многие из них были неверными, поэтому все необходимо проверить. ( Август 2024 ) |
| Фрагмент периодической таблицы, в котором выделены неметаллы |
 |
| всегда/обычно считаются неметаллами [1] [2] [3] |
| металлоиды, иногда считающиеся неметаллами [а] |
| статус неметалла или металла не подтвержден [5] |
| Часть серии о |
| Периодическая таблица |
|---|
В контексте периодической таблицы неметалл — это химический элемент , который в основном не имеет отличительных металлических свойств. Они варьируются от бесцветных газов, таких как водород, до блестящих кристаллов, таких как йод . Физически они обычно легче (менее плотные), чем элементы, образующие металлы, и часто являются плохими проводниками тепла и электричества . Химически неметаллы имеют относительно высокую электроотрицательность или обычно притягивают электроны в химической связи с другим элементом, а их оксиды, как правило, являются кислотными .
Семнадцать элементов широко признаны неметаллами. Кроме того, некоторые или все шесть пограничных элементов ( металлоиды ) иногда считаются неметаллами.
Два самых легких неметалла, водород и гелий , вместе составляют около 98% массы наблюдаемой Вселенной . Пять неметаллических элементов — водород, углерод, азот , кислород и кремний — составляют большую часть атмосферы Земли , биосферы , коры и океанов .
Промышленное использование неметаллов включает электронику , хранение энергии , сельское хозяйство и химическое производство .
Большинство неметаллических элементов были идентифицированы в XVIII и XIX веках. Хотя различие между металлами и другими минералами существовало с античности, базовая классификация химических элементов как металлических или неметаллических появилась только в конце XVIII века. С тех пор было предложено около двадцати свойств в качестве критериев для различения неметаллов от металлов.
Определение и применимые элементы
- Если не указано иное, в данной статье описывается стабильная форма элемента при стандартной температуре и давлении (СТП). [b]

Неметаллические химические элементы часто описываются как не имеющие свойств, свойственных металлам, а именно блеска, пластичности, хорошей тепло- и электропроводности и общей способности образовывать основные оксиды. [8] [9] Не существует общепринятого точного определения; [10] любой список неметаллов открыт для обсуждения и пересмотра. [1] Включенные элементы зависят от свойств, которые считаются наиболее характерными для неметаллического или металлического характера.
Четырнадцать элементов почти всегда признаются неметаллами: [1] [2]
Еще три обычно классифицируются как неметаллы, но некоторые источники относят их к « металлоидам » [3], термин, который относится к элементам, считающимся промежуточными между металлами и неметаллами: [11]
Один или несколько из шести элементов, которые обычно считаются металлоидами, иногда относят к неметаллам:
Таким образом, около 15–20% из 118 известных элементов [12] классифицируются как неметаллы. [c]
Общие свойства
Физический
некоторых неметаллических элементов
Неметаллы сильно различаются по внешнему виду, будучи бесцветными, окрашенными или блестящими. Для бесцветных неметаллов (водорода, азота, кислорода и благородных газов) поглощения света в видимой части спектра не происходит, и весь видимый свет пропускается. [15] Цветные неметаллы (сера, фтор, хлор, бром) поглощают некоторые цвета (длины волн) и пропускают дополнительные или противоположные цвета. Например, «знакомый желто-зеленый цвет хлора... обусловлен широкой областью поглощения в фиолетовой и синей областях спектра». [16] [d] Блеск бора, графита (углерода), кремния, черного фосфора, германия, мышьяка, селена, сурьмы, теллура и йода [e] является результатом различной степени металлической проводимости, где электроны могут отражать входящий видимый свет. [19]
Около половины неметаллических элементов являются газами при стандартной температуре и давлении ; большинство остальных являются твердыми веществами. Бром, единственная жидкость, обычно покрыта слоем своих красновато-коричневых паров. Газообразные и жидкие неметаллы имеют очень низкие плотности, температуры плавления и кипения и являются плохими проводниками тепла и электричества. [20] Твердые неметаллы имеют низкие плотности и низкую механическую прочность (будучи либо твердыми и хрупкими, либо мягкими и рассыпчатыми), [21] и широкий диапазон электропроводности. [f]
Это разнообразие форм проистекает из изменчивости внутренних структур и связей. Ковалентные неметаллы, существующие в виде дискретных атомов, таких как ксенон, или в виде небольших молекул, таких как кислород, сера и бром, имеют низкие температуры плавления и кипения; многие из них являются газами при комнатной температуре, поскольку они удерживаются вместе слабыми силами дисперсии Лондона, действующими между их атомами или молекулами, хотя сами молекулы имеют сильные ковалентные связи. [25] Напротив, неметаллы, которые образуют протяженные структуры, такие как длинные цепи атомов селена [26] , слои атомов углерода в графите [27] или трехмерные решетки атомов кремния [28], имеют более высокие температуры плавления и кипения и все являются твердыми телами, поскольку для преодоления их более сильных связей требуется больше энергии. [29] [ сомнительный – обсудить ] Неметаллы, расположенные ближе к левой или нижней части периодической таблицы (и, следовательно, ближе к металлам), часто имеют металлические взаимодействия между своими молекулами, цепями или слоями; это происходит в боре, [30] углероде, [31] фосфоре, [32] мышьяке, [33] селене, [ 34] сурьме, [ 35] теллуре [36] и йоде. [37]
| Аспект | Металлы | Неметаллы |
|---|---|---|
| Внешний вид и форма | Блестящий, если свежеприготовленный или сломанный; немного окрашенный; [38] все, кроме одного, твердые [39] | Блестящий, цветной или прозрачный; [40] все, кроме одного, твердые или газообразные [39] |
| Плотность | Часто выше | Часто ниже |
| Пластичность | В основном ковкий и пластичный | Часто хрупкие твердые тела |
| Электропроводность [41 ] | Хороший | От плохого к хорошему |
| Электронная структура [42] | Металл или полуметалл | Полуметалл , полупроводник или изолятор |
Ковалентно связанные неметаллы часто делят только те электроны, которые требуются для достижения электронной конфигурации благородного газа. [43] Например, азот образует двухатомные молекулы с тройной связью между каждым атомом, оба из которых, таким образом, достигают конфигурации благородного газа неона. Больший размер атома сурьмы препятствует тройной связи, что приводит к образованию смятых слоев, в которых каждый атом сурьмы связан одинарно с тремя другими соседними атомами. [44]
Хорошая электропроводность возникает при наличии металлической связи , [45] однако электроны в неметаллах часто не являются металлическими. [45] Хорошая электро- и теплопроводность, связанная с металлическими электронами, наблюдается у углерода (как у графита, вдоль его плоскостей), мышьяка и сурьмы. [g] Хорошая теплопроводность наблюдается у бора, кремния, фосфора и германия; [22] такая проводимость передается через колебания кристаллических решеток этих элементов. [46] Умеренная электропроводность наблюдается у полупроводников [47] бора, кремния, фосфора, германия, селена, теллура и йода.
Многие неметаллические элементы твердые и хрупкие, [21] в которых дислокации не могут легко перемещаться, поэтому они, как правило, подвергаются хрупкому разрушению, а не деформации. [48] Некоторые деформируются, например, белый фосфор (мягкий как воск, пластичный и может быть разрезан ножом при комнатной температуре), [49] в пластичной сере , [50] и в селене, который можно вытягивать в провода из его расплавленного состояния. [51] Графит является стандартной твердой смазкой , в которой дислокации очень легко перемещаются в базальных плоскостях. [52]
Аллотропы
Более половины неметаллических элементов демонстрируют ряд менее стабильных аллотропных форм, каждая из которых обладает различными физическими свойствами. [53] Например, углерод, наиболее стабильной формой которого является графит , может проявляться в виде алмаза , бакминстерфуллерена , [54] аморфных [55] и паракристаллических [56] вариаций. Аллотропы также встречаются у азота, кислорода, фосфора, серы, селена и йода. [57]
Химический
| Аспект | Металлы | Неметаллы | |
|---|---|---|---|
| Реактивность [58] | Широкий диапазон: очень реактивный на благородный | ||
| Оксиды | ниже | Базовый | Кислотный ; никогда не щелочной [59] |
| выше | Все более кислый | ||
| Соединения с металлами [60] | Сплавы | Ионные соединения | |
| Энергия ионизации [61] | От низкого к высокому | От умеренного до очень высокого | |
| Электроотрицательность [62] | От низкого к высокому | От умеренного до очень высокого | |
Неметаллы имеют относительно высокие значения электроотрицательности, и их оксиды обычно кислотные. Исключения могут быть, если неметалл не очень электроотрицателен, или если его степень окисления низкая, или и то, и другое. Эти некислотные оксиды неметаллов могут быть амфотерными (как вода, H 2 O [63] ) или нейтральными (как закись азота , N 2 O [64] [h] ), но никогда не основными.
Неметаллы имеют тенденцию получать электроны во время химических реакций, в отличие от металлов, которые имеют тенденцию отдавать электроны. Это поведение связано со стабильностью электронных конфигураций в благородных газах, которые имеют полные внешние оболочки , как суммировано в правилах дуэта и октета , более правильно объясненных в терминах теории валентных связей . [67]
Они обычно демонстрируют более высокие энергии ионизации , сродство к электрону и стандартные электродные потенциалы , чем металлы. Как правило, чем выше эти значения (включая электроотрицательность), тем более неметаллическим является элемент. [68] Например, химически очень активные неметаллы фтор, хлор, бром и йод имеют среднюю электроотрицательность 3,19 — показатель [i] выше, чем у любого металлического элемента.
Химические различия между металлами и неметаллами связаны с силой притяжения между положительным зарядом ядра отдельного атома и его отрицательно заряженными внешними электронами. Слева направо в каждом периоде периодической таблицы ядерный заряд (число протонов в атомном ядре ) увеличивается. [69] Соответствующее уменьшение атомного радиуса [70] происходит по мере того, как увеличенный заряд ядра притягивает внешние электроны ближе к ядру ядра. [71] В химических связях неметаллы имеют тенденцию получать электроны из-за своего более высокого заряда ядра, что приводит к отрицательно заряженным ионам. [72]
Число соединений, образованных неметаллами, огромно. [73] Первые 10 мест в таблице «топ-20» элементов, наиболее часто встречающихся в 895 501 834 соединениях, как указано в реестре Chemical Abstracts Service на 2 ноября 2021 года, были заняты неметаллами. Водород, углерод, кислород и азот в совокупности присутствовали в большинстве (80%) соединений. Кремний, металлоид, занял 11-е место. Металлом с самым высоким рейтингом, с частотой встречаемости 0,14%, было железо, занявшее 12-е место. [74] Несколько примеров неметаллических соединений: борная кислота ( H
3БО
3), используемый в керамических глазурях ; [75] селеноцистеин ( C
3ЧАС
7НЕТ
2Se ), 21-я аминокислота жизни; [76] полуторный сульфид фосфора (P 4 S 3 ), обнаруженный в спичках Strike Anywhere ; [77] и тефлон ( (C
2Ф
4) n ), используется для создания антипригарных покрытий для сковородок и другой кухонной посуды. [78]
Осложнения
Сложность химии неметаллов добавляют аномалии, возникающие в первой строке каждого блока периодической таблицы ; неравномерные периодические тенденции; более высокие степени окисления; образование кратных связей; и совпадения свойств с металлами.
Аномалия первой строки

| Сокращенная периодическая таблица с выделением первой строки каждого блока: с п г и ф | |||||||||||||
| Период | s-блок | ||||||||||||
| 1 | Н 1 | Он 2 | p-блок | ||||||||||
| 2 | Ли 3 | Быть 4 | Б 5 | С 6 | Н 7 | О 8 | Ф 9 | Не 10 | |||||
| 3 | На 11 | Мг 12 | d-блок | Ал 13 | Си 14 | П 15 | С 16 | Кл 17 | Ар 18 | ||||
| 4 | К 19 | Около 20 | Sc-Zn 21-30 | Га 31 | Ge 32 | Как 33 | С 34 | 35 бр . | Кр 36 | ||||
| 5 | 37 руб. | Ср 38 | f-блок | Y-Cd 39-48 | В 49 | Сн 50 | Сб 51 | Те 52 | Я 53 | Хе 54 | |||
| 6 | С55 | Ба 56 | La-Yb 57-70 | Лю-Ртуть 71-80 | Тл 81 | Пб 82 | Би 83 | По 84 | В 85 лет | Рн 86 | |||
| 7 | Пт 87 | Ра 88 | Ac-No 89-102 | Лр-Кн 103-112 | Нч 113 | Э 114 | Мк 115 | Ур. 116 | ТС 117 | Ог 118 | |||
| Группа | (1) | (2) | (3-12) | (13) | (14) | (15) | (16) | (17) | (18) | ||||
| Сила аномалии первой строки по блокам равна s >> p > d > f . [79] [j] | |||||||||||||
Начиная с водорода, аномалия первого ряда в первую очередь возникает из-за электронных конфигураций соответствующих элементов. Водород примечателен своим разнообразным поведением в связях. Чаще всего он образует ковалентные связи, но он также может потерять свой единственный электрон в водном растворе , оставляя после себя голый протон с огромной поляризующей силой. [80] Следовательно, этот протон может прикрепиться к неподеленной электронной паре атома кислорода в молекуле воды, закладывая основу для кислотно-щелочной химии . [81] Более того, атом водорода в молекуле может образовывать вторую, хотя и более слабую, связь с атомом или группой атомов в другой молекуле. Такая связь «помогает придать снежинкам их гексагональную симметрию, связывает ДНК в двойную спираль ; формирует трехмерные формы белков ; и даже повышает температуру кипения воды достаточно высоко, чтобы сделать приличную чашку чая». [82]
Водород и гелий, а также бор через неон, имеют необычно малые атомные радиусы. Это явление возникает из-за того, что подоболочки 1s и 2p не имеют внутренних аналогов (то есть нет нулевой оболочки и подоболочки 1p), и поэтому они испытывают меньше электрон-электронных обменных взаимодействий , в отличие от подоболочек 3p, 4p и 5p более тяжелых элементов. [83] [ сомнительно – обсудить ] В результате энергии ионизации и электроотрицательности среди этих элементов выше, чем предполагали бы периодические тенденции . Компактные атомные радиусы углерода, азота и кислорода облегчают образование двойных или тройных связей. [84]
Хотя обычно можно было бы ожидать, исходя из согласованности электронной конфигурации, что водород и гелий будут размещены над элементами s-блока, значительная аномалия первого ряда, показанная этими двумя элементами, оправдывает альтернативные размещения. Водород иногда размещается над фтором, в группе 17, а не над литием в группе 1. Гелий почти всегда размещается над неоном, в группе 18, а не над бериллием в группе 2. [85]
Вторичная периодичность
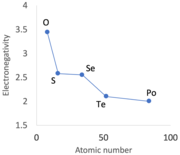
Чередование определенных периодических тенденций, иногда называемое вторичной периодичностью , становится очевидным при переходе от групп 13 к группам 15 и, в меньшей степени, к группам 16 и 17. [86] [k] Сразу после первого ряда металлов d-блока , от скандия к цинку, 3d-электроны в элементах p-блока , в частности, галлий (металл), германий, мышьяк, селен и бром, оказываются менее эффективными в экранировании увеличивающегося положительного заряда ядра.
Советский химик Щукарев приводит еще два наглядных примера: [88]
- «Токсичность некоторых соединений мышьяка и отсутствие этого свойства у аналогичных соединений фосфора [P] и сурьмы [Sb]; а также способность селеновой кислоты [ H 2 SeO 4 ] переводить металлическое золото [Au] в раствор и отсутствие этого свойства у серной [ H 2 SO 4 ] и [ H 2 TeO 4 ] кислот».
Высшие степени окисления
- Римские цифры, такие как III, V и VIII, обозначают степени окисления.
Некоторые неметаллические элементы проявляют степени окисления , которые отклоняются от тех, которые предсказываются правилом октета, что обычно приводит к степени окисления –3 в группе 15, –2 в группе 16, –1 в группе 17 и 0 в группе 18. Примерами являются аммиак NH 3 , сероводород H 2 S, фтористый водород HF и элементарный ксенон Xe. Между тем, максимально возможная степень окисления увеличивается с +5 в группе 15 до +8 в группе 18. Степень окисления +5 наблюдается со 2-го периода в таких соединениях, как азотная кислота HN(V)O 3 и пентафторид фосфора PCl 5 . [l] Более высокие степени окисления в более поздних группах появляются с 3-го периода, как это видно в гексафториде серы SF 6 , гептафториде йода IF 7 и тетроксиде ксенона (VIII) XeO 4 . Для более тяжелых неметаллов их большие атомные радиусы и более низкие значения электроотрицательности позволяют образовывать соединения с более высокими степенями окисления, что обеспечивает более высокие объемные координационные числа . [89]
Образование множественных связей
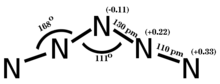
Неметаллы 2-го периода, в частности углерод, азот и кислород, проявляют склонность к образованию кратных связей. Соединения, образованные этими элементами, часто демонстрируют уникальные стехиометрии и структуры, как это видно в различных оксидах азота, [89], которые обычно не встречаются в элементах более поздних периодов.
Перекрытия свойств
Хотя некоторые элементы традиционно классифицировались как неметаллы, а другие как металлы, некоторые свойства частично перекрываются. В начале двадцатого века, когда эпоха современной химии уже прочно утвердилась, [91] Хамфри [92] заметил, что:
- ... эти две группы, однако, не отделены друг от друга совершенно резко; некоторые неметаллы напоминают металлы по некоторым своим свойствам, а некоторые металлы приближаются в некоторых отношениях к неметаллам.

Примерами металлоподобных свойств, встречающихся у неметаллических элементов, являются:
- Кремний имеет электроотрицательность (1,9), сравнимую с такими металлами, как кобальт (1,88), медь (1,9), никель (1,91) и серебро (1,93); [62]
- Электропроводность графита превышает электропроводность некоторых металлов; [n]
- Селен можно вытянуть в провод; [51]
- Радон является наиболее металлическим из благородных газов и начинает проявлять некоторое катионное поведение, что необычно для неметалла; [96] и
- В экстремальных условиях чуть более половины неметаллических элементов могут образовывать гомополиатомные катионы. [o]
Примерами неметаллоподобных свойств, встречающихся в металлах, являются:
- Вольфрам проявляет некоторые неметаллические свойства, иногда будучи хрупким, имея высокую электроотрицательность и образуя только анионы в водном растворе, [98] и преимущественно кислотные оксиды. [9] [99]
- Золото , «король металлов», имеет самый высокий электродный потенциал среди металлов, что предполагает предпочтение к приобретению, а не потере электронов. Энергия ионизации золота является одной из самых высоких среди металлов, а его электронное сродство и электроотрицательность высоки, причем последняя превышает таковую у некоторых неметаллов. Оно образует анион Au – аурида и проявляет тенденцию к связыванию с самим собой, поведение, которое является неожиданным для металлов. В ауридах (MAu, где M = Li–Cs), поведение золота похоже на поведение галогена. [100] Золото имеет достаточно большой ядерный потенциал, поэтому электроны должны рассматриваться с учетом релятивистских эффектов, которые изменяют некоторые свойства. [101]
Относительно недавняя разработка включает в себя определенные соединения более тяжелых элементов p-блока, таких как кремний, фосфор, германий, мышьяк и сурьма, демонстрирующие поведение, обычно связанное с комплексами переходных металлов . Это связано с небольшой энергетической щелью между их заполненными и пустыми молекулярными орбиталями , которые являются областями в молекуле, где находятся электроны и где они могут быть доступны для химических реакций. В таких соединениях это допускает необычную реакционную способность с малыми молекулами, такими как водород (H 2 ), аммиак (NH 3 ) и этилен (C 2 H 4 ), характеристику, ранее наблюдавшуюся в основном в соединениях переходных металлов. Эти реакции могут открыть новые пути в каталитических приложениях. [102]
Типы
Схемы классификации неметаллов сильно различаются, некоторые из них включают всего два подтипа, а другие — до семи. Например, периодическая таблица в Encyclopaedia Britannica распознает благородные газы, галогены и другие неметаллы и делит элементы, обычно признаваемые металлоидами, на «другие металлы» и «другие неметаллы». [103] С другой стороны, семь из двенадцати цветовых категорий в периодической таблице Королевского химического общества включают неметаллы. [104] [p]
| Группа (1, 13−18) | Период | ||||||
| 13 | 14 | 15 | 16 | 1 / 17 | 18 | (1−6) | |
| ЧАС | Он | 1 | |||||
| Б | С | Н | О | Ф | Не | 2 | |
| Си | П | С | Кл | Ар | 3 | ||
| Ге | Как | Сэ | Бр | Кр | 4 | ||
| Сб | Те | я | Хе | 5 | |||
| Рн | 6 | ||||||
Начиная с правой стороны периодической таблицы, можно выделить три типа неметаллов:
Элементы четвертого набора иногда относят к неметаллам:
Хотя многие из ранних исследователей пытались классифицировать элементы, ни одна из их классификаций не была удовлетворительной. Они были разделены на металлы и неметаллы, но вскоре было обнаружено, что некоторые из них обладают свойствами обоих. Их назвали металлоидами. Это только добавило путаницы, создав два нечетких подразделения там, где раньше существовало одно. [125]
Уайтфорд и Коффин 1939, Основы университетской химии
Границы между этими типами не являются резкими. [u] Углерод, фосфор, селен и йод граничат с металлоидами и проявляют некоторые металлические свойства, как и водород.
Наибольшее расхождение между авторами происходит в «пограничной территории» металлоидов. [127] Некоторые считают металлоиды отличными как от металлов, так и от неметаллов, в то время как другие классифицируют их как неметаллы. [4] Некоторые относят определенные металлоиды к металлам (например, мышьяк и сурьму из-за их сходства с тяжелыми металлами ). [128] [v] Металлоиды напоминают элементы, которые повсеместно считаются «неметаллами», имея относительно низкую плотность, высокую электроотрицательность и похожее химическое поведение. [124] [w]
Благородные газы

Шесть неметаллов классифицируются как благородные газы: гелий, неон, аргон, криптон, ксенон и радиоактивный радон. В обычных периодических таблицах они занимают крайний правый столбец. Их называют благородными газами из-за их исключительно низкой химической реактивности . [105]
Эти элементы проявляют схожие свойства, характеризующиеся бесцветностью, отсутствием запаха и негорючестью. Благодаря своим закрытым внешним электронным оболочкам, благородные газы обладают слабыми межатомными силами притяжения, что приводит к исключительно низким температурам плавления и кипения. [129] Как следствие, все они существуют в виде газов при стандартных условиях, даже те, у которых атомные массы превосходят многие типично твердые элементы. [130]
Химически благородные газы демонстрируют относительно высокие энергии ионизации, незначительное или отрицательное сродство к электрону и высокую или очень высокую электроотрицательность. Число соединений, образованных благородными газами, исчисляется сотнями и продолжает расти, [131] причем большинство этих соединений включают комбинацию кислорода или фтора с криптоном, ксеноном или радоном. [132]
Галогенные неметаллы
Хотя галогенные неметаллы являются особенно реактивными и едкими элементами, их также можно найти в повседневных соединениях, таких как зубная паста ( NaF ); обычная поваренная соль (NaCl); дезинфицирующее средство для бассейнов ( NaBr ); и пищевые добавки ( KI ). Сам термин «галоген» означает « солеобразователь ». [133]
С химической точки зрения галогенные неметаллы проявляют высокие энергии ионизации, сродство к электрону и значения электроотрицательности и в основном являются относительно сильными окислителями . [134] Эти характеристики способствуют их коррозионной природе. [135] Все четыре элемента имеют тенденцию образовывать в первую очередь ионные соединения с металлами, [136] в отличие от остальных неметаллов (за исключением кислорода), которые имеют тенденцию образовывать в первую очередь ковалентные соединения с металлами. [x] Высокореакционная и сильно электроотрицательная природа галогенных неметаллов олицетворяет неметаллический характер. [140]
Неклассифицированные неметаллы
.jpg/440px-Selenium_black_(cropped).jpg)
Водород ведет себя в некоторых отношениях как металлический элемент, а в других — как неметалл. [142] Как металлический элемент он может, например, образовывать сольватированный катион в водном растворе ; [143] он может замещать щелочные металлы в таких соединениях, как хлориды ( NaCl ср. HCl ) и нитраты ( KNO 3 ср. HNO 3 ), а также в некоторых комплексах щелочных металлов [144] [145] как неметалл. [146] Он достигает этой конфигурации, образуя ковалентную или ионную связь [147] или, если он изначально отдал свой электрон, присоединяясь к неподеленной паре электронов. [148]
Некоторые или все из этих неметаллов имеют несколько общих свойств. Будучи, как правило, менее реакционноспособными, чем галогены, [149] большинство из них могут встречаться в природе в окружающей среде. [150] Они играют важную роль в биологии [151] и геохимии . [152] В совокупности их физические и химические характеристики можно описать как «умеренно неметаллические». [152] Иногда они имеют коррозионные аспекты. Углеродная коррозия может происходить в топливных элементах . [153] Необработанный селен в почвах может привести к образованию едкого газа селенида водорода . [154] Совсем иначе, при сочетании с металлами, неклассифицированные неметаллы могут образовывать интерстициальные или тугоплавкие соединения [155] из-за их относительно малых атомных радиусов и достаточно низких энергий ионизации. [152] Они также проявляют тенденцию к связыванию друг с другом , особенно в твердых соединениях. [156] Кроме того, диагональные соотношения в периодической таблице между этими неметаллами отражают аналогичные соотношения между металлоидами. [157]
Изобилие, добыча и использование
Избыток
| Вселенная [158] | 75% водорода | 23% гелия | 1% кислорода |
| Атмосфера [159] | 78% азота | 21% кислорода | 0,5% аргона |
| Гидросфера [160] | 86% кислорода | 11% водорода | 2% хлора |
| Биомасса [161] | 63% кислорода | 20% углерода | 10% водорода |
| Корочка [160] | 46% кислорода | 27% кремния | 8% алюминия |
Обилие элементов во Вселенной является результатом таких ядерно-физических процессов, как нуклеосинтез и радиоактивный распад .
Летучие благородные газы неметаллических элементов менее распространены в атмосфере, чем ожидалось, исходя из их общего содержания из-за космического нуклеосинтеза . Механизмы, объясняющие эту разницу, являются важным аспектом планетарной науки . [162] Даже в рамках этой проблемы неметаллический элемент Xe неожиданно истощается. Возможное объяснение исходит из теоретических моделей высоких давлений в ядре Земли, предполагающих, что может быть около 10 13 тонн ксенона в форме стабильных интерметаллических соединений XeFe 3 и XeNi 3 . [163]
Пять неметаллов — водород, углерод, азот, кислород и кремний — образуют основную часть непосредственно наблюдаемой структуры Земли: около 73% коры , 93% биомассы , 96% гидросферы и более 99% атмосферы , как показано в прилагаемой таблице. Кремний и кислород образуют высокоустойчивые тетраэдрические структуры, известные как силикаты . Здесь «мощная связь, объединяющая ионы кислорода и кремния, является цементом, который удерживает земную кору вместе». [164]
В биомассе относительное обилие первых четырех неметаллов (и фосфора, серы и селена в незначительной степени) объясняется сочетанием относительно небольшого размера атома и достаточным количеством запасных электронов. Эти два свойства позволяют им связываться друг с другом и «некоторыми другими элементами, чтобы производить молекулярный суп, достаточный для построения самовоспроизводящейся системы». [165]
Извлечение
Девять из 23 неметаллических элементов являются газами или образуют соединения, которые являются газами, и извлекаются из природного газа или жидкого воздуха . К этим элементам относятся водород, гелий, азот, кислород, неон, сера, аргон, криптон и ксенон. Например, азот и кислород извлекаются из воздуха путем фракционной перегонки жидкого воздуха. Этот метод использует их различные температуры кипения для эффективного разделения. [166] Сера была извлечена с помощью процесса Фраша , который включал в себя закачку перегретой воды в подземные залежи для расплавления серы, которая затем выкачивается на поверхность. Этот метод использовал низкую температуру плавления серы по сравнению с другими геологическими материалами. Теперь ее получают путем реакции сероводорода в природном газе с кислородом. Образуется вода, оставляя серу. [167]
Неметаллические элементы извлекаются из следующих источников: [150]
| Группа (1, 13−18) | Период | ||||||
| 13 | 14 | 15 | 16 | 1 / 17 | 18 | (1−6) | |
| ЧАС | Он | 1 | |||||
| Б | С | Н | О | Ф | Не | 2 | |
| Си | П | С | Кл | Ар | 3 | ||
| Ге | Как | Сэ | Бр | Кр | 4 | ||
| Сб | Те | я | Хе | 5 | |||
| Рн | 6 | ||||||
Использует
Применение неметаллов и неметаллических элементов можно в целом разделить на бытовое, промышленное, смягчающее (смазочное, замедляющее, изолирующее или охлаждающее) и сельскохозяйственное.
Многие из них имеют бытовое и промышленное применение в бытовых принадлежностях; [169] [z] медицине и фармацевтике; [171] а также лазерах и освещении. [172] Они являются компонентами минеральных кислот ; [173] и широко распространены в подключаемых гибридных транспортных средствах; [174] и смартфонах . [175]
Значительное число имеет смягчающие и сельскохозяйственные применения. Они используются в смазочных материалах ; [176] и антипиренах и огнетушителях . [177] Они могут служить заменителями инертного воздуха; [178] и используются в криогенике и хладагентах . [179] Их значение распространяется на сельское хозяйство, через их использование в удобрениях . [180]
Кроме того, меньшее количество неметаллов или неметаллических элементов находит специализированное применение во взрывчатых веществах [ 181] и сварочных газах [182] .
- Азотная кислота (здесь окрашенная из-за присутствия диоксида азота ) часто используется в производстве взрывчатых веществ [183]
- Высоковольтный выключатель, использующий гексафторид серы (SF6 ) в качестве инертной (воздухозаменяющей) прерывающей среды [184]
- Система COIL ( химический кислородно-йодный лазер ), установленная на варианте Boeing 747, известном как бортовой лазер YAL-1
- Баллоны с аргоном для использования при тушении пожаров без повреждения серверного оборудования
Таксономическая история
Фон

Около 340 г. до н. э. в третьей книге своего трактата «Метеорология » древнегреческий философ Аристотель разделил вещества, обнаруженные в недрах Земли, на металлы и «ископаемые». [aa] Последняя категория включала различные минералы, такие как реальгар , охра , руддл , сера, киноварь и другие вещества, которые он называл «камнями, которые не могут быть расплавлены». [185]
До Средних веков классификация минералов оставалась в значительной степени неизменной, хотя и с различной терминологией. В четырнадцатом веке английский алхимик Ричард Англикус расширил классификацию минералов в своей работе Correctorium Alchemiae. В этом тексте он предположил существование двух основных типов минералов. Первая категория, которую он назвал «главными минералами», включала в себя хорошо известные металлы, такие как золото, серебро, медь, олово, свинец и железо. Вторая категория, названная «второстепенными минералами», охватывала такие вещества, как соли, атрамента ( сульфат железа ), квасцы , купорос , мышьяк, аурипигмент , сера и подобные вещества, которые не были металлическими телами. [186]
Термин «неметаллический» восходит как минимум к XVI веку. В своем медицинском трактате 1566 года французский врач Луа де Л'Оне различал вещества из растительных источников на основе того, произошли ли они из металлических или неметаллических почв. [187]
Позже французский химик Николя Лемери рассмотрел металлические и неметаллические минералы в своей работе «Универсальный трактат о простых лекарствах, расположенных в алфавитном порядке», опубликованной в 1699 году. В своих трудах он размышлял о том, принадлежит ли вещество «кадмий» либо к первой категории, родственной кобальту ( кобальтиту ), либо ко второй категории, примером которой служит то, что тогда было известно как каламин — смешанная руда, содержащая карбонат цинка и силикат . [188]
Организация элементов по типам
Подобно тому, как древние отличали металлы от других минералов, подобные различия развивались по мере того, как в конце 1700-х годов появлялась современная идея химических элементов. Французский химик Антуан Лавуазье опубликовал первый современный список химических элементов в своем революционном [190] 1789 Traité élémentaire de chimie . 33 элемента, известных Лавуазье, были разделены на четыре отдельные группы, включая газы, металлические вещества, неметаллические вещества, которые образуют кислоты при окислении, [191] и земли (термостойкие оксиды). [192] Работа Лавуазье получила широкое признание и была переиздана в двадцати трех изданиях на шести языках в течение первых семнадцати лет, значительно продвинув понимание химии в Европе и Америке. [193]
В 1802 году термин «металлоиды» был введен для элементов с физическими свойствами металлов, но химическими свойствами неметаллов. [194] Однако в 1811 году шведский химик Берцелиус использовал термин «металлоиды» [195] для описания всех неметаллических элементов, отметив их способность образовывать отрицательно заряженные ионы с кислородом в водных растворах . [196] [197] Таким образом, в 1864 году «Руководство по металлоидам» разделило все элементы либо на металлы, либо на металлоиды, причем последняя группа включала элементы, которые теперь называются неметаллами. [198] : 31 Обзоры книги показали, что термин «металлоиды» по-прежнему поддерживался ведущими авторитетами, [199] но были сомнения относительно его уместности. Хотя терминология Берцелиуса получила значительное признание, [200] позже она столкнулась с критикой со стороны некоторых, кто посчитал ее нелогичной, [197] неправильно применяемой, [201] или даже недействительной. [202] [203] Идея обозначения элементов, таких как мышьяк , как металлоидов рассматривалась. [199] Уже к 1866 году некоторые авторы начали предпочитать термин «неметалл» термину «металлоид» для описания неметаллических элементов. [204] В 1875 году Кемсхед [205] заметил, что элементы подразделяются на две группы: неметаллы (или металлоиды) и металлы. Он отметил, что термин «неметалл», несмотря на его составную природу, был более точным и стал общепринятым в качестве номенклатуры выбора.
Развитие типов
.jpg/440px-Lyon_1er_-_Place_Gabriel_Rambaud_-_Monument_aux_Grands_Hommes_de_la_Martinière_-_Gaspard_Alphonse_Dupasquier_(medaillon).jpg)
В 1844 году Альфонс Дюпаскье , французский врач, фармацевт и химик, [206] создал базовую таксономию неметаллов, чтобы помочь в их изучении. Он писал: [207]
- Они будут разделены на четыре группы или секции, как показано ниже:
- Органогены — кислород, азот, водород, углерод
- Сульфуроиды — сера, селен, фосфор
- Хлориды — фтор, хлор, бром, йод
- Бороиды — бор, кремний.
Квартет Дюпаскье параллелен современным неметаллическим типам. Органогены и сульфуроиды родственны неклассифицированным неметаллам. Хлориды позже были названы галогенами. [208] Бороиды в конечном итоге эволюционировали в металлоиды, причем эта классификация началась еще в 1864 году. [199] Неизвестные тогда благородные газы были признаны отдельной группой неметаллов после их открытия в конце 1800-х годов. [209]
Его таксономия была известна своей естественной основой. [210] [ab] Тем не менее, это было существенное отклонение от других современных классификаций, поскольку она объединяла кислород, азот, водород и углерод. [212]
В 1828 и 1859 годах французский химик Дюма классифицировал неметаллы как (1) водород; (2) от фтора до йода; (3) от кислорода до серы; (4) от азота до мышьяка; и (5) углерод, бор и кремний, [213] тем самым предвосхищая вертикальные группировки периодической таблицы Менделеева 1871 года. Пять классов Дюма попадают в современные группы 1 , 17 , 16 , 15 и 14–13 соответственно .
Предлагаемые отличительные критерии
This section's factual accuracy is disputed. (August 2024) |
| Год | Собственность и тип | |
|---|---|---|
| 1803 | Общие свойства [214] | П |
| 1906 | Гидролиз галогенидов [215 ] | С |
| 1911 | Образование катиона [216] [ сомнительно – обсудить ] | С |
| 1927 | Критерий металлизации Голдхаммера-Герцфельда [ac] [218] | П |
| 1931 | Структура электронной зоны [219] | А |
| 1949 | Массовое координационное число [220] | П |
| 1956 | Температурный коэффициент сопротивления [221] | С |
| 1956 | Кислотно-основная природа оксидов [222] | С |
| 1962 | Звучность [ad] [223] | П |
| 1969 | Температуры плавления и кипения, электропроводность [224] | П |
| 1977 | Образование сульфата [59] | С |
| 1977 | Растворимость оксидов в кислотах [225] | С |
| 1986 | Энтальпия испарения [226] | П |
| 1991 | Диапазон жидкости [ae] [227] | П |
| 1998 | Электропроводность при абсолютном нуле [219] | П |
| 1999 | Элементная структура (в большом объеме) [228] [ сомнительный – обсудить ] | П |
| 2001 | Эффективность упаковки [229] | П |
| 2020 | Параметр Мотта [af] [230] | А |
| Физические / Химические / Атомные : P / C / A | ||
Большая часть ранних анализов была феноменологической, и для различения металлов от неметаллов (или других тел) предлагались различные физические, химические и атомные свойства; полный ранний набор характеристик был изложен преподобным Таддеусом Мейсоном Харрисом в « Малой энциклопедии» 1803 года . [214]
- МЕТАЛЛ, в естественной истории и химии название класса простых тел; относительно которых установлено, что они обладают блеском; что они непрозрачны; что они плавки или могут быть расплавлены; что их удельный вес больше, чем у любых других до сих пор открытых тел; что они являются лучшими проводниками электричества, чем любые другие тела; что они ковкие или способны растягиваться и сплющиваться молотком; и что они пластичны или вязки, то есть их можно вытягивать в нити или проволоку.
Некоторые критерии не просуществовали долго; например, в 1809 году британский химик и изобретатель Гемфри Дэви выделил натрий и калий , [231] их низкая плотность контрастировала с их металлическим видом, поэтому свойство плотности было незначительным, хотя эти металлы были твердо установлены по их химическим свойствам. [232]
Джонсон [233] придерживается подхода, схожего с подходом Мейсона, различая металлы и неметаллы на основе их физического состояния, электропроводности, механических свойств и кислотно-основной природы их оксидов:
- газообразные элементы – неметаллы (водород, азот, кислород, фтор, хлор и благородные газы);
- жидкости (ртуть, бром) бывают металлическими и неметаллическими: ртуть, как хороший проводник, является металлом; бром, обладающий плохой проводимостью, является неметаллом;
- Твёрдые тела бывают либо пластичными и ковкими, либо твёрдыми и хрупкими, либо мягкими и рассыпчатыми:
- а) пластичные и ковкие элементы — металлы;
- б. твердые и хрупкие элементы включают бор, кремний и германий, которые являются полупроводниками и, следовательно, не металлами; и
- в. мягкие и крошащиеся элементы включают углерод, фосфор, серу, мышьяк, сурьму, [ag] теллур и йод, которые имеют кислотные оксиды, указывающие на неметаллический характер. [ah]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Несколько авторов [238] отметили, что неметаллы, как правило, имеют низкую плотность и высокую электроотрицательность. Сопроводительная таблица, использующая пороговое значение 7 г/см 3 для плотности и 1,9 для электроотрицательности (пересмотренная таблица Полинга), показывает, что все неметаллы имеют низкую плотность и высокую электроотрицательность. Напротив, все металлы имеют либо высокую плотность, либо низкую электроотрицательность (или и то, и другое). Голдвайт и Спилман [239] добавили, что «... более легкие элементы имеют тенденцию быть более электроотрицательными, чем более тяжелые». Средняя электроотрицательность для элементов в таблице с плотностью менее 7 г/см 3 (металлы и неметаллы) составляет 1,97 по сравнению с 1,66 для металлов, имеющих плотность более 7 г/см 3 .
Нет полного согласия относительно использования феноменологических свойств. Эмсли [240] указал на сложность этой задачи, утверждая, что ни одно свойство само по себе не может однозначно отнести элементы к категории металлов или неметаллов. Некоторые авторы делят элементы на металлы, металлоиды и неметаллы, но Одерберг [241] не согласен, утверждая, что по принципам категоризации все, что не классифицируется как металл, следует считать неметаллом.
Книн и коллеги [242] предположили, что классификация неметаллов может быть достигнута путем установления единого критерия металличности. Они признали, что существуют различные правдоподобные классификации, и подчеркнули, что, хотя эти классификации могут в некоторой степени различаться, они в целом согласны с категоризацией неметаллов. Они описывают электропроводность как ключевое свойство, утверждая, что это наиболее распространенный подход.
Одним из наиболее общепризнанных свойств является температурный коэффициент сопротивления , влияние нагрева на электрическое сопротивление и проводимость. С повышением температуры проводимость металлов уменьшается, а неметаллов увеличивается. [243] Однако плутоний , углерод, мышьяк и сурьма, по-видимому, не поддаются норме. Когда плутоний (металл) нагревается в диапазоне температур от −175 до +125 °C, его проводимость увеличивается. [244] Аналогично, несмотря на его общую классификацию как неметаллического элемента, углерод (как графит) является полуметаллом, который при нагревании испытывает снижение электропроводности. [245] Мышьяк и сурьма, которые иногда классифицируются как неметаллические элементы, также являются полуметаллами и демонстрируют поведение, подобное поведению углерода. [246] [ сомнительно – обсудить ]
Сравнение выбранных объектов недвижимости
Две таблицы в этом разделе перечисляют некоторые свойства пяти типов элементов (благородные газы, галогенные неметаллы, неклассифицированные неметаллы, металлоиды и, для сравнения, металлы) на основе их наиболее стабильных форм при стандартной температуре и давлении. Пунктирные линии вокруг столбцов для металлоидов означают, что трактовка этих элементов как отдельного типа может различаться в зависимости от автора или используемой схемы классификации.
Физические свойства по типу элемента
Физические свойства перечислены в произвольном порядке для удобства их определения.
| Свойство | Тип элемента | ||||
|---|---|---|---|---|---|
| Металлы | Металлоиды | Неметаллы | Галогенные неметаллы | Благородные газы | |
| Общий внешний вид | блестящий [20] | блестящий [247] |
|
| бесцветный [252] |
| Форма и плотность [253] | твердое вещество (жидкая ртуть) | твердый | твердое тело или газ | твердое вещество или газ (бромная жидкость) | газ |
| часто высокой плотности, такие как железо, свинец, вольфрам | низкая или умеренно высокая плотность | низкая плотность | низкая плотность | низкая плотность | |
| некоторые легкие металлы, включая бериллий, магний, алюминий | все легче железа | водород, азот легче воздуха [254] | гелий, неон легче воздуха [255] | ||
| Пластичность | в основном ковкий и пластичный [20] | часто хрупкий [247] | фосфор, сера, селен, хрупкий [aj] | йод хрупкий [259] | непригодный |
| Электропроводность | хорошо [ак] |
|
|
| плохой [ао] |
| Электронная структура [42] | металл (бериллий, стронций, α-олово, иттербий, висмут являются полуметаллами) | полуметалл (мышьяк, сурьма) или полупроводник |
| полупроводник ( I ) или изолятор | изолятор |
Химические свойства по типу элемента
Химические свойства перечислены от общих характеристик к более конкретным деталям.
| Свойство | Тип элемента | ||||
|---|---|---|---|---|---|
| Металлы | Металлоиды | Неметаллы | Галогенные неметаллы | Благородные газы | |
| Общее химическое поведение |
| слабо неметаллический [ap] | умеренно неметаллический [265] | сильно неметаллический [266] |
|
| Оксиды | основные; некоторые амфотерные или кислотные [9] | амфотерный или слабокислый [269] [водн.] | кислый [ар] или нейтральный [ас] | кислый [в] | метастабильный XeO 3 является кислым; [276] стабильный XeO 4 сильно, поэтому [277] |
| несколько формовщиков стекла [au] | все формовщики стекла [279] | некоторые стеклоформовщики [av] | не сообщалось о стеклообразователях | не сообщалось о стеклообразователях | |
| ионные, полимерные, слоистые, цепочечные и молекулярные структуры [281] | полимерная структура [282] |
|
|
| |
| Соединения с металлами | сплавы [20] или интерметаллические соединения [285] | имеют тенденцию образовывать сплавы или интерметаллические соединения [286] |
| в основном ионный [136] | простые соединения в STP неизвестны [aw] |
| Энергия ионизации (кДж моль −1 ) [61] ‡ | от низкого к высокому | умеренный | от умеренного до высокого | высокий | от высокого до очень высокого |
| 376 к 1007 | 762-947 | 941-1402 | 1008-1681 | 1037–2372 | |
| среднее 643 | среднее 833 | в среднем 1,152 | в среднем 1270 | в среднем 1589 | |
| Электроотрицательность (Полинг) [ax] [62] ‡ | от низкого к высокому | умеренный | от умеренного до высокого | высокий | высокий (радон) до очень высокого |
| 0,7–2,54 | 1,9 - 2,18 | 2.19 до 3.44 | 2,66 - 3,98 | примерно от 2,43 до 4,7 | |
| в среднем 1,5 | в среднем 2,05 | в среднем 2,65 | в среднем 3.19 | в среднем 3.3 | |
† Водород также может образовывать сплавоподобные гидриды [145]
‡ Метки «низкий» , «умеренный» , «высокий » и «очень высокий» произвольно основаны на диапазонах значений, указанных в таблице.
Смотрите также
- CHON (углерод, водород, кислород, азот)
- Список монографий по неметаллам
- Давление металлизации
- Неметалл (астрофизика)
- Элементы 1 периода (водород, гелий)
- Свойства неметаллов (и металлоидов) по группам
Примечания
- ^ Эти шесть элементов (бор, кремний, германий, мышьяк, сурьма и теллур) являются элементами, обычно называемыми «металлоидами» [3], категория, которую иногда считают подкатегорией неметаллов, а иногда — отдельной категорией как от металлов, так и от неметаллов. [4]
- ^ Наиболее стабильные формы: двухатомный водород H 2 ; β-ромбоэдрический бор ; графит для углерода ; двухатомный азот N 2 ; двухатомный кислород O 2 ; тетраэдрический кремний ; черный фосфор ; орторомбическая сера S 8 ; α-германий ; серый мышьяк ; серый селен ; серая сурьма ; серый теллур ; и двухатомный йод I 2 . Все остальные неметаллические элементы имеют только одну стабильную форму в STP . [6]
- ^ При более высоких температурах и давлениях количество неметаллов может быть поставлено под сомнение. Например, когда германий плавится, он превращается из полупроводникового металлоида в металлический проводник с электропроводностью, подобной электропроводности жидкой ртути. [13] При достаточно высоком давлении натрий (металл) становится непроводящим изолятором . [14]
- ^ Поглощенный свет может быть преобразован в тепло или повторно излучён во всех направлениях, так что спектр излучения в тысячи раз слабее, чем падающее световое излучение. [17]
- ^ Твердый йод имеет серебристо-металлический вид под белым светом при комнатной температуре. При обычных и более высоких температурах он возгоняется из твердой фазы непосредственно в фиолетовый пар. [18]
- ^ Твердые неметаллы имеют значения электропроводности в диапазоне от 10 −18 S•cm −1 для серы [22] до 3 × 10 4 в графите [23] или 3,9 × 10 4 для мышьяка ; [24] ср. 0,69 × 10 4 для марганца до 63 × 10 4 для серебра , оба металла. [22] Проводимость графита (неметалла) и мышьяка (металлоидного неметалла) превышает проводимость марганца. Такие совпадения показывают, что может быть трудно провести четкую границу между металлами и неметаллами.
- ^ Значения теплопроводности металлов варьируются от 6,3 Вт м −1 К −1 для нептуния до 429 для серебра ; ср. сурьма 24,3, мышьяк 50 и углерод 2000. [22] Значения электропроводности металлов варьируются от 0,69 См•см −1 × 10 4 для марганца до 63 × 10 4 для серебра ; ср. углерод 3 × 10 4 , [23] мышьяк 3,9 × 10 4 и сурьма 2,3 × 10 4 . [22]
- ^ В то время как CO и NO обычно считаются нейтральными, CO является слабокислым оксидом, реагирующим с основаниями с образованием формиатов (CO + OH − → HCOO − ); [65] а в воде NO реагирует с кислородом с образованием азотистой кислоты HNO 2 (4NO + O 2 + 2H 2 O → 4HNO 2 ). [66]
- ^ Значения электроотрицательности фтора по отношению к йоду составляют: 3,98 + 3,16 + 2,96 + 2,66 = 12,76/4 3,19.
- ^ Гелий изображен выше бериллия в целях согласованности электронной конфигурации; как благородный газ он обычно располагается выше неона, в группе 18.
- ^ Конечный результат — четно-нечетная разница между периодами (за исключением s-блока ): элементы в четных периодах имеют меньшие атомные радиусы и предпочитают терять меньше электронов, в то время как элементы в нечетных периодах (за исключением первого) отличаются в противоположном направлении. Многие свойства в p-блоке затем показывают зигзагообразную, а не плавную тенденцию вдоль группы. Например, фосфор и сурьма в нечетных периодах группы 15 легко достигают степени окисления +5, тогда как азот, мышьяк и висмут в четных периодах предпочитают оставаться на уровне +3. [87]
- ^ Состояния окисления, которые обозначают гипотетические заряды для концептуализации распределения электронов в химических связях, не обязательно отражают чистый заряд молекул или ионов. Эта концепция иллюстрируется анионами, такими как NO 3 − , где атом азота считается имеющим степень окисления +5 из-за распределения электронов. Однако чистый заряд иона остается −1. Такие наблюдения подчеркивают роль состояний окисления в описании потери или получения электронов в контекстах связывания, отличную от указания фактического электрического заряда, особенно в ковалентно связанных молекулах.
- ^ Гринвуд [93] прокомментировал, что: «То, в какой степени металлические элементы имитируют бор (имея меньше электронов, чем орбиталей, доступных для связывания), стало плодотворной объединяющей концепцией в развитии химии металлоборана... Действительно, металлы упоминались как «почетные атомы бора» или даже как «атомы гибкобора». Обратное отношение этого соотношения, очевидно, также справедливо».
- ^ Например, проводимость графита составляет 3 × 10 4 См•см −1. [94] тогда как проводимость марганца составляет 6,9 × 10 3 См•см −1 . [95]
- ^ Гомополиатомный катион состоит из двух или более атомов одного и того же элемента, связанных вместе и несущих положительный заряд, например, N 5 + , O 2 + и Cl 4 + . Это необычное поведение для неметаллов, поскольку образование катионов обычно связано с металлами, а неметаллы обычно связаны с образованием анионов. Гомополиатомные катионы также известны для углерода, фосфора, сурьмы, серы, селена, теллура, брома, йода и ксенона. [97]
- ^ Из двенадцати категорий в периодической таблице Королевского общества пять отображаются только с фильтром по металлу, три — только с фильтром по неметаллу и четыре — с обоими фильтрами. Интересно, что шесть элементов, отмеченных как металлоиды (бор, кремний, германий, мышьяк, сурьма и теллур), отображаются под обоими фильтрами. Шесть других элементов (113–118: нихоний, флеровий, московий, ливерморий, теннессин и оганесон), статус которых неизвестен, также отображаются под обоими фильтрами, но не включены ни в одну из двенадцати цветовых категорий.
- ^ Кавычки отсутствуют в источнике; здесь они используются для того, чтобы было ясно, что источник использует слово «неметаллы» как формальный термин для подмножества рассматриваемых химических элементов, а не применяет его к неметаллам в целом.
- ^ Различные конфигурации этих неметаллов были названы, например, основными неметаллами, [107] биоэлементами, [108] центральными неметаллами, [109] CHNOPS, [110] эссенциальными элементами, [111] «неметаллами», [112] [q] сиротскими неметаллами, [113] или окислительно-восстановительными неметаллами. [114]
- ^ Мышьяк стабилен в сухом воздухе. Длительное воздействие влажного воздуха приводит к образованию черного поверхностного слоя. «Мышьяк нелегко подвергается воздействию воды, щелочных растворов или неокисляющих кислот». [119] Иногда его можно найти в природе в несвязанной форме. [120] Он имеет положительный стандартный восстановительный потенциал (As → As 3+ + 3e = +0,30 В), что соответствует классификации полублагородных металлов. [121]
- ^ "Кристаллический бор относительно инертен." [115] Кремний "обычно крайне инертен." [116] "Германий является относительно инертным полуметаллом." [117] "Чистый мышьяк также относительно инертен." [118] [с] "Металлическая сурьма … инертна при комнатной температуре." [122] "По сравнению с S и Se , Te имеет относительно низкую химическую реактивность." [123]
- ^ В схемах классификации часто встречаются размытость границ и перекрытия. [126]
- ^ Джонс придерживается философского или прагматического взгляда на эти вопросы. Он пишет: «Хотя классификация является неотъемлемой чертой всех отраслей науки, на границах всегда есть сложные случаи. Граница класса редко бывает резкой ... Ученые не должны терять сон из-за сложных случаев. Пока система классификации выгодна для экономии описания, структурирования знаний и нашего понимания, а сложные случаи составляют незначительное меньшинство, тогда сохраняйте ее. Если система становится менее полезной, тогда откажитесь от нее и замените ее системой, основанной на других общих характеристиках». [126]
- ^ Для сравнения свойств металлов, металлоидов и неметаллов см. Rudakiya & Patel (2021), стр. 36.
- ^ Оксиды металлов обычно несколько ионные, в зависимости от электроположительности металлического элемента. [137] С другой стороны, оксиды металлов с высокими степенями окисления часто являются либо полимерными, либо ковалентными. [138] Полимерный оксид имеет связанную структуру, состоящую из нескольких повторяющихся единиц. [139]
- ^ В качестве исключения, исследование, опубликованное в 2012 году, отметило наличие 0,04% собственного фтора ( F
2) по весу в антозоните , приписывая эти включения излучению от крошечных количеств урана. [168] - ^ Радон иногда встречается как потенциально опасный загрязнитель внутри помещений [170]
- ^ Термин «ископаемый» не следует путать с современным использованием термина « ископаемый» для обозначения сохранившихся останков, отпечатков или следов любого некогда живого существа.
- ^ Естественная классификация основывалась на «всех признаках веществ, подлежащих классификации, в отличие от «искусственных классификаций», основанных на одном единственном признаке», таком как сродство металлов к кислороду. «Естественная классификация в химии рассматривала бы самые многочисленные и самые существенные аналогии». [211]
- ^ Отношение Голдхаммера-Герцфельда примерно равно кубу атомного радиуса, деленного на молярный объем . [217] Более конкретно, это отношение силы, удерживающей внешние электроны отдельного атома на месте, к силам, действующим на те же электроны от взаимодействия между атомами в твердом или жидком элементе. Когда межатомные силы больше или равны атомной силе, указывается внешнее электронное блуждание и предсказывается металлическое поведение. В противном случае ожидается неметаллическое поведение.
- ^ Звонкость — это издавание звенящего звука при ударе.
- ^ Диапазон жидкости — это разница между температурой плавления и температурой кипения.
- ^ Параметр Мотта равен N 1/3 ɑ* H , где N — число атомов в единице объема, а ɑ* H — «их эффективный размер, обычно принимаемый за эффективный радиус Бора максимума в распределении вероятности самых внешних (валентных) электронов». В условиях окружающей среды для значения разделительной линии между металлами и неметаллами дается значение 0,45.
- ^ Хотя триоксид сурьмы обычно относят к амфотерным веществам, его очень слабые кислотные свойства преобладают над свойствами очень слабого основания. [234]
- ^ Джонсон считал бор неметаллом, а кремний, германий, мышьяк, сурьму, теллур, полоний и астат — «полуметаллами», т. е. металлоидами.
- ^ (a) Таблица включает элементы до эйнштейния (99), за исключением астата (85) и франция (87), с плотностями и большинством электроотрицательностей по Эйлворду и Финдли; [235] Электроотрицательности благородных газов взяты из Рама, Зенга и Хоффмана. [236]
(b) Обзор определений термина «тяжелый металл» сообщил критерии плотности в диапазоне от более 3,5 г/см 3 до более 7 г/см 3 ; [237]
(c) Вернон указал минимальную электроотрицательность 1,9 для металлоидов по пересмотренной шкале Полинга; [3] - ^ Все четыре имеют менее стабильные нехрупкие формы: углерод в виде расслоенного (расширенного) графита , [256] [257] и в виде углеродной нанотрубчатой проволоки; [258] фосфор в виде белого фосфора (мягкий как воск, пластичный и может быть разрезан ножом при комнатной температуре); [49] сера в виде пластичной серы; [50] и селен в виде селеновой проволоки. [51]
- ^ Металлы имеют значения электропроводности от6,9 × 10 3 См• см −1 для марганца6,3 × 10 5 для серебра . [260]
- ^ Металлоиды имеют значения электропроводности от1,5 × 10−6 См•см −1 для бора3,9 × 10 4 для мышьяка . [261]
- ^ Неклассифицированные неметаллы имеют значения электропроводности от прибл.1 × 10−18 См•см −1 для элементарных газов3 × 10 4 в графите. [94]
- ^ Галогенные неметаллы имеют значения электропроводности от прибл.1 × 10−18 См • см −1 для F и Cl в1,7 × 10−8 См•см −1 для йода. [94] [ 262]
- ^ Элементарные газы имеют значения электропроводности около.1 × 10 -18 См•см -1 . [94]
- ^ Металлоиды всегда дают «соединения менее кислотные по характеру, чем соответствующие соединения [типичных] неметаллов». [247]
- ^ Триоксид мышьяка реагирует с триоксидом серы, образуя «сульфат» мышьяка As 2 (SO 4 ) 3 . [270] Это вещество по своей природе ковалентное, а не ионное; [271] его также называют As 2 O 3 ·3SO 3 . [272]
- ^ НЕТ
2, Н
2О
5, ТАК
3, SeO
3сильно кислые. [273] - ^ H 2 O, CO, NO, N 2 O — нейтральные оксиды; CO и N 2 O — «формально ангидриды муравьиной и азотноватистой кислот , соответственно, а именно: CO + H 2 O → H 2 CO 2 (HCOOH, муравьиная кислота); N 2 O + H 2 O → H 2 N 2 O 2 (азотноватистая кислота)». [274]
- ^ ClO
2, Кл
2О
7, я
2О
5сильно кислые. [275] - ^ Металлы, образующие стекла: ванадий, молибден, вольфрам, алюминий, индий, таллий, олово, свинец и висмут. [278]
- ^ Неклассифицированные неметаллы, образующие стекла, — фосфор, сера, селен; [278] CO 2 образует стекло при 40 ГПа. [280]
- ^ Гелид динатрия ( Na2He ) — это соединение гелия и натрия, стабильное при высоких давлениях выше 113 ГПа. Аргон образует сплав с никелем при 140 ГПа и близко к 1500 К, однако при этом давлении аргон уже не является благородным газом. [288]
- ^ Значения для благородных газов взяты из Рама, Зенга и Хоффмана. [236]
Ссылки
Цитаты
- ^ abc Ларраньяга, Льюис и Льюис 2016, стр. 988
- ^ ab Steudel 2020, стр. 43: Монография Штейделя представляет собой обновленный перевод пятого немецкого издания 2013 года, включающий литературу по весну 2019 года.
- ^ abcde Вернон 2013
- ^ аб Гудрич 1844, с. 264; Химические новости 1897, с. 189; Хэмпель и Хоули, 1976, стр. 174, 191; Льюис 1993, с. 835; Герольд 2006, стр. 149–50.
- ^ В: Рестрепо и др. 2006, с. 411; Торнтон и Бердетт, 2010, с. 86; Герман, Хоффманн и Эшкрофт, 2013 г., стр. 11604–1–11604–5; Спикер: Мьюс и др. 2019 год; Fl: Флорес и др. 2022 год; Например: Смитс и др. 2020 год
- ^ Wismer 1997, стр. 72: H, He, C, N, O, F, Ne, S, Cl, Ar, As, Se, Br, Kr, Sb, I, Xe; Powell 1974, стр. 174, 182: P, Te; Greenwood & Earnshaw 2002, стр. 143: B; Field 1979, стр. 403: Si, Ge; Addison 1964, стр. 120: Rn
- ^ Pascoe 1982, стр. 3 [ сломанный якорь ]
- ↑ Мэлоун и Долтер 2010, стр. 110–111.
- ^ abc Porterfield 1993, стр. 336
- ^ Годовиков и Ненашева 2020, с. 4; Морли и Мьюир 1892, с. 241
- ^ ab Vernon 2020, стр. 220; Rochow 1966, стр. 4
- ^ Периодическая таблица элементов ИЮПАК
- ^ Бергер 1997, стр. 71–72.
- ^ Гатти, Токатли и Рубио 2010
- ↑ Wibaut 1951, стр. 33: «Многие вещества ...бесцветны и поэтому не проявляют избирательного поглощения в видимой части спектра».
- ↑ Эллиот 1929, стр. 629
- ^ Фокс 2010, стр. 31
- ↑ Tidy 1887, стр. 107–108; Koenig 1962, стр. 108
- ^ Wiberg 2001, стр. 416; Здесь Wiberg имеет в виду йод.
- ^ abcdef Книн, Роджерс и Симпсон 1972, стр. 261–264
- ^ ab Джонсон 1966, стр. 4
- ^ abcde Aylward & Findlay 2008, стр. 6–12
- ^ ab Jenkins & Kawamura 1976, стр. 88
- ^ Карапелла 1968, стр. 30
- ^ Zumdahl & DeCoste 2010, стр. 455, 456, 469, A40; Earl & Wilford 2021, стр. 3-24
- ^ Corb, BW; Wei, WD; Averbach, BL (1982). «Атомные модели аморфного селена». Журнал некристаллических твердых тел . 53 (1–2): 29–42. Bibcode : 1982JNCS...53...29C. doi : 10.1016/0022-3093(82)90016-3.
- ^ Виберг 2001, стр. 780
- ^ Виберг 2001, стр. 824, 785
- ^ Эрл и Уилфорд 2021, стр. 3-24
- ^ Секиерски и Берджесс 2002, стр. 86
- ^ Шарлье, Гонз и Мишено, 1994 г.
- ^ Taniguchi et al. 1984, стр. 867: «... черный фосфор ... [характеризуется] широкими валентными зонами с довольно делокализованной природой».; Carmalt & Norman 1998, стр. 7: «Поэтому следует ожидать, что фосфор ... будет обладать некоторыми свойствами металлоида».; Du et al. 2010: Считается, что межслоевые взаимодействия в черном фосфоре, которые приписываются силам Ван-дер-Ваальса-Кизома, способствуют уменьшению ширины запрещенной зоны объемного материала (расчетное значение 0,19 эВ; наблюдаемое значение 0,3 эВ) по сравнению с большей шириной запрещенной зоны одного слоя (расчетное значение ~0,75 эВ).
- ^ Виберг 2001, стр. 742
- ↑ Эванс 1966, стр. 124–25.
- ^ Виберг 2001, стр. 758.
- ^ Стьюк 1974, стр. 178; Донохью 1982, стр. 386–87; Коттон и др. 1999, стр. 501
- ^ Steudel 2020, стр. 601: "... Можно ожидать значительного перекрытия орбиталей. По-видимому, в кристаллическом йоде существуют межмолекулярные многоцентровые связи, которые распространяются по всему слою и приводят к делокализации электронов, подобной таковой в металлах. Это объясняет некоторые физические свойства йода: темный цвет, блеск и слабую электропроводность, которая в 3400 раз сильнее внутри слоев, чем перпендикулярно им. Таким образом, кристаллический йод является двумерным полупроводником."; Segal 1989, стр. 481: "Йод проявляет некоторые металлические свойства ..."
- ^ Тейлор 1960, с. 207; Брант 1919, с. 34
- ^ ab Green 2012, стр. 14
- ^ Спенсер, Боднер и Рикард 2012, стр. 178
- ^ Redmer, Hensel & Holst 2010, предисловие
- ^ ab Килер и Уотерс 2013, стр. 293
- ^ ДеКок и Грей 1989, стр. 423, 426—427
- ^ Боресков 2003, стр. 45
- ^ ab Эшкрофт и Мермин
- ^ Ян 2004, стр. 9
- ^ Wiberg 2001, стр. 416, 574, 681, 824, 895, 930; Секерский и Берджесс 2002, с. 129
- ^ Weertman, Johannes; Weertman, Julia R. (1992). Элементарная теория дислокаций. Нью-Йорк: Oxford University Press. ISBN 978-0-19-506900-6.
- ^ Фарадей 1853, стр. 42; Холдернесс и Берри 1979, стр. 255
- ^ ab Partington 1944, стр. 405
- ^ abc Реньо 1853, стр. 208
- ^ Scharf, TW; Prasad, SV (январь 2013 г.). «Твердые смазочные материалы: обзор». Journal of Materials Science . 48 (2): 511–531. Bibcode : 2013JMatS..48..511S. doi : 10.1007/s10853-012-7038-2. ISSN 0022-2461.
- ^ Бартон 2021, стр. 200
- ^ Виберг 2001, стр. 796
- ^ Шан и др. 2021
- ^ Тан и др. 2021
- ^ Steudel 2020, passim; Carrasco et al. 2023; Shanabrook, Lannin & Hisatsune 1981, стр. 130–133
- ^ Уэллер и др. 2018, предисловие
- ^ ab Эбботт 1966, стр. 18
- ^ Гангули 2012, стр. 1-1
- ^ ab Aylward & Findlay 2008, стр. 132
- ^ abc Aylward & Findlay 2008, стр. 126
- ^ Иглсон 1994, 1169
- ^ Муди 1991, стр. 365
- ^ Дом 2013, стр. 427
- ^ Льюис и Дин 1994, стр. 568
- ^ Смит 1990, стр. 177–189.
- ^ Йодер, Суйдам и Снавли 1975, стр. 58
- ^ Янг и др. 2018, стр. 753
- ^ Браун и др. 2014, стр. 227
- ^ Секиерски и Берджесс 2002, стр. 21, 133, 177.
- ^ Мур 2016; Берфорд, Пассмор и Сандерс 1989, стр. 54
- ^ Брэди и Сенезе 2009, стр. 69
- ^ Служба химических рефератов 2021
- ^ Эмсли 2011, стр. 81
- ^ Кокелл 2019, стр. 210
- ^ Скотт 2014, стр. 3
- ^ Эмсли 2011, стр. 184
- ^ Йенсен 1986, стр. 506
- ^ Ли 1996, стр. 240
- ^ Гринвуд и Эрншоу 2002, стр. 43
- ^ Кресси 2010
- ^ Секиерски и Берджесс, 2002, стр. 24–25.
- ^ Секиерски и Берджесс 2002, стр. 23
- ^ Петрушевский и Цветкович 2018; Грочала 2018
- ^ Книн, Роджерс и Симпсон 1972, стр. 226, 360; Сикьерски и Берджесс 2002, стр. 52, 101, 111, 124, 194
- ^ Шерри 2020, стр. 407–420
- ^ Щукарев 1977, стр. 229
- ^ ab Cox 2004, стр. 146
- ^ Видж и др. 2001
- ^ Дорси 2023, стр. 12–13
- ^ Хамфри 1908
- ^ Гринвуд 2001, стр. 2057
- ^ abcd Богородицкий и Пасынков 1967, с. 77; Дженкинс и Кавамура 1976, с. 88
- ^ Десаи, Джеймс и Хо 1984, стр. 1160
- ^ Штейн 1983, стр. 165
- ^ Энгессер и Кроссинг 2013, с. 947
- ^ Швейцер и Пестерфилд 2010, стр. 305
- ^ Рик 1967, стр. 97: Триоксид вольфрама растворяется в плавиковой кислоте, образуя оксифторидный комплекс .
- ^ Виберг 2001, стр. 1279
- ^ Pyper, NC (2020-09-18). «Относительность и периодическая таблица». Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences . 378 (2180): 20190305. Bibcode : 2020RSPTA.37890305P. doi : 10.1098/rsta.2019.0305. ISSN 1364-503X. PMID 32811360.
- ^ Power 2010; Crow 2013; Weetman & Inoue 2018
- ^ Энциклопедия Британника 2021
- ^ Королевское химическое общество 2021
- ^ ab Matson & Orbaek 2013, стр. 203
- ^ Кернион и Маскетта 2019, с. 191; Цао и др. 2021, стр. 20–21; Хусейн и др. 2023 год; также называемые «неметаллическими галогенами»: Chambers & Holliday 1982, стр. 273–274; Больманн 1992, с. 213; Йентч и Матиле, 2015, с. 247 или «стабильные галогены»: Василакис, Калемос и Мавридис 2014, стр. 1; Хэнли и Кога, 2018, с. 24; Кайхо 2017, гл. 2, с. 1
- ^ Уильямс 2007, стр. 1550–1561: H, C, N, P, O, S
- ^ Wächtershäuser 2014, с. 5: Н, С, Н, П, О, С, Се
- ^ Хенгевельд и Федонкин 2007, стр. 181–226: C, N, P, O, S
- ↑ Уэйкман 1899, стр. 562.
- ↑ Fraps 1913, стр. 11: H, C, Si, N, P, O, S, Cl
- ^ Парамесваран и др. 2020, с. 210: Ч, С, Н, П, О, С, Се
- ^ Найт 2002, стр. 148: H, C, N, P, O, S, Se
- ^ Фраусто да Силва и Уильямс 2001, с. 500: Н, С, Н, О, С, Се
- ^ Чжу и др. 2022
- ^ Могилы 2022
- ^ Розенберг 2013, стр. 847
- ^ Ободовский 2015, стр. 151
- ^ Гринвуд и Эрншоу 2002, стр. 552
- ^ Иглсон 1994, стр. 91
- ^ Хуан 2018, стр. 30, 32
- ^ Орисакве 2012, стр. 000
- ^ Инь и др. 2018, стр. 2
- ^ аб Мёллер и др. 1989, с. 742
- ^ Уайтфорд и Гроб 1939, с. 239
- ^ ab Jones 2010, стр. 169–71
- ^ Рассел и Ли 2005, стр. 419
- ↑ Тайлер 1948, стр. 105; Рейлли 2002, стр. 5–6
- ^ Джолли 1966, стр. 20
- ↑ Клагстон и Флемминг 2000, стр. 100–101, 104–105, 302
- ^ Маошэн 2020, стр. 962
- ^ Мазей 2020
- ^ Виберг 2001, стр. 402
- ^ Рудольф 1973, стр. 133: «Кислород и галогены в частности ... являются поэтому сильными окислителями».
- ^ Дэниел и Рапп 1976, стр. 55
- ^ аб Коттон и др. 1999, с. 554
- ^ Вудворд и др. 1999, стр. 133–194.
- ↑ Филлипс и Уильямс 1965, стр. 478–479.
- ^ Мёллер и др. 1989, стр. 314
- ^ Ланфорд 1959, стр. 176
- ^ Эмсли 2011, стр. 478
- ^ Зеесе и Дауб 1985, стр. 65
- ^ Маккей, Маккей и Хендерсон 2002, стр. 209, 211
- ^ Казинс, Дэвидсон и Гарсиа-Виво, 2013, стр. 11809–11811.
- ^ ab Cao et al. 2021, стр. 4
- ^ Липтрот 1983, стр. 161; Мэлоун и Долтер 2008, стр. 255
- ^ Виберг 2001, стр. 255–257.
- ^ Скотт и Канда 1962, стр. 153
- ^ Тейлор 1960, стр. 316
- ^ ab Emsley 2011, везде
- ^ Crawford 1968, стр. 540; Benner, Ricardo & Carrigan 2018, стр. 167–168: «Стабильность связи углерод-углерод ... сделала ее элементом первого выбора для создания каркаса биомолекул. Водород необходим по многим причинам; по крайней мере, он завершает цепи CC. Гетероатомы (атомы, которые не являются ни углеродом, ни водородом) определяют реакционную способность биомолекул, созданных на основе углерода. В ... жизни это кислород, азот и, в меньшей степени, сера, фосфор, селен и иногда галоген».
- ^ abc Cao et al. 2021, стр. 20
- ^ Чжао, Ту и Чан 2021
- ^ Wasewar 2021, стр. 322–323
- ^ Месслер 2011, стр. 10
- ^ Кинг 1994, стр. 1344; Пауэлл и Тимс 1974, стр. 189–191; Као и др. 2021, стр. 20–21
- ^ Вернон 2020, стр. 221–223; Рейнер-Кэнхэм 2020, стр. 216
- ^ Чандра Рентгеновский центр 2018
- ^ Чапин, Мэтсон и Витоусек 2011, стр. 27
- ^ ab Fortescue 1980, стр. 56
- ^ Георгиевский 1982, стр. 58
- ^ Pepin, RO; Porcelli, D. (2002-01-01). «Происхождение благородных газов на планетах земной группы». Обзоры по минералогии и геохимии . 47 (1): 191–246. Bibcode :2002RvMG...47..191P. doi :10.2138/rmg.2002.47.7. ISSN 1529-6466.
- ^ Чжу и др. 2014, стр. 644–648.
- ^ Кляйн и Датроу 2007, стр. 435 [ сломанный якорь ]
- ^ Кокелл 2019, стр. 212, 208–211
- ^ Эмсли 2011, стр. 363, 379
- ^ Эмсли 2011, стр. 516
- ^ Шмедт, Мангстл и Краус 2012, с. 7847‒7849
- ^ Emsley 2011, стр. 39, 44, 80–81, 85, 199, 248, 263, 367, 478, 531, 610; Smulders 2011, стр. 416–421; Chen 1990, часть 17.2.1; Hall 2021, стр. 143: H (основной компонент воды); He (воздушные шары для вечеринок); B (в моющих средствах ); C (в карандашах , как графит); N ( пивные штучки ); O (как перекись , в моющих средствах ); F (как фторид , в зубной пасте ); Ne (освещение); Si (в стеклянной посуде); P ( спички ); S (средства для ухода за садом); Cl ( компонент отбеливателя ); Ar ( изолированные окна ); Ge (в широкоугольных объективах камер ); Se ( стекло ; солнечные батареи ); Br (в виде бромида , для очистки воды в спа-салонах); Kr (энергосберегающие люминесцентные лампы ); Sb (в батареях); Te (в керамике , солнечных батареях, перезаписываемых DVD-дисках ); I (в антисептических растворах); Xe (в ячейках плазменных телевизоров , технология, которая впоследствии стала ненужной из-за недорогих светодиодных и органических светодиодных дисплеев ).
- ^ Марони 1995, стр. 108–123.
- ^ Имбертиерти 2020: H, He, B, C, N, O, F, Si, P, S, Cl, Ar, As, Se, Br, Kr, Sb, Te, I, Xe и Rn
- ^ Челе 2016; Винстел 2000; Дэвис и др. 2006, с. 431–432; Грондзик и др. 2010, с. 561: Cl, Ar, Ge, As, Se, Br, Kr, Te, I и Xe.
- ^ Оксфордский словарь английского языка ; Eagleson 1994 (все за исключением германиевой кислоты ); Wiberg 2001, стр. 897, германиевая кислота: H, B, C, N, O, F, Si, P, S, Cl, Ge, As, Sb, Br, Te, I и Xe
- ^ Бхувалка и др. 2021, стр. 10097–10107: H, He, B, C, N, O, F, Si, P, S, Cl, Ar, Br, Sb, Te и I
- ^ Кинг 2019, стр. 408: H, He, B, C, N, O, F, Si, P, S, Cl, Ge, As, Se, Br, Sb
- ^ Эмсли 2011, стр. 98, 117, 331, 487; Грешам и др. 2015, стр. 25, 55, 60, 63: H, He, B, C, N, O, F, Si, P, S, Cl, Ar, Se, Sb
- ^ Бирд и др. 2021; Слай 2008: H, B, C (включая графит), N, O, F, Si, P, S, Cl, Ar, Br и Sb
- ^ Рейнхардт и др. 2015; Иглсон 1994, стр. 1053: H, He, C, N, O, F, P, S и Ar
- ^ Windmeier & Barron 2013: H, He, N, O, F, Ne, S, Cl и Ar
- ^ Кииски и др. 2016: Ч, Б, С, Н, О, Си, П, С
- ^ Эмсли 2011, стр. 113, 231, 327, 362, 377, 393, 515:: H, C, N, O, P, S, Cl
- ^ Брандт и Вайлер 2000: H, He, C, N, O, Ar
- ^ Харбисон, Буржуа и Джонсон 2015, стр. 364
- ^ Болин 2017, стр. 2-1
- ^ Джордан 2016
- ^ Стиллман 1924, стр. 213
- ^ де Л'Оне 1566, стр. 7
- ^ Лемери 1699, с. 118; Дежонге 1998, с. 329
- ↑ Лавуазье 1790, стр. 175
- ^ Стратерн 2000, стр. 239
- ^ Мур, Ф. Дж.; Холл, Уильям Т. (1918). История химии. McGraw-Hill. стр. 99. Получено 01.08.2024 .Таблица Лавуазье воспроизведена на странице 99.
- ^ Крисвелл 2007, стр. 1140
- ^ Зальцберг 1991, стр. 204
- ↑ Френд Дж. Н. 1953, Человек и химические элементы, 1-е изд., Charles Scribner's Sons, Нью-Йорк
- ↑ Берцелиус 1811, стр. 258.
- ^ Партингтон 1964, стр. 168
- ^ ab Bache 1832, стр. 250
- ^ Апджон, Дж. (1864). Справочник по металлоидам. Соединенное Королевство: Longman.
- ^ abc Химические новости и журнал физической науки 1864
- ^ Голдсмит 1982, стр. 526
- ^ Роско и Шормлеммер 1894, стр. 4
- ↑ Глинка 1960, стр. 76
- ↑ Герольд 2006, стр. 149–150.
- ↑ Оксфордский словарь английского языка 1989 г.
- ↑ Кемсхед 1875, стр. 13
- ^ Бертомеу-Санчес и др. 2002, стр. 248–249.
- ^ Дюпаскье 1844, стр. 66–67.
- ↑ Бах 1832, стр. 248–276.
- ↑ Ренуф 1901, стр. 268.
- ^ Бертомеу-Санчес и др. 2002, с. 248
- ^ Бертомеу-Санчес и др. 2002, с. 236
- ↑ Хёфер 1845, стр. 85
- ↑ Дюма 1828; Дюма 1859
- ^ ab Harris 1803, стр. 274
- ↑ Смит 1906, стр. 646–647.
- ^ Пляж 1911
- ^ Эдвардс и Сиенко 1983, стр. 693
- ^ Херцфельд 1927; Эдвардс 2000, стр. 100–103.
- ^ Эдвардс 2010, стр. 941–965
- ^ Кубашевский 1949, стр. 931–940
- ^ Бутера, Ричард А.; Вальдек, Дэвид Х. (сентябрь 1997 г.). «Зависимость сопротивления от температуры для металлов, полупроводников и сверхпроводников». Журнал химического образования . 74 (9): 1090. Bibcode : 1997JChEd..74.1090B. doi : 10.1021/ed074p1090. ISSN 0021-9584.
- ↑ Стотт 1956, стр. 100–102.
- ^ Уайт 1962, стр. 106
- ^ Мартин 1969, стр. 6
- ↑ Пэриш 1977, стр. 178
- ^ Рао и Гангули 1986
- ^ Смит и Дуайер 1991, стр. 65
- ^ Скотт 2001, стр. 1781
- ^ Суреш и Кога 2001, стр. 5940–5944
- ^ Яо Б, Кузнецов ВЛ, Сяо Т и др. (2020). «Металлы и неметаллы в периодической таблице». Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences . 378 (2180): 1–21. Bibcode : 2020RSPTA.37800213Y. doi : 10.1098/rsta.2020.0213. PMC 7435143. PMID 32811363 .
- ↑ Дэвид Найт (2004) «Дэви, сэр Хамфри, баронет (1778–1829)» Архивировано 24 сентября 2015 г. в Wayback Machine в Оксфордском национальном биографическом словаре , Oxford University Press
- ^ Эдвардс 2000, стр. 85
- ^ Джонсон 1966, стр. 3–6, 15
- ^ Школьников 2010, стр. 2127
- ^ Эйлворд и Финдли 2008, стр. 6–13; 126
- ^ Аб Рам, Зенг и Хоффманн, 2019, стр. 345
- ^ Даффус 2002, стр. 798
- ^ Hein & Arena 2011, стр. 228, 523; Timberlake 1996, стр. 88, 142; Kneen, Rogers & Simpson 1972, стр. 263; Baker 1962, стр. 21, 194; Moeller 1958, стр. 11, 178
- ^ Голдвайт и Шпильман 1984, стр. 130
- ^ Эмсли 1971, стр. 1
- ^ Одерберг 2007, стр. 97
- ↑ Книн, Роджерс и Симпсон 1972, стр. 218–219.
- ^ Герман 1999, стр. 702
- ^ Рассел и Ли 2005, стр. 466
- ^ Аткинс и др. 2006, стр. 320–21
- ^ Жигальский и Джонс 2003, с. 66
- ^ abc Rochow 1966, стр. 4
- ^ Wiberg 2001, стр. 780; Emsley 2011, стр. 397; Rochow 1966, стр. 23, 84
- ^ Книн, Роджерс и Симпсон 1972, стр. 439
- ^ Книн, Роджерс и Симпсон 1972, стр. 321, 404, 436
- ^ Книн, Роджерс и Симпсон 1972, стр. 465
- ^ Книн, Роджерс и Симпсон 1972, стр. 308
- ^ Трегартен 2003, стр. 10
- ^ Льюис 1993, стр. 28, 827
- ^ Льюис 1993, стр. 28, 813
- ^ Чунг 1987
- ^ Годфрин и Лаутер 1995, стр. 216–218.
- ^ Янас, Кабреро-Вилатела и Балмер, 2013 г.
- ^ Виберг 2001, стр. 416
- ^ Десаи, Джеймс и Хо 1984, стр. 1160; Матула 1979, с. 1260
- ^ Шефер 1968, с. 76; Карапелла 1968, стр. 29–32.
- ^ Гринвуд и Эрншоу 2002, стр. 804
- ^ Книн, Роджерс и Симпсон 1972, стр. 264
- ^ Рейнер-Кэнхэм 2018, стр. 203
- ↑ Welcher 2009, стр. 3–32: «Элементы изменяются от ... металлоидов до умеренно активных неметаллов, очень активных неметаллов и благородных газов».
- ^ Макин 2014, стр. 80
- ↑ Джонсон 1966, стр. 105–108.
- ↑ Штейн 1969, стр. 5396‒5397; Питцер 1975, стр. 760‒761
- ^ Рохов 1966, стр. 4; Аткинс и др. 2006, стр. 8, 122–123
- ^ Виберг 2001, стр. 750.
- ^ Дуглас и Мерсье 1982, стр. 723
- ^ Джиллеспи и Робинсон 1959, стр. 418
- ^ Сандерсон 1967, с. 172; Мингос 2019, с. 27
- ↑ Дом 2008, стр. 441
- ^ Мингос 2019, с. 27; Сандерсон 1967, с. 172
- ^ Виберг 2001, стр. 399
- ^ Кленинг и Аппельман 1988, с. 3760
- ^ ab Rao 2002, стр. 22
- ↑ Сидоров 1960, стр. 599–603.
- ^ Макмиллан 2006, стр. 823
- ^ Уэллс 1984, стр. 534
- ^ ab Puddephatt & Monaghan 1989, стр. 59
- ^ Кинг 1995, стр. 182
- ^ Риттер 2011, стр. 10
- ^ Ямагути и Шираи 1996, стр. 3
- ^ Вернон 2020, стр. 223
- ^ Вудворд и др. 1999, стр. 134
- ^ Далтон 2019
Библиография
- Эбботт Д. 1966, Введение в Периодическую таблицу , JM Dent & Sons, Лондон
- Эддисон У. Э. 1964, Аллотропия элементов , Oldbourne Press, Лондон
- Аткинс П.А. и др. 2006, Неорганическая химия Шрайвера и Аткинса , 4-е изд., Oxford University Press, Оксфорд, ISBN 978-0-7167-4878-6
- Эйлуорд Дж. и Финдли Т. 2008, SI Chemical Data , 6-е изд., John Wiley & Sons Australia, Милтон, ISBN 978-0-470-81638-7
- Bache AD 1832, «Очерк химической номенклатуры, предваряющий трактат по химии; Дж. Дж. Берцелиус», American Journal of Science , т. 22, стр. 248–277
- Бейкер и др. PS 1962, Химия и вы , Лайонс и Карнахан, Чикаго
- Barton AFM 2021, Состояния материи, Состояния разума , CRC Press, Бока-Ратон, ISBN 978-0-7503-0418-4
- Beach FC (ред.) 1911, The Americana: Универсальная справочная библиотека , т. XIII, Mel–New, Metalloid, Отдел компиляции Scientific American, Нью-Йорк
- Бирд А., Баттенберг К. и Саткер Б.Дж. 2021, «Антипирены», в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.a11_123.pub2
- Бейсер А. 1987, Концепции современной физики , 4-е изд., McGraw-Hill, Нью-Йорк, ISBN 978-0-07-004473-9
- Беннер СА, Рикардо А и Карриган МА 2018, «Существует ли общая химическая модель жизни во Вселенной?», в Cleland CE и Bedau MA (ред.), Природа жизни: классические и современные перспективы с точки зрения философии и науки , Cambridge University Press, Кембридж, ISBN 978-1-108-72206-3
- Benzhen et al. 2020, Металлы и неметаллы в периодической таблице, Philosophical Transactions of the Royal Society A , т. 378, 20200213
- Бергер Л.И. 1997, Полупроводниковые материалы , CRC Press, Бока-Ратон, ISBN 978-0-8493-8912-2
- Bertomeu-Sánchez JR, Garcia-Belmar A & Bensaude-Vincent B 2002, «В поисках порядка вещей: учебники и химические классификации во Франции девятнадцатого века», Ambix , т. 49, № 3, doi :10.1179/amb.2002.49.3.227
- Берцелиус JJ 1811, «Очерк химической номенклатуры», Journal de Physique, de Chimie, d'Histoire Naturelle , vol. LXXIII, стр. 253–286.
- Бхувалка и др. 2021, «Характеристика изменений в использовании материалов в связи с электрификацией транспортных средств», Environmental Science & Technology, т. 55, № 14, doi : 10.1021/acs.est.1c00970
- Богородицкий Н.П. и Пасынков В.В. 1967, Радио- и электронные материалы , Iliffe Books, Лондон
- Больманн Р. 1992, «Синтез галогенидов», в Winterfeldt E (ред.), Манипуляция гетероатомами , Pergamon Press, Оксфорд, ISBN 978-0-08-091249-3
- Боресков Г.К. 2003, Гетерогенный катализ , Nova Science, Нью-Йорк, ISBN 978-1-59033-864-3
- Брэди Дж. Э. и Сенезе Ф. 2009, Химия: изучение материи и ее изменений , 5-е изд., John Wiley & Sons, Нью-Йорк, ISBN 978-0-470-57642-7
- Бранде В.Т. 1821, Руководство по химии , т. II, Джон Мюррей, Лондон
- Брандт Х. Г. и Вайлер Х., 2000, «Сварка и резка», в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.a28_203
- Брэннт У. Т. 1919, Справочник по приемам и процессам для металлистов , HC Baird & Company, Филадельфия
- Браун Т.Л. и др. 2014, Химия: Центральная наука , 3-е изд., Pearson Australia: Сидней, ISBN 978-1-4425-5460-3
- Burford N, Passmore J & Sanders JCP 1989, «Получение, структура и энергетика гомополиатомных катионов групп 16 (халькогенов) и 17 (галогенов)», в Liebman JF & Greenberg A (ред.), От атомов к полимерам: изоэлектронные аналогии , VCH, Нью-Йорк, ISBN 978-0-89573-711-3
- Байнум У.Ф., Браун Дж. и Портер Р. 1981 (редакторы), Словарь истории науки , Princeton University Press, Принстон, ISBN 978-0-691-08287-5
- Кан Р.В. и Хаасен П., Физическая металлургия: Том 1 , 4-е изд., Elsevier Science, Амстердам, ISBN 978-0-444-89875-3
- Cao C et al. 2021, «Понимание периодической и непериодической химии в периодических таблицах», Frontiers in Chemistry , т. 8, № 813, doi : 10.3389/fchem.2020.00813
- Carapella SC 1968, «Мышьяк» в Hampel CA (ред.), Энциклопедия химических элементов , Рейнхольд, Нью-Йорк
- Carmalt CJ & Norman NC 1998, «Мышьяк, сурьма и висмут: некоторые общие свойства и аспекты периодичности», в Norman NC (ред.), Химия мышьяка, сурьмы и висмута , Blackie Academic & Professional, Лондон, стр. 1–38, ISBN 0-7514-0389-X
- Карраско и др. 2023, «Антимонен: настраиваемый постграфеновый материал для современных приложений в оптоэлектронике, катализе, энергетике и биомедицине», Chemical Society Reviews , т. 52, № 4, стр. 1288–1330, doi : 10.1039/d2cs00570k
- Чаллонер Дж. 2014, Элементы: Новое руководство по строительным блокам нашей Вселенной , Carlton Publishing Group, ISBN 978-0-233-00436-5
- Чемберс E 1743, в "Металл", Энциклопедия: или универсальный словарь искусств и наук (и т.д.) , т. 2, D Midwinter, Лондон
- Chambers C & Holliday AK 1982, Неорганическая химия , Butterworth & Co., Лондон, ISBN 978-0-408-10822-5
- Chandra X-ray Observatory 2018, Круговая диаграмма изобилия , доступ 26 октября 2023 г.
- Чапин Ф.С., Мэтсон П.А. и Витоусек П.М. 2011, Климатическая система Земли, в книге «Принципы экологии наземных экосистем», Springer, Нью-Йорк, ISBN 978-1-4419-9503-2
- Charlier JC, Gonze X, Michenaud JP 1994, "Изучение эффекта стекирования на электронных свойствах графита(ов) из первых принципов", Carbon , т. 32, № 2, стр. 289–99, doi :10.1016/0008-6223(94)90192-9
- Чедд Г. 1969, Элементы на полпути: Технология металлоидов , Double Day, Гарден-Сити, Нью-Йорк
- Chemical Abstracts Service 2021, база данных CAS REGISTRY по состоянию на 2 ноября, дело № 01271182
- Чен К. 1990, Промышленные системы распределения электроэнергии и освещения, Марсель Деккер, Нью-Йорк, ISBN 978-0-8247-8237-5
- Chung DD 1987, «Обзор вспученного графита», Журнал материаловедения , т. 22, doi :10.1007/BF01132008
- Clugston MJ & Flemming R 2000, Advanced Chemistry , Oxford University Press, Оксфорд, ISBN 978-0-19-914633-8
- Кокелл С. 2019, Уравнения жизни: как физика формирует эволюцию , Atlantic Books, Лондон, ISBN 978-1-78649-304-0
- Кук К.Г. 1923, Химия в повседневной жизни: с лабораторным руководством , Д. Эпплтон, Нью-Йорк
- Коттон А. и др. 1999, Advanced Inorganic Chemistry , 6-е изд., Wiley, Нью-Йорк, ISBN 978-0-471-19957-1
- Казинс Д.М., Дэвидсон М.Г. и Гарсия-Виво Д. 2013, «Беспрецедентное участие четырехкоординированного атома водорода в кубановом ядре фенолятов лития и натрия», Chemical Communications , т. 49, doi :10.1039/C3CC47393G
- Кокс П.А. 1997, Элементы: их происхождение, распространенность и распространение , Oxford University Press, Оксфорд, ISBN 978-0-19-855298-7
- Кокс Т. 2004, Неорганическая химия , 2-е изд., BIOS Scientific Publishers, Лондон, ISBN 978-1-85996-289-3
- Crawford FH 1968, Введение в науку физики , Harcourt, Brace & World, Нью-Йорк
- Cressey D 2010, «Химики переосмысливают водородную связь» Архивировано 24.01.2019 в Wayback Machine , Nature newsblog , просмотрено 23 августа 2017 г.
- Крайтон Р. 2012, Биологическая неорганическая химия: Новое введение в молекулярную структуру и функцию , 2-е изд., Elsevier, Амстердам, ISBN 978-0-444-53783-6
- Крисвелл Б. 2007, «Ошибка, когда студенты становятся Менделеевыми всего на один день», Журнал химического образования , т. 84, № 7, стр. 1140–1144, doi :10.1021/ed084p1140
- Crow JM 2013, Возрождение основной группы, Chemistry World , 31 мая, дата обращения 26 декабря 2023 г.
- Csele M 2016, Лазеры , в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.a15_165.pub2
- Далтон Л. 2019, «Аргон реагирует с никелем в условиях скороварки», Chemical & Engineering News , дата обращения 6 ноября 2019 г.
- де Клав E 1651, Nouvelle Lumière philosophique des vrais principes et élémens de Nature, et qualité d'iceux, contre l'opinion commune, Оливье де Варенн, Париж
- Daniel PL и Rapp RA 1976, «Галогенная коррозия металлов», в Fontana MG и Staehle RW (ред.), Advances in Corrosion Science and Technology , Springer, Бостон, doi :10.1007/978-1-4615-9062-0_2
- де Л'Онэ L 1566, Responce au discours de maistre Яака Гревена, доктора Парижа, qu'il a escript contre le livre de maistre Loys de l'Aunay, врача в Ла-Рошели, касающегося факультета Антимуана (Ответ на Речь магистра Жака Гревена... которую он написал против книги мастера Луа де Л'Онэ... Касаясь факультета сурьмы), De l'Imprimerie de Barthelemi Berton, La Rochelle
- Дэвис и др. 2006, «Лазеры на атомарном йоде», в Endo M & Walter RF (редакторы) 2006, Газовые лазеры, CRC Press, Бока-Ратон, Флорида, ISBN 978-0-470-19565-9
- DeKock RL & Gray HB 1989, Химическая структура и связь , University Science Books, Mill Valley, CA, ISBN 978-0-935702-61-3
- Dejonghe L 1998, «Месторождения цинка и свинца в Бельгии», Ore Geology Reviews , т. 12, № 5, 329–354, doi :10.1016/s0169-1368(98)00007-9
- Десаи PD, Джеймс HM и Хо CY 1984, «Электрическое сопротивление алюминия и марганца», Журнал справочных физических и химических данных , т. 13, № 4, doi : 10.1063/1.555725
- Донохью Дж. 1982, Структуры элементов , Роберт Э. Кригер, Малабар, Флорида, ISBN 978-0-89874-230-5
- Дорси МГ 2023, Затаив дыхание: как союзники противостояли угрозе химического оружия во Второй мировой войне , Издательство Корнеллского университета, Итака, Нью-Йорк, стр. 12–13, ISBN 978-1-5017-6837-8
- Дуглас Дж., Мерсье Р. 1982, Кристаллическая структура и ковалентность связей в сульфате мышьяка(III), As 2 (SO 4 ) 3 , Acta Crystallographica Раздел B , vol. 38, нет, 3, 720–723, doi :10.1107/s056774088200394x
- Du Y, Ouyang C, Shi S & Lei M 2010, Ab initio исследования атомных и электронных структур черного фосфора, Журнал прикладной физики , т. 107, № 9, стр. 093718–1–4, doi : 10.1063/1.3386509
- Даффус Дж. Х. 2002, «Тяжелые металлы — бессмысленный термин?», Pure and Applied Chemistry , т. 74, № 5, стр. 793–807, doi :10.1351/pac200274050793
- Дюма JBA 1828, Traité de Chimie Appliquée aux Arts , Béchet Jeune, Париж
- Дюма JBA 1859, Mémoire sur les Équiваленты де Corps Simples , Малле-Башелье, Париж
- Дюпаскье А 1844, Traité élémentaire de chimie industrielle , Шарль Сави Жюэн, Лион
- Иглсон М. 1994, Краткая энциклопедия химии , Вальтер де Грюйтер, Берлин, ISBN 3-11-011451-8
- Earl B & Wilford D 2021, Кембриджский курс химии уровня O , Hodder Education, Лондон, ISBN 978-1-3983-1059-9
- Эдвардс PP 2000, «Что, почему и когда является металлом?», в Hall N (ред.), The New Chemistry , Кембриджский университет, Кембридж, стр. 85–114, ISBN 978-0-521-45224-3
- Эдвардс П.П. и др. 2010, «... металл проводит, а неметалл нет», Philosophical Transactions of the Royal Society A , 2010, т. 368, № 1914, doi :10.1098/rsta.2009.0282
- Эдвардс ПП и Сиенко МДЖ 1983, «О появлении металлических свойств в периодической таблице элементов», Журнал химического образования , т. 60, № 9, doi :10.1021/ed060p691, PMID 25666074
- Эллиот А. 1929, «Спектр полосы поглощения хлора», Труды Королевского общества А. , т. 123, № 792, стр. 629–644, doi :10.1098/rspa.1929.0088
- Эмсли Дж. 1971, Неорганическая химия неметаллов , Methuen Educational, Лондон, ISBN 978-0-423-86120-4
- Эмсли Дж. 2011, «Строительные блоки природы: путеводитель по элементам от А до Я», Oxford University Press, Оксфорд, ISBN 978-0-19-850341-5
- Encyclopaedia Britannica , 2021, Периодическая таблица, дата обращения 21 сентября 2021 г.
- Engesser TA & Krossing I 2013, "Последние достижения в синтезе гомополиатомных катионов неметаллических элементов C , N , P , S , Cl , Br , I и Xe ", Coordination Chemistry Reviews , т. 257, №№ 5–6, стр. 946–955, doi :10.1016/j.ccr.2012.07.025
- Эрман П. и Саймон П. 1808, «Третий отчет профессора Эрмана и государственного архитектора Саймона об их совместных экспериментах», Annalen der Physik , т. 28, № 3, стр. 347–367
- Эванс RC 1966, Введение в кристаллохимию , 2-е изд., Кембриджский университет, Кембридж
- Фарадей М. 1853, Содержание курса из шести лекций о неметаллических элементах (аранжировка Джона Скофферна ), Longman, Brown, Green и Longmans, Лондон
- Филд Дж. Э. (ред.) 1979, Свойства алмаза, Academic Press, Лондон, ISBN 978-0-12-255350-9
- Флорес и др. 2022, «От газовой фазы к твердому состоянию: химическая связь в сверхтяжелом элементе флеровии», Журнал химической физики , т. 157, 064304, doi : 10.1063/5.0097642
- Fortescue JAC 2012, Геохимия окружающей среды: целостный подход , Springer-Verlag, Нью-Йорк, ISBN 978-1-4612-6047-9
- Фокс М. 2010, Оптические свойства твердых тел , 2-е изд., Oxford University Press, Нью-Йорк, ISBN 978-0-19-957336-3
- Fraps GS 1913, Основы агрохимии , The Chemical Publishing Company, Истон, Пенсильвания
- Фраусто да Силва JJR и Уильямс RJP 2001, Биологическая химия элементов: неорганическая химия жизни , 2-е изд., Oxford University Press, Оксфорд, ISBN 978-0-19-850848-9
- Gaffney J & Marley N 2017, Общая химия для инженеров , Elsevier, Амстердам, ISBN 978-0-12-810444-6
- Гангули А. 2012, Основы неорганической химии , 2-е изд., Dorling Kindersley (Индия), Нью-Дели ISBN 978-81-317-6649-1
- Гарго М. и др. (ред.) 2006, Лекции по астробиологии, т. 1, часть 1: Ранняя Земля и другие космические среды обитания жизни , Springer, Берлин, ISBN 978-3-540-29005-6
- Гатти М., Токатли И.В. и Рубио А., 2010, Натрий: изолятор с переносом заряда при высоких давлениях, Physical Review Letters , т. 104, № 21, doi : 10.1103/PhysRevLett.104.216404
- Георгиевский В.И. 1982, Минеральный состав тел и тканей животных, в Георгиевский В.И., Анненков Б.Н. и Самохин В.Т. (ред.), Минеральное питание животных: исследования в области сельскохозяйственных и пищевых наук, Butterworths, Лондон, ISBN 978-0-408-10770-9
- Gillespie RJ, Robinson EA 1959, Система растворителей серной кислоты, в Emeléus HJ, Sharpe AG (редакторы), Advances in Inorganic Chemistry and Radiochemistry , т. 1, стр. 386–424, Academic Press, Нью-Йорк
- Gillham EJ 1956, Полупроводниковый сурьмяный болометр, Journal of Scientific Instruments , т. 33, № 9, doi :10.1088/0950-7671/33/9/303
- Глинка Н 1960, Общая химия , Соболев Д (пер.), Издательство иностранных языков, Москва
- Godfrin H & Lauter HJ 1995, «Экспериментальные свойства 3 He, адсорбированного на графите», в Halperin WP (ред.), Progress in Low Temperature Physics, том 14 , Elsevier Science BV, Амстердам, ISBN 978-0-08-053993-5
- Годовиков А.А. и Ненашева Н. 2020, Структурно-химическая систематика минералов , 3-е изд., Springer, Cham, Швейцария, ISBN 978-3-319-72877-3
- Голдсмит Р. Х. 1982, «Металлоиды», Журнал химического образования , т. 59, № 6, стр. 526–527, doi :10.1021/ed059p526
- Goldwhite H & Spielman JR 1984, Колледж химии , Harcourt Brace Jovanovich, Сан-Диего, ISBN 978-0-15-601561-5
- Гудрич Б.Г. 1844, Взгляд на физические науки , Брэдбери, Соден и Ко., Бостон
- Грешам и др. 2015, Смазка и смазочные материалы, в Энциклопедии химической технологии Кирка-Отмера, John Wiley & Sons, doi : 10.1002/0471238961.1221021802151519.a01.pub3, по состоянию на 3 июня 2024 г.
- Grondzik WT и др. 2010, Механическое и электрическое оборудование для зданий, 11-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-470-19565-9
- Правительство Канады 2015, Периодическая таблица элементов , доступ 30 августа 2015 г.
- Грейвс-младший JL 2022, Голос в пустыне: биолог-новатор объясняет, как эволюция может помочь нам решить наши самые большие проблемы , Basic Books, Нью-Йорк, ISBN 978-1-6686-1610-9 ,
- Грин Д. 2012, Элементы , Scholastic, Саутэм, Уорикшир, ISBN 978-1-4071-3155-9
- Гринберг А. 2007, От алхимии к химии в картинках и рассказах , John Wiley & Sons, Хобокен, Нью-Джерси, 978-0-471-75154-0
- Гринвуд НН 2001, Химия основных групп элементов в новом тысячелетии, Журнал химического общества, Dalton Transactions , № 14, стр. 2055–66, doi : 10.1039/b103917m
- Гринвуд Н.Н. и Эрншоу А. 2002, Химия элементов , 2-е изд., Баттерворт-Хайнеманн, ISBN 978-0-7506-3365-9
- Грохала В. 2018, «О положении гелия и неона в Периодической таблице элементов», Основы химии , т. 20, стр. 191–207, doi :10.1007/s10698-017-9302-7
- Hall RA 2021, Поп-музыка идет на протяжении десятилетия: 2000-е, ABC-CLIO, Санта-Барбара, Калифорния, ISBN 978-1-4408-6812-2
- Haller EE 2006, «Германий: от его открытия до SiGe-устройств», Materials Science in Semiconductor Processing , т. 9, №№ 4–5, дата обращения 9 октября 2013 г.
- Hampel CA & Hawley GG 1976, Глоссарий химических терминов , Van Nostrand Reinhold, Нью-Йорк, ISBN 978-0-442-23238-2
- Hanley JJ & Koga KT 2018, «Галогены в земных и космических геохимических системах: распространенность, геохимическое поведение и аналитические методы» в книге «Роль галогенов в земных и внеземных геохимических процессах: поверхность, кора и мантия» , Harlov DE & Aranovich L (ред.), Springer, Cham, ISBN 978-3-319-61667-4
- Harbison RD, Bourgeois MM и Johnson GT 2015, Промышленная токсикология Гамильтона и Харди , 6-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-470-92973-5
- Hare RA & Bache F 1836, Сборник курса химического обучения на медицинском факультете Пенсильванского университета , 3-е изд., JG Auner, Филадельфия
- Харрис ТМ 1803, Малая энциклопедия , т. III, West & Greenleaf, Бостон
- Hein M & Arena S 2011, Основы университетской химии , 13-е изд., John Wiley & Sons, Хобокен, Нью-Джерси, ISBN 978-0470-46061-0
- Хенгевелд Р. и Федонкин М.А. 2007, «Начальная загрузка потока энергии в начале жизни», Acta Biotheoretica , т. 55, doi :10.1007/s10441-007-9019-4
- Герман ЗС 1999, «Природа химической связи в металлах, сплавах и интерметаллических соединениях по Лайнусу Полингу», в Максич, ЗБ, Орвилл-Томас ВДж (ред.), 1999, Наследие Полинга: Современное моделирование химической связи , Elsevier, Амстердам, doi :10.1016/S1380-7323(99)80030-2
- Hermann A, Hoffmann R & Ashcroft NW 2013, «Конденсированный астат: одноатомный и металлический», Physical Review Letters , т. 111, doi :10.1103/PhysRevLett.111.116404
- Герольд А. 2006, «Расположение химических элементов в нескольких классах внутри периодической таблицы в соответствии с их общими свойствами», Comptes Rendus Chimie , т. 9, № 1, doi :10.1016/j.crci.2005.10.002
- Герцфельд К. 1927, «Об атомных свойствах, которые делают элемент металлом», Physical Review , т. 29, № 5, doi :10.1103/PhysRev.29.701
- Хилл Г., Холман Дж. и Хьюм П. Г. 2017, Химия в контексте , 7-е изд., Oxford University Press, Оксфорд, ISBN 978-0-19-839618-5
- Хоефер Ф. 1845, «Номенклатура и химические классификации» , Ж.-Б. Байер, Париж
- Холдернесс А. и Берри М. 1979, Продвинутый уровень неорганической химии , 3-е изд., Heinemann Educational Books, Лондон, ISBN 978-0-435-65435-1
- Хорват АЛ 1973, «Критическая температура элементов и периодическая система», Журнал химического образования , т. 50, № 5, doi :10.1021/ed050p335
- House JE 2008, Неорганическая химия , Elsevier, Амстердам, ISBN 978-0-12-356786-4
- House JE 2013, Неорганическая химия , 2-е изд., Elsevier, Kidlington, ISBN 978-0-12-385110-9
- Хуан И, 2018 г., Термодинамика коррозии материалов, Хуан И и Чжан Дж. (ред.), Коррозия и защита материалов , Де Грюйтер, Бостон, стр. 25–58, doi : 10.1515/9783110310054-002.
- Хамфри TPJ 1908, «Систематический курс обучения, химия и физика», Pharmaceutical Journal , т. 80, стр. 58
- Хуссейн и др. 2023, «Настройка электронных свойств монослоев дисульфида молибдена посредством легирования с использованием расчетов из первых принципов», Physica Scripta , т. 98, № 2, doi : 10.1088/1402-4896/acacd1
- Imberti C & Sadler PJ, 2020, «150 лет периодической таблицы: новые лекарства и диагностические агенты», в Sadler PJ & van Eldik R 2020, Advances in Inorganic Chemistry , т. 75, Academic Press, ISBN 978-0-12-819196-5
- Периодическая таблица элементов ИЮПАК , дата обращения 11 октября 2021 г.
- Janas D, Cabrero-Vilatela, A & Bulmer J 2013, «Провода из углеродных нанотрубок для работы при высоких температурах», Carbon , т. 64, стр. 305–314, doi :10.1016/j.carbon.2013.07.067
- Дженкинс ГМ и Кавамура К. 1976, Полимерные углероды — углеродное волокно, стекло и уголь , Cambridge University Press, Кембридж, ISBN 978-0-521-20693-8
- Jentzsch AV & Matile S 2015, «Транспорт анионов с галогенными связями», в Metrangolo P & Resnati G (ред.), Галогенные связи I: влияние на химию материалов и науки о жизни , Springer, Cham, ISBN 978-3-319-14057-5
- Jensen WB 1986, Классификация, симметрия и периодическая таблица, Компьютеры и математика с приложениями , т. 12B, №№ 1/2, стр. 487−510, doi :10.1016/0898-1221(86)90167-7
- Джонсон RC 1966, Введение в описательную химию , WA Benjamin, Нью-Йорк
- Jolly WL 1966, Химия неметаллов , Prentice-Hall, Энглвуд Клиффс, Нью-Джерси
- Джонс Б.В. 2010, Плутон: Страж внешней Солнечной системы , Кембриджский университет, Кембридж, ISBN 978-0-521-19436-5
- Jordan JM 2016 «Древняя эпистема и природа ископаемых: исправление современной научной ошибки», История и философия наук о жизни , т. 38, № 1, стр. 90–116, doi :10.1007/s40656-015-0094-6
- Kaiho T 2017, Йод как простой способ , CRC Press, электронная книга, doi : 10.1201/9781315158310
- Keeler J & Wothers P 2013, Химическая структура и реакционная способность: комплексный подход , Oxford University Press, Оксфорд, ISBN 978-0-19-960413-5
- Kemshead WB 1875, Неорганическая химия , William Collins, Sons, & Company, Лондон
- Kernion MC & Mascetta JA 2019, Химия: легкий путь , 6-е изд., Kaplan, Нью-Йорк, ISBN 978-1-4380-1210-0
- King AH 2019, «Наш элементарный след», Nature Materials , т. 18, doi : 10.1038/s41563-019-0334-3
- Кинг Р.Б. 1994, Энциклопедия неорганической химии , т. 3, John Wiley & Sons, Нью-Йорк, ISBN 978-0-471-93620-6
- Кинг Р.Б. 1995, Неорганическая химия элементов главной группы , VCH, Нью-Йорк, ISBN 978-1-56081-679-9
- Кийски и др. 2016, «Удобрения, 1. Общие сведения», в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.a10_323.pub4
- Kläning UK & Appelman EH 1988, "Протолитические свойства перксеновой кислоты", Неорганическая химия , т. 27, № 21, doi :10.1021/ic00294a018
- Книн В.Р., Роджерс М.Дж.В. и Симпсон П. 1972, Химия: факты, закономерности и принципы , Эддисон-Уэсли, Лондон, ISBN 978-0-201-03779-1
- Найт Дж. 2002, Наука повседневных вещей: химия в реальной жизни , Gale Group, Детройт, ISBN 9780787656324
- Кёниг СХ 1962, в Трудах Международной конференции по физике полупроводников , состоявшейся в Эксетере, 16–20 июля 1962 г., Институт физики и Физическое общество, Лондон
- Косанке и др. 2012, Энциклопедический словарь по пиротехнике (и смежным предметам) , часть 3 – от P до Z, Пиротехническая справочная серия № 5, Журнал пиротехники, Уайтуотер, Колорадо, ISBN 978-1-889526-21-8
- Кубашевский О. 1949, «Изменение энтропии, объема и состояния связи элементов при плавлении», Труды Фарадейского общества , т. 45, doi :10.1039/TF9494500931
- Labinger JA 2019, «История (и предыстория) открытия и химии благородных газов», в Giunta CJ, Mainz VV & Girolami GS (ред.), 150 лет Периодической таблице: памятный симпозиум , Springer Nature, Cham, Швейцария, ISBN 978-3-030-67910-1
- Lanford OE 1959, Использование химии , McGraw-Hill, Нью-Йорк
- Larrañaga MD, Lewis RJ & Lewis RA 2016, Сжатый химический словарь Хоули , 16-е изд., Wiley, Хобокен, Нью-Йорк, ISBN 978-1-118-13515-0
- Лавуазье А. 1790, Элементы химии , Р. Керр (перевод), Уильям Крич, Эдинбург
- Ли Дж. Д. 1996, Краткая неорганическая химия , 5-е изд., Blackwell Science, Оксфорд, ISBN 978-0-632-05293-6
- Лемери N 1699, Traité Universel des Drogues Simple, Mises en ordre алфавитный , L d'Houry, Париж, с. 118
- Льюис Р. Дж. 1993, Сжатый химический словарь Хоули , 12-е изд., Van Nostrand Reinhold, Нью-Йорк, ISBN 978-0-442-01131-4
- Льюис RS и Дин WM 1994, «Кинетика реакции оксида азота с кислородом в водных растворах», Химические исследования в токсикологии , т. 7, № 4, стр. 568–574, doi :10.1021/tx00040a013
- Липтрот ГФ 1983, Современная неорганическая химия , 4-е изд., Bell & Hyman, ISBN 978-0-7135-1357-8
- Национальная лаборатория Лос-Аламоса 2021, Периодическая таблица элементов: ресурс для учащихся начальной, средней и старшей школы , дата обращения 19 сентября 2021 г.
- Лундгрен А. и Бенсоде-Винсент Б. 2000, Распространение химии: учебники и их аудитория, 1789–1939 , История науки, Кантон, Массачусетс, ISBN 0-88135-274-8
- MacKay KM, MacKay RA и Henderson W 2002, Введение в современную неорганическую химию , 6-е изд., Nelson Thornes, Cheltenham, ISBN 978-0-7487-6420-4
- Макин М. 2014, Учебное пособие по основам химии , Elsevier Science, Сент-Луис, ISBN 978-0-323-14652-4
- Malone LJ & Dolter T 2008, Основные понятия химии , 8-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-471-74154-1
- Манн и др. 2000, Конфигурационные энергии элементов d-блока, Журнал Американского химического общества , т. 122, № 21, стр. 5132–5137, doi :10.1021/ja9928677
- Маошэн М. 2020, «Благородные газы в твердых соединениях демонстрируют богатое проявление химии при достаточном давлении», Frontiers in Chemistry , т. 8, doi : 10.3389/fchem.2020.570492
- Марони М., Сейферт Б. и Линдвалл Т. (редакторы) 1995, «Физические загрязнители», в книге «Качество воздуха в помещениях: всеобъемлющий справочник» , Elsevier, Амстердам, ISBN 978-0-444-81642-9
- Мартин Дж. В. 1969, Элементарная наука о металлах , Wykeham Publications, Лондон
- Мэтсон М и Орбек AW 2013, Неорганическая химия для чайников , John Wiley & Sons: Хобокен, ISBN 978-1-118-21794-8
- Матула РА 1979, «Электрическое сопротивление меди, золота, палладия и серебра», Журнал справочных физических и химических данных , т. 8, № 4, doi : 10.1063/1.555614
- Mazej Z 2020, «Химия благородных газов более чем полвека после первого сообщения о соединении благородных газов», Molecules , т. 25, № 13, doi : 10.3390/molecules25133014, PMID 32630333, PMC 7412050
- Макмиллан П. 2006, «Стакан углекислого газа», Nature , т. 441, doi :10.1038/441823a
- Менделеев Д.И. 1897, Принципы химии , т. 2, 5-е изд., перевод Г. Каменского, А.Дж. Гринуэя (ред.), Longmans, Green & Co., Лондон
- Месслер-младший RW 2011, Сущность материалов для инженеров , Jones and Bartlett Learning, Садбери, Массачусетс, ISBN 978-0-7637-7833-0
- Мьюс и др. 2019, «Коперниций: релятивистская благородная жидкость», Angewandte Chemie International Edition , vol. 58, стр. 17964–17968, номер документа : 10.1002/anie.201906966.
- Mingos DMP 2019, «Открытие элементов в Периодической таблице», в Mingos DMP (ред.), Периодическая таблица I. Структура и связь , Springer Nature, Cham, doi : 10.1007/978-3-030-40025-5
- Мёллер Т. 1958, Качественный анализ: Введение в химию равновесия и растворов , Макгроу-Хилл, Нью-Йорк
- Мёллер Т. и др. 1989, Химия: с неорганическим качественным анализом , 3-е изд., Academic Press, Нью-Йорк, ISBN 978-0-12-503350-3
- Муди Б. 1991, Сравнительная неорганическая химия , 3-е изд., Эдвард Арнольд, Лондон, ISBN 978-0-7131-3679-1
- Мур Дж. Т. 2016, Химия для чайников , 2-е изд., гл. 16, Отслеживание периодических тенденций, John Wiley & Sons: Hoboken, ISBN 978-1-119-29728-4
- Morely HF & Muir MM 1892, Словарь химии Уатта , т. 3, Longman's Green, and Co., Лондон
- Мосс, TS 1952, Фотопроводимость в элементах , Butterworths Scientific, Лондон
- Майерс РТ 1979, «Физические и химические свойства и связь металлических элементов», Журнал химического образования , т. 56, № 11, стр. 712–73, doi :10.1021/ed056p71
- Ободовский И. 2015, Основы радиационной и химической безопасности , Elsevier, Амстердам, ISBN 978-0-12-802026-5
- Одерберг ДС 2007, Настоящий эссенциализм , Routledge, Нью-Йорк, ISBN 978-1-134-34885-5
- Ostriker JP & Steinhardt PJ 2001, «Квинтэссенция вселенной», Scientific American , т. 284, № 1, стр. 46–53 PMID 11132422, doi :10.1038/scientificamerican0101-46
- Оксфордский словарь английского языка 1989, «неметалл»
- Orisakwe OE 2012, Другие тяжелые металлы: сурьма, кадмий, хром и ртуть, в Pacheco-Torgal F, Jalali S & Fucic A (ред.), Токсичность строительных материалов , Woodhead Publishing, Оксфорд, стр. 297–333, doi :10.1533/9780857096357.297
- Парамесваран П и др. 2020, «Эволюция фаз и характеристика механически легированного гексанарного сплава Al 16,6 Mg 16,6 Ni 16,6 Cr 16,6 Ti 16,6 Mn 16,6 с высокой энтропией», Metal Powder Report , т. 75, № 4, doi : 10.1016/j.mprp.2019.08.001
- Parish RV 1977, Металлические элементы , Longman, Лондон, ISBN 978-0-582-44278-8
- Партингтон Дж. Р. 1944, Учебник неорганической химии , 5-е изд., Macmillan & Co., Лондон
- Партингтон Дж. Р. 1964, История химии , т. 4, Macmillan, Лондон
- Паско К.Дж. 1982, Введение в свойства конструкционных материалов , 3-е изд., Von Nostrand Reinhold (Великобритания), Уокингем, Беркшир, ISBN 978-0-442-30233-7
- Полинг Л. 1947, Общая химия: Введение в описательную химию и современную химическую теорию , WH Freeman, Сан-Франциско
- Павлицкий Т., Скандербег Д.Дж. и Старкшалл Г. 2016, Физика лучевой терапии Хенди , 4-е изд., John Wiley & Sons, Хобокен, Нью-Джерси, стр. 228, ISBN 978-0-470-37651-5
- Петрушевский В.М. и Цветкович Дж. 2018, «Об «истинном положении» водорода в Периодической таблице», Основы химии , т. 20, стр. 251–260, doi :10.1007/s10698-018-9306-y
- Phillips CSG & Williams RJP 1965, Неорганическая химия , т. 1, Принципы и неметаллы, Clarendon Press, Оксфорд
- Питцер К. 1975, «Фториды радона и элементы 118», Журнал химического общества, Chemical Communications , № 18, doi : 10.1039/C3975000760B
- Porterfield WW 1993, Неорганическая химия , Academic Press, Сан-Диего, ISBN 978-0-12-562980-5
- Povh B & Rosina M 2017, Рассеяние и структуры: основы и аналогии в квантовой физике , 2-е изд., Springer, Берлин, doi : 10.1007/978-3-662-54515-7
- Powell P & Timms P 1974, Химия неметаллов , Chapman and Hall, Лондон, ISBN 978-0-412-12200-2
- Power PP 2010, Элементы главной группы как переходные металлы, Nature , т. 463, 14 января 2010 г., стр. 171–177, doi :10.1038/nature08634
- Пуддефатт Р. Дж. и Монаган П. К. 1989, Периодическая таблица элементов , 2-е изд., Clarendon Press, Оксфорд, ISBN 978-0-19-855516-2
- Рам М., Зенг Т. и Хоффманн Р. 2019, «Электроотрицательность, рассматриваемая как средняя энергия связи валентных электронов в основном состоянии», Журнал Американского химического общества , т. 141, № 1, стр. 342–351, doi : 10.1021/jacs.8b10246
- Рамдор П. 1969, Рудные минералы и их срастания , Pergamon Press, Оксфорд
- Rao CNR & Ganguly PA 1986, "Новый критерий металличности элементов", Solid State Communications , т. 57, № 1, стр. 5–6, doi :10.1016/0038-1098(86)90659-9
- Рао К. Я. 2002, Структурная химия стекол, Elsevier, Оксфорд, ISBN 0-08-043958-6
- Рейнер-Кэнем Г. 2018, «Организация переходных металлов», в книге Шерри Э. и Рестрепо Г. (ред.) Менделеев — Оганесон: междисциплинарный взгляд на периодическую таблицу , Оксфордский университет, Нью-Йорк, ISBN 978-0-190-668532
- Рейнер-Кэнем Г. 2020, Периодическая таблица: прошлое, настоящее и будущее , World Scientific, Нью-Джерси, ISBN 978-981-121-850-7
- Редмер Р., Хенсель Ф. и Хольст Б. (редакторы) 2010, «Переходы металл-неметалл», Springer, Берлин, ISBN 978-3-642-03952-2
- Реньо М.В. 1853, Элементы химии , т. 1, 2-е изд., Кларк и Гессер, Филадельфия
- Рейлли С. 2002, Загрязнение пищевых продуктов металлами , Blackwell Science, Оксфорд, ISBN 978-0-632-05927-0
- Reinhardt et al. 2015, Инертирование в химической промышленности, Линде, Пуллах, Германия, дата обращения 19 октября 2021 г.
- Remy H 1956, Трактат по неорганической химии , Anderson JS (перевод), Kleinberg J (редактор), т. II, Elsevier, Амстердам
- Ренуф Э. 1901, «Lehrbuch der Anorganischen Chemie», Science , vol. 13, нет. 320, номер домена : 10.1126/science.13.320.268
- Рестрепо Г., Льянос Э.Дж. и Меса Х. 2006, «Топологическое пространство химических элементов и его свойства», Журнал математической химии , т. 39, doi :10.1007/s10910-005-9041-1
- Рик Г.Д. 1967, Вольфрам и его соединения , Pergamon Press, Оксфорд
- Риттер СК 2011, «Дело о пропавшем ксеноне», Chemical & Engineering News , т. 89, № 9, ISSN 0009-2347
- Рохов Э.Г. 1966, Металлоиды , DC Heath and Company, Бостон
- Rosenberg E 2013, Германийсодержащие соединения, современные знания и применение, в Kretsinger RH, Uversky VN & Permyakov EA (редакторы), Encyclopedia of Metalloproteins , Springer, New York, doi :10.1007/978-1-4614-1533-6_582
- Роско Х. Э. и Шорлеммер, FRS 1894, Трактат по химии: Том II: Металлы , D Appleton, Нью-Йорк
- Королевское химическое общество 2021, Периодическая таблица: неметаллы, дата обращения 3 сентября 2021 г.
- Rudakiya DM и Patel Y 2021, Биоремедиация металлов, металлоидов и неметаллов, в Panpatte DG и Jhala YK (редакторы), Микробное омоложение загрязненной среды , т. 2, Springer Nature, Сингапур, стр. 33–49, doi : 10.1007/978-981-15-7455-9_2
- Рудольф Дж. 1973, Химия для современного разума , Macmillan, Нью-Йорк
- Рассел А.М. и Ли К.Л. 2005, Зависимость структуры от свойств цветных металлов, Wiley-Interscience, Нью-Йорк, ISBN 0-471-64952-X
- Салинас Дж. Т. 2019 Исследование физической науки в лаборатории , Moreton Publishing, Энглвуд, Колорадо, ISBN 978-1-61731-753-8
- Зальцберг Х.В. 1991, От пещерного человека к химику: обстоятельства и достижения , Американское химическое общество, Вашингтон, округ Колумбия, ISBN 0-8412-1786-6
- Сандерсон РТ 1967, Неорганическая химия , Рейнхольд, Нью-Йорк
- Шерри Э. (ред.) 2013, 30-секундные элементы: 50 самых важных элементов, каждый из которых объясняется за полминуты , Ivy Press, Лондон, ISBN 978-1-84831-616-4
- Шерри Э. 2020, Периодическая таблица: ее история и ее значение , Oxford University Press, Нью-Йорк, ISBN 978-0-19091-436-3
- Шефер Дж. К. 1968, «Бор» в Хэмпеле, Калифорния (ред.), Энциклопедия химических элементов , Рейнхольд, Нью-Йорк
- Шмедт ауф дер Гюнне Дж., Мангстл М. и Краус Ф. 2012, «Присутствие дифтора F 2 в природе — доказательство in situ и количественная оценка методом ЯМР-спектроскопии», Angewandte Chemie International Edition , vol. 51, нет. 31, дои : 10.1002/anie.201203515
- Швейцер Г.К. и Пестерфилд Л.Л. 2010, Водная химия элементов , Oxford University Press, Оксфорд, ISBN 978-0-19-539335-4
- Скотт Д. 2014, Вокруг света за 18 элементов , Королевское химическое общество, электронная книга, ISBN 978-1-78262-509-4
- Скотт Э.К. и Канда ФА 1962, Природа атомов и молекул: общая химия , Harper & Row, Нью-Йорк
- Скотт УАХ 2001, Основные факты о химии , 5-е изд., HarperCollins, Глазго, ISBN 978-0-00-710321-8
- Seese WS & Daub GH 1985, Основы химии , 4-е изд., Prentice-Hall, Englewood Cliffs, NJ, ISBN 978-0-13-057811-2
- Сигал Б.Г. 1989, Химия: Эксперимент и теория , 2-е изд., John Wiley & Sons, Нью-Йорк, ISBN 0-471-84929-4
- Shanabrook BV, Lannin JS и Hisatsune IC 1981, "Неупругое рассеяние света в однократно координированном аморфном полупроводнике", Physical Review Letters , т. 46, № 2, 12 января, doi :10.1103/PhysRevLett.46.130
- Шан и др. 2021, «Сверхтвердый объемный аморфный углерод из сколлапсировавшего фуллерена», Nature , т. 599, стр. 599–604, doi :10.1038/s41586-021-03882-9
- Щукарев С.А. 1977, Новые взгляды на систему Д.И. Менделеева. I. Периодичность стратиграфии электронных оболочек атомов в системе и концепция кайносимметрии, Журнал общей химии , т. 47, № 2, с. 246–259
- Школьников Е.В. 2010, "Термодинамическая характеристика амфотерности оксидов M 2 O 3 (M = AS , Sb , Bi ) и их гидратов в водных средах", Журнал прикладной химии , т. 83, № 12, с. 2121–2127, doi :10.1134/S1070427210120104
- Сидоров Т.А. 1960, «Связь между структурными окислами и их склонностью к стеклованию», Стекло и керамика , т. 17, № 11, doi :10.1007BF00670116
- Siekierski S & Burgess J 2002, Краткая химия элементов , Horwood Press, Чичестер, ISBN 978-1-898563-71-6
- Slye OM Jr 2008, «Огнетушающие вещества», в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.a11_113.pub2
- Смит А. 1906, Введение в неорганическую химию , The Century Co., Нью-Йорк
- Смит А. и Дуайер К. 1991, Ключевая химия: Исследование химии в современном мире: Книга 1: Материалы и повседневная жизнь , Издательство Мельбурнского университета, Карлтон, Виктория, ISBN 978-0-522-84450-4
- Смит Д.В. 1990, Неорганические вещества: прелюдия к изучению описательной химии , Cambridge University Press, Кембридж, ISBN 978-0-521-33136-4
- Смитс и др. 2020, «Оганесон: благородный газовый элемент, который не является ни благородным, ни газом», Angewandte Chemie International Edition , т. 59, стр. 23636–23640, doi : 10.1002/anie.202011976
- Smulders E & Sung E 2011, «Стиральные порошки, 2, Ингредиенты и продукты», в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.o15_o13
- Спенсер Дж. Н., Боднер Г. М., Рикард Л. Ю. 2012, Химия: Структура и динамика , 5-е изд., John Wiley & Sons, Хобокен, ISBN 978-0-470-58711-9
- Stein L 1969, «Окисленный радон в растворах фторида галогена», Журнал Американского химического общества , т. 19, № 19, doi : 10.1021/ja01047a042
- Штейн Л. 1983, «Химия радона», Radiochimica Acta , т. 32, doi :10.1524/ract.1983.32.13.163
- Штойдель Р. 2020, Химия неметаллов: синтезы – структуры – связь – применение , в сотрудничестве с Д. Шешкевицем, Берлин, Вальтером де Грюйтером, doi : 10.1515/9783110578065
- Still B 2016 Тайная жизнь Периодической таблицы , Касселл, Лондон, ISBN 978-1-84403-885-5
- Стиллман Дж. М. 1924, История ранней химии , Д. Эпплтон, Нью-Йорк
- Стотт РВА 1956, Справочник по физической и неорганической химии , Longmans, Green and Co, Лондон
- Stuke J 1974, «Оптические и электрические свойства селена», в Zingaro RA & Cooper WC (ред.), Selenium , Van Nostrand Reinhold, Нью-Йорк, стр. 174
- Strathern P 2000, Сон Менделеева: Поиски элементов , Hamish Hamilton, Лондон, ISBN 9780425184677
- Suresh CH & Koga NA 2001, «Последовательный подход к атомным радиусам», Журнал физической химии A , т. 105, № 24. doi : 10.1021/jp010432b
- Тан и др. 2021, «Синтез паракристаллического алмаза», Nature , т. 599, стр. 605–610, doi :10.1038/s41586-021-04122-w
- Taniguchi M, Suga S, Seki M, Sakamoto H, Kanzaki H, Akahama Y, Endo S, Terada S и Narita S 1984, "Резонансная фотоэмиссия, вызванная остовным экситоном в ковалентном полупроводниковом черном фосфоре", Solid State Communications , т. 1. 49, № 9, стр. 867–7, doi :10.1016/0038-1098(84)90441-1
- Тейлор, доктор медицины, 1960 г., «Первые принципы химии» , Ван Ностранд, Принстон
- Химические новости и журнал физической науки 1864, «Объявления о книгах: Справочник металлоидов», т. 9, стр. 22
- Химические новости и журнал физической науки 1897, «Объявления о книгах: Руководство по химии, теоретическое и практическое», автор У. А. Тилден, том 75, стр. 188–189
- Thornton BF & Burdette SC 2010, «Finding eka-iodine: Discovery priority in modern times», Bulletin for the History of Chemistry , т. 35, № 2, по состоянию на 14 сентября 2021 г.
- Tidy CM 1887, Справочник по современной химии , 2-е изд., Smith, Elder & Co., Лондон
- Timberlake KC 1996, Химия: Введение в общую, органическую и биологическую химию , 6-е изд., HarperCollinsCollege, ISBN 978-0-673-99054-9
- Toon R 2011, «Открытие фтора», Образование в области химии , Королевское химическое общество, дата обращения 7 октября 2023 г.
- Трегартен Л. 2003, Вводная химия , Macmillan Education: Мельбурн, ISBN 978-0-7329-9011-4
- Тайлер ПМ 1948, С самого начала: факты и цифры горнодобывающей промышленности США , Макгроу-Хилл, Нью-Йорк
- Василакис А.А., Калемос А. и Мавридис А. 2014, "Точные расчеты первых принципов для фторида хлора ClF и его ионов ClF ± ", Theoretical Chemistry Accounts , т. 133, № 1436, doi :10.1007/s00214-013-1436-7
- Вернон Р. 2013, «Какие элементы являются металлоидами?», Журнал химического образования , т. 90, № 12, стр. 1703‒1707, doi :10.1021/ed3008457
- Вернон Р. 2020, «Организация металлов и неметаллов», Основы химии , т. 22, стр. 217‒233 doi :10.1007/s10698-020-09356-6 (открытый доступ)
- Vij et al. 2001, Полиазотная химия. Синтез, характеристика и кристаллическая структура удивительно стабильных фторантимонатных солей N 5+ . Журнал Американского химического общества , т. 123, № 26, стр. 6308−6313, doi :10.1021/ja010141g
- Вехтерсхойзер Г. 2014, «От химической инвариантности к генетической изменчивости», в Вейганд В. и Шоллхаммер П. (ред.), Биовдохновленный катализ: комплексы металлов и серы , Wiley-VCH, Вайнхайм, doi : 10.1002/9783527664160.ch1
- Уэйкман TH 1899, «Свободная мысль — прошлое, настоящее и будущее», Free Thought Magazine , т. 17
- Wang HS, Lineweaver CH и Ireland TR 2018, Содержание элементов (с неопределенностями) на планете, наиболее похожей на Землю, Icarus , т. 299, стр. 460–474, doi : 10.1016/j.icarus.2017.08.024
- Wasewar KL 2021, «Усиление подходов к удалению селена», в Devi et al. (ред.), Загрязнение воды селеном , John Wiley & Sons, Хобокен, стр. 319–355, ISBN 978-1-119-69354-3
- Weeks ME и Leicester HM 1968, Открытие элементов , 7-е изд., Журнал химического образования , Истон, Пенсильвания
- Weetman C & Inoue S 2018, Пройденный путь: После того, как элементы основной группы стали переходными металлами, ChemCatChem , т. 10, № 19, стр. 4213–4228, doi : 10.1002/cctc.201800963
- Уэлчер СХ 2009, Высокие оценки: Regents Chemistry Made Easy , 2-е изд., Высокие оценки Made Easy, Нью-Йорк, ISBN 978-0-9714662-0-3
- Уэллер и др. 2018, Неорганическая химия , 7-е изд., Oxford University Press, Оксфорд, ISBN 978-0-19-252295-5
- Уэллс А.Ф. 1984, Структурная неорганическая химия , 5-е изд., Clarendon Press, Оксфорд, ISBN 978-0-19-855370-0
- Уайт Дж. Х. 1962, Неорганическая химия: продвинутый и стипендиальный уровни , Издательство Лондонского университета, Лондон
- Уайтфорд Г. Х. и Коффин Р. Г. 1939, Основы университетской химии , 2-е изд., Mosby Co., Сент-Луис
- Whitten KW & Davis RE 1996, Общая химия , 5-е изд., Saunders College Publishing, Филадельфия, ISBN 978-0-03-006188-2
- Вибо П. 1951, Органическая химия , Elsevier Publishing Company, Нью-Йорк
- Wiberg N 2001, Неорганическая химия , Academic Press, Сан-Диего, ISBN 978-0-12-352651-9
- Williams RPJ 2007, «Жизнь, окружающая среда и наша экосистема», Журнал неорганической биохимии , т. 101, №№ 11–12, doi :10.1016/j.jinorgbio.2007.07.006
- Windmeier C & Barron RF 2013, «Криогенная технология», в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.b03_20.pub2
- Winstel G 2000, «Электролюминесцентные материалы и устройства», в Энциклопедии промышленной химии Ульмана, doi :10.1002/14356007.a09_255
- Висмер Р.К. 1997, Учебное пособие для студентов, Общая химия: принципы и современные приложения, 7-е изд., Prentice Hall, Upper Saddle River, ISBN 978-0-13-281990-9
- Вудворд и др. 1999, «Электронная структура оксидов металлов», в Fierro JLG (ред.), Оксиды металлов: химия и применение , CRC Press, Бока-Ратон, ISBN 1-4200-2812-X
- Всемирный экономический форум 2021 г., Визуализация распространенности элементов в земной коре, дата обращения 21 марта 2024 г.
- Вульфсберг Г. 2000, Неорганическая химия , University Science Books, Саусалито, Калифорния, ISBN 978-1-891389-01-6
- Ямагучи М. и Шираи Я. 1996, «Дефектные структуры», в книге Столофф Н.С. и Сикка В.К. (ред.), Физическая металлургия и обработка интерметаллических соединений , Chapman & Hall, Нью-Йорк, ISBN 978-1-4613-1215-4
- Yang J 2004, «Теория теплопроводности», в Tritt TM (ред.), Теплопроводность: теория, свойства и применение , Kluwer Academic/Plenum Publishers, Нью-Йорк, стр. 1–20, ISBN 978-0-306-48327-1
- Инь и др. 2018, Водородное замещение теллура в монослоях дисульфида молибдена с регулируемым составом после роста, Нанотехнология , т. 29, № 14, doi : 10.1088/1361-6528/aaabe8
- Yoder CH, Suydam FH и Snavely FA 1975, Химия , 2-е изд., Harcourt Brace Jovanovich, Нью-Йорк, ISBN 978-0-15-506470-6
- Young JA 2006, "Йод", Журнал химического образования , т. 83, № 9, doi :10.1021/ed083p1285
- Янг и др. 2018, Общая химия: Сначала атомы , Cengage Learning: Бостон, ISBN 978-1-337-61229-6
- Чжао Дж., Ту З. и Чан Ш. 2021, «Механизм углеродной коррозии и стратегии смягчения в топливном элементе с протонообменной мембраной (PEMFC): обзор», Журнал источников питания , т. 488, № 229434, doi : 10.1016/j.jpowsour.2020.229434
- Жигальский ГП и Джонс БК 2003, Физические свойства тонких металлических пленок , Тейлор и Фрэнсис, Лондон, ISBN 978-0-415-28390-8
- Чжу В 2020, Химические элементы в жизни , World Scientific, Сингапур, ISBN 978-981-121-032-7
- Чжу и др. 2014, «Реакции ксенона с железом и никелем предсказаны во внутреннем ядре Земли», Nature Chemistry , т. 6, doi :10.1038/nchem.1925, PMID 24950336
- Чжу и др. 2022, Введение: основная концепция бора и его физические и химические свойства, в книге «Основы и применение химии бора» , т. 2, Чжу И. (ред.), Elsevier, Амстердам, ISBN 978-0-12-822127-3
- Zumdahl SS & DeCoste DJ 2010, Введение в химию: Основы , 7-е изд., Cengage Learning, Мейсон, Огайо, ISBN 978-1-111-29601-8








