Входящий выпрямляющий калиевый канал
| Внутренний выпрямляющий калиевый канал | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура внутреннего выпрямляющего калиевого канала | |||||||||
| Идентификаторы | |||||||||
| Символ | ИРК | ||||||||
| Пфам | ПФ01007 | ||||||||
| Клан ПФАМ | CL0030 | ||||||||
| ИнтерПро | IPR013521 | ||||||||
| СКОП2 | 1n9p / SCOPe / SUPFAM | ||||||||
| TCDB | 1.А.2 | ||||||||
| суперсемейство OPM | 8 | ||||||||
| белок ОПМ | 3СПГ | ||||||||
| |||||||||
Каналы внутреннего выпрямления калия ( K ir , IRK ) являются специфическим липид-зависимым подмножеством калиевых каналов . На сегодняшний день в различных типах клеток млекопитающих, [1] растениях [2] и бактериях идентифицировано семь подсемейств . [3] Они активируются фосфатидилинозитол-4,5-бисфосфатом ( PIP 2 ). Нарушение работы каналов было связано с несколькими заболеваниями. [4] [5] Каналы IRK обладают пористым доменом, гомологичным таковому у потенциалзависимых ионных каналов , и фланкирующими трансмембранными сегментами (TMS). Они могут существовать в мембране в виде гомо- или гетероолигомеров , и каждый мономер обладает от 2 до 4 TMS. С точки зрения функции эти белки транспортируют калий (K + ) , с большей тенденцией к поглощению K + , чем к экспорту K + . [3] Процесс внутреннего выпрямления был открыт Денисом Ноблом в клетках сердечной мышцы в 1960-х годах [6] и Ричардом Адрианом и Аланом Ходжкиным в 1970 году в клетках скелетных мышц. [7]
Обзор внутреннего исправления
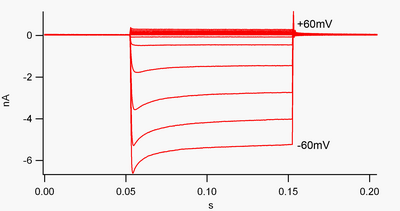
Канал, который является "внутренне-выпрямляющим", - это тот, который пропускает ток (положительный заряд) легче вовнутрь (в клетку), чем наружу (из клетки). Считается, что этот ток может играть важную роль в регуляции нейронной активности, помогая стабилизировать мембранный потенциал покоя клетки.
По соглашению, входящий ток (положительный заряд, движущийся в клетку) отображается в зажиме напряжения как отклонение вниз, в то время как исходящий ток (положительный заряд, движущийся из клетки) отображается как отклонение вверх. При мембранных потенциалах, отрицательных по отношению к потенциалу реверсии калия , выпрямляющие внутрь каналы K + поддерживают поток положительно заряженных ионов K + в клетку, подталкивая мембранный потенциал обратно к потенциалу покоя. Это можно увидеть на рисунке 1: когда мембранный потенциал зафиксирован отрицательно по отношению к потенциалу покоя канала (например, -60 мВ), течет входящий ток (т. е. положительный заряд течет в клетку). Однако, когда мембранный потенциал установлен положительным по отношению к потенциалу покоя канала (например, +60 мВ), эти каналы пропускают очень мало тока. Проще говоря, этот канал пропускает гораздо больше тока во внутреннем направлении, чем наружу, в своем рабочем диапазоне напряжений. Эти каналы не являются идеальными выпрямителями, так как они могут пропускать некоторый исходящий ток в диапазоне напряжений примерно до 30 мВ выше потенциала покоя.
Эти каналы отличаются от калиевых каналов, которые обычно отвечают за реполяризацию клетки после потенциала действия , таких как отсроченный выпрямитель и калиевые каналы типа А. Эти более «типичные» калиевые каналы преимущественно переносят внешние (а не внутренние) калиевые токи при деполяризованных мембранных потенциалах и могут рассматриваться как «внешне выпрямляющие». Когда впервые было обнаружено внутреннее выпрямление, его назвали «аномальным выпрямлением», чтобы отличить его от внешних калиевых токов. [8]
Внутренние выпрямители также отличаются от тандемных поровых доменных калиевых каналов , которые в значительной степени ответственны за токи «утечки» K + . [9] Некоторые внутренние выпрямители, называемые «слабыми внутренними выпрямителями», переносят измеримые внешние токи K + при напряжениях, положительных по отношению к потенциалу реверсии K + (соответствующих, но больших, чем небольшие токи выше линии 0 нА на рисунке 1). Они, вместе с каналами «утечки», устанавливают мембранный потенциал покоя клетки. Другие внутренние выпрямляющие каналы, называемые «сильными внутренними выпрямителями», переносят очень небольшой внешний ток вообще и в основном активны при напряжениях, отрицательных по отношению к потенциалу реверсии K + , где они переносят внутренний ток (гораздо большие токи ниже линии 0 нА на рисунке 1). [10]
Механизм внутреннего исправления
Феномен внутреннего выпрямления каналов K ir является результатом высокоаффинного блока эндогенными полиаминами , а именно спермином , а также ионами магния , которые закупоривают поры канала при положительных потенциалах, что приводит к уменьшению внешних токов. Этот зависящий от напряжения блок полиаминами приводит к эффективному проведению тока только во внутреннем направлении. Хотя основная идея полиаминного блока понятна, конкретные механизмы все еще остаются спорными. [11]
Активация через PIP2
Для активации всех каналов K ir необходим фосфатидилинозитол 4,5-бисфосфат (PIP 2 ). [12] PIP 2 связывается с K ir 2.2 и напрямую активирует его, обладая свойствами агониста. [13] В этом отношении каналы K ir являются ионными каналами, управляемыми лигандом PIP 2 .
Роль
Каналы K ir обнаружены во многих типах клеток, включая макрофаги , сердечные и почечные клетки, лейкоциты , нейроны и эндотелиальные клетки . Опосредуя небольшой деполяризующий ток K + при отрицательных мембранных потенциалах, они помогают установить мембранный потенциал покоя, а в случае группы K ir 3 они помогают опосредовать ингибирующие нейротрансмиттерные реакции, но их роли в клеточной физиологии различаются в зависимости от типа клеток:
| Расположение | Функция |
|---|---|
| сердечные миоциты | Каналы K ir закрываются при деполяризации, замедляя реполяризацию мембраны и помогая поддерживать более длительный потенциал действия сердца . Этот тип канала внутреннего выпрямления отличается от каналов K + с задержкой выпрямления , которые помогают реполяризовать нервные и мышечные клетки после потенциалов действия ; и каналов утечки калия , которые обеспечивают большую часть основы для мембранного потенциала покоя . |
| эндотелиальные клетки | Каналы K ir участвуют в регуляции синтазы оксида азота . |
| почки | K ir экспортирует избыток калия в собирательные трубочки для выведения с мочой или, в качестве альтернативы, может участвовать в обратном поглощении калия организмом. |
| нейронах и в клетках сердца | Активированные G-белком IRK (K ir 3) являются важными регуляторами, модулируемыми нейротрансмиттерами. Мутация в канале GIRK2 приводит к мутации мышей Weaver. Мутантные мыши «Weaver» атаксичны и демонстрируют нейровоспалительную дегенерацию своих дофаминергических нейронов. [14] По сравнению с неатаксичными контрольными животными, мутанты Weaver имеют дефицит координации движений и изменения в региональном метаболизме мозга. [15] Мыши Weaver изучались в лабораториях, занимающихся развитием нервной системы и болезнями, на протяжении более 30 лет. |
| бета-клетки поджелудочной железы | Каналы K АТФ (состоящие из субъединиц K ir 6.2 и SUR1 ) контролируют высвобождение инсулина. |
Регулирование
Зависимость от напряжения может регулироваться внешним K + , внутренним Mg 2+ , внутренним АТФ и/или G-белками . Домены P каналов IRK демонстрируют ограниченное сходство последовательностей с таковыми из семейства VIC. Внутренние выпрямители играют роль в установке клеточных мембранных потенциалов, и закрытие этих каналов при деполяризации допускает возникновение длительных потенциалов действия с фазой плато. Внутренние выпрямители не имеют внутренних спиралей, чувствительных к напряжению, обнаруженных во многих каналах семейства VIC. В некоторых случаях, например, у Kir1.1a, Kir6.1 и Kir6.2, было предложено прямое взаимодействие с членом суперсемейства ABC для придания уникальных функциональных и регуляторных свойств гетеромерному комплексу, включая чувствительность к АТФ. Эти АТФ-чувствительные каналы обнаружены во многих тканях организма. Они делают активность канала чувствительной к цитоплазматическому соотношению АТФ/АДФ (увеличение АТФ/АДФ закрывает канал). Человеческие рецепторы сульфонилмочевины SUR1 и SUR2 (spQ09428 и Q15527 соответственно) являются белками ABC, которые регулируют каналы Kir6.1 и Kir6.2 в ответ на АТФ, а CFTR (TC #3.A.1.208.4) может регулировать Kir1.1a. [16]
Структура
Определены кристаллическая структура [17] и функция [18] бактериальных членов семейства IRK-C. KirBac1.1 из Burkholderia pseudomallei состоит из 333 аминокислотных остатков (aas) с двумя N-концевыми TMS, фланкирующими P-петлю (остатки 1-150), а C-концевая половина белка гидрофильна. Он транспортирует одновалентные катионы с селективностью: K ≈ Rb ≈ Cs ≫ Li ≈ Na ≈ NMGM (протонированный N -метил- D -глюкамин ). Активность ингибируется Ba 2+ , Ca 2+ и низким pH. [18]
Классификация
Существует семь подсемейств каналов K ir , обозначаемых как K ir 1 – K ir 7. [1] Каждое подсемейство имеет несколько членов (например, K ir 2.1, K ir 2.2, K ir 2.3 и т. д.), которые имеют почти идентичные аминокислотные последовательности среди известных видов млекопитающих.
Каналы K ir образуются из гомотетрамерных мембранных белков. Каждая из четырех идентичных белковых субъединиц состоит из двух трансмембранных альфа-спиралей (M1 и M2). Гетеротетрамеры могут образовываться между членами одного и того же подсемейства (т. е. K ir 2.1 и K ir 2.3), когда каналы сверхэкспрессируются.
Разнообразие
| Ген | Белок | Псевдонимы | Ассоциированные субъединицы |
|---|---|---|---|
| KCNJ1 | К ир 1.1 | РОМК1 | NHERF2 |
| KCNJ2 | К ир 2.1 | ИРК1 | Кир 2.2 , Кир 4.1 , ПСД-95 , САП97 , АКАП79 |
| KCNJ12 | К ир 2.2 | ИРК2 | K ir 2.1 и K ir 2.3 образуют гетеромерный канал, вспомогательная субъединица: SAP97, Veli-1 , Veli-3 , PSD-95 |
| KCNJ4 | К ир 2.3 | ИРК3 | K ir 2.1 и K ir 2.3 образуют гетеромерный канал, PSD-95, Chapsyn-110 /PSD-93 |
| KCNJ14 | К ир 2.4 | ИРК4 | K ir 2.1 для формирования гетеромерного канала |
| KCNJ3 | К ир 3.1 | GIRK1, КГА | К ир 3.2, К ир 3.4, К ир 3.5, К ир 3.1 сам по себе не функционален |
| KCNJ6 | К ир 3.2 | GIRK2 | K ir 3.1, K ir 3.3, K ir 3.4 для формирования гетеромерного канала |
| KCNJ9 | К ир 3.3 | GIRK3 | K ir 3.1, K ir 3.2 для формирования гетеромерного канала |
| KCNJ5 | К ир 3.4 | GIRK4 | К ир 3.1, К ир 3.2, К ир 3.3 |
| KCNJ10 | К ир 4.1 | К ир 1.2 | K ir 4.2, K ir 5.1 и K ir 2.1 для формирования гетеромерных каналов |
| KCNJ15 | К ир 4.2 | К ир 1.3 | |
| KCNJ16 | К ир 5.1 | БИР 9 | |
| KCNJ8 | К ир 6.1 | К АТФ | SUR2B |
| KCNJ11 | К ир 6.2 | К АТФ | SUR1 , SUR2A и SUR2B |
| KCNJ13 | К ир 7.1 | К ир 1.4 |
Заболевания, связанные с Кирканалы
- Стойкая гиперинсулинемическая гипогликемия младенчества связана с аутосомно-рецессивными мутациями в K ir 6.2. Определенные мутации этого гена снижают способность канала регулировать секрецию инсулина, что приводит к гипогликемии .
- Синдром Барттера может быть вызван мутациями в каналах K ir . Это состояние характеризуется неспособностью почек перерабатывать калий, что приводит к низкому уровню калия в организме.
- Синдром Андерсена — редкое заболевание, вызванное множественными мутациями K ir 2.1. В зависимости от мутации он может быть доминантным или рецессивным. Он характеризуется периодическим параличом , сердечной аритмией и дисморфическими чертами. (См. также KCNJ2 )
- Отравление барием , вероятно, связано с его способностью блокировать K -ir -каналы.
- Атеросклероз (заболевание сердца) может быть связан с K ir каналами. Потеря токов K ir в эндотелиальных клетках является одним из первых известных показателей атерогенеза (начала заболевания сердца).
- Тиреотоксический гипокалиемический периодический паралич связан с измененной функцией K ir 2.6. [19]
- Синдром EAST/SeSAME вызван мутациями в гене KCNJ10. [20]
Смотрите также
Ссылки
- ^ ab Kubo Y, Adelman JP, Clapham DE, Jan LY, Karschin A, Kurachi Y, et al. (декабрь 2005 г.). «Международный союз фармакологии. LIV. Номенклатура и молекулярные связи внутренне выпрямляющих калиевых каналов». Pharmacological Reviews . 57 (4): 509– 26. doi :10.1124/pr.57.4.11. PMID 16382105. S2CID 11588492.
- ^ Хедрич Р., Моран О., Конти Ф., Буш Х., Беккер Д., Гамбале Ф. и др. (1995). «Внутренние выпрямительные калиевые каналы у растений отличаются от своих животных аналогов в ответ на модуляторы напряжения и каналов». European Biophysics Journal . 24 (2): 107–15 . doi :10.1007/BF00211406. PMID 8582318. S2CID 12718513.
- ^ ab "1.A.2 Inward Rectifier K Channel (IRK-C) Family". TCDB . Получено 2016-04-09 .
- ^ Hansen SB (май 2015 г.). «Агонизм липидов: парадигма PIP2 лиганд-управляемых ионных каналов». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов . 1851 (5): 620– 8. doi :10.1016/j.bbalip.2015.01.011. PMC 4540326. PMID 25633344 .
- ^ Авраам MR, Джахангир A, Алексеев AE, Терзич A (ноябрь 1999). «Каналопатии внутренне выпрямляющих калиевых каналов». FASEB Journal . 13 (14): 1901– 10. doi : 10.1096/fasebj.13.14.1901 . PMID 10544173. S2CID 22205168.
- ^ Нобл, Денис (декабрь 1965 г.). «Электрические свойства сердечной мышцы, обусловленные направленным внутрь (аномальным) выпрямлением». Журнал клеточной и сравнительной физиологии . 66 (S2): 127– 135. doi :10.1002/jcp.1030660520. ISSN 0095-9898.
- ^ Adrian RH, Chandler WK, Hodgkin AL (июль 1970). «Медленные изменения проницаемости калия в скелетных мышцах». The Journal of Physiology . 208 (3): 645–68 . doi :10.1113/jphysiol.1970.sp009140. PMC 1348790. PMID 5499788 .
- ^ Бертил Хилле (2001). Ионные каналы возбудимых мембран 3-е изд. (Sinauer: Sunderland, MA), стр. 151. ISBN 0-87893-321-2 .
- ↑ Хилле, стр. 155.
- ↑ Хилле, стр. 153.
- ^ Лопатин АН, Махина ЕН, Николс КГ (ноябрь 1995). «Механизм внутреннего выпрямления калиевых каналов: «закупорка длинных пор» цитоплазматическими полиаминами». Журнал общей физиологии . 106 (5): 923–55 . doi :10.1085/jgp.106.5.923. PMC 2229292. PMID 8648298 .
- ^ Tucker SJ, Baukrowitz T (май 2008). «Как высокозаряженные анионные липиды связывают и регулируют ионные каналы». Журнал общей физиологии . 131 (5): 431– 8. doi :10.1085/jgp.200709936. PMC 2346576. PMID 18411329 .
- ^ Hansen SB, Tao X, MacKinnon R (август 2011). "Структурная основа активации PIP2 классического внутреннего выпрямительного канала K+ Kir2.2". Nature . 477 (7365): 495– 8. Bibcode :2011Natur.477..495H. doi :10.1038/nature10370. PMC 3324908 . PMID 21874019.
- ^ Peng J, Xie L, Stevenson FF, Melov S, Di Monte DA, Andersen JK (ноябрь 2006 г.). «Нигростриатальная дофаминергическая нейродегенерация у мышей-ткачей опосредуется нейровоспалением и облегчается введением миноциклина». The Journal of Neuroscience . 26 (45): 11644– 51. doi :10.1523/JNEUROSCI.3447-06.2006. PMC 6674792 . PMID 17093086.
- ^ Strazielle C, Deiss V, Naudon L, Raisman-Vozari R, Lalonde R (октябрь 2006 г.). «Региональные мозговые вариации активности цитохромоксидазы и координации движений у мышей с мутацией Girk2(Wv) (Weaver)». Neuroscience . 142 (2): 437– 49. doi :10.1016/j.neuroscience.2006.06.011. PMID 16844307. S2CID 33064439.
- ^ Заявка WO 0190360, Wei MH, Chaturvedi K, Guegler K, Webster M, Ketchum KA, Di Francesco V, Beasley E, «Изолированные транспортные белки человека, молекулы нуклеиновых кислот, кодирующие транспортные белки человека, и их применение», опубликована 29 ноября 2001 г., передана Apperla Corporation
- ^ Kuo A, Gulbis JM, Antcliff JF, Rahman T, Lowe ED, Zimmer J, et al. (Июнь 2003). «Кристаллическая структура калиевого канала KirBac1.1 в закрытом состоянии». Science . 300 (5627): 1922– 6. Bibcode :2003Sci...300.1922K. doi : 10.1126/science.1085028 . PMID 12738871. S2CID 2703162.
- ^ ab Enkvetchakul D, Bhattacharyya J, Jeliazkova I, Groesbeck DK, Cukras CA, Nichols CG (ноябрь 2004 г.). "Функциональная характеристика прокариотического канала Kir". Журнал биологической химии . 279 (45): 47076– 80. doi : 10.1074/jbc.C400417200 . PMC 8629170. PMID 15448150 .
- ^ Райан DP, да Силва MR, Сунг TW, Фонтейн B, Дональдсон MR, Кунг AW и др. (январь 2010 г.). «Мутации в калиевом канале Kir2.6 вызывают восприимчивость к тиреотоксическому гипокалиемическому периодическому параличу». Cell . 140 (1): 88– 98. doi :10.1016/j.cell.2009.12.024. PMC 2885139 . PMID 20074522.
- ^ Bockenhauer D, Feather S, Stanescu HC, Bandulik S, Zdebik AA, Reichold M и др. (май 2009 г.). «Эпилепсия, атаксия, нейросенсорная глухота, тубулопатия и мутации KCNJ10». The New England Journal of Medicine . 360 (19): 1960–70 . doi :10.1056/NEJMoa0810276. PMC 3398803. PMID 19420365 .
Дальнейшее чтение
- Хилле Б. (2001). Ионные каналы возбудимых мембран (3-е изд.). Сандерленд, Массачусетс: Sinauer. стр. 149–154 . ISBN 0-87893-321-2.
Внешние ссылки
- Внутренние+Выпрямительные+Каналы+в разделе « Медицинские предметные рубрики » Национальной медицинской библиотеки США (MeSH).
- «Внутренне ректифицирующие калиевые каналы». База данных рецепторов и ионных каналов IUPHAR . Международный союз фундаментальной и клинической фармакологии.
- UMich Ориентация белков в мембранах семейства/семейство-85 - Пространственное положение внутренних выпрямляющих калиевых каналов в мембранах.