Активация связи углерод-водород
В органической химии и металлоорганической химии активация связи углерод–водород ( активация C−H ) представляет собой тип органической реакции , в которой связь углерод–водород разрывается и заменяется связью C−X ( X ≠ H обычно является элементом основной группы, таким как углерод , кислород или азот ). Некоторые авторы далее ограничивают термин активация C–H реакциями, в которых связь C–H, которая обычно считается «нереакционноспособной», взаимодействует с центром переходного металла M, что приводит к ее разрыву и образованию металлоорганических видов со связью M–C. Промежуточный продукт этого шага (иногда называемый шагом активации C−H ) затем может подвергаться последующим реакциям с другими реагентами, либо in situ (часто позволяя использовать переходный металл в каталитическом количестве), либо на отдельном шаге, чтобы получить функционализированный продукт . [1]

Альтернативный термин функционализация C−H используется для описания любой реакции, которая преобразует относительно инертную связь C−H в связь C−X , независимо от механизма реакции (или с агностическим отношением к нему). В частности, это определение не требует, чтобы расщепленная связь C–H изначально взаимодействовала с переходным металлом в механизме реакции. [2] В отличие от металлоорганической разновидности, этот расширенный тип активации CH широко используется в промышленности и в природе. Это более широкое определение охватывает все реакции, которые подпадают под ограниченное определение активации C–H, данное выше. Однако оно также включает катализируемые железом реакции гидроксилирования алканов C–H, которые протекают через механизм отскока кислорода (например, ферменты цитохрома P450 и их синтетические аналоги), в которых металлоорганические виды, как полагают, не участвуют в механизме. В других случаях металлоорганические виды участвуют косвенно. Это происходит, например, в катализируемых Rh(II) процессах внедрения C–H , в которых генерируется электрофильный металлический карбеновый вид, а углеводородная связь C–H внедряется в карбеновый углерод без прямого взаимодействия углеводорода с металлом. Другие механистические возможности, не включающие прямой разрыв связи C–H металлом, включают (i) образование арилметаллических соединений по механизму электрофильного ароматического замещения (обычно для электрофильных соединений Pd, Pt, Au, Hg ), (ii) разрыв связи C–H посредством отрыва атома водорода радикалом с центром на O или N, который затем может вступать в дальнейшую реакцию и подвергаться функционализации с образованием или без образования металлоорганического промежуточного соединения (например, реакция Хараша-Сосновского ), и (iii) депротонирование связи C–H в α-положении π-системы, которому способствует начальное образование π-комплекса с электрофильным металлом для образования нуклеофильных металлоорганических соединений (например, комплексами циклопентадиенилжелеза ).
Часто, когда авторы проводят различие между функционализацией C–H и активацией C–H , они ограничивают последнюю узким смыслом. Однако может быть сложно окончательно продемонстрировать участие или неучастие взаимодействия между связью C–H и металлом до разрыва связи. В этой статье обсуждаются реакции функционализации C–H в целом, но с акцентом на активацию C–H в узком смысле .
Классификация
Механизмы активации CH металлическими центрами можно разделить на три основные категории:
- (i) Окислительное присоединение , при котором низковалентный металлический центр встраивается в углерод-водородную связь, что приводит к разрыву связи и окислению металла:
- ДпМ + РН → ДпМ ( Р)(Н )
- (ii) Электрофильная активация, при которой электрофильный металл атакует углеводород, вытесняя протон:
- L n M + + RH → L n MR + H +
- Один особенно распространенный вариант этой категории, известный как согласованное металлирование-депротонирование , включает в себя лигированное внутреннее основание (часто карбоксилат, например, ацетат или пивалат), одновременно принимающее смещенный протон внутримолекулярно.
- (iii) Метатезис сигма-связи , который протекает через «четырехцентровое» переходное состояние , в котором связи разрываются и образуются за один шаг:
- L n MX + RH → L n MR + XH
Исторический обзор
Первую реакцию активации C–H часто приписывают Отто Димроту , который в 1902 году сообщил, что бензол реагирует с ацетатом ртути(II) (см.: ртутьорганические соединения ). Многие электрофильные металлические центры подвергаются этой реакции, подобной реакции Фриделя-Крафтса. Джозеф Чатт наблюдал присоединение связей CH нафталина комплексами Ru(0). [3]
Распространены активации CH с участием хелатирования. Шунсуке Мурахаши сообщил о кобальт -катализируемой хелатировании с участием CH-функционализации 2-фенилизоиндолин-1-она из ( E )-N,1-дифенилметанимина. [4]

В 1969 году А. Е. Шилов сообщил, что тетрахлороплатинат калия индуцирует изотопную скремблировку между метаном и тяжелой водой . Было предложено, что этот путь включает связывание метана с Pt(II). В 1972 году группа Шилова смогла получить метанол и метилхлорид в аналогичной реакции с участием стехиометрического количества тетрахлороплатината калия , каталитического гексахлороплатината калия , метана и воды. Из-за того, что Шилов работал и публиковался в Советском Союзе в эпоху холодной войны , его работа была в значительной степени проигнорирована западными учеными. Эта так называемая система Шилова сегодня является одной из немногих настоящих каталитических систем для функционализации алканов . [1] [5]
В некоторых случаях открытия в активации CH были сделаны в сочетании с открытиями кросс-сочетания . В 1969 году [6] Юдзо Фудзивара сообщил о синтезе ( E )-1,2-дифенилэтена из бензола и стирола с Pd(OAc) 2 и Cu (OAc) 2 , процедура очень похожая на кросс-сочетание. В категории окислительного присоединения MLH Green в 1970 году сообщил о фотохимической вставке вольфрама (в виде комплекса Cp2WH2 ) в связь C–H бензола [7], а Джордж М. Уайтсайдс в 1979 году был первым , кто осуществил внутримолекулярную алифатическую активацию C–H [8].

Следующий прорыв был независимо озвучен двумя исследовательскими группами в 1982 году. RG Bergman сообщил о первой межмолекулярной активации C–H, опосредованной переходными металлами, неактивированных и полностью насыщенных углеводородов путем окислительного присоединения. Используя фотохимический подход, фотолиз Cp*Ir(PMe 3 )H 2 , где Cp* представляет собой пентаметилциклопентадиенильный лиганд, привел к координационно ненасыщенным видам Cp*Ir(PMe 3 ), которые реагировали посредством окислительного присоединения с циклогексаном и неопентаном с образованием соответствующих гидридоалкильных комплексов Cp*Ir(PMe 3 )HR, где R = циклогексил и неопентил соответственно. [9] WAG Graham обнаружил, что те же углеводороды реагируют с Cp*Ir(CO) 2 при облучении, давая родственные алкилгидридные комплексы Cp*Ir(CO) HR, где R = циклогексил и неопентил соответственно. [10] В последнем примере предполагается, что реакция протекает через окислительное присоединение алкана к 16-электронному промежуточному соединению иридия(I), Cp*Ir(CO), образованному при облучении Cp*Ir(CO) 2 .
Селективная активация и функционализация связей C–H алканов была описана с использованием вольфрамового комплекса, снабженного пентаметилциклопентадиенильными , нитрозильными , аллильными и неопентильными лигандами, Cp*W(NO)(η 3 -аллил)(CH 2 CMe 3 ). [11]

Активация связи C–H пентана, как показано в работе Ledgzdins et al., J. Am. Chem. Soc. 2007; 129, 5372–3.
В одном примере, включающем эту систему, алкан пентан селективно преобразуется в галогенуглерод 1-иодпентан . Это преобразование было достигнуто посредством термолиза Cp*W(NO)(η 3 -аллил)(CH 2 CMe 3 ) в пентане при комнатной температуре , что приводит к устранению неопентана с помощью процесса псевдопервого порядка, генерируя необнаруживаемый электронно и стерически ненасыщенный 16-электронный промежуточный продукт, который координируется η 2 -бутадиеновым лигандом. Последующая межмолекулярная активация молекулы растворителя пентана затем дает 18-электронный комплекс, обладающий н -пентильным лигандом. На отдельном этапе реакция с иодом при -60 °C высвобождает 1-иодпентан из комплекса.
Механистическое понимание
Одним из подходов к улучшению химических реакций является понимание лежащего в основе механизма реакции . Для отслеживания динамики химической реакции можно использовать спектроскопические методы с временным разрешением . Этот метод требует триггера для инициирования процесса, которым в большинстве случаев является освещение соединения. Фотоинициированные реакции комплексов переходных металлов с алканами служат мощными модельными системами для понимания разрыва прочной связи CH. [9] [10]

В таких системах образец освещается УФ-светом, который возбуждает металлический центр, что приводит к диссоциации лиганда. Эта диссоциация создает высокореакционноспособный, электронодефицитный 16-электронный промежуточный продукт с вакантным координационным центром. Затем этот вид связывается с молекулой алкана, образуя σ-комплекс (координация связи CH). На третьем этапе атом металла встраивается в связь CH, разрывая ее и давая алкил (или арил)металлгидрид.
Промежуточные продукты и их кинетику можно наблюдать с помощью спектроскопических методов с временным разрешением (например, TR- IR , TR- XAS , TR- RIXS ). Инфракрасная спектроскопия с временным разрешением (TR-IR) является довольно удобным методом наблюдения за этими промежуточными продуктами. Однако она ограничена только комплексами, которые имеют ИК-активные лиганды, и склонна к исправлению назначений на фемтосекундной шкале времени из-за лежащего в основе колебательного охлаждения. Чтобы ответить на вопрос о различии в реакционной способности для различных комплексов, необходимо исследовать их электронную структуру. Этого можно достичь с помощью рентгеновской абсорбционной спектроскопии (XAS) или резонансного неупругого рассеяния рентгеновских лучей (RIXS). Эти методы использовались для отслеживания этапов активации CH с орбитальным разрешением и предоставления подробного понимания ответственных взаимодействий для разрыва связи CH. [12] [13]
Полная характеристика структуры метана, связанного с металлическим центром, была представлена Джиролами в 2023 году: исследования изотопного возмущения равновесия (IPE) с участием дейтерированных изотопологов показали, что метан связывается с металлическим центром через один мостик M···HC; изменения в константах связи 1 J CH ясно указывают на то, что структура лиганда метана значительно возмущена относительно свободной молекулы. [14]
Направленная активация CH
Направленная, хелатирующая или «управляемая» активация CH включает направляющие группы , которые влияют на регио- и стереохимию. [15] Это наиболее полезный стиль активации CH в органическом синтезе. N,N-диметилбензиламин легко подвергается циклометаллированию многими переходными металлами. [16] Полупрактическая реализация включает слабо координирующие направляющие группы, как показано на примере реакции Мураи . [17]

Механизм реакций активации CH, катализируемых Pd, 2-фенилпиридина включает промежуточное соединение металлацикла. Промежуточное соединение окисляется с образованием вида Pd IV , за которым следует восстановительное элиминирование с образованием связи CO и высвобождением продукта. [18]

Борилирование
Преобразование связей CH в связи CB посредством борирования было тщательно исследовано из-за их полезности в синтезе (например, для реакций кросс-сочетания). Джон Ф. Хартвиг сообщил о высокорегиоселективном борировании арена и алкана, катализируемом родиевым комплексом. В случае алканов наблюдалась исключительная терминальная функционализация. [19]

Позднее было обнаружено, что рутениевые катализаторы обладают более высокой активностью и совместимостью функциональных групп. [20]
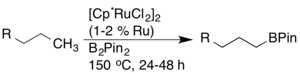
Также были разработаны другие катализаторы борирования, включая катализаторы на основе иридия, которые активируют связи CH с высокой совместимостью. [21] [22] [23]
Для получения более подробной информации обратитесь к разделу Борилирование .
Природный газ
Хотя химикам не удалось разработать коммерческий процесс селективной активации метана CH, такая реакция является основой обратного метаногенеза . В этом катализируемом никелем процессе метан преобразуется в метильный заместитель кофермента M , CH 3 SCH 2 CH 2 SO−3. [24]
Природный метан не используется в качестве химического сырья, несмотря на его обилие и низкую стоимость. Современные технологии изумительно используют метан путем парового риформинга для производства синтез-газа , смеси оксида углерода и водорода. Затем этот синтез-газ используется в реакциях Фишера-Тропша для получения продуктов с более длинной углеродной цепью или метанола, одного из важнейших промышленных химических видов сырья. [25] [26] Интригующий метод преобразования этих углеводородов включает активацию CH. Например, Рой А. Периана сообщил, что комплексы, содержащие поздние переходные металлы, такие как Pt , Pd , Au и Hg , реагируют с метаном (CH4 ) в H2SO4 , образуя метилбисульфат . [ 27] [28] Однако этот процесс не был реализован в коммерческих целях.
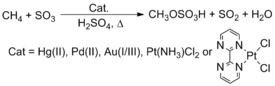
Асимметричные активации CH

Полный синтез литоспермовой кислоты использует управляемую функционализацию CH на поздней стадии для высокофункционализированной системы. Направляющая группа, хиральный нерацемический имин, способна выполнять внутримолекулярное алкилирование, что позволяет катализируемое родием превращение имина в дигидробензофуран. [30]

Полный синтез калотриксина А и В характеризуется внутримолекулярной катализируемой Pd реакцией кросс-сочетания через активацию CH, примером направленной активации CH. Кросс-сочетание происходит между арильными связями CI и CH с образованием связи CC. [31] Синтез аналога мескалина использует катализируемое родием энантиоселективное аннулирование арилимина через активацию CH. [32]

Изомеризация алкенов
Одним из типов полезных активаций связи CH переходного металла является изомеризация алкенов . Признаны по крайней мере два механизма. Для гидридов алкенов-металлов изомеризация может протекать через миграционную вставку с последующим устранением бета-гидрида. Этот процесс является основой обхода цепи . Другим механизмом изомеризации алкенов является преобразование комплекса алкена в комплекс аллил-гидрида . [33]
Смотрите также
- Активация связи углерод-углерод
- Окислительная связь метана
- Перекрестная дегидрогенизационная связь [реакция CDC]
- система Шилова
- Мета-селективная функционализация CH
Старые обзоры
- До 2004 г.
- Arndtsen, BA; Bergman, RG; Mobley, TA; Peterson, TH (1995). «Селективная активация межмолекулярной связи углерод–водород синтетическими металлическими комплексами в гомогенном растворе». Accounts of Chemical Research . 28 (3): 154– 162. doi :10.1021/ar00051a009.
- Crabtree, RH (2001). «Активация и функционализация алканов C–H с помощью гомогенных катализаторов на основе переходных металлов: столетие прогресса – новое тысячелетие в перспективе». J. Chem. Soc., Dalton Trans . 17 (17): 2437– 2450. doi :10.1039/B103147N.
- 2004-7
- Crabtree, RH (2004). «Активация металлоорганических алканов CH». J. Organomet. Chem . 689 (24): 4083– 4091. doi :10.1016/j.jorganchem.2004.07.034. S2CID 95482372.
- Металлоорганическая активация связи C–H: введение Алан С. Голдман и Карен И. Голдберг Серия симпозиумов Американского химического общества 885, Активация и функционализация связей C–H, 2004 , 1–43
- Periana, RA; Bhalla, G.; Tenn, WJ; III; Young, KJH; Liu, XY; Mironov, O.; Jones, C.; Ziatdinov, VR (2004). «Перспективы некоторых проблем и подходов к разработке следующего поколения селективных низкотемпературных катализаторов окисления для гидроксилирования алканов на основе реакции активации C–H». Journal of Molecular Catalysis A: Chemical . 220 (1): 7– 25. doi :10.1016/j.molcata.2004.05.036.
- Лерш, М. Тилсет (2005). «Механистические аспекты активации C−H комплексами Pt». Chem. Rev. 105 ( 6): 2471– 2526. doi :10.1021/cr030710y. PMID 15941220., Ведерников, АН (2007). "Последние достижения в области платино-опосредованной функционализации связи CH". Curr. Org. Chem . 11 (16): 1401– 1416. doi :10.2174/138527207782418708.
- 2008-2011
- Davies, HML; Manning, JR (2008). "Каталитическая функционализация C–H с помощью вставки металлкарбеноида и нитреноида". Nature . 451 (7177): 417– 424. Bibcode :2008Natur.451..417D. doi :10.1038/nature06485. PMC 3033428 . PMID 18216847.
- Boutadla, Y.; Davies, DL; Macgregor, SA; Poblador-Bahamonde, AI (2009). «Механизмы активации связи C–H: богатая синергия между вычислениями и экспериментом». Dalton Trans . 2009 (30): 5820– 5831. doi :10.1039/B904967C. PMID 19623381.
- Венсель-Делорд, Дж.; Дроге, Т.; Лю, Ф.; Глориус, Ф. (2011). «К умеренной активации связи C–H, катализируемой металлами». Chem. Soc. Rev. 40 (9): 4740– 4761. doi :10.1039/C1CS15083A. PMID 21666903.
- Шульпин, ГБ (2010). «Повышение селективности при функционализации связей C–H: обзор». Org. Biomol. Chem . 8 (19): 4217– 4228. doi :10.1039/c004223d. PMID 20593075.
- Lyons, TW; Sanford, MS (2010). «Реакции функционализации C–H, катализируемые палладием и направляемые лигандом». Chem. Rev. 110 ( 2): 1147– 1169. doi : 10.1021/cr900184e. PMC 2836499. PMID 20078038.* Балселлс, Д.; Клот, Э.; Эйзенштейн, О. (2010). «Активация связи C–H в переходных металлических соединениях с точки зрения вычислений». Chem. Rev. 110 ( 2): 749– 823. doi :10.1021/cr900315k. PMID 20067255.
- 2012-2015
- Хашигучи, Б.Г.; Бишоф, СМ; Конник, ММ; Периана, РА (2012). «Проектирование катализаторов для функционализации неактивированных связей C–H на основе реакции активации CH». Acc. Chem. Res . 45 (6): 885– 898. doi :10.1021/ar200250r. PMID 22482496.
- Kuhl, N.; Hopkinson, MN; Wencel-Delord, J.; Glorius, F. (2012). «За пределами направляющих групп: катализируемая переходными металлами активация CH простых аренов». Angew. Chem. Int. Ed . 51 (41): 10236– 10254. doi :10.1002/anie.201203269. PMID 22996679.
- Венсель-Делорд, Дж.; Глориус, Ф. (2013). «Активация связи C–H обеспечивает быстрое построение и диверсификацию функциональных молекул на поздней стадии». Nature Chemistry . 5 (5): 369– 375. Bibcode :2013NatCh...5..369W. doi :10.1038/nchem.1607. PMID 23609086.
Дополнительные источники
- Часто задаваемые вопросы Бергмана в журнале Nature об активации CH (2007)
- Презентация литературы Рамтохула в группе Штольца о применении активации СН
- PowerPoint по работе Джона Беркоу
- Центр селективной функционализации СН
Ссылки
- ^ ab Gandeepan, Parthasarathy; Müller, Thomas; Zell, Daniel; Cera, Gianpiero; Warratz, Svenja; Ackermann, Lutz (2019). "3d Transition Metals for C–H Activation". Chemical Reviews . 119 (4): 2192– 2452. doi :10.1021/acs.chemrev.8b00507. PMID 30480438. S2CID 53726772.
- ^ Альтус, Кристоф М.; Лав, Дженнифер А. (10.12.2021). «Континуум механизмов активации углерод–водород (C–H) и терминология». Химия коммуникаций . 4 (1): 1– 11. doi :10.1038/s42004-021-00611-1. ISSN 2399-3669. PMC 9814233 .
- ^ Чатт, Дж.; Дэвидсон, Дж. М. (1965). «Таутомерия ареновых и дитретичных фосфиновых комплексов рутения(0) и получение новых типов гидридных комплексов рутения(II)». J. Chem. Soc. 1965 : 843. doi :10.1039/JR9650000843.
- ^ Мурахаси, Шунсуке (1955-12-01). «Синтез фталимидинов из оснований Шиффа и оксида углерода». Журнал Американского химического общества . 77 (23): 6403– 6404. doi :10.1021/ja01628a120. ISSN 0002-7863.
- ^ Фекл, У.; Голдберг, КИ (2003). Гомогенная активация связи CH углеводорода и функционализация платиной . Достижения в неорганической химии. Т. 54. С. 259–320 . doi :10.1016/S0898-8838(03)54005-3. ISBN 9780120236541.
- ^ Фудзивара, Юзо; Норитани, Ичиро; Данно, Садао; Асано, Рюдзо; Тераниши, Сиичиро (1 декабря 1969 г.). «Ароматическое замещение олефинов. VI. Арилирование олефинов ацетатом палладия (II)». Журнал Американского химического общества . 91 (25): 7166–7169 . doi :10.1021/ja01053a047. ISSN 0002-7863. ПМИД 27462934.
- ^ Грин, ML; Ноулз, PJ (1970). «Образование производных фенилгидрида вольфрама из бензола». J. Chem. Soc. D. 24 ( 24): 1677. doi :10.1039/C29700001677.
- ^ Фоли, Пол; Уайтсайдс, Джордж М. (1979). «Термическое образование бис(триэтилфосфин)-3,3-диметилплатинациклобутана из динеопентилбис(триэтилфосфин)платины(II)». J. Am. Chem. Soc. 101 (10): 2732– 2733. doi :10.1021/ja00504a041.
- ^ ab Janowicz, Andrew H.; Bergman, Robert G. (1982). «Углерод-водородная активация в насыщенных углеводородах: прямое наблюдение M + R−H → M(R)(H)». J. Am. Chem. Soc. 104 (1): 352– 354. doi :10.1021/ja00365a091.
- ^ ab Хойано, Джеймс К.; Грэм, Уильям АГ (1982). «Окислительное присоединение связей углерод–водород неопентана и циклогексана к фотохимически полученному комплексу иридия(I)». J. Am. Chem. Soc. 104 (13): 3723– 3725. doi :10.1021/ja00377a032.
- ^ Baillie, Rhett A.; Legzdins, Peter (2013). «Отличительная активация и функционализация углеводородных связей C–H, инициированных комплексами Cp*W(NO)(η 3 -allyl)(CH 2 CMe 3 )». Acc. Chem. Res . 47 (2): 330– 340. doi :10.1021/ar400108p. PMID 24047442.
- ^ Джей, Рафаэль М.; Банерджи, Амбар; Лейтнер, Торстен; Ван, Ру-Пан; Харич, Джессика; Стефануик, Роберт; Викмарк, Хампус; Коутс, Майкл Р.; Бил, Эмма В.; Кабанова, Виктория; Кахраман, Абдулла; Вах, Анна; Озеров, Дмитрий; Аррелл, Кристофер; Джонсон, Филип Дж. М. (2023-06-02). «Отслеживание активации C–H с орбитальным разрешением». Science . 380 (6648): 955– 960. doi :10.1126/science.adf8042. ISSN 0036-8075. PMID 37262165. S2CID 259002884.
- ^ Баннерджи, Амбар; Джей, Рафаэль М.; Лейтнер, Торстен; Ванг, Ру-Пан; Харич, Джессика; Стефануик, Роберт; Коутс, Майкл Р.; Бил, Эмма В.; Кабанова, Виктория (2023-07-26). Оценка металл-специфических орбитальных взаимодействий в активации CH с использованием резонансного неупругого рассеяния рентгеновских лучей (отчет). Химия. doi :10.26434/chemrxiv-2023-fm49h.
- ^ Sempsrott, Peter J.; Trinh, Brian B.; Flener Lovitt, Charity; Capra, Nicolas E.; Girolami, Gregory S. (2023-06-09). "Комплекс метана осмия (II): выяснение способа координации метана". Science Advances . 9 (23): eadg8130. doi :10.1126/sciadv.adg8130. PMC 10256148. PMID 37294762 .
- ^ Брюкл, Т.; Бакстер, РД; Исихара, Й.; Баран , П.С. (2012). «Врожденная и управляемая логика функционализации CH». Accounts of Chemical Research . 45 (6): 826– 839. doi :10.1021/ar200194b. PMC 3288638. PMID 22017496.
- ^ Chetcuti, Michael J.; Ritleng, Vincent (2007). «Формирование комплекса рутения с ареном, циклометаллирование с замещенным бензиламином и вставка алкина». J. Chem. Educ . 84 (6): 1014. Bibcode :2007JChEd..84.1014C. doi :10.1021/ed084p1014.
- ^ Мурай, Синдзи; Какиучи, Фумитоши; Секине, Шинья; Танака, Ясуо; Каматани, Асаюки; Сонода, Мотохиро; Чатани, Наото (1993). «Эффективное каталитическое присоединение ароматических углерод-водородных связей к олефинам». Природа . 366 (6455): 529–531 . Бибкод : 1993Natur.366..529M. дои : 10.1038/366529a0. S2CID 5627826.
- ^ Lyons, TW; Sanford, MS (2010). "Palladium-Catalyzed Ligand-Directed C–H Functionalization Reactions". Chem. Rev. 110 ( 2): 1147– 1169. doi :10.1021/cr900184e. PMC 2836499. PMID 20078038 .
- ^ Чэнь, Хуэйюань; Шлехт, Сабина; Семпл, Томас К.; Хартвиг, Джон Ф. (2000). «Термическая, каталитическая, региоспецифическая функционализация алканов». Science . 287 (5460): 1995– 1997. Bibcode :2000Sci...287.1995C. doi :10.1126/science.287.5460.1995. PMID 10720320.
- ^ Murphy, JM; Lawrence, JD; Kawamura, K.; Incarvito, C.; Hartwig, JF (2006). "Региоспецифическое борилирование метил-CH-связей, катализируемое рутением". J. Am. Chem. Soc . 128 (42): 13684– 13685. doi :10.1021/ja064092p. PMID 17044685.
- ^ Ишияма, Т.; Такаги, Дж.; Ишида, К.; Мияура, Н .; Анастази, Н. Р.; Хартвиг, Дж. Ф. (2002). «Мягкое катализируемое иридием борилирование аренов. Высокие числа оборотов, реакции при комнатной температуре и выделение потенциального промежуточного продукта». J. Am. Chem. Soc . 124 (3): 390– 391. doi :10.1021/ja0173019. PMID 11792205.
- ^ Ишияма, Т.; Такаги, Дж.; Хартвиг, Дж. Ф.; Мияура, Н. (2002). «Стехиометрическое ароматическое борирование CH, катализируемое комплексами иридия(I)/2,2′-бипиридина при комнатной температуре». Angewandte Chemie International Edition . 41 (16): 3056– 3058. doi :10.1002/1521-3773(20020816)41:16<3056::aid-anie3056>3.0.co;2-#. PMID 12203457.
- ^ Press, LP; Kosanovich, AJ; McCulloch, BJ; Ozerov, OV (2016). "Высокооборотное ароматическое борирование C–H, катализируемое пинцетными комплексами иридия типа POCOP". J. Am. Chem. Soc . 138 (30): 9487– 9497. doi :10.1021/jacs.6b03656. PMID 27327895.
- ^ Тиммерс, Пер ХА; Вельте, Корнелия У.; Кохорст, Джаспер Дж.; Плагг, Кэролайн М.; Джеттен, Майк С.М.; Стамс, Альфонс Дж. М. (2017). «Обратный метаногенез и дыхание метанотрофных архей». Археи : 1–22 . doi : 10.1155/2017/1654237 . ПМК 5244752 . ПМИД 28154498.
- ^ Сен, А. (1999). «Каталитическая активация метана и этана соединениями металлов». В Murai, S. (ред.). Активация нереакционноспособных связей и органический синтез . Том 3. Springer Berlin Heidelberg. С. 81–95 . ISBN 978-3-540-64862-8.
- ^ "Метанол". www.essentialchemicalindustry.org . Получено 2016-02-01 .
- ^ Periana, RA; Taube, DJ; Evitt, ER; Loffler, DG; Wentrcek, PR; Voss, G.; Masuda, T. (1993). "Высокопроизводительная система окисления метана в метанол, катализируемая ртутью". Science . 259 (5093): 340– 343. Bibcode :1993Sci...259..340P. doi :10.1126/science.259.5093.340. PMID 17832346. S2CID 21140403.
- ^ Periana, RA; Taube, DJ; Gamble, S.; Taube, H.; Satoh, T.; Fujii, H. (1998). «Платиновые катализаторы для высокопроизводительного окисления метана в производное метанола». Science . 280 (5363): 560– 564. Bibcode :1998Sci...280..560P. doi :10.1126/science.280.5363.560. PMID 9554841.
- ^ Дэвис, Х. М. Л.; Мортон, Д. (2011). «Руководящие принципы для сайт-селективной и стереоселективной межмолекулярной C–H-функционализации донорно-акцепторными родиевыми карбенами». Обзоры химического общества . 40 (4): 1857– 69. doi : 10.1039/C0CS00217H. PMID 21359404.
- ^ O'Malley, SJ; Tan, KL; Watzke, A.; Bergman, RG; Ellman, JA (2005). «Полный синтез (+)-литоспермовой кислоты асимметричным внутримолекулярным алкилированием с помощью каталитической активации связи CH». J. Am. Chem. Soc . 127 (39): 13496– 13497. doi :10.1021/ja052680h. PMID 16190703.
- ^ Рамкумар, Н.; Нагараджан, Р. (2013). "b. Полный синтез калотриксина A и B через активацию CH". J. Org. Chem . 78 (6): 2802– 2807. doi :10.1021/jo302821v. PMID 23421392.
- ^ Арендт, Катери А.; Бергман, Роберт Г.; Эллман, Джонатан А. (2003-04-01). «Синтез трициклического аналога мескалина с помощью каталитической активации связи C−H». Organic Letters . 5 (8): 1301– 1303. doi :10.1021/ol034228d. ISSN 1523-7060. PMID 12688744.
- ^ Моллой, Джон Дж.; Морак, Тобиас; Гилмор, Райан (2019). «Позиционная и геометрическая изомеризация алкенов: вершина атомной экономики». Angewandte Chemie International Edition . 58 (39): 13654– 13664. doi :10.1002/anie.201906124. PMID 31233259.

