Активация связи углерод-углерод
Активация связи углерод-углерод относится к разрыву связей углерод-углерод в органических молекулах. Этот процесс является важным инструментом в органическом синтезе , поскольку он позволяет образовывать новые связи углерод-углерод и строить сложные органические молекулы. [1] Однако активация связи C–C является сложной задачей в основном по следующим причинам: (1) активация связи CH является конкурентным процессом активации CC, который как энергетически, так и кинетически более выгоден; (2) доступность центра переходного металла к связям C–C, как правило, затруднена из-за его «скрытой» природы; (3) относительно высокая стабильность связи C–C (90 ккал/моль −1 ). В результате на ранней стадии большинство примеров активации CC представляют собой струнные кольцевые системы, [2] [3] , что делает активацию CC более выгодной за счет увеличения энергии исходного материала. Однако активация CC ненапряженных связей CC оставалась сложной задачей до последних двух десятилетий.
Примеры активации связи CC
Из-за сложности активации CC для облегчения реакции требуется движущая сила. Одной из распространенных стратегий является образование стабильных комплексов металлов. Один пример был описан Мильштейном и его коллегами, в котором связь C(sp 2 )–C(sp 3 ) бисфосфиновых лигандов была селективно расщеплена рядом металлов, что дало стабильные пинцетные комплексы в мягких условиях. [4] [5] [6]

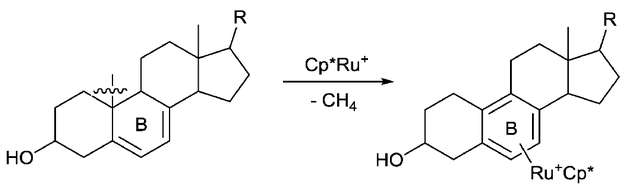
Ароматизация — это еще одна движущая сила, которая используется для активации связи C–C. Например, группа Шодре сообщила, что связь C–C стероидных соединений может быть расщеплена посредством ароматизации кольца B, стимулируемой Ru. [7] В то же время высвобождается молекула метана, которая, возможно, является еще одной движущей силой для этой реакции.
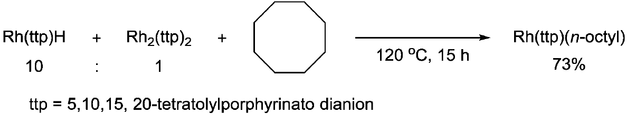
Кроме того, было доказано, что металлорадикал способен расщеплять одинарную связь C–C. Группа Чана сообщила о разрыве связи C–C циклооктана посредством 1,2-присоединения с порфирингидридом Rh(III), в котором в качестве ключевого промежуточного соединения использовался радикал [Rh II (ttp)]·. [8]
Механизм активации связи CC
Вообще говоря, существует два различных механистических пути, которые приводят к активации связи CC: (a) устранение β-углерода из комплексов металлов. В этом механизме одновременно образуются промежуточное соединение M–C и двойная связь; и (b) прямое окислительное присоединение связей C–C к низковалентным металлическим аддуктам с образованием бис(органил)металлического комплекса.

устранение β-углерода
В 1997 году группа Тамару сообщила о первом катализируемом металлом β-углеродном элиминировании ненапряженного соединения. [9] Их работа выявила новое катализируемое Pd(0) раскрытие кольца 4-виниловых циклических карбонатов. Они предположили, что реакция инициируется элиминированием диоксида углерода с образованием π-аллилпалладиевого промежуточного продукта, за которым следует β-декарбопалладирование с образованием диеналей и диенонов. С тех пор эта область расцвела, и было разработано много подобных реакций, которые показали свой большой потенциал в органическом синтезе. Ранняя стадия исследований в этой области была сосредоточена на реакции видов M–O–C–C, а β-углеродное элиминирование промежуточного продукта M–N–C–C не было обнаружено до последних десяти лет. В 2010 году Накамура сообщил о реакции замещения пропаргиловых аминов, катализируемой Cu, алкинами или другими аминами как о первом примере катализируемого переходными металлами β-углеродного элиминирования аминов. [10]

Окислительное присоединение
По сравнению с устранением β-углерода, окислительное присоединение связи CC является более прямым способом активации связи CC. Однако это сложнее сделать по следующим причинам: 1) оно образует две слабые связи MC за счет разрыва стабильной связи CC, поэтому это энергетически невыгодно; 2) связь CC обычно затруднена, что затрудняет доступ к металлическому центру. В результате расщепление ненапряженных соединений, которое было достигнуто, в основном сосредоточено на кетонных субстратах. Это связано с тем, что связь C–C, смежная с карбонилом кетонов, слабее и может быть гораздо легче расщеплена. Оно также выигрывает от меньшего стерического препятствия из-за плоской структуры карбонильного мотива. Саггс и Джун являются пионерами в этой области. Они обнаружили, что комплекс Rh(I), [RhCl(C 2 H 4 ) 2 ] 2 , может быть окислительно вставлен в связь C–C 8-ацилхинолинов в 8-положении с образованием относительно стабильных 5-членных родациклов. Впоследствии 8-ацилхинолин может быть связан с этиленом с получением 8-хинолинилэтилкетона, который представляет собой первый катализируемый переходным металлом разрыв связей C–C посредством окислительного присоединения. [11]

Применение активации связи CC
Реакции активации углерод-углеродной связи имеют многочисленные применения в органическом синтезе, материаловедении и фармацевтике. В органическом синтезе эти реакции используются для построения сложных молекул высокоэффективным и селективным образом. Например, в 2021 году Dong Group описала первый энантиоселективный полный синтез природных продуктов пеницибилаенов с использованием стратегии активации углерод-углеродной связи на поздней стадии. [12] Существует также много других примеров, подчеркивающих потенциал стратегий активации углерод-углеродной связи в полном синтезе сложных природных продуктов с высоким стереоконтролем.
Ссылки
- ^ Song, Feijie; Gou, Ting; Wang, Bi-Qin; Shi, Zhang-Jie (2018-09-17). «Каталитические активации ненапряженной связи C–C с участием металлоорганических интермедиатов». Chemical Society Reviews . 47 (18): 7078– 7115. doi :10.1039/C8CS00253C. ISSN 1460-4744. PMID 30112546.
- ^ Крэбтри, Роберт Х. (1985-08-01). «Металлоорганическая химия алканов». Chemical Reviews . 85 (4): 245–269 . doi :10.1021/cr00068a002. ISSN 0009-2665.
- ^ Periana, Roy A.; Bergman, Robert G. (ноябрь 1986 г.). «Углерод-углеродная активация органических соединений с малым кольцом путем размещения комплексов циклоалкилгидридородия в родациклоалканы. Синтез металлациклобутанов, включая один с третичной связью металл-углерод, путем нуклеофильного присоединения к .pi.-аллильным комплексам». Журнал Американского химического общества . 108 (23): 7346– 7355. doi :10.1021/ja00283a033. ISSN 0002-7863.
- ^ Гозин, Майкл; Вайсман, Александр; Бен-Дэвид, Йехошуа; Мильштейн, Дэвид (август 1993 г.). «Активация связи углерод–углерод в растворе путем введения переходного металла». Nature . 364 (6439): 699– 701. Bibcode :1993Natur.364..699G. doi :10.1038/364699a0. ISSN 1476-4687. S2CID 4314638.
- ^ Мураками, Масахиро; Амии, Хидеки; Ито, Ёсихико (август 1994 г.). «Селективная активация углерод-углеродных связей рядом с карбонильной группой». Nature . 370 (6490): 540– 541. Bibcode :1994Natur.370..540M. doi :10.1038/370540a0. ISSN 1476-4687. S2CID 4316378.
- ^ Альбрехт, Мартин; Линднер, Моника М. (2011-08-23). «Расщепление нереакционноспособных связей с помощью комплексов металлов-пинцеров». Dalton Transactions . 40 (35): 8733– 8744. doi : 10.1039/C1DT10339C. hdl : 10197/6720 . ISSN 1477-9234. PMID 21614378. S2CID 18094040.
- ^ Halcrow, Malcolm A.; Urbanos, Francisco; Chaudret, Bruno (март 1993). "Ароматизация B-кольца 5,7-диенилстероидов электрофильным фрагментом рутения "[Cp*Ru]+"". Organometallics . 12 (3): 955– 957. doi :10.1021/om00027a054. ISSN 0276-7333.
- ^ Чан, Юн Вай; Чан, Кин Шинг (2010-05-26). «Алифатическая углерод-углеродная активация циклооктана, катализируемая металлрадикалами». Журнал Американского химического общества . 132 (20): 6920– 6922. doi :10.1021/ja101586w. ISSN 0002-7863. PMID 20441175.
- ^ Хараяма, Хирото; Куроки, Тосицугу; Кимура, Масанари; Танака, Сюдзи; Тамару, Ёсинао (14 ноября 1997 г.). «Синтез дважды ненасыщенных альдегидов и кетонов путем нового β-декарбопалладирования». Angewandte Chemie International Edition на английском языке . 36 (21): 2352–2354 . doi :10.1002/anie.199723521. ISSN 0570-0833.
- ^ Sugiishi, Tsuyuka; Kimura, Akifumi; Nakamura, Hiroyuki (2010-04-21). "Copper(I)-Catalyzed Substitution Reactions of Propargylic Amines: Importance of C(sp)−C(sp 3 ) Bond Cleavage in Generation of Iminium Intermediates". Journal of the American Chemical Society . 132 (15): 5332– 5333. doi :10.1021/ja9109055. ISSN 0002-7863. PMID 20353176.
- ^ Саггс, Дж. Уильям; Джун, Чул-Хо (1985-01-01). «Катализируемые металлом превращения алкилкетона в этилкетон в хелатирующих кетонах посредством расщепления связи углерод-углерод». Журнал химического общества, Chemical Communications (2): 92– 93. doi :10.1039/C39850000092. ISSN 0022-4936.
- ^ Сюэ, Ибинь; Дун, Гуанбинь (2021-06-09). «Полный синтез пеницибилаенов посредством деконструкции скелета с помощью активации C–C и функционализации C–H, опосредованной реле десатурации». Журнал Американского химического общества . 143 (22): 8272– 8277. doi :10.1021/jacs.1c04335. ISSN 0002-7863. PMC 9112325. PMID 34038107 .