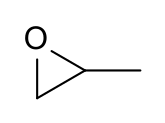
оксид пропилена
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК (2R)-2-Метилоксиран (2S)-2-Метилоксиран | |
| Другие имена Окись пропилена Эпоксипропан Эпоксид пропилена 1,2-Оксид пропилена Метилоксиран 1,2-Эпоксипропан Окись пропилена Окись метилэтилена Окись метилэтилена | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ | |
| ChemSpider |
|
| Информационная карта ECHA | 100.000.800 |
| Номер ЕС |
|
| КЕГГ | |
CID PubChem |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С3Н6О | |
| Молярная масса | 58,080 г·моль −1 |
| Появление | Бесцветная жидкость. |
| Запах | бензолоподобный [1] |
| Плотность | 0,859 г/см 3 [2] |
| Температура плавления | −111,9 °C (−169,4 °F; 161,2 К) [2] |
| Точка кипения | 35 °C (95 °F; 308 К) [2] |
| 41% (20 °С) [1] | |
| Давление пара | 445 мм рт. ст. (20 °C) [1] |
| −4,25 × 10−5 см 3 /моль [ 3] | |
Показатель преломления ( nD ) | 1.3660 [2] |
| Термохимия | |
Теплоемкость ( С ) | 120,4 Дж·(К·моль) −1 |
Стандартная молярная энтропия ( S ⦵ 298 ) | 196,5 Дж·(К·моль) −1 |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −123,0 кДж·моль −1 [4] |
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | Чрезвычайно огнеопасно [5] [6] |
| Маркировка СГС : | |
   | |
| Опасность | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | −37 °C (−35 °F; 236 K) |
| 747 °C (1377 °F; 1020 K) | |
| Пределы взрывоопасности | 2,3–36% [1] |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 660 мг/кг (морская свинка, перорально) 380 мг/кг (крыса, перорально) 440 мг/кг (мышь, перорально) 1140 мг/кг (крыса, перорально) 690 мг/кг (морская свинка, перорально) [7] |
LC 50 ( средняя концентрация ) | 1740 ppm (мышь, 4 ч) 4000 ppm (крыса, 4 ч) [7] |
LC Lo ( самый низкий опубликованный ) | 2005 ppm (собака, 4 ч) 4000 ppm (морская свинка, 4 ч) [7] |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (допустимый) | TWA 100 частей на миллион (240 мг/м 3 ) [1] |
РЕЛ (рекомендуется) | Ка [1] |
IDLH (Непосредственная опасность) | Ca [400 частей на миллион] [1] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Пропиленоксид — это остротоксичное и канцерогенное органическое соединение с молекулярной формулой C3H6O . Эта бесцветная летучая жидкость с запахом, похожим на запах эфира , производится в больших промышленных масштабах. Ее основное применение — это производство полиэфирполиолов для использования в производстве полиуретановых пластиков . Это хиральный эпоксид , хотя обычно он используется в виде рацемической смеси .
Это соединение иногда называют 1,2-пропиленоксидом, чтобы отличить его от его изомера 1,3-пропиленоксида, более известного как оксетан .
Производство
Промышленное производство пропиленоксида начинается с пропилена . [8] Применяются два общих подхода: один с гидрохлорированием , а другой с окислением . [9] В 2005 году около половины мирового производства осуществлялось по технологии хлоргидрина , а половина — по окислительным путям. Значение последнего подхода растет. [10]
Путь гидрохлорирования
Традиционный путь осуществляется через превращение пропена в пропиленхлоргидрин по следующей упрощенной схеме:
Смесь 1-хлор-2-пропанола и 2-хлор-1-пропанола затем дегидрохлорируется. Например:
Для поглощения HCl часто используют известь ( гидроксид кальция ) .
Окисление пропилена
Другой общий путь к пропиленоксиду включает окисление пропилена органическим пероксидом . Реакция следует этой стехиометрии:
- CH 3 CH=CH 2 + RO 2 H → CH 3 CHCH 2 O + ROH
Процесс осуществляется с четырьмя гидропероксидами : [10]
- В процессе Halcon гидропероксид t -бутила получается путем окисления изобутана , что дает t -бутанол . Этот побочный продукт может быть дегидратирован до изобутена, преобразованного в МТБЭ , добавку к бензину .
- Гидропероксид этилбензола , полученный путем окисления этилбензола , который дает 1-фенилэтанол. Этот побочный продукт может быть дегидратирован с получением стирола , полезного мономера.
- Гидропероксид кумола, полученный путем окисления кумола (изопропилбензола), который дает кумиловый спирт . С помощью дегидратации и гидрирования этот побочный продукт может быть переработан обратно в кумол. Эта технология была коммерциализирована Sumitomo Chemical. [11]
- Перекись водорода является окислителем в процессе превращения перекиси водорода в пропиленоксид (HPPO), катализируемом силикалитом , легированным титаном :
- С3Н6 + Н2О2 → С3Н6О + Н2О
В принципе, этот процесс производит только воду в качестве побочного продукта . На практике образуются некоторые производные PO с открытым кольцом. [12]
Пропиленоксид представляет собой хиральный строительный блок, который коммерчески доступен в любой энантиомерной форме (( R )-(+) и ( S )-(–)). Разделенные энантиомеры могут быть получены посредством гидролитического кинетического разделения рацемического материала, катализируемого Co(III)-саленом. [13]
Реакции
Как и другие эпоксиды, PO подвергается реакциям раскрытия кольца. С водой образуется пропиленгликоль. Со спиртами происходят реакции, называемые гидроксилпропилированием , аналогичные этоксилированию . Реактивы Гриньяра присоединяются к пропиленоксиду, давая вторичные спирты.
Некоторые другие реакции пропиленоксида включают: [14]
- Реакция с оксидом алюминия при 250–260 °C приводит к образованию пропионового альдегида и небольшого количества ацетона .
- Реакция с оксидом серебра(I) приводит к образованию уксусной кислоты .
- Реакция с амальгамой натрия и ртути и водой приводит к образованию изопропанола .
Использует
От 60 до 70% всего пропиленоксида преобразуется в полиэфирполиолы в процессе, называемом алкоксилированием . [15] Эти полиолы являются строительными блоками в производстве полиуретановых пластиков. [16] Около 20% пропиленоксида гидролизуется в пропиленгликоль посредством процесса, который ускоряется кислотным или основным катализом . Другими основными продуктами являются полипропиленгликоль , эфиры пропиленгликоля и пропиленкарбонат .
Ниша использует
Фумигант
Управление по контролю за продуктами питания и лекарственными средствами США одобрило использование пропиленоксида для пастеризации сырого миндаля с 1 сентября 2007 года в ответ на два случая заражения сальмонеллой в коммерческих садах, один из которых произошел в Канаде, а другой в Соединенных Штатах. [17] [18] Фисташки также можно подвергать обработке пропиленоксидом для контроля сальмонеллы .
Микроскопия
Оксид пропилена обычно используется при подготовке биологических образцов для электронной микроскопии , чтобы удалить остаточный этанол, ранее использованный для дегидратации. В типичной процедуре образец сначала погружают в смесь равных объемов этанола и окиси пропилена на 5 минут, а затем четыре раза в чистый оксид, по 10 минут каждый.
Боеприпасы
Оксид пропилена иногда используется в термобарических боеприпасах в качестве топлива в топливно-воздушных взрывчатых веществах. В дополнение к взрывному повреждению от взрывной волны , неразорвавшийся оксид пропилена может вызывать дополнительные эффекты от прямой токсичности. [19]
Безопасность
Оксид пропилена является как остротоксичным, так и канцерогенным . Острое воздействие вызывает раздражение дыхательных путей , что в конечном итоге приводит к смерти. [20] Признаки токсичности после острого воздействия включают слюнотечение , слезотечение , выделения из носа, одышку, летаргию и гипоактивность , слабость и нарушение координации. Оксид пропилена также нейротоксичен для крыс и, предположительно, для людей [21] Оксид пропилена алкилирует ДНК и считается мутагеном как для животных, так и для людей. [22] [23] [24] Беременные крысы, подвергшиеся воздействию 500 ppm оксида пропилена в течение менее 8 часов, рожали помет со значительными уродствами и дефицитом веса. Подобное воздействие также показало снижение фертильности животных. [25] Таким образом, он является известным канцерогеном для животных [26] и потенциальным канцерогеном для человека и включен в Список канцерогенов группы 2B МАИР . [27]
Оксид пропилена является чрезвычайно легковоспламеняющейся жидкостью, и его пары могут образовывать взрывоопасные смеси с воздухом при концентрации всего 2,3% ( нижний предел взрываемости ). [25] Пары оксида пропилена в два раза плотнее воздуха . При воздействии на открытую атмосферу пары могут скапливаться в низинных областях, распространяясь на большие расстояния и достигая источника возгорания, вызывая обратную вспышку или взрыв. [25] [28] При нагревании оксид пропилена может быстро самополимеризоваться и разлагаться, образуя другие токсичные газы, такие как оксид углерода и различные свободные радикалы . [29] [25] Пожары оксида пропилена особенно опасны и трудны для тушения пожарными. При пожаре герметичные резервуары с оксидом пропилена следует охлаждать пожарными шлангами, чтобы предотвратить взрыв от самополимеризации. [25] Однако при горении на открытом воздухе вода может переносить оксид пропилена за пределы зоны пожара, который может повторно воспламениться, всплыв на поверхность. Необходимо принять дополнительные меры по тушению пожара, чтобы предотвратить попадание пропиленоксида в близлежащие стоки и канализацию, загрязняя окружающую среду. [30] [25]
Естественное явление
В 2016 году сообщалось, что пропиленоксид был обнаружен в Стрельце B2 , облаке газа в Млечном Пути весом в три миллиона солнечных масс . Это первая хиральная молекула, обнаруженная в космосе, хотя и без энантиомерного избытка . [31]
Ссылки
- ^ abcdefg Карманный справочник NIOSH по химическим опасностям. "#0538". Национальный институт охраны труда и здоровья (NIOSH).
- ^ abcd Haynes 2011, стр. 3.384
- ^ Хейнс 2011, стр. 3.577
- ^ Хейнс 2011, стр. 5.24
- ^ "NFPA DIAMOND". www.otrain.com .
- ^ GOV, Управление реагирования и восстановления NOAA, США. "ОКСИД ПРОПИЛЕНА | Химикаты CAMEO | NOAA". cameochemicals.noaa.gov .
- ^ abc "Оксид пропилена". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ Nijhuis TA, Makkee M, Moulijn JA, Weckhuysen BM (2006). «Производство оксида пропена: каталитические процессы и последние разработки». Industrial & Engineering Chemistry Research . 45 (10): 3447–3459. doi :10.1021/ie0513090. hdl : 1874/20149 .
- ^ Калих Д., Вичерн Ю., Линднер Дж. (2002). «Пропиленоксид». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_239. ISBN 978-3527306732.
- ^ ab Nijhuis TA, Makkee M, Moulijn JA, Weckhuysen BM (2006). «Производство оксида пропена: каталитические процессы и последние разработки». Industrial & Engineering Chemistry Research . 45 (10): 3447–3459. doi :10.1021/ie0513090. hdl : 1874/20149 .
- ^ "Краткое изложение процесса Sumitomo из Nexant Reports". Архивировано из оригинала 2006-01-17 . Получено 2007-09-18 .
- ^ Russo V, Tesser R, Santacesaria E, Di Serio M (2013). «Химические и технические аспекты производства оксида пропена с помощью перекиси водорода (процесс HPPO)». Industrial & Engineering Chemistry Research . 52 (3): 1168–1178. doi :10.1021/ie3023862.
- ^ Шаус, Скотт Э.; Брандес, Бриджит Д.; Ларроу, Джей Ф.; Токунага, Макото; Хансен, Карл Б.; Гулд, Александра Э.; Фурроу, Майкл Э.; Якобсен, Эрик Н. (2002-02-01). "Высокоселективное гидролитическое кинетическое разделение терминальных эпоксидов, катализируемое хиральными комплексами (сален)Co III. Практический синтез энантиообогащенных терминальных эпоксидов и 1,2-диолов". Журнал Американского химического общества . 124 (7): 1307–1315. doi :10.1021/ja016737l. ISSN 0002-7863. PMID 11841300.
- ^ Heilbron I, ред. (1953). Словарь органических соединений. Т. 4. Oxford University Press. С. 249.
- ^ Адам Н., Авар Г., Бланкенхайм Х., Фридрихс В., Гирсиг М., Вейганг Э. и др. (2005). «Полиуретаны». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a21_665.pub2. ISBN 978-3527306732.
- ^ "Использование оксида пропилена". Dow Chemical. Архивировано из оригинала 2007-09-15 . Получено 2007-09-10 .
- ^ «Руководство для промышленности: меры по устранению риска заражения видами сальмонелл в пищевых продуктах, содержащих в качестве ингредиента продукт, полученный из фисташек; проект руководства». fda.gov . Июнь 2009 г. Архивировано из оригинала 2011-02-09.
- ^ Служба сельскохозяйственного маркетинга, Министерство сельского хозяйства США (30 марта 2007 г.). «Миндаль, выращенный в Калифорнии; Требования к контролю качества на выходе» (PDF) . Федеральный реестр . 72 (61): 15, 021–15, 036. Архивировано из оригинала (PDF) 28 сентября 2007 г. . Получено 22 августа 2007 г.
- ^ "Информационная справка о российских взрывчатых веществах топливно-воздушного типа ("вакуумных бомбах") | Human Rights Watch". Hrw.org. 1 февраля 2000 г. Архивировано из оригинала 10 февраля 2013 г. Получено 23 апреля 2013 г.
- ^ Комитет Национального исследовательского совета (США) по уровням острого воздействия (2010). "Уровни острого воздействия оксида пропилена". Уровни острого воздействия для отдельных химических веществ, содержащихся в воздухе: Том 9. Издательство Национальных академий.
- ^ Ohnishi A, Murai Y (февраль 1993 г.). «Полиневропатия, вызванная оксидом этилена, оксидом пропилена и оксидом бутилена». Environmental Research . 60 (2): 242–247. Bibcode : 1993ER.....60..242O. doi : 10.1006/enrs.1993.1032. PMID 8472653.
- ^ Lawley PD, Jarman M (февраль 1972). «Алкилирование пропиленоксидом дезоксирибонуклеиновой кислоты, аденина, гуанозина и дезоксигуаниловой кислоты». The Biochemical Journal . 126 (4): 893–900. doi :10.1042/bj1260893. PMC 1178497. PMID 5073240 .
- ^ Альбертини, Ричард Дж. (апрель 2003 г.). «Переписка по поводу: Чене и др., Анализ ДНК и гемоглобиновых аддуктов и сестринских хроматидных обменов в популяции людей, профессионально подвергавшихся воздействию пропиленоксида: пилотное исследование. Cancer Epidemiol. Biomark. Prev., 11: 315-318, 2002». Cancer Epidemiology, Biomarkers & Prevention . 12 (4): 388, ответ автора 388–389. ISSN 1055-9965. PMID 12692119.
- ^ Thiess, AM; Schwegler, H.; Fleig, I.; Stocker, WG (1981). «Исследование мутагенности рабочих, подвергшихся воздействию алкиленоксидов (этиленоксида/пропиленоксида) и их производных». Журнал профессиональной медицины . 23 (5): 343–347. ISSN 0096-1736. JSTOR 45005617. PMID 7241247.
- ^ abcdef Fishersci (1 июля 1999 г.). "Паспорт безопасности материала оксид пропилена". Fisher Scientific . Получено 27 сентября 2024 г. .
- ^ Ринго DL, Бреннан EF, Кота-Роблес EH (сентябрь 1982 г.). «Эпоксидные смолы мутагенные: выводы для специалистов по электронной микроскопии». Журнал исследований ультраструктуры . 80 (3): 280–287. doi :10.1016/s0022-5320(82)80041-5. PMID 6752439.
- ^ Грана Р., Беновиц Н., Гланц С.А. (май 2014 г.). «Электронные сигареты: научный обзор». Тираж . 129 (19): 1972–1986. дои : 10.1161/circulationaha.114.007667. ПМК 4018182 . ПМИД 24821826.
- ^ Вань, Хангвэй; Вэнь, Юйцюань; Чжан, Ци (2023-01-01). «Взрывное поведение смеси пар–жидкость пропиленоксид/воздух при высокотемпературном источнике воспламенения». Топливо . 331 : 125815. Bibcode :2023Fuel..33125815W. doi :10.1016/j.fuel.2022.125815. ISSN 0016-2361.
- ^ HARDWICK, T (8 марта 1968 г.). «Термическое разложение окиси пропилена». Canadian Journal of Chemistry . 46 (14): 2454–2456. doi :10.1139/v68-398 – через Canadian Science Publishing.
- ^ "Руководство по реагированию на чрезвычайные ситуации № 127P для ЛЕГКОВОСПЛАМЕНЯЮЩИХСЯ ЖИДКОСТЕЙ (смешивающихся с водой) – HazMat Tool". www.hazmattool.com . Получено 27.09.2024 .
- ^ «Ученые только что впервые обнаружили эту молекулу, формирующую жизнь, в межзвездном пространстве». Science Alert. 2016-06-15.
Цитируемые источники
- Haynes WM, ред. (2011). CRC Handbook of Chemistry and Physics (92-е изд.). Boca Raton, FL: CRC Press . ISBN 1-4398-5511-0.
Внешние ссылки
- Страница WebBook для C3H6O
- Окись пропилена в Агентстве по охране окружающей среды США
- Оксид пропилена – информация о химическом продукте: свойства, производство, применение.
- Оксид пропилена на веб-сайте Сети передачи технологий по токсичности воздуха
- CDC – Карманный справочник NIOSH по химическим опасностям





