Сероводород
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Систематическое название ИЮПАК Сероводород [1] | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 3535004 | |||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.029.070 | ||
| Номер ЕС |
| ||
| 303 | |||
| КЕГГ | |||
| МеШ | Водород+сульфид | ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 1053 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| H2S | |||
| Молярная масса | 34,08 г·моль −1 | ||
| Появление | Бесцветный газ. | ||
| Запах | Вонючий, резкий, как запах тухлых яиц | ||
| Плотность | 1,539 г л −1 (0°C) [2] | ||
| Температура плавления | −85,5 [3] °C (−121,9 °F; 187,7 K) | ||
| Точка кипения | −59,55 [3] °C (−75,19 °F; 213,60 К) | ||
| 3,980 г дм −3 (при 20 °C) [4] | |||
| Давление пара | 1740 кПа (при 21 °C) | ||
| Кислотность ( pK a ) | 7.0 [5] [6] | ||
| Сопряженная кислота | Сульфоний | ||
| Сопряженное основание | Бисульфид | ||
| −25,5·10 −6 см 3 /моль | |||
Показатель преломления ( nD ) | 1,000644 (0 °С) [2] | ||
| Структура | |||
| С 2в | |||
| Бент | |||
| 0,97 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 1,003 ДжК −1 г −1 | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 206 Дж моль −1 К −1 [7] | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −21 кДж моль −1 [7] | ||
| Опасности | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | Легковоспламеняющийся и высокотоксичный | ||
| Маркировка СГС : | |||
   | |||
| Опасность | |||
| Н220 , Н330 , Н400 | |||
| Р210 , Р260 , Р271 , Р273 , Р284 , Р304+Р340 , Р310 , Р320 , Р377 , Р381 , Р391 , Р403 , Р403+Р233 , Р405 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −82,4 °C (−116,3 °F; 190,8 К) [10] | ||
| 232 °C (450 °F; 505 К) | |||
| Пределы взрывоопасности | 4,3–46% | ||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LC 50 ( средняя концентрация ) |
| ||
LC Lo ( самый низкий опубликованный ) |
| ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (допустимый) | C 20 частей на миллион; 50 частей на миллион [максимальный пик за 10 минут] [8] | ||
ОТВ (рекомендуется) | C 10 частей на миллион (15 мг/м 3 ) [10-минутный] [8] | ||
IDLH (Непосредственная опасность) | 100 частей на миллион [8] | ||
| Родственные соединения | |||
Родственные халькогениды водорода | |||
Родственные соединения | Фосфин | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Сероводород — это химическое соединение с формулой H2S . Это бесцветный халькогенгидридный газ , ядовитый, едкий и огнеопасный, при наличии следовых количеств в окружающей атмосфере имеет характерный неприятный запах тухлых яиц . [11] Шведскому химику Карлу Вильгельму Шееле приписывают открытие химического состава очищенного сероводорода в 1777 году. [ 12]
Сернистый газ токсичен для людей и большинства других животных, подавляя клеточное дыхание аналогично цианистому водороду . При его вдыхании или попадании его солей в организм в больших количествах происходит быстрое повреждение органов с симптомами от затрудненного дыхания до судорог и смерти. [13] [14] Несмотря на это, организм человека вырабатывает небольшие количества этого сульфида и его минеральных солей и использует его в качестве сигнальной молекулы . [15]
Сероводород часто образуется в результате микробного распада органического вещества при отсутствии кислорода, например, в болотах и канализации; этот процесс обычно называют анаэробным сбраживанием , которое осуществляется сульфатредуцирующими микроорганизмами . Он также встречается в вулканических газах , месторождениях природного газа и иногда в хорошо прокачиваемой воде.
Характеристики
Сероводород немного плотнее воздуха. Смесь H 2 S и воздуха может быть взрывоопасной.
Окисление
В целом, сероводород действует как восстановитель , на что указывает его способность восстанавливать диоксид серы в процессе Клауса . Сероводород горит в кислороде синим пламенем с образованием диоксида серы ( SO2 ) и воды :
- 2H2S + 3O2 → 2SO2 + 2H2O
При избытке кислорода образуется триоксид серы ( SO3 ) , который быстро гидратируется до серной кислоты :
- H2S + 2O2 → H2SO4
Кислотно-основные свойства
Он слабо растворим в воде и действует как слабая кислота ( p K a = 6,9 в растворах 0,01–0,1 моль/л при 18 °C), давая гидросульфид -ион HS − . Сероводород и его растворы бесцветны. При контакте с воздухом он медленно окисляется с образованием элементарной серы, которая не растворяется в воде. Сульфид- анион S 2− не образуется в водном растворе. [16]
H 2 S и H 2 O быстро обмениваются протонами. Такое поведение является основой технологий очистки оксида дейтерия («тяжелой воды» или D 2 O ), которые используют легкую перегонку этих соединений. [17]
Экстремальные температуры и давления
При давлении выше 90 ГПа ( гигапаскаль ) сероводород становится металлическим проводником электричества. При охлаждении ниже критической температуры эта фаза высокого давления проявляет сверхпроводимость . Критическая температура увеличивается с давлением, варьируясь от 23 К при 100 ГПа до 150 К при 200 ГПа. [18] Если сероводород сжимать при более высоких температурах, а затем охлаждать, критическая температура достигает 203 К (−70 °C), самой высокой принятой критической температуры сверхпроводимости по состоянию на 2015 год. Было предсказано, что, заменив небольшую часть серы фосфором и используя еще более высокие давления, можно будет повысить критическую температуру до значения выше 0 °C (273 К) и достичь сверхпроводимости при комнатной температуре . [19]
Сероводород разлагается без присутствия катализатора при атмосферном давлении около 1200 °C на водород и серу. [20]
Реакции с металлами
Сероводород реагирует с ионами металлов, образуя сульфиды металлов, которые являются нерастворимыми, часто темными твердыми веществами. Это поведение является основой использования сероводорода в качестве реагента в качественном неорганическом анализе ионов металлов. В этих анализах ионы тяжелых металлов (и неметаллов ) (например, Pb(II), Cu(II), Hg(II), As(III)) осаждаются из раствора при воздействии H2S . Затем компоненты полученного твердого вещества идентифицируются по их реакционной способности. Бумага с ацетатом свинца(II) используется для обнаружения сероводорода, поскольку он легко превращается в сульфид свинца (II) , который имеет черный цвет. [21] [22]
Сероводород также вызывает потускнение различных металлов, включая медь и серебро ; химическим веществом, ответственным за черную тонировку , обнаруженную на серебряных монетах, является сульфид серебра ( Ag2S ), который образуется, когда серебро на поверхности монеты реагирует с атмосферным сероводородом. [23] Монеты, которые были подвергнуты тонировке сероводородом и другими серосодержащими соединениями, могут иметь тонировку, добавляющую к нумизматической ценности монеты, основанной на эстетике, поскольку тонировка может вызывать тонкопленочную интерференцию , в результате чего монета приобретает привлекательную окраску. [24] Монеты также могут быть намеренно обработаны сероводородом, чтобы вызвать тонировку, хотя искусственную тонировку можно отличить от естественной тонировки, и она, как правило, критикуется коллекционерами. [25]
Производство
Сероводород чаще всего получают путем его отделения от кислого газа , который является природным газом с высоким содержанием H 2 S. Его также можно получить путем обработки водорода расплавленной элементарной серой при температуре около 450 °C. Источником водорода в этом процессе могут служить углеводороды. [26]
- С + Н2 → Н2С
Очень благоприятная термодинамика для гидрогенизации серы подразумевает, что дегидрогенизация (или крекинг ) сероводорода потребует очень высоких температур. [27]
Стандартная лабораторная подготовка заключается в обработке сульфида железа сильной кислотой в генераторе Киппа :
- FeS + 2HCl → FeCl2 + H2S
Для использования в качественном неорганическом анализе тиоацетамид используется для получения H 2 S :
- CH3C (S) NH2 + H2O → CH3C ( O ) NH2 + H2S
Многие сульфиды металлов и неметаллов, например , сульфид алюминия , пентасульфид фосфора , дисульфид кремния, выделяют сероводород при воздействии воды: [28]
- 6H2O + Al2S3 → 3H2S + 2Al ( OH ) 3
Этот газ также получается при нагревании серы с твердыми органическими соединениями и при восстановлении сернистых органических соединений водородом. Его также можно получить путем смешивания роданида аммония с концентрированной серной кислотой и добавления к ней воды.
Биосинтез
Сероводород может образовываться в клетках ферментативным или неферментативным путем. Три фермента катализируют образование H
2S : цистатионин γ-лиаза (CSE), цистатионин β-синтетаза (CBS) и 3-меркаптопируватсульфуртрансфераза (3-MST). [29] CBS и CSE являются основными сторонниками биогенеза H 2 S , который следует пути транссульфурации. [30] Эти ферменты были обнаружены во множестве биологических клеток и тканей, и их активность индуцируется рядом болезненных состояний. [31] Эти ферменты характеризуются переносом атома серы от метионина к серину с образованием молекулы цистеина. [30] 3-MST также способствует образованию сероводорода посредством катаболического пути цистеина. [31] [30] Пищевые аминокислоты, такие как метионин и цистеин, служат основными субстратами для путей транссульфурации и производства сероводорода. Сероводород также может быть получен из белков, таких как ферредоксины и белки Риске . [31]
Сульфатредуцирующие (соответственно сероредуцирующие ) бактерии вырабатывают полезную энергию в условиях низкого содержания кислорода, используя сульфаты (соответственно элементарную серу) для окисления органических соединений или водорода; в результате в качестве побочного продукта образуется сероводород. [32]
Сигнальная роль
H 2 S в организме действует как газообразная сигнальная молекула , имеющая значение для здоровья и развития заболеваний. [29] [33] [34] [35]
Сероводород участвует в вазодилатации у животных, а также в повышении прорастания семян и стрессовых реакций у растений. [36] Сигнализация сероводорода регулируется активными формами кислорода ( АФК ) и активными формами азота (АФА). [36] Было показано, что H2S взаимодействует с путем NO, что приводит к нескольким различным клеточным эффектам, включая ингибирование цГМФ-фосфодиэстераз, [37] а также образование другого сигнала, называемого нитрозотиолом. [36] Известно также, что сероводород повышает уровень глутатиона, который снижает или нарушает уровень АФК в клетках. [36]
Область биологии H 2 S продвинулась от экологической токсикологии к исследованию роли эндогенно продуцируемого H 2 S в физиологических условиях и различных патофизиологических состояниях. [38] H 2 S участвует в развитии рака, синдрома Дауна и сосудистых заболеваний. [39] [40] [41] [42]
При более низких концентрациях он стимулирует функцию митохондрий посредством множества механизмов, включая прямое донорство электронов. [43] [44] Однако при более высоких концентрациях он ингибирует комплекс IV митохондриальной цепи переноса электронов, что эффективно снижает выработку АТФ и биохимическую активность внутри клеток. [36]
Использует
Производство серы
Сероводород в основном потребляется как предшественник элементарной серы. Это преобразование, называемое процессом Клауса , включает частичное окисление до диоксида серы. Последний реагирует с сероводородом, давая элементарную серу. Преобразование катализируется оксидом алюминия. [45]
- 2H2S + SO2 → 3S + 2H2O
Производство тиоорганических соединений
Многие фундаментальные сероорганические соединения производятся с использованием сероводорода. К ним относятся метантиол , этантиол и тиогликолевая кислота . [26] Гидросульфиды могут использоваться в производстве тиофенола . [46]
Производство сульфидов металлов
При соединении с основаниями щелочных металлов сероводород превращается в гидросульфиды щелочных металлов, такие как гидросульфид натрия и сульфид натрия :
- H2S + NaOH → NaSH + H2O
- NaSH + NaOH → Na 2 S + H 2 O
Сульфиды натрия используются в бумажной промышленности. В частности, соли SH − разрывают связи между лигнином и целлюлозными компонентами пульпы в процессе крафт-варки . [26]
Как указано выше, многие ионы металлов реагируют с сероводородом, давая соответствующие сульфиды металлов. Оксидные руды иногда обрабатывают сероводородом, чтобы получить соответствующие сульфиды металлов, которые легче очищаются флотацией . Металлические части иногда пассивируют сероводородом. Катализаторы, используемые в гидродесульфурации , обычно активируют сероводородом. [26]
Происшествие

Вулканы и некоторые горячие источники (а также холодные источники ) выделяют некоторое количество H 2 S. Сероводород может естественным образом присутствовать в колодезной воде, часто в результате действия сульфатредуцирующих бактерий . [47] [ нужен лучший источник ] Сероводород вырабатывается человеческим организмом в небольших количествах посредством бактериального расщепления белков, содержащих серу, в кишечном тракте; поэтому он способствует характерному запаху метеоризма. Он также вырабатывается во рту ( галитоз ). [48]
Часть мировых выбросов H 2 S обусловлена деятельностью человека. На сегодняшний день крупнейшим промышленным источником H 2 S являются нефтеперерабатывающие заводы : процесс гидродесульфурации высвобождает серу из нефти под действием водорода. Полученный H 2 S преобразуется в элементарную серу путем частичного сжигания с помощью процесса Клауса , который является основным источником элементарной серы. Другие антропогенные источники сероводорода включают коксовые печи, бумажные фабрики (использующие процесс Крафта), кожевенные заводы и канализацию . H 2 S возникает практически в любом месте, где элементарная сера вступает в контакт с органическим материалом, особенно при высоких температурах. В зависимости от условий окружающей среды, он отвечает за ухудшение качества материала под действием некоторых микроорганизмов, окисляющих серу. Это называется биогенной сульфидной коррозией . [ необходима ссылка ]
В 2011 году сообщалось, что в сырой нефти из формации Баккен наблюдались повышенные концентрации H 2 S , возможно, из-за методов работы на нефтяном месторождении, и что это создавало такие проблемы, как «риски для здоровья и окружающей среды, коррозия ствола скважины, дополнительные расходы на обработку материалов и трубопроводное оборудование, а также дополнительные требования к очистке». [49]
Помимо проживания вблизи газовых и нефтяных скважин, обычные граждане могут подвергаться воздействию сероводорода, находясь вблизи очистных сооружений, свалок и ферм с навозохранилищами. Воздействие происходит через вдыхание загрязненного воздуха или питье загрязненной воды. [50]
На муниципальных свалках отходов захоронение органического материала быстро приводит к анаэробному брожению в массе отходов, и с влажной атмосферой и относительно высокой температурой, которые сопровождают биодеградацию , биогаз образуется, как только воздух в массе отходов уменьшается. Если есть источник сульфатсодержащего материала, такого как гипсокартон или природный гипс (дигидрат сульфата кальция), в анаэробных условиях сульфатредуцирующие бактерии преобразуют его в сероводород. Эти бактерии не могут выживать на воздухе, но влажные, теплые, анаэробные условия захороненных отходов, которые содержат высокий источник углерода — на инертных свалках бумага и клей, используемые при изготовлении таких изделий, как гипсокартон, могут обеспечить богатый источник углерода [51] — являются отличной средой для образования сероводорода.
В промышленных анаэробных процессах сбраживания, таких как очистка сточных вод или сбраживание органических отходов сельского хозяйства , сероводород может образовываться в результате восстановления сульфата и деградации аминокислот и белков в органических соединениях. [ 52] Сульфаты относительно не ингибируют метанобразующие бактерии , но могут быть восстановлены до H2S сульфатвосстанавливающими бактериями , которых существует несколько родов. [53]
Удаление из воды
Разработан ряд процессов для удаления сероводорода из питьевой воды . [54]
- Непрерывное хлорирование
- Для уровней до 75 мг/л хлор используется в процессе очистки как окисляющий химикат для реакции с сероводородом. Эта реакция дает нерастворимую твердую серу. Обычно используемый хлор находится в форме гипохлорита натрия . [55]
- Аэрация
- Для концентраций сероводорода менее 2 мг/л аэрация является идеальным процессом обработки. Кислород добавляется в воду, и реакция между кислородом и сероводородом приводит к образованию сульфата без запаха. [56]
Удаление из топливных газов
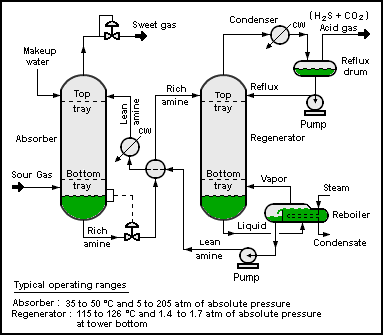
Сероводород обычно содержится в сыром природном газе и биогазе. Обычно его удаляют с помощью технологий очистки амина . В таких процессах сероводород сначала преобразуется в соль аммония, тогда как природный газ остается нетронутым. [57] [58]
- РНХ 2 + Н 2 S ⇌ [РНХ 3 ] + + Ш −
Бисульфид-анион впоследствии регенерируется путем нагревания раствора сульфида амина. Сероводород, образующийся в этом процессе, обычно преобразуется в элементарную серу с использованием процесса Клауса .
Безопасность
Термин подземного рудничного газа для зловонных газовых смесей, богатых сероводородом, - stinkdamp . Сероводород - высокотоксичный и легковоспламеняющийся газ ( диапазон воспламеняемости : 4,3–46%). Он может отравить несколько систем организма, хотя больше всего страдает нервная система . [ требуется ссылка ] Токсичность H 2 S сопоставима с токсичностью угарного газа . [59] Он связывается с железом в митохондриальных ферментах цитохрома , тем самым предотвращая клеточное дыхание . Его токсические свойства были подробно описаны в 1843 году Юстусом фон Либихом . [60]
Еще до открытия сероводорода итальянский врач Бернардино Рамаццини в своей книге 1713 года «De Morbis Artificum Diatriba» выдвинул гипотезу о том, что профессиональные заболевания работников канализации и почернение монет на их одежде могут быть вызваны неизвестной невидимой летучей кислотой (более того, в конце XVIII века токсичные выбросы газа из парижской канализации стали проблемой для граждан и властей). [61]
Хотя поначалу он очень резкий (пахнет тухлыми яйцами [62] ), он быстро притупляет обоняние, вызывая временную аносмию [63] , поэтому жертвы могут не знать о его присутствии, пока не станет слишком поздно. Процедуры безопасного обращения с ним указаны в его паспорте безопасности (SDS) . [64]
Низкий уровень воздействия
Поскольку сероводород естественным образом встречается в организме, окружающей среде и кишечнике, существуют ферменты для его метаболизма. На некотором пороговом уровне, который, как полагают, составляет в среднем около 300–350 ppm, окислительные ферменты перегружаются. Многие персональные детекторы газа безопасности, такие как те, которые используются работниками коммунальных служб, канализационных систем и нефтехимической промышленности, настроены на сигнализацию при уровне от 5 до 10 ppm и на высокую тревогу при уровне 15 ppm. Метаболизм вызывает окисление до сульфата, который безвреден. [65] Следовательно, низкие уровни сероводорода могут переноситься неограниченно долго. [ необходима цитата ]
Воздействие более низких концентраций может привести к раздражению глаз , боли в горле и кашлю , тошноте, одышке и скоплению жидкости в легких . [59] Считается, что эти эффекты вызваны тем, что сероводород соединяется со щелочью, присутствующей во влажных поверхностных тканях, образуя сульфид натрия , едкое вещество . [66] Эти симптомы обычно проходят через несколько недель.
Длительное воздействие низких концентраций может привести к усталости , потере аппетита, головным болям , раздражительности, плохой памяти и головокружению . Хроническое воздействие низких концентраций H 2 S (около 2 ppm ) было связано с увеличением числа выкидышей и проблемами репродуктивного здоровья среди российских и финских рабочих целлюлозно-бумажной промышленности, [67], но эти сообщения (по состоянию на 1995 год) не были воспроизведены.
Высокий уровень воздействия
Кратковременное воздействие высокого уровня может вызвать немедленный коллапс с потерей дыхания и высокой вероятностью смерти. Если смерть не наступает, высокое воздействие сероводорода может привести к кортикальному псевдоламинарному некрозу , дегенерации базальных ганглиев и отеку мозга . [59] Хотя паралич дыхания может быть немедленным, он также может быть отсрочен до 72 часов. [68]
Вдыхание H 2 S приводило примерно к 7 случаям смерти на рабочем месте в год в США (данные за 2011–2017 гг.), уступая по частоте смертей от вдыхания химических веществ на рабочем месте только оксиду углерода (17 случаев смерти в год). [69]
Пороги воздействия
- Пределы воздействия, установленные правительством США: [70]
- 10 ppm REL - Потолок ( NIOSH ): рекомендуемый допустимый потолок воздействия (рекомендуемый уровень, который нельзя превышать, за исключением одного раза в течение 10 минут в 8-часовую смену, если не происходит другого измеримого воздействия)
- 20 ppm PEL - Потолок ( OSHA ): допустимый потолок воздействия (уровень, который не должен быть превышен, за исключением одного раза в течение 10 минут в 8-часовую смену, если не происходит другого измеримого воздействия)
- 50 ppm PEL-Peak (OSHA): максимально допустимое воздействие (уровень, который ни в коем случае нельзя превышать)
- 100 ppm IDLH (NIOSH): немедленно опасно для жизни и здоровья (уровень, который препятствует возможности эвакуации)
- 0,00047 частей на миллион или 0,47 частей на миллиард — это порог обоняния, точка, при которой 50% людей могут обнаружить присутствие запаха, не будучи в состоянии идентифицировать его. [71]
- 10–20 ppm — это пограничная концентрация, вызывающая раздражение глаз.
- 50–100 ppm приводит к повреждению глаз.
- При концентрации 100–150 ppm обонятельный нерв парализуется после нескольких вдыханий, и обоняние исчезает , часто вместе с осознанием опасности. [72] [73]
- 320–530 ppm приводит к отеку легких с возможностью летального исхода. [59]
- 530–1000 ppm вызывает сильную стимуляцию центральной нервной системы и учащенное дыхание, приводящее к остановке дыхания.
- 800 ppm — смертельная концентрация для 50% людей при воздействии в течение 5 минут ( LC50 ).
- Концентрации свыше 1000 ppm вызывают мгновенный коллапс с потерей дыхания даже после однократного вдыхания.
Уход
Лечение включает немедленную ингаляцию амилнитрита , инъекции нитрита натрия или введение 4-диметиламинофенола в сочетании с ингаляцией чистого кислорода, введение бронходилататоров для преодоления возможного бронхоспазма и в некоторых случаях гипербарическую оксигенотерапию (ГБО). [59] ГБО имеет клиническую и анекдотическую поддержку. [74] [75] [76]
Инциденты
Сероводород использовался британской армией в качестве химического оружия во время Первой мировой войны . Он не считался идеальным военным газом, отчасти из-за его воспламеняемости и потому, что характерный запах можно было обнаружить даже при небольшой утечке, предупреждая противника о присутствии газа. Тем не менее, он был использован дважды в 1916 году, когда другие газы были в дефиците. [77]
2 сентября 2005 года утечка в отсеке винта круизного лайнера Royal Caribbean, пришвартованного в Лос-Анджелесе, привела к гибели 3 членов экипажа из-за утечки канализационной линии. В результате все такие отсеки теперь должны иметь систему вентиляции. [78] [79]
Считается, что сброс токсичных отходов, содержащих сероводород, стал причиной 17 смертей и тысяч заболеваний в Абиджане , на западноафриканском побережье, в 2006 году в Кот-д'Ивуаре . [80]
В сентябре 2008 года трое рабочих погибли, а двое получили серьезные травмы, включая долгосрочное повреждение мозга, на предприятии по выращиванию грибов в Лэнгли , Британская Колумбия . Клапан трубы, по которой куриный помет , солома и гипс поступали в компостное топливо для выращивания грибов, засорился, и когда рабочие прочищали клапан в замкнутом пространстве без надлежащей вентиляции, сероводород, накопившийся из-за анаэробного разложения материала, высвободился, отравив рабочих в близлежащей зоне. [81] Следователь сказал, что могло быть больше смертельных случаев, если бы труба была полностью очищена и/или если бы ветер изменил направление. [82]
В 2014 году уровень сероводорода достигал 83 ppm в недавно построенном торговом центре в Таиланде под названием Siam Square One в районе Siam Square . Арендаторы магазинов в торговом центре сообщили о таких проблемах со здоровьем, как воспаление придаточных пазух носа, затрудненное дыхание и раздражение глаз. После расследования было установлено, что большое количество газа возникло из-за несовершенной очистки и утилизации сточных вод в здании. [83]
В 2014 году сероводородный газ убил рабочих торгового центра Promenade в Северном Скоттсдейле, штат Аризона , США [84] после того, как они поднялись в камеру глубиной 15 футов без средств индивидуальной защиты . «Прибывшие бригады зафиксировали высокие уровни цианистого водорода и сероводорода, выходящих из канализации».
В ноябре 2014 года значительное количество сероводородного газа окутало центральную, восточную и юго-восточную части Москвы . МЧС настоятельно рекомендовало жителям этого района оставаться в помещениях. Хотя точный источник газа не был известен, вина была возложена на московский нефтеперерабатывающий завод. [85]
В июне 2016 года мать и ее дочь были найдены мертвыми в их все еще работающем внедорожнике Porsche Cayenne 2006 года у ограждения на автомагистрали Turnpike во Флориде . Первоначально считалось, что они стали жертвами отравления угарным газом . [86] [87] Их смерть оставалась необъяснимой, поскольку судмедэксперт ждал результатов токсикологических тестов жертв, [88] пока анализы мочи не показали, что причиной смерти стал сероводород. В отчете Управления судебно-медицинской экспертизы округа Ориндж-Оцеола указано, что токсичные пары исходили от стартерной батареи Porsche , расположенной под передним пассажирским сиденьем. [89] [90]
В январе 2017 года трое работников коммунальных служб в Ки-Ларго, Флорида , погибли один за другим в течение нескольких секунд после того, как спустились в узкое пространство под крышкой люка, чтобы проверить участок мощеной улицы. [91] Пытаясь спасти людей, пожарный, который вошел в отверстие без своего воздушного баллона (потому что он не мог пролезть через отверстие с ним), потерял сознание в течение нескольких секунд, и его пришлось спасать коллеге. [92] Пожарного доставили по воздуху в больницу Jackson Memorial Hospital , где он позже выздоровел. [93] [94] Офицер шерифа округа Монро первоначально определил, что в пространстве содержались сероводород и метан , образующиеся при разложении растительности. [95]
24 мая 2018 года двое рабочих погибли, еще один получил серьезные ранения, а 14 других были госпитализированы из-за вдыхания сероводорода на бумажной фабрике Norske Skog в Олбери, Новый Южный Уэльс . [96] [97] Расследование, проведенное SafeWork NSW, показало, что газ выделялся из резервуара, используемого для хранения технологической воды . Рабочие подверглись воздействию в конце трехдневного периода технического обслуживания. Сероводород накопился в резервуаре выше по течению, который был оставлен застоявшимся и не обработанным биоцидом в течение периода технического обслуживания. Эти условия позволили сульфатредуцирующим бактериям размножаться в резервуаре выше по течению, поскольку вода содержала небольшое количество древесной массы и волокна . Высокая скорость перекачки из этого резервуара в резервуар, вовлеченный в инцидент, привела к утечке сероводорода из различных отверстий вокруг его верхней части, когда перекачка была возобновлена в конце периода технического обслуживания. Территория над ним была достаточно закрыта для того, чтобы газ мог там скапливаться, несмотря на то, что Norske Skog не идентифицировала ее как замкнутое пространство . Один из рабочих, который погиб, был обнаружен во время расследования очевидной утечки жидкости в резервуаре, в то время как другой, который погиб, и рабочий, который был тяжело ранен, пытались спасти первого после того, как он упал на него. В результате уголовного дела Norske Skog была обвинена в неспособности обеспечить здоровье и безопасность своей рабочей силы на заводе в разумно осуществимой степени. Она признала себя виновной и была оштрафована на 1 012 500 австралийских долларов и обязана профинансировать производство анонимного образовательного видео об инциденте. [98] [99] [96] [100]
В октябре 2019 года сотрудник компании Aghorn Operating Inc. в Одессе, штат Техас, и его жена погибли из-за отказа водяного насоса. Насос выпустил воду с высокой концентрацией сероводорода. Рабочий погиб, отвечая на автоматический телефонный звонок, который он получил, сообщив о механической неисправности насоса, а его жена умерла, приехав на объект, чтобы проверить его. [101] Расследование CSB указало на нестрогие правила техники безопасности на объекте, такие как неформальная процедура блокировки-маркировки и неработающая система оповещения о сероводороде. [102]
Самоубийства
Газ, полученный путем смешивания определенных бытовых ингредиентов, использовался во время волны самоубийств в 2008 году в Японии. [103] Эта волна побудила сотрудников токийского центра по предотвращению самоубийств создать специальную горячую линию во время « Золотой недели », поскольку они получили больше звонков от людей, желающих покончить с собой во время ежегодного майского праздника. [104]
По состоянию на 2010 год это явление наблюдалось в ряде городов США, что повлекло за собой предупреждения для тех, кто прибывал на место самоубийства. [105] [106] [107] [108] [109]
В 2020 году японский профессиональный борец Хана Кимура использовал прием H 2 S в качестве метода самоубийства . [110]
В 2024 году Люси-Блю Найт, падчерица известного музыканта Слэша , также использовала H2S , чтобы совершить самоубийство. [111]
Сероводород в природной среде
Микробный: Цикл серы

Сероводород является центральным участником цикла серы , биогеохимического цикла серы на Земле. [112]
При отсутствии кислорода серовосстанавливающие и сульфатредуцирующие бактерии получают энергию от окисления водорода или органических молекул путем восстановления элементарной серы или сульфата до сероводорода. Другие бактерии высвобождают сероводород из серосодержащих аминокислот ; это вызывает запах тухлых яиц и способствует появлению запаха метеоризма .
Поскольку органическое вещество разлагается в условиях низкого содержания кислорода (или гипоксии ) (например, в болотах, эвтрофных озерах или мертвых зонах океанов), сульфатредуцирующие бактерии будут использовать сульфаты, присутствующие в воде, для окисления органического вещества, производя сероводород в качестве отходов. Часть сероводорода будет реагировать с ионами металлов в воде с образованием сульфидов металлов, которые не растворяются в воде. Эти сульфиды металлов, такие как сульфид железа FeS, часто имеют черный или коричневый цвет, что приводит к темному цвету ила .
Несколько групп бактерий могут использовать сероводород в качестве топлива, окисляя его до элементарной серы или сульфата, используя растворенный кислород, оксиды металлов (например, оксигидроксиды железа и оксиды марганца ) или нитрат в качестве акцепторов электронов. [113]
Пурпурные серные бактерии и зеленые серные бактерии используют сероводород в качестве донора электронов в фотосинтезе , тем самым производя элементарную серу. Этот режим фотосинтеза старше режима цианобактерий , водорослей и растений , которые используют воду в качестве донора электронов и высвобождают кислород.
Биохимия сероводорода является ключевой частью химии железо -серного мира . В этой модели происхождения жизни на Земле геологически произведенный сероводород постулируется как донор электронов, приводящий к восстановлению углекислого газа. [114]
Животные
Сероводород смертелен для большинства животных, но несколько высокоспециализированных видов ( экстремофилов ) процветают в местах обитания, богатых этим соединением. [115]
В глубоком море гидротермальные источники и холодные просачивания с высоким содержанием сероводорода являются домом для ряда чрезвычайно специализированных форм жизни, от бактерий до рыб. [ какие? ] [116] Из-за отсутствия солнечного света на этих глубинах эти экосистемы полагаются на хемосинтез, а не на фотосинтез . [117]
Пресноводные источники, богатые сероводородом, в основном являются средой обитания беспозвоночных, но также включают в себя небольшое количество рыб: Cyprinodon bobmilleri ( рыба-куколка из Мексики), Limia sulphurophila ( пецилиида из Доминиканской Республики ), Gambusia eurystoma (пецилиида из Мексики) и несколько Poecilia (пецилиида из Мексики). [115] [118] Беспозвоночные и микроорганизмы в некоторых пещерных системах, таких как пещера Мовиле , адаптированы к высоким уровням сероводорода. [119]
Межзвездные и планетарные явления
Сероводород часто обнаруживался в межзвездной среде. [120] Он также встречается в облаках планет в нашей солнечной системе. [121] [122]
Массовые вымирания

Сероводород был замешан в нескольких массовых вымираниях , которые произошли в прошлом Земли. В частности, накопление сероводорода в атмосфере могло вызвать или, по крайней мере, способствовать пермско-триасовому вымиранию 252 миллиона лет назад. [123] [124] [125]
Органические остатки с этих границ вымирания указывают на то, что океаны были бескислородными (истощенными кислородом) и имели виды мелководного планктона, которые метаболизировали H 2 S. Образование H 2 S могло быть инициировано массивными извержениями вулканов, которые выбрасывали в атмосферу углекислый газ и метан , что нагревало океаны, снижая их способность поглощать кислород, который в противном случае окислял бы H 2 S. Повышенные уровни сероводорода могли убить растения, генерирующие кислород, а также истощить озоновый слой, вызывая дополнительный стресс. Небольшие цветения H 2 S были обнаружены в наше время в Мертвом море и в Атлантическом океане у побережья Намибии . [123]
Смотрите также
- Халькогенид водорода – любое бинарное соединение водорода с халькогенами, включая полихалькогениды водорода.Страницы, отображающие описания викиданных в качестве резерва
- Хемосинтез сероводорода
- болотный газ
- Канализационный газ – газы, которые производятся и собираются в канализационных системах.
- Целевое управление температурой , также известное как индуцированная гипотермия – Медицинская процедура
Ссылки
- ^ "Hydrogen Sulfide - PubChem Public Chemical Database". Проект PubChem . США: Национальный центр биотехнологической информации.
- ^ ab Patnaik, Pradyot (2002). Справочник по неорганическим химикатам . McGraw-Hill. ISBN 978-0-07-049439-8.
- ^ ab William M. Haynes (2016). CRC Handbook of Chemistry and Physics (97-е изд.). Boca Raton: CRC Press. стр. 4–87 . ISBN 978-1-4987-5429-3.
- ^ "Сероводород". pubchem.ncbi.nlm.nih.gov .
- ^ Перрин, Д.Д. (1982). Константы ионизации неорганических кислот и оснований в водных растворах (2-е изд.). Оксфорд: Pergamon Press.
- ^ Брюкенштейн, С.; Колтхофф, И.М., в Колтхофф, И.М.; Элвинг, П.Дж. Трактат по аналитической химии , т. 1, ч. 1; Wiley, Нью-Йорк, 1959 , стр. 432–433.
- ^ ab Zumdahl, Steven S. (2009). Химические принципы (6-е изд.). Houghton Mifflin Company. стр. A23. ISBN 978-0-618-94690-7.
- ^ abc NIOSH Карманный справочник по химическим опасностям. "#0337". Национальный институт охраны труда и здоровья (NIOSH).
- ^ ab "Сероводород". Концентрации, представляющие непосредственную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ "Сероводород". npi.gov.au .
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Смит, Роджер П. (2010). «Краткая история сероводорода». American Scientist . 98 (1): 6. doi :10.1511/2010.82.6.
- ^ Shackelford, RE; Li, Y.; Ghali, GE; Kevil, CG (2021). «Неприятные запахи и сломанная ДНК: история о сотрудничестве серы и нуклеиновых кислот». Антиоксиданты . 10 (11): 1820. doi : 10.3390/antiox10111820 . PMC 8614844. PMID 34829691 .
- ^ Reiffenstein, RJ; Hulbert, WC; Roth, SH (1992). «Токсикология сероводорода». Annual Review of Pharmacology and Toxicology . 32 : 109– 134. doi :10.1146/annurev.pa.32.040192.000545. PMID 1605565.
- ^ Bos, E. M; Van Goor, H; Joles, J. A; Whiteman, M; Leuvenink, H. G (2015). «Сероводород: физиологические свойства и терапевтический потенциал при ишемии». British Journal of Pharmacology . 172 (6): 1479–1493 . doi : 10.1111/bph.12869 . PMC 4369258. PMID 25091411 .
- ^ Мэй, ПМ; Батка, Д.; Хефтер, Г.; Кёнигбергер, Э.; Роуленд, Д. (2018). «Прощай, S2-». Chem. Comm . 54 (16): 1980– 1983. doi :10.1039/c8cc00187a. PMID 29404555.
- ^ . дои : 10.1002/0471238961.0919152008011212.a01.
{{cite journal}}: Требуется цитировать журнал|journal=( помощь ) ; Отсутствует или пусто|title=( помощь ) - ^ Дроздов, А.; Еремец, МИ; Троян, ИА (2014). "Обычная сверхпроводимость при 190 К при высоких давлениях". arXiv : 1412.0460 [cond-mat.supr-con].
- ^ Картлидж, Эдвин (август 2015 г.). «Отчет о сверхпроводимости зажигает волну последующей физики». Nature . 524 (7565): 277. Bibcode :2015Natur.524..277C. doi : 10.1038/nature.2015.18191 . PMID 26289188.
- ^ Фараджи, Ф. (1998). «Прямое преобразование сероводорода в водород и серу». Международный журнал водородной энергетики . 23 (6): 451– 456. Bibcode : 1998IJHE...23..451F. doi : 10.1016/S0360-3199(97)00099-2.
- ^ Кинг, Эдвард Дж.; Фаринхолт, Ларкин Х. (1959). Качественный анализ и электролитические растворы. Нью-Йорк: Harcourt, Brace. OCLC 594863676.
- ^ Vogel, AI; Svehla, G. (1996). Качественный неорганический анализ Vogel. Harlow, England (1996); New Delhi, India (2008): Longman. ISBN 9788177582321. OCLC 792729931.
{{cite book}}: CS1 maint: местоположение ( ссылка ) - ^ Сотрудники JCE (март 2000 г.). «От серебра к черному — и обратно». Журнал химического образования . 77 (3): 328A. Bibcode : 2000JChEd..77R.328J. doi : 10.1021/ed077p328a. ISSN 0021-9584.
- ^ «Что заставляет монеты тонировать – ICCS». iccscoin.ca . 23 сентября 2021 г. Получено 2024-02-11 .
- ^ "Тонирование монет 101: Различия между естественно и искусственно тонированными монетами". Оригинальные монеты с кожей . 26 июня 2016 г. Получено 15 октября 2021 г.
- ^ abcd Пуликен, Франсуа; Блан, Клод; Аррец, Эммануэль; Лабат, Айвз; Турнье-Лассерв, Жак; Ладусс, Ален; Нугайред, Жан; Савен, Жерар; Ивальди, Рауль; Николя, Моник; Фиалер, Жан; Миллишер, Рене; Азема, Чарльз; Испаньо, Люсьен; Хеммер, Анри; Перро, Жак (2000). «Сероводород». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a13_467. ISBN 3527306730.
- ^ Чан, Йи Хернг; Лой, Адриан Чун Минь; Чиа, Кин Вай; Чай, Слайвестер Ю Ван; Нгу, Лок Хей; Хау, Бин Шен; Ли, Клаудия; Лок, Серен Соу Мун; Вонг, Ми Ки; Иин, Чунг Лунг; Чин, Бриджид Лай Фуй; Чан, Чжэ Фак; Лам, Су Шиунг (2023). «Преобразование сероводорода (H2S) в водород (H2) и химические вещества с добавленной стоимостью: прогресс, проблемы и перспективы» (PDF) . Chemical Engineering Journal . 458 . doi :10.1016/j.cej.2023.141398. S2CID 255887336.
- ^ Макферсон, Уильям (1913). Лабораторное руководство. Бостон: Ginn and Company. С. 445.
- ^ ab Huang, Caleb Weihao; Moore, Philip Keith (2015), «H2S синтезирующие ферменты: биохимия и молекулярные аспекты», Химия, биохимия и фармакология сероводорода , Справочник экспериментальной фармакологии, т. 230, Springer International Publishing, стр. 3–25 , doi :10.1007/978-3-319-18144-8_1, ISBN 9783319181431, PMID 26162827
- ^ abc Кабил, Омер; Витвицкий, Виктор; Кси, Питер; Банерджи, Рума (15 июля 2011 г.). «Количественное значение ферментов транссульфурации для продукции H 2 S в тканях мышей». Антиоксиданты и окислительно-восстановительная сигнализация . 15 (2): 363– 372. doi :10.1089/ars.2010.3781. PMC 3118817. PMID 21254839 .
- ^ abc Кабил, Омер; Банерджи, Рума (10 февраля 2014 г.). «Энзимология биогенеза, распада и сигнализации H2S». Антиоксиданты и окислительно-восстановительная сигнализация . 20 (5): 770– 782. doi :10.1089/ars.2013.5339. PMC 3910450. PMID 23600844 .
- ^ Ларри Бартон, ред. (1995), Сульфатредуцирующие бактерии, Springer, ISBN 9780306448577
- ^ Уоллес, Джон Л.; Ван, Руи (май 2015 г.). «Терапия на основе сероводорода: использование уникального, но повсеместно распространенного газотрансмиттера». Nature Reviews Drug Discovery . 14 (5): 329– 345. doi :10.1038/nrd4433. PMID 25849904. S2CID 5361233.
- ^ Powell, Chadwick R.; Dillon, Kearsley M.; Matson, John B. (2018). «Обзор доноров сероводорода (H2S): химия и потенциальное терапевтическое применение». Биохимическая фармакология . 149 : 110– 123. doi : 10.1016/j.bcp.2017.11.014. ISSN 0006-2952. PMC 5866188. PMID 29175421 .
- ^ Чирино, Джузеппе; Сабо, Чаба; Папапетропулос, Андреас (2023-01-01). «Физиологическая роль сероводорода в клетках, тканях и органах млекопитающих». Physiological Reviews . 103 (1): 31– 276. doi :10.1152/physrev.00028.2021. ISSN 0031-9333. PMID 35435014.
- ^ abcde Hancock, John T. (2017). Cell signaling (Четвертое изд.). Оксфорд, Великобритания. ISBN 9780199658480. OCLC 947925636.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Буччи, Мариаросария; Папапетропулос, Андреас; Веллеко, Валентина; Чжоу, Зонгминь; Пириоху, Анастасия; Руссос, Харис; Ровеццо, Фиорентина; Бранкалеоне, Винченцо; Чирино, Джузеппе (2010). «Сероводород — эндогенный ингибитор активности фосфодиэстеразы». Артериосклероз, тромбоз и сосудистая биология . 30 (10): 1998–2004 . doi :10.1161/ATVBAHA.110.209783. ISSN 1079-5642. PMID 20634473.
- ^ Сабо, Чаба (март 2018 г.). «Хронология исследований сероводорода (H2S): от экологического токсина до биологического медиатора». Биохимическая фармакология . 149 : 5–19 . doi :10.1016/j.bcp.2017.09.010. PMC 5862769. PMID 28947277 .
- ^ Сабо, Чаба; Папапетропулос, Андреас (октябрь 2017 г.). «Международный союз базовой и клинической фармакологии. CII: Фармакологическая модуляция уровней H2S: доноры H2S и ингибиторы биосинтеза H2S». Pharmacological Reviews . 69 (4): 497– 564. doi :10.1124/pr.117.014050. PMC 5629631 . PMID 28978633.
- ^ Ван, Руи (апрель 2012 г.). «Физиологические последствия сероводорода: исследование дуновения, которое расцвело». Physiological Reviews . 92 (2): 791– 896. doi :10.1152/physrev.00017.2011. PMID 22535897. S2CID 21932297.
- ^ Ли, Чжэнь; Полхемус, Дэвид Дж.; Лефер, Дэвид Дж. (17 августа 2018 г.). «Эволюция терапии сероводородом для лечения сердечно-сосудистых заболеваний». Circulation Research . 123 (5): 590– 600. doi : 10.1161/CIRCRESAHA.118.311134 . PMID 30355137. S2CID 53027283.
- ^ Кимура, Хидео (февраль 2020 г.). «Сигнализация сероводородом и полисульфидами через S-сульфирование белка». British Journal of Pharmacology . 177 (4): 720– 733. doi :10.1111/bph.14579. PMC 7024735. PMID 30657595.
- ^ Губерн, Марк; Андриамихая, Мирей; Нюбель, Тобиас; Блаше, Франсуа; Буйо, Фредерик (2007). «Сульфид, первый неорганический субстрат для клеток человека». Журнал ФАСЭБ . 21 (8): 1699–1706 . doi : 10.1096/fj.06-7407com . ISSN 0892-6638. ПМИД 17314140.
- ^ Мерфи, Бренна; Бхаттачарья, Решам; Мукерджи, Приябрата (2019). «Передача сигналов сероводорода в митохондриях и заболевания». Журнал FASEB . 33 (12): 13098– 13125. doi : 10.1096/fj.201901304R . ISSN 0892-6638. PMC 6894098. PMID 31648556 .
- ^ Ли, Дж. Д. (1998). Краткая неорганическая химия (5-е изд., переизданное изд.). Оксфорд: Blackwell Science. стр. 538. ISBN 978-0-632-05293-6.
- ^ Хазаи, Ардешир; Казем-Ростами, Масуд; Мусави-Заре, Ахмад; Баят, Мохаммад; Саедния, Шахназ (август 2012 г.). «Новый однореакторный синтез тиофенолов из родственных триазенов в мягких условиях». Synlett . 23 (13): 1893– 1896. doi :10.1055/s-0032-1316557. S2CID 196805424.
- ^ "Сероводород в колодезной воде" . Получено 4 сентября 2018 г.
- ^ Агентство по регистрации токсичных веществ и заболеваний (июль 2006 г.). "Токсикологический профиль сероводорода" (PDF) . стр. 154. Получено 20 июня 2012 г.
- ^ OnePetro. "Главная - OnePetro". onepetro.org . Архивировано из оригинала 2013-10-14 . Получено 2013-08-14 .
- ^ "Сероводород" (PDF) . Агентство по регистрации токсичных веществ и заболеваний. Декабрь 2016 г.
- ^ Джанг, Йонг-Чул; Таунсенд, Тимоти (2001). «Выщелачивание сульфатов из восстановленных мелких фракций строительного и сносного мусора». Advances in Environmental Research . 5 (3): 203–217 . doi :10.1016/S1093-0191(00)00056-3.
- ^ Кавинато, К. (2013) [2013]. «Основы анаэробного пищеварения» (PDF) .
- ^ Покорна, Дана; Забранска, Яна (ноябрь 2015 г.). «Бактерии, окисляющие серу, в экологических технологиях». Biotechnology Advances . 33 (6): 1246– 1259. doi :10.1016/j.biotechadv.2015.02.007. PMID 25701621.
- ^ Лемли, Энн Т.; Шварц, Джон Дж.; Вагенет, Линда П. «Сероводород в питьевой воде для домашнего хозяйства» (PDF) . Корнелльский университет. Архивировано из оригинала (PDF) 19 августа 2019 г.
- ^ «Сероводород (запах тухлых яиц) в скважинах грунтовых вод Пенсильвании». Penn State . Колледж сельскохозяйственных наук штата Пенсильвания. Архивировано из оригинала 4 января 2015 года . Получено 1 декабря 2014 года .
- ^ Макфарланд, Марк Л.; Провин, Т.Л. «Причины и альтернативы сероводорода в питьевой воде» (PDF) . Техасский университет A&M. Архивировано из оригинала (PDF) 30 июля 2020 г. . Получено 1 декабря 2014 г. .
- ^ Артур Коль; Ричард Нильсон (1997). Очистка газа (5-е изд.). Gulf Publishing. ISBN 0-88415-220-0.
- ^ Гэри, Дж. Х.; Хандверк, Дж. Э. (1984). Технология и экономика нефтепереработки (2-е изд.). Marcel Dekker, Inc. ISBN 0-8247-7150-8.
- ^ abcde Lindenmann, J.; Matzi, V.; Neuboeck, N.; Ratzenhofer-Komenda, B.; Maier, A; Smolle-Juettner, FM (декабрь 2010 г.). «Тяжелое отравление сероводородом, леченное 4-диметиламинофенолом и гипербарическим кислородом». Diving and Hyperbaric Medicine . 40 (4): 213– 217. PMID 23111938. Архивировано из оригинала 15 июня 2013 г. Получено 07.06.2013 .
- ^ Харрисон, Дж. Бауэр (1843-11-18). «Некоторые замечания о производстве сероводородного газа в пищеварительном тракте и его влиянии на систему». Provincial Medical Journal and Retrospect of the Medical Sciences . 7 (164): 127– 129. JSTOR 25492480.
- ^ "Краткая история сероводорода". American Scientist . 2017-02-06 . Получено 2023-12-25 .
- ^ «Почему моя вода пахнет тухлыми яйцами?». Департамент здравоохранения Миннесоты . Получено 20 января 2020 г.
- ^ Загрязняющие вещества, Национальный исследовательский совет (США), Комитет по аварийным и постоянным уровням воздействия для отдельных подводных лодок (2009). Сероводород. National Academies Press (США).
- ^ Университет штата Айова . "Паспорт безопасности материала сероводорода" (PDF) . Кафедра химии. Архивировано из оригинала (PDF) 2009-03-27 . Получено 2009-03-14 .
- ^ Ramasamy, S.; Singh, S.; Taniere, P.; Langman, MJS; Eggo, MC (август 2006 г.). «Уровень сульфид-детоксифицирующих ферментов в толстой кишке человека снижается при раке и повышается при дифференциации». American Journal of Physiology. Gastrointestinal and Liver Physiology . 291 (2): G288 – G296 . doi :10.1152/ajpgi.00324.2005. PMID 16500920. S2CID 15443357.
- ^ Льюис, Ричард Дж. (1996). Опасные свойства промышленных материалов Сакса (9-е изд.). Нью-Йорк, Нью-Йорк: Van Nostrand Reinhold. стр. 1844. ISBN 0442022557.
- ^ Хемминки, К.; Ниеми, М.Л. (1982). «Исследование самопроизвольных абортов в обществе: связь с профессией и загрязнением воздуха диоксидом серы, сероводородом и сероуглеродом». Int. Arch. Occup. Environ. Health . 51 (1): 55– 63. Bibcode : 1982IAOEH..51...55H. doi : 10.1007/bf00378410. PMID 7152702. S2CID 2768183.
- ^ "Феномен химического самоубийства". Firerescue1.com. 2011-02-07. Архивировано из оригинала 2015-04-04 . Получено 2013-12-19 .
- ^ "Смертельные случаи вдыхания химических веществ на рабочем месте выросли в 2017 году". Бюро статистики труда США . Получено 15 апреля 2022 г.
- ^ "Сероводород - Опасности | Управление по охране труда и технике безопасности". www.osha.gov . Получено 27.09.2021 .
- ^ Iowa State University Extension (май 2004 г.). «Наука обоняния. Часть 1: восприятие запаха и физиологическая реакция» (PDF) . PM 1963a . Получено 20 июня 2012 г.
- ^ USEPA; Профиль воздействия сероводорода на здоровье и окружающую среду, стр. 118-8 (1980) ECAO-CIN-026A
- ^ Зенц, К.; Дикерсон, О.Б.; Хорват, Э.П. (1994). Медицина труда (3-е изд.). Сент-Луис, Миссури. С. 886.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Gerasimon, Gregg; Bennett, Steven; Musser, Jeffrey; Rinard, John (январь 2007 г.). «Острое отравление сероводородом у молочного фермера». Клиническая токсикология . 45 (4): 420– 423. doi :10.1080/15563650601118010. PMID 17486486. S2CID 10952243.
- ^ Белли, Р.; Бернар, Н.; Коте, М; Паке, Ф.; Пуатрас, Ж. (июль 2005 г.). «Гипербарическая оксигенотерапия при лечении двух случаев отравления сероводородом из жидкого навоза». CJEM . 7 (4): 257– 261. doi : 10.1017/s1481803500014408 . PMID 17355683.
- ^ Hsu, P; Li, HW; Lin, YT (1987). «Лечение острого отравления сероводородом с помощью гипербарического кислорода». Журнал гипербарической медицины . 2 (4): 215–221 . Архивировано из оригинала 7 декабря 2008 г.
- ^ Foulkes, Charles Howard (2001) [Впервые опубликовано Blackwood & Sons, 1934]. "Газ!" История специальной бригады . Опубликовано Naval & Military P. стр. 105. ISBN 978-1-84342-088-0.
- ^ "LA County Department of Public Health" (PDF) . Округ Лос-Анджелес: Department of Public Health . Архивировано из оригинала (PDF) 2017-02-18 . Получено 2017-06-11 .
- ↑ Бесерра, Гектор; Пирсон, Дэвид (2005-09-03). «Газ убивает 3 членов экипажа на корабле». Los Angeles Times .
- ^ Amnesty International и Greenpeace Netherlands: Токсичная правда — о компании Trafigura, судне Probo Koala и сбросе токсичных отходов в Кот-д'Ивуаре. Amnesty International Publications, Лондон 2012, ISBN 978-0-86210-478-8 . (PDF, 232 страницы, 7,6 Мб Архивировано 3 марта 2016 года на Wayback Machine )
- ^ Фергюсон, Дэн (16 сентября 2011 г.). «Подробности трагедии на грибной ферме в Лэнгли наконец раскрыты». Abbotsford News . Получено 13 апреля 2020 г.
- ^ Теодор, Терри (8 мая 2012 г.). «Десятки людей могли погибнуть из-за халатности владельца в инциденте на грибной ферме в Британской Колумбии: следователь». The Canadian Press . The Globe and Mail . Получено 13 апреля 2020 г. .
- ^ "Не вдыхайте: Опасный, токсичный газ обнаружен в Siam Square One". Coconuts Bangkok . Coconuts Media . 2014-10-21 . Получено 20 ноября 2014 г. .
- ^ "Двое рабочих канализации погибли, по-видимому, из-за токсичных паров - CBS News". CBS News . 26 августа 2014 г.
- ^ "Российская столица Москва окутана ядовитым газом". BBC News . British Broadcasting Corporation. 2014-11-10 . Получено 1 декабря 2014 г.
- ^ "Источники: Мать и дочь, найденные мертвыми в Porsche, вероятно, умерли от угарного газа". WFTV . 7 июня 2016 г.
У обоих были покрасневшая кожа и симптомы, похожие на сыпь, а также рвота, сообщили источники.
- ^ Сэлинджер, Тобиас (4 октября 2016 г.). «Женщина, девочка скончались после вдыхания сероводорода, говорят коронеры». New York Daily News . Получено 28 апреля 2017 г.
- ^ Лотан, Гал Циперман (4 октября 2016 г.). «Вдыхание сероводорода убило мать, ребенка нашли на платной автомагистрали Флориды в июне». Orlando Sentinel . Получено 28 апреля 2017 г.
- ^ Килинг, Боб. «Судебный эксперт подтверждает предполагаемую причину смерти в загадочном деле на трассе Тернпайк». Архивировано из оригинала 2016-10-05 . Получено 2016-10-04 .
- ^ Белл, Лиза (19 марта 2017 г.). «Скрытые опасности в автомобиле, о которых вам следует знать». ClickOrlando.com . Продюсер: Донован Мири. WKMG-TV . Получено 28 апреля 2017 г. Porsche
Cayennes, как и несколько других транспортных средств, имеют аккумуляторы в пассажирском салоне.
- ^ "Один за другим трое работников коммунальных служб спустились в люк. Один за другим они погибли". www.washingtonpost.com . Архивировано из оригинала 2017-01-18.
- ^ Гудхью, Дэвид (17 января 2017 г.). «Пожарный, пытавшийся спасти 3 человек в люке, борется за свою жизнь». Miami Herald . Получено 28 апреля 2017 г.
- ^ "Пожарный из Ки-Ларго делает первые шаги после того, как его едва не убили". WSVN . 18 января 2017 г.
- ^ "Пожарный, переживший попытку спасения на Ки-Ларго, в результате которой погибли 3 человека, покидает больницу". Sun Sentinel . Associated Press. 26 января 2017 г.
- ^ Рабин, Чарльз; Гудхью, Дэвид (16 января 2017 г.). «Работники коммунальной службы Three Keys умирают в траншее для сточных вод». Miami Herald . Получено 28 апреля 2017 г.
- ^ ab Clantar, Claire (25 сентября 2020 г.). «Бывшая бумажная фабрика в Виктории оштрафована на 1 миллион долларов после смерти двух рабочих». 9News . Получено 30 мая 2021 г. .
- ^ "Два смертельных случая при предполагаемой утечке сероводородного газа на бумажной фабрике". Австралийский институт здравоохранения и безопасности . 31 мая 2018 г. Получено 30 мая 2021 г.
- ↑ Брешия, Пол (28 мая 2018 г.). «SafeWork расследует Norske Skog». Спринтер . Проверено 30 мая 2021 г.
- ^ SafeWork NSW против Norske Skog Paper Mills (Australia) Limited , NSWDC 559 ( Окружной суд Нового Южного Уэльса, 25 сентября 2020 г.).
- ^ SafeWork NSW (29 марта 2021 г.). Анимация инцидента – Опасный газ (кинофильм). Архивировано из оригинала 2021-10-30 . Получено 30 мая 2021 г.
- ^ "Feds Probe Fatal 2019 Hydrogen Sulfide Release in Texas". Industrial Fire World . 27 июля 2020 г. Получено 29 мая 2021 г.
- ^ "Aghorn Operating Waterflood Station Hydrogen Sulfide Release". Совет по расследованию химических веществ и опасных веществ США. 21 мая 2021 г. Получено 29 мая 2021 г.
- ^ «Опасная японская техника самоубийства с помощью моющих средств проникает в США». Wired . 13 марта 2009 г.
- ↑ Намики, Норико (23 мая 2008 г.). «Ужасный поворот в волнах самоубийств в Японии». ABC News .
- ^ http://info.publicintelligence.net/LARTTAChydrogensulfide.pdf [ необходима полная ссылка ]
- ^ http://info.publicintelligence.net/MAchemicalsuicide.pdf [ необходима полная ссылка ]
- ^ http://info.publicintelligence.net/illinoisH2Ssuicide.pdf [ необходима полная ссылка ]
- ^ http://info.publicintelligence.net/NYhydrogensulfide.pdf [ требуется полная ссылка ]
- ^ http://info.publicintelligence.net/KCTEWhydrogensulfide.pdf [ необходима полная ссылка ]
- ^ Кейси, Коннор (26 мая 2020 г.). «Раскрыта причина смерти Ханы Кимуры». ComicBook.com .
С тех пор появились новые подробности о ее смерти, поскольку Дэйв Мельцер рассказал подробности о том, что произошло в ночь ее смерти во время недавнего выступления на радио Wrestling Observer Radio. По словам Мельцера, Кимура умерла после вдыхания сероводорода. Он объяснил, что опасения по поводу ее здоровья впервые возникли, когда она опубликовала твит рано утром в субботу, в котором говорилось, что она собирается причинить себе вред.
- ^ "Причина смерти падчерицы Слэша объяснена судмедэкспертом". tribune.com.pk . 30 августа 2024 г. Получено 30 августа 2024 г.
- ^ Бартон, Ларри Л.; Фардо, Мари-Лор; Фок, Гай Д. (2014). «Сероводород: токсичный газ, образующийся при диссимиляционном восстановлении сульфата и серы и потребляемый микробным окислением». Биогеохимия газообразных соединений в окружающей среде, обусловленная металлами . Ионы металлов в науках о жизни. Том 14. С. 237–277 . doi :10.1007/978-94-017-9269-1_10. ISBN 978-94-017-9268-4. PMID 25416397.
- ^ Йоргенсен, BB; Нельсон, DC (2004). «Окисление сульфидов в морских отложениях: геохимия встречается с микробиологией». В Amend, JP; Edwards, KJ; Lyons, TW (ред.). Биогеохимия серы – прошлое и настоящее . Геологическое общество Америки. стр. 36–81 .
- ^ Wächtershäuser, G (декабрь 1988). «До ферментов и шаблонов: теория поверхностного метаболизма». Microbiological Reviews . 52 (4): 452– 484. doi :10.1128/MMBR.52.4.452-484.1988. PMC 373159 . PMID 3070320.
- ^ аб Тоблер, М; Риш, Р.; Гарсиа де Леон, Ф.Дж.; Шлупп, И.; Плат, М. (2008). «Две эндемичные и находящиеся под угрозой исчезновения рыбы, Poecilia ulfuraria (Alvarez, 1948) и Gambusia eurystoma Miller, 1975 (Poeciliidae, Teleostei), единственные выжившие в небольшой сульфидной среде обитания». Журнал биологии рыб . 72 (3): 523–533 . Бибкод : 2008JFBio..72..523T. дои : 10.1111/j.1095-8649.2007.01716.x. S2CID 27303725.
- ^ Бернардино, Анджело Ф.; Левин, Лиза А.; Тербер, Эндрю Р.; Смит, Крейг Р. (2012). «Сравнительный состав, разнообразие и трофическая экология макрофауны осадка в жерлах, выходах и органических водопадах». PLOS ONE . 7 (4): e33515. Bibcode : 2012PLoSO...733515B. doi : 10.1371/journal.pone.0033515 . PMC 3319539. PMID 22496753 .
- ^ "Гидротермальные источники". Морское общество Австралии . Получено 28 декабря 2014 г.
- ^ Паласиос, Маура; Ариас-Родригес, Ленин; Плат, Мартин; Эйферт, Констанце; Лерп, Ханнес; Ламбой, Антон; Фёлькер, Гари; Тоблер, Майкл (2013). «Повторное открытие давно описанного вида выявило дополнительную сложность в моделях видообразования рыб семейства пецилиевых в сульфидных источниках». PLOS ONE . 8 (8): e71069. Bibcode : 2013PLoSO...871069P. doi : 10.1371/journal.pone.0071069 . PMC 3745397. PMID 23976979 .
- ^ Kumaresan, Deepak; Wischer, Daniela; Stephenson, Jason; Hillebrand-Voiculescu, Alexandra; Murrell, J. Colin (16 марта 2014 г.). «Микробиология пещеры Мовиле — хемолитоавтотрофная экосистема». Geomicrobiology Journal . 31 (3): 186– 193. Bibcode : 2014GmbJ...31..186K. doi : 10.1080/01490451.2013.839764. S2CID 84472119.
- ^ Деспоа, Д. (1997). «Наблюдения молекулярных и изотопных видов в комете C/1995 O1 (Хейла-Боппа) по радиолиниям». Земля, Луна и планеты . 79 (1/3): 103–124 . Bibcode : 1997EM&P...79..103D. doi : 10.1023/A:1006229131864. S2CID 118540103.
- ^ Ирвин, Патрик Г. Дж.; Толедо, Дэниел; Гарланд, Райан; Тинби, Николас А.; Флетчер, Ли Н.; Ортон, Гленн А.; Безар, Бруно (май 2018 г.). «Обнаружение сероводорода над облаками в атмосфере Урана». Nature Astronomy . 2 (5): 420– 427. Bibcode :2018NatAs...2..420I. doi :10.1038/s41550-018-0432-1. hdl : 2381/42547 . S2CID 102775371.
- ^ Лиссауэр, Джек Дж.; де Патер, Имке (2019). Фундаментальные планетарные науки: физика, химия и обитаемость . Нью-Йорк, Нью-Йорк, США: Cambridge University Press. С. 149–152 . ISBN 9781108411981.[ нужна страница ]
- ^ ab "Удар из глубины". Scientific American . Октябрь 2006 г.
- ^ Lamarque, J.-F.; Kiehl, JT; Orlando, JJ (16 января 2007 г.). «Роль сероводорода в разрушении озонового слоя на границе перми и триаса». Geophysical Research Letters . 34 (2): 1– 4. Bibcode : 2007GeoRL..34.2801L. doi : 10.1029/2006GL028384 . S2CID 55812439.
- ^ Камп, Ли; Павлов, Александр; Артур, Майкл А. (1 мая 2005 г.). «Массовый выброс сероводорода на поверхность океана и в атмосферу в периоды океанической аноксии». Геология . 33 (5): 397– 400. Bibcode : 2005Geo....33..397K. doi : 10.1130/G21295.1 . Получено 2 апреля 2023 г.
Дополнительные ресурсы
- Комитет по медицинским и биологическим эффектам загрязнителей окружающей среды (1979). Сероводород . Балтимор: University Park Press. ISBN 978-0-8391-0127-7.
- Siefers, Andrea (2010). Новая и экономически эффективная технология удаления сероводорода с использованием резиновых частиц, полученных из шин (диссертация на степень магистра). Университет штата Айова . Получено 8 февраля 2013 г.
Внешние ссылки
- Международная карта химической безопасности 0165
- Краткий международный документ по оценке химических веществ 53
- Национальный реестр загрязняющих веществ - Информационный листок о сероводороде
- Карманный справочник NIOSH по химическим опасностям
- NACE (Национальная ассоциация по коррозионной стойкости)