ДОкс

4-Замещенные-2,5-диметоксиамфетамины ( DO x ) — это химический класс замещенных производных амфетамина , имеющих метоксигруппы в положениях 2 и 5 фенильного кольца и заместитель , такой как алкил или галоген , в положении 4 фенильного кольца. [1] [2] Они являются 4-замещенными производными 2,5-диметоксиамфетамина (2,5-DMA, DOH) и структурно связаны с природным фенэтиламином — психоделическим средством мескалином .
Наиболее известными препаратами DOx являются DOM , DOI , DOB , DOET и DOC . [3] DOI широко используется в научных исследованиях . [2] [4] DOM использовался как рекреационный наркотик , в то время как DOET был экспериментальным фармацевтическим препаратом . [5]
Большинство соединений этого класса являются мощными и длительно действующими психоделическими препаратами и действуют как селективные агонисты рецепторов 5-HT 2A , 5-HT 2B и 5-HT 2C . [6] [7] Несколько более объемных производных, таких как DOAM, имеют аналогично высокое сродство к рецепторам 5-HT 2 , но имеют сниженную активационную эффективность и не производят психоделических эффектов. [2] [6]
Было обнаружено, что DOI обладает чрезвычайно мощным противовоспалительным действием. [8] [9] [10] Эти свойства не свойственны всем другим родственным препаратам и, по-видимому, опосредованы функционально селективной активацией серотонинового 5-HT 2A рецептора. [9] [11] Противовоспалительное действие DOI и родственных препаратов может иметь медицинское применение. [8] [9]
Побочные эффекты
Препараты DOx, такие как DOM, связаны с определенными побочными эффектами , которые не проявляются в той же степени при использовании других психоделиков, таких как ЛСД . [5] Примерами таких побочных эффектов являются физические симптомы, такие как потоотделение , тремор и значительное увеличение частоты сердечных сокращений . [5]
Фармакология
Фармакодинамика
Действия
Препараты DOx действуют как агонисты серотониновых рецепторов 5-HT 2 , включая серотониновые рецепторы 5-HT 2A , 5-HT 2B и 5-HT 2C . [6] [12] [7] [2] [ 3] Считается, что их психоделические эффекты опосредуются, в частности, активацией серотонинового рецептора 5-HT 2A . [12] [2]
В отличие от других амфетаминов, препараты DOx, такие как DOC , DOET и DOM, неактивны в качестве агентов высвобождения моноаминов и ингибиторов обратного захвата . [13] [14] [6] Некоторые из препаратов DOx, включая DOB , DOET, DOI и DOM, являются агонистами TAAR1 крысы, резус-макаки и/или человека. [15] [16]
Эффекты
В отличие от амфетаминов, таких как (–)-катинон , но подобно мескалину , DOM не показал стимулирующих или подкрепляющих эффектов у макак-резусов . [17] [18] [19] [20] Однако, наоборот, DOC показал подкрепляющие эффекты, включая обусловленное предпочтение места (CPP) и самоупотребление , у грызунов, подобно метамфетамину . [21] Это аналогично другим результатам, в которых было обнаружено, что различные препараты 2C и NBOMe вызывают повышение дофаминергической активности мозга и подкрепляющие эффекты у грызунов. [22] [23] [24] [25] [26] [27] [28]
Фармакокинетика
Препараты DOx активны при приеме внутрь , и многие из них имеют дозировку в диапазоне от 1 до 10 мг и продолжительность действия в диапазоне от 8 до 30 часов. [29] [3] [2] [30] [5] Некоторые препараты DOx, такие как DOM и DOB, по-видимому, имеют продолжительность действия, которая увеличивается нелинейно с дозировкой, например, 8 часов при более низких дозах и до 30 часов или даже до 3 или 4 дней при более высоких дозах. [5] [31] Это говорит о том, что пути, опосредующие метаболизм этих препаратов, могут насыщаться. [5] Препараты DOx метаболизируются в основном путем O - деметилирования . [3] Однако DOM в основном метаболизируется путем гидроксилирования по его метильной группе . [3]
История
DOM был первым открытым психоделиком из серии DOx. [4] Впервые он был синтезирован Александром Шульгиным в компании Dow Chemical в 1963 году, у которого был первый психоделический опыт с мескалином (3,4,5-триметоксифенэтиламином) в 1960 году. [4] [5] [32] Шульгин лично попробовал DOM 4 января 1964 года и обнаружил его психоделические эффекты. [33] [4] [5] [32] 2,4,5-триметоксиамфетамин (ТМА-2; «ДОМеО») был синтезирован Брукнером в 1933 году, но его психоделические эффекты не были описаны, пока Шульгин не попробовал это соединение и не сообщил о его эффектах в научной литературе в 1964 году. [34] [35] [36] До этого 3,4,5-триметоксиамфетамин (ТМА; α-метилмескалин) был синтезирован Хеем в 1947 году, и, как он обнаружил, вызывает эйфорию , и был описан Перецем и коллегами в 1955 году как явно вызывающий психоделические эффекты. [34] [37] [38] [39]
После открытия DOM Шульгин разработал DOET и обнаружил, что в малых дозах он является замечательным « психическим стимулятором », не вызывая при этом психоделических эффектов. [5] Компания Dow Chemical решила продолжить клинические испытания DOET как потенциального фармацевтического препарата для таких целей. [5] Шульгин и компания Dow Chemical Company подали заявку на патент DOET в 1966 году, хотя он был опубликован только в 1970 году. [5] [4] [40] Компания Dow Chemical Company поручила Соломону Х. Снайдеру из Университета Джонса Хопкинса провести клиническое исследование DOET. [5]
В апреле 1967 года, после запрета ЛСД в Калифорнии в 1966 году, ДОМ появился как уличный наркотик и легальная альтернатива ЛСД под названием «STP» (предположительно сокращение от «Serenity, Tranquility, and Peace») в районе Хейт-Эшбери в Сан-Франциско . [5] [41] Это произошло из-за того, что ДОМ публично распространялся бесплатно в форме таблеток с высокой дозой дистрибьютором ЛСД Оусли Стэнли , который лично узнал о ДОМ от Шульгина. [5] [41] Неясно, почему Шульгин предоставил Стэнли информацию о ДОМ, поскольку это могло поставить под угрозу профессиональную карьеру Шульгина и клинические исследования DOET. [5] [41] Одна из возможностей заключается в том, что компания Dow Chemical не занималась дальнейшим изучением ДОМ, и Шульгин считал, что это многообещающий препарат, который в противном случае был бы забыт. [5] В любом случае, уличное использование DOM было недолгим, поскольку таблетки вызвали кризис общественного здравоохранения из-за того, что они часто вызывали очень длительные периоды действия (до 3–4 дней), интенсивные переживания, тревожные физические побочные эффекты и госпитализации . [5] Впервые о DOM сообщили в СМИ и научной литературе в 1967 году в результате кризиса. [5] [42] [43] DOM стал незаконным в Соединенных Штатах в 1968 году. [5]
Компания Dow Chemical Company прекратила свою программу клинических исследований DOET из-за кризиса общественного здравоохранения, связанного с DOM. [5] DOET впоследствии был впервые описан в литературе Снайдером и его коллегами в 1968 году. [43] Снайдер продолжал интересоваться DOET как потенциальным лекарством, но оно так и не было разработано в дальнейшем. [43] Снайдер также описал 2,5-диметоксиамфетамин (2,5-DMA), который был синтезирован и испытан Шульгиным, в литературе в 1968 году. [44] DOM и DOET были дополнительно описаны в научной литературе Шульгиным в 1969 году. [45] [4] [5] Кроме того, Шульгин обсуждал DOM, DOET, TMA-2 и 2,5-DMA в главе книги о галлюциногенах, опубликованной в 1970 году. [46]
За более ранними препаратами DOx, такими как DOM и DOET, впоследствии последовал DOB , который был разработан Шульгиным и его коллегами, такими как Клаудио Наранхо , в 1971 году, [4] [47] и DOI , DOC и несколько других аналогов , которые были разработаны другой исследовательской группой в 1973 году. [4] [48] После этого были синтезированы и охарактеризованы многочисленные другие препараты DOx, как Шульгиным, так и другими учеными. [34] [49] [31] [30] [32] [50] [2]
После своего открытия DOI стал широко использоваться в научных исследованиях при изучении серотониновых 5-HT2 рецепторов . [4] [2]
Список препаратов DOx
Семейство DO x включает в себя следующих членов:
| Структура | Имя | Аббревиатура | Номер CAS |
|---|---|---|---|
 | 2,5-Диметоксиамфетамин | 2,5-ДМА | 2801-68-5 |
 | 2,5-Диметокси-4-амиламфетамин | ДОАМ | 63779-90-8 |
 | 2,5-Диметокси-4-бромамфетамин | дата рождения | 64638-07-9 |
 | 2,5-Диметокси-4-бутиламфетамин | ДОБУ | 63779-89-5 |
 | 2,5-Диметокси-4-хлорамфетамин | ДОКТОР | 123431-31-2 |
 | 2,5-Диметокси-4-этоксиамфетамин | МЭМ | 16128-88-4 |
 | 2,5-Диметокси-4-(метоксиметил)амфетамин | ДОМОМ [51] | 260810-10-4 |
 | 2,5-Диметокси-4-(этоксиметил)амфетамин | ДОМОЕ | 930836-81-0 |
 | 2,5-Диметокси-4-этиламфетамин | ДОЭТ | 22004-32-6 |
 | 2,5-Диметокси-4-этилтиоамфетамин | Алеф-2 | 185562-00-9 |
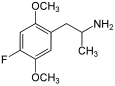 | 2,5-Диметокси-4-фторамфетамин | ДОФ | 125903-69-7 |
 | 2,5-Диметокси-4-(2-фторэтил)амфетамин | ДОЭФ | 121649-01-2 |
 | 2,5-Диметокси-4-(3-фторпропил)амфетамин | ДОПФ | ? |
 | 2,5-Диметокси-4-йодоамфетамин | ДОИ | 42203-78-1 |
 | 2,5-Диметокси-4-изопропилтиоамфетамин | Алеф-4 | 123643-26-5 |
 | 2,4,5-Триметоксиамфетамин | ТМА-2 (ДОМеО) | 1083-09-6 |
 | 2,5-Диметокси-4-метиламфетамин | ДОМ | 15588-95-1 |
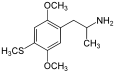 | 2,5-Диметокси-4-метилтиоамфетамин | Алеф-1 | 61638-07-1 |
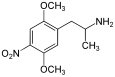 | 2,5-Диметокси-4-нитроамфетамин | ДОН | 67460-68-8 |
 | 2,5-Диметокси-4-фенилтиоамфетамин | Алеф-6 | 952006-44-9 |
 | 2,5-Диметокси-4-бензиламфетамин | ДОБЗ [52] | 125903-73-3 |
 | 2,5-Диметокси-4-(3-метоксибензил)амфетамин | ДО3МеОБЗ [53] | 930836-90-1 |
 | 2,5-Диметокси-4-[(тетрагидрофуран-2-ил)метил]амфетамин | ДОТХФМ | 930776-12-8 |
 | 2,5-Диметокси-4-пропиламфетамин | ДОПР | 63779-88-4 |
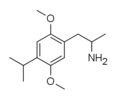 | 2,5-Диметокси-4-изопропиламфетамин | ДОиП | 42306-96-7 |
 | 2,5-Диметокси-4-пропилтиоамфетамин | Алеф-7 | 207740-16-7 |
 | 2,5-Диметокси-4-(дифторметил)амфетамин | ДОДФМ | ? |
 | 2,5-Диметокси-4-трифторметиламфетамин | ДОТФМ | 159277-07-3 |
 | 2,5-Диметокси-4-(2,2,2-трифторэтил)амфетамин | ДОТФЕ [54] | ? |
 | 2,5-Диметокси-4-цианоамфетамин | ДОКН [55] | 125903-74-4 |
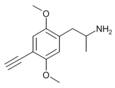 | 2,5-Диметокси-4-этиниламфетамин | ДОЙН [56] | 633290-70-7 |
| 2,5-Диметокси-4-изобутиламфетамин | ДОИБ | ||
| 2,5-Диметокси-4- сек -бутиламфетамин | ДОСБ | 89556-71-8 | |
| 2,5-Диметокси-4- трет -бутиламфетамин | ДОТБ | 41538-42-5 |
Родственные соединения
Известен ряд дополнительных соединений с альтернативными заменами:
| Структура | Имя | Аббревиатура | Номер CAS |
|---|---|---|---|
 | Димоксамин («Ариадна») | 4С-Д | 52842-59-8 |
 | 1-(2,5-Диметокси-4-этилфенил)бутан-2-амин [57] | 4С-Е | |
 | 1-(2,5-Диметокси-4-(н-пропил)фенил)бутан-2-амин | 4С-П | |
 | 1-(2,5-Диметокси-4-бромфенил)бутан-2-амин | 4С-Б | 69294-23-1 |
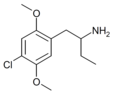 | 1-(2,5-Диметокси-4-хлорфенил)бутан-2-амин | 4С-С | 791010-74-7 |
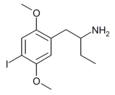 | 1-(2,5-Диметокси-4-иодфенил)бутан-2-амин | 4С-I | 758631-75-3 |
 | 1-(2,5-Диметокси-4-нитрофенил)бутан-2-амин | 4C-N | 775234-58-7 |
 | 1-[2,5-Диметокси-4-(этилтио)фенил]бутан-2-амин | 4С-Т-2 | 850007-13-5 |
 | Диметоксиметамфетамин («Беатрис») | N-метил-ДОМ | 92206-37-6 |
 | 2,5-Диметокси-3,4-метилендиоксиамфетамин | ДММДА | 15183-13-8 |
 | 2,5-диметокси-3,4-диметиламфетамин («Ганеша») | 3-метил-ДОМ | 207740-37-2 |
 | 2,5-Диметокси-3,4-триметилениламфетамин | Г-3 | |
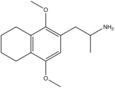 | 2,5-Диметокси-3,4-тетраметилениламфетамин | Г-4 | |
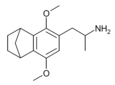 | 2,5-Диметокси-3,4-норборниламфетамин | Г-5 | |
 | 1-(5,8-диметокси-3,4-дигидро-1H-изохромен-7-ил)пропан-2-амин [58] | ИДТИ | 774538-38-4 |
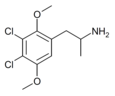 | 2,5-Диметокси-3,4-дихлорамфетамин | ДОДК | 1373918-65-0 |
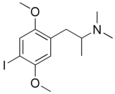 | ИДННА | ИДННА | 67707-78-2 |
 | Метил-ДОБ | N-метил-ДОБ | 155638-80-5 |
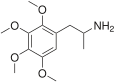 | 2,3,4,5-Тетраметоксиамфетамин | 2,3,4,5-Тетраметоксиамфетамин | 23693-26-7 |
 | 1-(4-Бром-2,3,6,7-тетрагидрофуро[2,3-f][1]бензофуран-8-ил)пропан-2-амин | ДОБ-ФЛАЙ | 219986-75-1 |
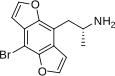 | Бромо-DragonFLY | ДОБ-ДФЛАЙ | 502759-67-3 |
 | 3-(4-бром-2,5-диметоксифенил)азетидин | Соединение 1, [59] ZC-B |
Смотрите также
- 2,5-Диметоксиамфетамин
- 2Cs , 25-NB
- Замещенные амфетамины
- Замещенные бензофураны
- Замещенные катиноны
- Замещенные метилендиоксифенэтиламины
- Замещенные фенэтиламины
- Замещенные триптамины
- ПиХКАЛ
- Индекс Шульгина
Ссылки
- ^ Дэниел Траксел; Дэвид Леманн и Кристоф Энценспергер (2013). Фенэтиламин: Von der Struktur zur Funktion . Нахтшаттен Верлаг АГ. ISBN 978-3-03788-700-4.
- ^ abcdefgh Гленнон РА, Дукат М (июнь 2024 г.). «1-(2,5-диметокси-4-иодфенил)-2-аминопропан (DOI): от неизвестного до основного члена семейства серотонинергических психоделических агентов DOX — обзор». ACS Pharmacol Transl Sci . 7 (6): 1722– 1745. doi :10.1021/acsptsci.4c00157. PMC 11184610. PMID 38898956.
- ^ abcde Wills B, Erickson T (9 марта 2012 г.). "Психоактивные производные фенэтиламина, пиперазина и пирролидинофенона". В Barceloux DG (ред.). Медицинская токсикология злоупотребления наркотиками: синтезированные химические вещества и психоактивные растения . Wiley. стр. 156– 192. doi :10.1002/9781118105955.ch10. ISBN 978-0-471-72760-6.
- ^ abcdefghi Canal CE, Morgan D (2012). «Реакция подергивания головы у грызунов, вызванная галлюциногеном 2,5-диметокси-4-йодоамфетамином: всесторонняя история, переоценка механизмов и ее полезность в качестве модели». Drug Test Anal . 4 ( 7– 8): 556– 576. doi : 10.1002/dta.1333. PMC 3722587. PMID 22517680 .
- ^ abcdefghijklmnopqrstu Baggott, Matthew J. (1 октября 2023 г.). «Узнаем о STP: забытый психоделик из лета любви» (PDF) . История фармации и фармацевтики . 65 (1): 93– 116. doi : 10.3368/hopp.65.1.93 . ISSN 2694-3034 . Получено 26 января 2025 г. .
- ^ abcd Люэти, Дино; Рудин, Дебора; Хёнер, Мариус К.; Лихти, Маттиас Э. (2022). "Профили взаимодействия моноаминовых рецепторов и транспортеров 4-алкилзамещенных 2,5-диметоксиамфетаминов" (PDF) . Журнал FASEB . 36 (S1). doi : 10.1096/fasebj.2022.36.S1.R2691 . ISSN 0892-6638.
- ^ ab Ray TS (февраль 2010 г.). «Психоделики и человеческий рецептором». PLOS ONE . 5 (2): e9019. doi : 10.1371/journal.pone.0009019 . PMC 2814854 . PMID 20126400.
- ^ ab Nichols DE, Johnson MW, Nichols CD (февраль 2017 г.). «Психоделики как лекарства: новая возникающая парадигма». Clin Pharmacol Ther . 101 (2): 209– 219. doi :10.1002/cpt.557. PMID 28019026.
- ^ abc Flanagan TW, Nichols CD (август 2018). «Психоделики как противовоспалительные агенты». Int Rev Psychiatry . 30 (4): 363–375 . doi :10.1080/09540261.2018.1481827. PMID 30102081.
- ^ Yu B, Becnel J, Zerfaoui M, Rohatgi R, Boulares AH, Nichols CD (ноябрь 2008 г.). «Активация рецептора серотонина 5-гидрокситриптамина (2A) с необычайной силой подавляет воспаление, вызванное фактором некроза опухоли альфа». J Pharmacol Exp Ther . 327 (2): 316– 323. doi :10.1124/jpet.108.143461. PMID 18708586.
- ^ Flanagan TW, Foster TP, Galbato TE, Lum PY, Louie B, Song G, Halberstadt AL, Billac GB, Nichols CD (февраль 2024 г.). «Агонисты рецепторов серотонина-2 оказывают противовоспалительное действие посредством функционально селективных механизмов, включающих подавление вызванной заболеванием экспрессии аргиназы 1». ACS Pharmacol Transl Sci . 7 (2): 478– 492. doi :10.1021/acsptsci.3c00297. PMC 10863441. PMID 38357283.
- ^ ab Nichols, DE; Nichols, CD (2021). «Фармакология психоделиков». В Grob, CS; Grigsby, J. (ред.). Справочник по медицинским галлюциногенам . Guilford Publications. стр. 3–28 . ISBN 978-1-4625-4544-5. Получено 17 января 2025 г. .
Фенилалкиламиновые галлюциногены, такие как DOM, DOI и DOB, высокоселективны в отношении подтипов рецепторов 5-HT2 (Pierce & Peroutka, 1989; Titeler, Lyon, & Glennon, 1988), и в литературе существует консенсус относительно того, что поведенческие эффекты психоделиков в первую очередь опосредованы рецептором 5-HT2A (Halberstadt, 2015; Nichols, 2016).
- ^ Eshleman AJ, Forster MJ, Wolfrum KM, Johnson RA, Janowsky A, Gatch MB (март 2014 г.). «Поведенческая и нейрохимическая фармакология шести психоактивных замещенных фенэтиламинов: локомоция у мышей, различение наркотиков у крыс и связывание и функция рецепторов и транспортеров in vitro». Психофармакология (Berl) . 231 (5): 875– 888. doi :10.1007/s00213-013-3303-6. PMC 3945162. PMID 24142203 .
- ^ Eshleman AJ, Wolfrum KM, Reed JF, Kim SO, Johnson RA, Janowsky A (декабрь 2018 г.). «Нейрохимическая фармакология психоактивных замещенных N-бензилфенэтиламинов: высокоэффективные агонисты рецепторов 5-HT2A». Biochem Pharmacol . 158 : 27–34 . doi :10.1016/j.bcp.2018.09.024. PMC 6298744. PMID 30261175 .
- ^ Lewin AH, Miller GM, Gilmour B (декабрь 2011 г.). «Связанный со следами аминов рецептор 1 является стереоселективным сайтом связывания для соединений класса амфетаминов». Bioorg Med Chem . 19 (23): 7044– 7048. doi :10.1016/j.bmc.2011.10.007. PMC 3236098. PMID 22037049 .
- ^ Bunzow JR, Sonders MS, Arttamangkul S, Harrison LM, Zhang G, Quigley DI, Darland T, Suchland KL, Pasumamula S, Kennedy JL, Olson SB, Magenis RE, Amara SG, Grandy DK (декабрь 2001 г.). «Амфетамин, 3,4-метилендиоксиметамфетамин, диэтиламид лизергиновой кислоты и метаболиты нейротрансмиттеров катехоламинов являются агонистами рецептора следовых аминов крысы». Mol Pharmacol . 60 (6): 1181– 1188. doi :10.1124/mol.60.6.1181. PMID 11723224.
- ^ Fantegrossi WE, Murnane KS, Reissig CJ (январь 2008 г.). "Поведенческая фармакология галлюциногенов". Biochem Pharmacol . 75 (1): 17– 33. doi :10.1016/j.bcp.2007.07.018. PMC 2247373. PMID 17977517. Несмотря
на достаточно постоянное рекреационное использование галлюциногенов по крайней мере с начала 1970-х годов [44], подкрепляющие эффекты галлюциногенов не были широко исследованы на лабораторных животных. Действительно, одно из самых ранних исследований подкрепляющих эффектов наркотиков с использованием процедуры внутривенного самостоятельного введения у макак-резусов показало, что ни одно животное не инициировало самостоятельную инъекцию мескалина ни спонтанно, ни после одного месяца запрограммированного введения [45]. Аналогично, фенетиламиновый галлюциноген 2,5-диметокси-4-метиламфетамин (ДОМ) не был эффективен в поддержании самовведения у макак-резусов [46]. Тем не менее, было показано, что галлюциногеноподобный фенетиламин 3,4-метилендиоксиметамфетамин (МДМА) действует как подкрепитель в парадигмах внутривенного самовведения у бабуинов [47], макак-резусов [48 – 50], крыс [51] и мышей [52].
- ^ Canal CE, Murnane KS (январь 2017 г.). «Серотониновый 5-HT2C-рецептор и невызывающая привыкания природа классических галлюциногенов». J Psychopharmacol . 31 (1): 127– 143. doi :10.1177/0269881116677104. PMID 27903793.
Одно из самых ранних исследований подкрепляющих эффектов наркотиков с использованием процедуры внутривенного самостоятельного введения у макак-резусов показало, что ни одно животное не инициировало самостоятельное введение мескалина ни спонтанно, ни после одного месяца запрограммированного введения, [...] (Deneau et al., 1969). Отсутствие самостоятельного приема мескалина контрастировало с положительными результатами самостоятельного приема морфина, кодеина, кокаина, амфетамина, пентобарбитала, этанола и кофеина. Последующее исследование с резус-макаками с использованием 2,5-диметокси-4-метиламфетамина (DOM; Yanagita, 1986) дало результаты, схожие с результатами исследования мескалина. Эти результаты выдержали испытание временем, поскольку в первичной литературе практически отсутствуют какие-либо отчеты о самостоятельном приеме [классических галлюциногенов (CH)], что свидетельствует о том, что существуют очень ограниченные условия, при которых лабораторные животные добровольно потребляют CH.
- ^ Янагита Т (июнь 1986). «Внутривенное самостоятельное введение (-)-катинона и 2-амино-1-(2,5-диметокси-4-метил)фенилпропана макакам-резусам». Drug Alcohol Depend . 17 ( 2–3 ): 135–141 . doi :10.1016/0376-8716(86)90004-9.
- ^ Maguire DR (октябрь 2024 г.). «Оценка потенциальных карающих эффектов 2,5-диметокси-4-метиламфетамина (DOM) у резус-макак, реагирующих на процедуру выбора». Behav Pharmacol . 35 (7): 378– 385. doi :10.1097/FBP.00000000000000787. PMID 39052019.
- ^ Cha HJ, Jeon SY, Jang HJ, Shin J, Kim YH, Suh SK (май 2018 г.). «Поощрительные и усиливающие эффекты 4-хлоро-2,5-диметоксиамфетамина и AH-7921 у грызунов». Neurosci Lett . 676 : 66–70 . doi :10.1016/j.neulet.2018.04.009. PMID 29626650.
- ^ Gil-Martins E, Barbosa DJ, Borges F, Remião F, Silva R (июнь 2025 г.). «Токсикодинамические аспекты препаратов 2C и NBOMe — есть ли потенциал злоупотребления?». Toxicol Rep . 14 : 101890. doi : 10.1016/j.toxrep.2025.101890. PMID 39867514.
- ^ Kim YJ, Ma SX, Hur KH, Lee Y, Ko YH, Lee BR, Kim SK, Sung SJ, Kim KM, Kim HC, Lee SY, Jang CG (апрель 2021 г.). «Новые дизайнерские фенэтиламины 2C-C и 2C-P обладают потенциалом злоупотребления и вызывают нейротоксичность у грызунов». Arch Toxicol . 95 (4): 1413– 1429. doi :10.1007/s00204-021-02980-x. PMID 33515270.
- ^ Custodio RJ, Sayson LV, Botanas CJ, Abiero A, You KY, Kim M, Lee HJ, Yoo SY, Lee KW, Lee YS, Seo JW, Ryu IS, Kim HJ, Cheong JH (ноябрь 2020 г.). «25B-NBOMe, новое производное N-2-метоксибензил-фенэтиламина (NBOMe), может вызывать эффекты вознаграждения и подкрепления через дофаминергический механизм: доказательства потенциала злоупотребления». Addict Biol . 25 (6): e12850. doi :10.1111/adb.12850. PMID 31749223.
- ^ Seo JY, Hur KH, Ko YH, Kim K, Lee BR, Kim YJ, Kim SK, Kim SE, Lee YS, Kim HC, Lee SY, Jang CG (октябрь 2019 г.). «Новый дизайнерский препарат 25N-NBOMe проявляет потенциал злоупотребления через дофаминергическую систему у грызунов». Brain Res Bull . 152 : 19– 26. doi : 10.1016/j.brainresbull.2019.07.002. PMID 31279579.
- ^ Jo C, Joo H, Youn DH, Kim JM, Hong YK, Lim NY, Kim KS, Park SJ, Choi SO (ноябрь 2022 г.). «Поощрительные и усиливающие эффекты 25H-NBOMe у грызунов». Brain Sci . 12 (11): 1490. doi : 10.3390/brainsci12111490 . PMC 9688077 . PMID 36358416.
- ^ Lee JG, Hur KH, Hwang SB, Lee S, Lee SY, Jang CG (август 2023 г.). «Дизайнерский препарат 25D-NBOMe оказывает укрепляющее и вознаграждающее действие посредством изменения дофаминергической нейрохимической системы». ACS Chem Neurosci . 14 (15): 2658– 2666. doi :10.1021/acschemneuro.3c00196. PMID 37463338.
- ^ Kim YJ, Kook WA, Ma SX, Lee BR, Ko YH, Kim SK, Lee Y, Lee JG, Lee S, Kim KM, Lee SY, Jang CG (апрель 2024 г.). «Новое психоактивное вещество 25E-NBOMe вызывает поведение, связанное с вознаграждением, через сигнализацию рецептора дофамина D1 у самцов грызунов». Arch Pharm Res . 47 (4): 360–376 . doi :10.1007/s12272-024-01491-4. PMID 38551761.
- ^ Ballentine G, Friedman SF, Bzdok D (март 2022 г.). «Трипы и нейротрансмиттеры: обнаружение принципиальных закономерностей в 6850 галлюциногенных переживаниях». Sci Adv . 8 (11): eabl6989. doi :10.1126/sciadv.abl6989. PMC 8926331. PMID 35294242 .
- ^ ab Jacob P, Shulgin AT (1994). "Структурно-активностные связи классических галлюциногенов и их аналогов" (PDF) . NIDA Res Monogr . 146 : 74–91 . PMID 8742795.
- ^ ab Шульгин, AT; Шульгин, А. (1991). PiHKAL: Химическая история любви. Transform Press. ISBN 978-0-9630096-0-9. Получено 2 ноября 2024 г.
- ^ abc Шульгин, А.; Мэннинг, Т.; Дейли, П. Ф. (2011). Индекс Шульгина, том первый: психоделические фенэтиламины и родственные соединения. Том 1. Беркли: Transform Press. ISBN 978-0-9630096-3-0. Получено 2 ноября 2024 г. .
Краткая история DOM (STP) отмечает, что первоначальный синтез состоялся в 1963 году, психологические эффекты были обнаружены в следующем году, и что соединение появилось на сцене Хейт-Эшбери в середине 1967 года (Шульгин, 1977b). Известные конгенеры DOM были рассмотрены на предмет взаимосвязи структуры и активности (Барфкнехт и др., 1978). [...] Шульгин, АТ. (1977b) Профили психоделических препаратов. 5. STP. J. Psych. Drugs 9(2): 171-172.
- ^ "Александр Теодор Шульгин (1925-2014)". openDemocracy . 9 июня 2014 . Получено 26 января 2025 .
Внимание [Шульгина] было привлечено к 4-й позиции после того, как он задумал и синтезировал соединение ДОМ, которое он подверг биологическому анализу 4 января 1964 года и обнаружил, что оно обладает удивительной активностью: оно было психоактивным при дозе 1 мг.
- ^ abc Шульгин AT (1978). «Психотомиметические препараты: взаимосвязь структуры и активности». В Iversen LL, Iversen SD, Snyder SH (ред.). Стимуляторы. Бостон, Массачусетс: Springer US. стр. 243–333 . doi :10.1007/978-1-4757-0510-2_6. ISBN 978-1-4757-0512-6.
3,4,5-Триметоксифенилизопропиламин (33, ТМА, триметоксиамфетамин) является первым психотомиметическим препаратом, который появился в результате систематического применения принципов, открытых при изучении взаимосвязей между химической структурой и биологической активностью. Вооружившись известной структурой мескалина, склонностью большинства фенэтиламинов проявлять лишь мимолетную активность в центральной нервной системе (из-за легкого дезаминирования) и эффективностью метильной группы альфа- по отношению к азоту как стабилизирующего фактора в центральной активности, Хер (1947) синтезировал ТМА. Его благоприятные впечатления об эйфорических свойствах соединения побудили канадскую группу Переца и его коллег (1955) исследовать его психофармакологическую природу и оценить его потенциал в качестве психотомиметика. [...] 3.1.6. 2,4,5-Триметоксифенилизопропиламин Этот геометрический изомер ТМА был впервые синтезирован Брукнером (1933), а его психотомиметические свойства впервые были обнаружены примерно 30 лет спустя (Шульгин, 1964а). 2,4,5-Триметоксифенилизопропиламин (34, ТМА-2, 2,4,5-триметоксиамфетамин) был вторым из шести возможных позиционных изомеров, которые, как было обнаружено, обладают психотомиметическими свойствами, и поэтому был назван ТМА-2.
- ↑ Брукнер, Виктор (24 октября 1933 г.). «Über das Pseudonitrosit des Asarons». Журнал практической химии . 138 ( 9–10 ): 268–274 . doi :10.1002/prac.19331380907. ISSN 0021-8383.
- ^ Шульгин АТ (июль 1964). «Психотомиметические амфетамины: метокси 3,4-диалкоксиамфетамины». Experientia . 20 (7): 366– 367. doi :10.1007/BF02147960. PMID 5855670.
- ^ Peretz DI, Smythies JR, Gibson WC (апрель 1955 г.). «Новый галлюциноген: 3,4,5-триметоксифенил-бета-аминопропан с заметками о стробоскопическом явлении». J Ment Sci . 101 (423): 317– 329. doi :10.1192/bjp.101.423.317. PMID 13243046.
3,4,5-Триметоксифенил-β-аминопропан (триметоксиамфетамин, ТМА) был впервые синтезирован Хеем в 1947 г. (Hey, 1947), который был впечатлен его эйфорическими свойствами (частное сообщение). [...]
- ^ Шульгин, Александр Т.; Баннелл, Стерлинг; Сарджент, Торнтон (1961). «Психотомиметические свойства 3,4,5-триметоксиамфетамина». Nature . 189 (4769): 1011– 1012. doi :10.1038/1891011a0. ISSN 0028-0836.
- ^ Hey P (1947). «Синтез нового гомолога мескалина». QJ Pharm Pharmacol . 20 (2): 129– 134. PMID 20260568.
- ^ "фенэтиламины и их фармакологически приемлемые соли". Google Patents . 1970 . Получено 26 января 2025 .
- ^ abc Trout K, Daley PF (декабрь 2024 г.). «Происхождение 2,5-диметокси-4-метиламфетамина (DOM, STP)». Drug Test Anal . 16 (12): 1496– 1508. doi :10.1002/dta.3667. PMID 38419183.
- ^ Snyder SH, Faillace L, Hollister L (ноябрь 1967). «2,5-диметокси-4-метил-амфетамин (STP): новый галлюциногенный препарат». Science . 158 (3801): 669– 670. doi :10.1126/science.158.3801.669. PMID 4860952.
- ^ abc Snyder SH, Faillace LA, Weingartner H (сентябрь 1968). «DOM (STP), новый галлюциногенный препарат, и DOET: эффекты у нормальных субъектов». Am J Psychiatry . 125 (3): 113– 120. doi :10.1176/ajp.125.3.357. PMID 4385937.
- ^ Snyder SH, Richelson E (май 1968). "Психоделические препараты: стерические факторы, которые предсказывают психотропную активность". Proc Natl Acad Sci USA . 60 (1): 206– 213. doi :10.1073/pnas.60.1.206. PMC 539103 . PMID 5241523.
Шульгин (личное сообщение) синтезировал 2,5-диметоксиамфетамин (2,5-ДМА) (рис. 4) и наблюдал его активность у человека от 8 до 10 МЕ. Это соединение соответствует ТМА-2 с отсутствием метокси в положении С-4. 2,5-ДМА значительно более активен, чем ТМА, ТМА-3 или ТМА-4, все из которых имеют три метоксигруппы. [...]
- ^ Шульгин, Александр Т. (1969). «Психотомиметические агенты, родственные катехоламинам». Журнал психоделических препаратов . 2 (2): 14– 19. doi :10.1080/02791072.1969.10524409. ISSN 0022-393X.
- ^ Александр Шульгин (1970). «Химия и связь структуры и активности психотомиметиков». В DH Efron (ред.). Психотомиметические препараты (PDF) . Нью-Йорк: Raven Press. С. 21–41 .
- ^ Шульгин АТ, Сарджент Т, Наранхо С (1971). «4-Бром-2,5-диметоксифенилизопропиламин, новый аналог амфетамина с центральным действием». Фармакология . 5 (2): 103– 107. doi :10.1159/000136181. PMID 5570923.
- ^ Coutts, Ronald T.; Malicky, Jerry L. (1 мая 1973 г.). «Синтез некоторых аналогов галлюциногена 1-(2,5-диметокси-4-метилфенил)-2-аминопропана (DOM)». Canadian Journal of Chemistry . 51 (9): 1402– 1409. doi : 10.1139/v73-210 . ISSN 0008-4042 . Получено 26 января 2025 г. .
- ^ Николс Д.Е., Гленнон Р.А. (1984). «Медицинская химия и связь структуры и активности галлюциногенов». Галлюциногены: нейрохимические, поведенческие и клинические перспективы. С. 95–142 .
- ^ Nichols DE (2018). «Химия и связь между структурой и активностью психоделиков». Curr Top Behav Neurosci . 36 : 1– 43. doi : 10.1007/7854_2017_475. PMID 28401524.
- ^ Хармс А., Ульмер Э., Ковар К. Синтез и анализы связывания радиолигандного рецептора 5-HT2A DOMCl и DOMOM, двух новых лигандов рецептора 5-HT2A. Arch. Pharm ., 16 июня 2003 г., 336(3): 155–158. doi :10.1002/ardp.200390014
- ^ Nelson DL, Lucaites VL, Wainscott DB, Glennon RA. Сравнение связывающих свойств галлюциногенного фенилизопропиламина на клонированных человеческих рецепторах 5-HT2A, 5-HT2B и 5-HT2C. NS. Arch. Pharmacol. , 1 января 1999 г., 359(1): 1–6. doi :10.1007/PL00005315
- ^ Хеллберг М., Намил А., Фэн З., Уорд Дж. Аналоги фенилэтиламина и их применение для лечения глаукомы. Патент WO 2007/038372, 6 апреля 2007 г.
- ^ Trachsel D. Фтор в психоделических фенэтиламинах. Drug Test. Anal. , 1 июля 2012 г., 4(7-8): 577-590. doi :10.1002/dta.413
- ^ Seggel MR, Yousif MY, Lyon RA, Titeler M, Roth BL , Suba EA, Glennon RA. Исследование структуры и сродства связывания 4-замещенных аналогов 1-(2,5-диметоксифенил)-2-аминопропана с рецепторами серотонина 5-HT2. J. Med. Chem. , 1 марта 1990 г., 33(3): 1032–1036. doi :10.1021/jm00165a023
- ^ Trachsel D (август 2003 г.). «Синтез новых (фенилалкил) аминов для исследования связей структура–активность, часть 3: 4-этинил-2,5-диметоксифенэтиламин (= 4-этинил-2,5-диметоксибензолэтанамин; 2C-YN)». Helvetica Chimica Acta . 86 (8): 2754– 9. doi :10.1002/hlca.200390224.
- ^ Шульгин А.Т. Лечение больных старческого возраста с целью восстановления работоспособности. Патент США 4034113
- ^ Хеллберг М.Р., Намил А. Аналоги бензопирана и их применение для лечения глаукомы. Патент США 7396856
- ^ Кристенсен Дж. и др. Агонисты 5-HT2A для использования при лечении депрессии. Патент США 2021/0137908
Внешние ссылки
- PiHKAL («Фенэтиламины, которые я знал и любил») Александра «Саши» Шульгина (1991)
- Психотомиметические препараты: взаимосвязь структуры и активности Александра «Саши» Шульгина (1978)