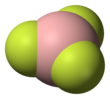Трифторид бора
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Трифторид бора | |||
| Систематическое название ИЮПАК Трифторборан | |||
| Другие имена Фторид бора, трифторборан | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ХЭБИ | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.028.699 | ||
| Номер ЕС |
| ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | сжатый: 1008 . дигидрат трифторида бора: 2851 . | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| БФ 3 | |||
| Молярная масса | 67,82 г/моль (безводный) 103,837 г/моль (дигидрат) | ||
| Появление | бесцветный газ (безводный) бесцветная жидкость (дигидрат) | ||
| Запах | Острый | ||
| Плотность | 0,00276 г/см 3 (безводный газ) 1,64 г/см 3 (дигидрат) | ||
| Температура плавления | −126,8 °C (−196,2 °F; 146,3 K) | ||
| Точка кипения | −100,3 °C (−148,5 °F; 172,8 К) | ||
| экзотермическое разложение [1] (безводный) очень растворимый (дигидрат) | |||
| Растворимость | растворим в бензоле , толуоле , гексане , хлороформе и метиленхлориде | ||
| Давление пара | >50 атм (20 °C) [2] | ||
| 0 Д | |||
| Термохимия | |||
Теплоемкость ( С ) | 50,46 Дж/(моль·К) | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 254,3 Дж/(моль·К) | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −1137 кДж/моль | ||
Свободная энергия Гиббса (Δ f G ⦵ ) | −1120 кДж/моль | ||
| Опасности [4] [5] | |||
| Маркировка СГС : | |||
   | |||
| Опасность | |||
| Н314 , Н330 , Н335 , Н373 | |||
| Р260 , Р280 , Р303+Р361+Р353 , Р304+Р340 , Р305+Р351+Р338 , Р310 , Р403+Р233 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Негорючий | ||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LC 50 ( средняя концентрация ) | 1227 ppm (мышь, 2 часа) 39 ppm (морская свинка, 4 часа) 418 ppm (крыса, 4 часа) [3] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (допустимый) | C 1 ppm (3 мг/м 3 ) [2] | ||
РЕЛ (рекомендуется) | C 1 ppm (3 мг/м 3 ) [2] | ||
IDLH (Непосредственная опасность) | 25 частей на миллион [2] | ||
| Паспорт безопасности (SDS) | МКХС | ||
| Родственные соединения | |||
Другие анионы | |||
Другие катионы | |||
Родственные соединения | Монофторид бора | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Трифторид бора — неорганическое соединение с формулой BF 3 . Этот едкий, бесцветный и токсичный газ образует белые пары во влажном воздухе. Это полезная кислота Льюиса и универсальный строительный блок для других соединений бора .
Структура и связь
Геометрия молекулы BF 3 является тригональной плоской . Ее симметрия D 3h соответствует предсказанию теории VSEPR . Молекула не имеет дипольного момента в силу своей высокой симметрии. Молекула изоэлектронна с карбонатным анионом, CO 2−3.
BF3 обычно называют « электронодефицитным », что подтверждается его экзотермической реакционной способностью по отношению к основаниям Льюиса .
В тригалогенидах бора , BX 3 , длина связей B–X (1,30 Å) короче, чем можно было бы ожидать для одинарных связей, [7] и эта короткость может указывать на более сильную π-связь B–X во фториде. Простейшее объяснение включает в себя разрешенное симметрией перекрытие ap-орбитали на атоме бора с синфазной комбинацией трех одинаково ориентированных p-орбиталей на атомах фтора. [7] Другие указывают на ионную природу связей в BF 3 . [8]
Синтез и обработка
BF3 получают путем реакции оксидов бора с фтористым водородом :
- B2O3 + 6HF → 2BF3 + 3H2O
Обычно HF производится на месте из серной кислоты и флюорита ( CaF2 ). [9] Ежегодно производится около 2300-4500 тонн трифторида бора. [ 10]
Лабораторные весы
Для реакций в лабораторных масштабах BF3 обычно производят in situ с использованием эфирата трифторида бора , который представляет собой коммерчески доступную жидкость.
Лабораторные пути к материалам без растворителей многочисленны. Хорошо документированный путь включает термическое разложение солей диазония [ BF 4 ] − : [11]
Альтернативно он возникает в результате реакции тетрафторбората натрия , триоксида бора и серной кислоты : [12]
- 6 Na[BF 4 ] + B 2 O 3 + 6 H 2 SO 4 → 8 BF 3 + 6 NaHSO 4 + 3 H 2 O
Характеристики
Безводный трифторид бора имеет температуру кипения −100,3 °C и критическую температуру −12,3 °C, поэтому его можно хранить в качестве охлажденной жидкости только между этими температурами. Сосуды для хранения или транспортировки должны быть спроектированы так, чтобы выдерживать внутреннее давление, поскольку отказ системы охлаждения может привести к повышению давления до критического значения 49,85 бар (4,985 МПа). [13]
Трифторид бора вызывает коррозию. Подходящие металлы для оборудования, работающего с трифторидом бора, включают нержавеющую сталь , монель и хастеллой . В присутствии влаги он разъедает сталь, включая нержавеющую. Он реагирует с полиамидами . Политетрафторэтилен , полихлортрифторэтилен , поливинилиденфторид и полипропилен показывают удовлетворительную стойкость. Смазка, используемая в оборудовании, должна быть на основе фторуглерода , так как трифторид бора реагирует с углеводородными. [14]
Реакции
В отличие от тригалогенидов алюминия и галлия, тригалогениды бора являются мономерными . Они вступают в быстрые реакции обмена галогенидов:
Из-за легкости этого процесса обмена смешанные галогениды не могут быть получены в чистом виде.
Трифторид бора — универсальная кислота Льюиса , которая образует аддукты с такими основаниями Льюиса, как фторид и эфиры :
Соли тетрафторбората обычно используются в качестве некоординирующих анионов . Аддукт с диэтиловым эфиром , диэтилэфиратом трифторида бора или просто эфиратом трифторида бора ( BF 3 ·O(CH 2 CH 3 ) 2 ) является удобной в обращении жидкостью и, следовательно, широко встречается в качестве лабораторного источника BF 3 . [15] Другим распространенным аддуктом является аддукт с диметилсульфидом ( BF 3 ·S(CH 3 ) 2 ), который можно обрабатывать как чистую жидкость. [16]
Сравнительная кислотность по Льюису
Все три более легких тригалогенида бора, BX 3 (X = F, Cl, Br), образуют стабильные аддукты с общими основаниями Льюиса. Их относительные кислотности Льюиса можно оценить с точки зрения относительной экзотермичности реакции образования аддукта. Такие измерения выявили следующую последовательность для кислотности Льюиса:
- BF 3 < BCl 3 < BBr 3 < BI 3 (сильнейшая кислота Льюиса)
Эту тенденцию обычно приписывают степени π-связи в плоском тригалогениде бора , которая будет потеряна при пирамидализации молекулы BX 3. [17] что следует этой тенденции:
- BF 3 > BCl 3 > BBr 3 < BI 3 (легче всего пирамидализуется)
Однако критерии оценки относительной прочности π-связи не ясны. [7] Одно из предположений заключается в том, что атом F мал по сравнению с более крупными атомами Cl и Br. Как следствие, длина связи между бором и галогеном увеличивается при переходе от фтора к йоду, поэтому пространственное перекрытие между орбиталями становится более затруднительным. Неподеленная пара электронов в p z F легко и просто отдается и перекрывается с пустой p z орбиталью бора. В результате pi-донорство F больше, чем у Cl или Br.
В альтернативном объяснении низкая кислотность Льюиса для BF 3 объясняется относительной слабостью связи в аддуктах F 3 B−L . [18] [19]
Еще одно объяснение можно найти в том факте, что p z- орбитали в каждом более высоком периоде имеют дополнительную узловую плоскость и противоположные знаки волновой функции с каждой стороны этой плоскости. Это приводит к связывающим и антисвязывающим областям в пределах одной связи, уменьшая эффективное перекрытие и, таким образом, снижая π-донорную блокировку кислотности. [20]
Гидролиз
Трифторид бора реагирует с водой, давая борную кислоту и фторборную кислоту . Реакция начинается с образования водного аддукта, H 2 O−BF 3 , который затем теряет HF, что дает фторборную кислоту с трифторидом бора. [21]
- 4BF3 + 3H2O → 3H[BF4 ] + B(OH) 3
Более тяжелые тригалогениды не вступают в аналогичные реакции, возможно, из-за меньшей стабильности тетраэдрических ионов [BCl 4 ] − и [BBr 4 ] − . Из-за высокой кислотности фторборат-ион может быть использован для выделения особенно электрофильных катионов, таких как ионы диазония , которые в противном случае трудно выделить в виде твердых веществ.
Использует
Органическая химия
Трифторид бора наиболее часто используется в качестве реагента в органическом синтезе , как правило, в качестве кислоты Льюиса . [10] [22] Примеры включают:
- инициирует реакции полимеризации ненасыщенных соединений , таких как полиэфиры
- как катализатор в некоторых реакциях изомеризации , ацилирования , [23] алкилирования , этерификации , дегидратации , [24] конденсации , альдольного присоединения Мукаямы и других реакциях [25] [ требуется ссылка ]
Ниша использует
Другие, менее распространенные применения трифторида бора включают:
- применяется в качестве легирующей примеси при ионной имплантации
- легирующая примесь p-типа для эпитаксиально выращенного кремния
- используется в чувствительных нейтронных детекторах в ионизационных камерах и устройствах для контроля уровня радиации в атмосфере Земли
- в фумигации
- как флюс для пайки магния
- для приготовления диборана [12]
Открытие
Трифторид бора был открыт в 1808 году Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром , которые пытались выделить «плавиковую кислоту» (т. е. плавиковую кислоту ), соединяя фторид кальция с остеклованной борной кислотой . Полученные пары не могли протравить стекло, поэтому они назвали его фтороборовым газом . [26] [27]
Смотрите также
Ссылки
- ↑ Благоразумная практика в лаборатории. 16 августа 1995 г. doi :10.17226/4911. ISBN 978-0-309-05229-0. Архивировано из оригинала 14 декабря 2014 . Получено 7 мая 2018 .
{{cite book}}:|website=проигнорировано ( помощь ) - ^ abcd Карманный справочник NIOSH по химическим опасностям. "#0062". Национальный институт охраны труда и здоровья (NIOSH).
- ^ "Трифторид бора". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ Индекс № 005-001-00-X Приложения VI, Часть 3, к Регламенту (ЕС) № 1272/2008 Европейского парламента и Совета от 16 декабря 2008 года о классификации, маркировке и упаковке веществ и смесей, вносящему изменения и отменяющему Директивы 67/548/EEC и 1999/45/EC, и вносящему изменения в Регламент (ЕС) № 1907/2006. OJEU L353, 31.12.2008, стр. 1–1355 на стр. 341.
- ^ «Трифторид бора», Карманный справочник по химическим опасностям, Министерство здравоохранения и социальных служб США (NIOSH), публикация № 2005-149, Вашингтон, округ Колумбия: Правительственная типография, 2005, ISBN 9780160727511.
- ^ Inc, New Environment. "New Environment Inc. - NFPA Chemicals". www.newenv.com . Архивировано из оригинала 27 августа 2016 года . Получено 7 мая 2018 года .
{{cite web}}:|last=имеет общее название ( помощь ) - ^ abc Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Gillespie, Ronald J. (1998). «Ковалентные и ионные молекулы: почему BeF 2 и AlF 3 являются твердыми веществами с высокой температурой плавления, тогда как BF 3 и SiF 4 являются газами?». Журнал химического образования . 75 (7): 923. Bibcode : 1998JChEd..75..923G. doi : 10.1021/ed075p923.
- ^ Холлеман, А. Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Academic Press. ISBN 0-12-352651-5.
- ^ ab Brotherton, RJ; Weber, CJ; Guibert, CR; Little, JL "Соединения бора". Энциклопедия промышленной химии Ульмана . Weinheim: Wiley-VCH. doi :10.1002/14356007.a04_309. ISBN 978-3527306732.
- ^ Flood, DT (1933). "Фторбензол". Органические синтезы . 13 : 46; Собрание томов , т. 2, стр. 295.
- ^ ab Brauer, Georg (1963). Справочник по препаративной неорганической химии. Т. 1 (2-е изд.). Нью-Йорк: Academic Press. стр. 220 и 773. ISBN 978-0121266011.
- ^ Yaws, CL, ред. (1999). Справочник по химическим свойствам . McGraw-Hill. стр. 25.
- ^ "Трифторид бора". Газовая энциклопедия . Air Liquide . 2016-12-15. Архивировано из оригинала 2006-12-06.
- ^ Корнел, Вероника; Лавли, Карл Дж. (2007). "Эфират трехфтористого бора". Энциклопедия реагентов для органического синтеза . doi :10.1002/9780470842898.rb249.pub2. ISBN 978-0471936237. S2CID 100921225.
- ^ Хини, Гарри (2001). "Трифторид бора-диметилсульфид". Энциклопедия реагентов для органического синтеза . doi :10.1002/047084289X.rb247. ISBN 0471936235.
- ^ Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Advanced Inorganic Chemistry (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Бурман, П. М.; Поттс, Д. (1974). «Комплексы халькогенидов группы V тригалогенидов бора». Канадский журнал химии . 52 (11): 2016–2020. doi :10.1139/v74-291.
- ^ Brinck, T.; Murray, JS; Politzer, P. (1993). «Вычислительный анализ связей в трифториде бора и трихлориде бора и их комплексах с аммиаком». Неорганическая химия . 32 (12): 2622–2625. doi :10.1021/ic00064a008.
- ^ Здесь, в Википедии, можно найти простую для понимания таблицу, в которой показаны рисунки нескольких высших p-орбиталей.
- ^ Вамсер, Калифорния (1951). «Равновесия в системе трифторид бора–вода при 25°». Журнал Американского химического общества . 73 (1): 409–416. doi :10.1021/ja01145a134.
- ^ Хини, Х. (2001). "Трифторид бора". Энциклопедия реагентов для органического синтеза . doi :10.1002/047084289X.rb250. ISBN 0-471-93623-5.
- ^ Mani, Rama I.; Erbert, Larry H.; Manise, Daniel (1991). "Трифторид бора в синтезе растительных фенолов: синтез фенольных кетонов и фенилстрилкетонов" (PDF) . Журнал Tennessee Academy of Science . 66 (1): 1–8. Архивировано из оригинала (PDF) 27 октября 2016 г. . Получено 27 октября 2016 г. .
- ^ Sowa, FJ; Hennion, GF; Nieuwland, JA (1935). «Органические реакции с фторидом бора. IX. Алкилирование фенола спиртами». Журнал Американского химического общества . 57 (4): 709–711. doi :10.1021/ja01307a034.
- ^ "Применение трифторида бора (BF3)". Honeywell . Архивировано из оригинала 29-01-2012.
- ^ Гей-Люссак, JL; Тенар, ЖЖ (1809). «Сюр фтористая кислота». Анналы де Химье . 69 : 204–220.
- ^ Гей-Люссак, JL; Тенар, ЖЖ (1809). «Des proprietés de l'acide fluorique et sur-tout de son action sur le metal de la potasse». Mémoires de Physique et de Chimie de la Société d'Arcueil . 2 : 317–331.
Внешние ссылки
- «Темы безопасности и охраны труда: трифторид бора». OSHA.
- "БОРОН ТРИФТОРИД ICSC: 0231". Международные карты химической безопасности . CDC. Архивировано из оригинала 2017-11-23 . Получено 2017-09-08 .
- «Бор и его соединения: обзор». Национальный реестр загрязняющих веществ . Правительство Австралии.
- "Фтористые соединения: обзор". Национальный реестр загрязняющих веществ . Правительство Австралии.
- "Трифторид бора". Веб-книга . NIST.
- "Применение трифторида бора (BF3)". Honeywell. Архивировано из оригинала 2012-01-29 . Получено 2012-02-14 .