Агонист никотиновых рецепторов
Никотиновый агонист — это препарат, который имитирует действие ацетилхолина (ACh) на никотиновые ацетилхолиновые рецепторы (nAChR). nAChR назван так из-за его сродства к никотину.
Примерами являются никотин (по определению), ацетилхолин ( эндогенный агонист nAChR), холин , эпибатидин , лобелин , варениклин и цитизин . [1]
История

Никотин известен на протяжении столетий своим опьяняющим эффектом. Впервые он был выделен в 1828 году из табачного растения немецкими химиками Поссельтом и Рейманном. [2]
Открытие положительного влияния никотина на память животных было обнаружено в ходе исследований in vivo в середине 1980-х годов. Эти исследования открыли новую эру в изучении никотиновых ацетилхолиновых рецепторов (nAChR) и их стимуляции, но до этого основное внимание уделялось никотиновой зависимости. [3] [4] Разработка агонистов nAChR началась в начале 1990-х годов после открытия положительного влияния никотина. Некоторые исследования показали возможный вариант терапии в доклинических исследованиях. ABT-418 был одним из первых в серии агонистов nAChR, и он был разработан Abbott Labs . [4] ABT-418 показал значительное увеличение производительности отложенного сопоставления с образцом (DMTS) у половозрелых макак разных видов и полов. [5] ABT-418 также изучался как возможное средство лечения болезни Альцгеймера, болезни Паркинсона и синдрома дефицита внимания и гиперактивности: эти эксперименты показали положительные результаты. [4]
Одним из первых активных соединений nAChR, помимо никотина, который был представлен на рынке в качестве лекарственного средства, был галантамин , растительный алкалоид , который действует как слабый ингибитор холинэстеразы (IC50 = 5 мкМ), а также как аллостерический сенсибилизатор для nAChR (EC50 = 50 нМ). [6]
Никотиновые ацетилхолиновые рецепторы и их сигнальная система

Система сигнализации
В нервной системе человека никотиновые холинергические сигналы распространяются по всей системе, где нейротрансмиттер ацетилхолин (ACh) играет ключевую роль в активации лиганд-зависимых ионных каналов . [7] Холинергическая система является жизненно важным нервным путем, где холинергические нейроны синтезируют, хранят и высвобождают нейротрансмиттер ACh. Основными рецепторами, которые преобразуют сообщения ACh, являются холинергические мускариновые ацетилхолиновые рецепторы , нейрональные и мышечные nAChR. Если оглянуться на эволюционную историю, ACh считается старейшей молекулой-трансмиттером, которая появилась до нервной клетки. В нервной системе холинергическая стимуляция, опосредованная nAChR, контролирует такие пути, как высвобождение трансмиттеров и чувствительность клеток, что может влиять на физиологическую активность, включая сон, беспокойство, обработку боли и когнитивные функции. [8]
Никотиновые ацетилхолиновые рецепторы
nAChR — это холинергические рецепторы, обнаруженные в центральной нервной системе (ЦНС), периферической нервной системе (ПНС) и скелетных мышцах. Эти рецепторы представляют собой лиганд-управляемые ионные каналы с сайтами связывания для ацетилхолина и других молекул. Когда ACh или другие агонисты связываются с рецепторами, это стабилизирует открытое состояние ионного канала, позволяя притоку катионов, таких как ионы калия, кальция и натрия. nAChR состоят из различных субъединиц, которые определяют четвертичную структуру рецептора, эти субъединицы — это α-субъединицы (α1−α10), β-субъединицы (β1−β4), одна δ-субъединица, одна γ-субъединица и одна ε-субъединица. nAChR могут быть как гетеромерными , так и гомомерными . Гетеромерные рецепторы, обнаруженные в центральной нервной системе, состоят из двух α-субъединиц и трех β-субъединиц с сайтом связывания на границе α и соседней субъединицы. Эти рецепторы содержат два сайта связывания на рецептор и имеют различное сродство к химическим веществам в зависимости от состава субъединиц. Оба сайта связывания работают вместе, и поэтому оба сайта должны быть заняты агонистом nAChR, чтобы могла произойти активация канала. [9] Было показано, что nAChR, содержащие субъединицы α2−α6 и β2−β4, имеют более высокое сродство к ACh, чем другие рецепторы. Гомомерные рецепторы содержат 5 идентичных субъединиц, они имеют 5 сайтов связывания, расположенных на границе между двумя соседними субъединицами. В 2000 году у людей были идентифицированы два гомомерных рецептора, рецепторы α7 и α8. [8] [10] [11] [12]
Место привязки
На гетеромерных nAChR есть два сайта связывания; для стабилизации открытой формы nAChR оба сайта связывания должны быть заняты агонистом, таким как никотин или ACh. [11]
Сайт связывания ACh nAChR состоит из шести петель, называемых A–F. Петли A, B и C сайта связывания являются частью субъединицы α и являются основными компонентами сайта связывания. Соседняя субъединица к субъединице α (γ, δ, ε или β) содержит петли D, E и F. [11]
Механизм действия

Агонисты рецепторов α4β2
α4β2 nAChRs содержат две субъединицы α4 и три субъединицы β2, поэтому у них есть два сайта связывания для ACh и других агонистов . α4β2 nAChRs составляют приблизительно 90% nAChRs в мозге человека, и при хроническом воздействии никотина или других агонистов никотина приводит к увеличению плотности рецепторов α4β2, что является противоположностью тому, что обычно происходит, когда другие рецепторы хронически подвергаются воздействию своих агонистов. Рецептор α4β2 широко изучался в отношении болезни Альцгеймера, а также никотиновой зависимости, и в 2009 году на рынке появилось несколько препаратов, которые нацелены конкретно на α4β2 nAChR. [13] [14]
Агонисты рецепторов α7
Рецепторы α7 являются гомомерными нейронными ацетилхолиновыми рецепторами, состоящими из пяти субъединиц α7 и имеющими пять участков связывания ACh. Сообщалось, что аномалия в экспрессии рецепторов α7 влияет на прогрессирование таких заболеваний, как болезнь Альцгеймера и шизофрения . Считается, что α7 не имеют такого же сродства к никотину, как гетеромерный рецептор, но вместо этого они показали большее сродство к альфа-бунгаротоксину , который является никотиновым антагонистом, обнаруженным в яде некоторых змей. Поэтому считается, что нацеливание на рецепторы α7 полезно при лечении болезни Альцгеймера и шизофрении. [9] [15]
Агонисты рецепторов мышечного типа
nAChR обнаружены в нервно-мышечном соединении скелетных мышц. Было обнаружено два различных рецептора, один из которых в первую очередь обнаружен у взрослых и содержит две субъединицы α1, одну β1, одну ε и одну δ, другой обнаружен у плодов и содержит субъединицу γ вместо субъединицы ε. nAChR принимают участие в деполяризации мышечной концевой пластинки, увеличивая проницаемость катионов, что приводит к сокращению скелетных мышц. [16] nAChR, обнаруженные в системе скелетных мышц, имеют два сайта связывания ACh, один из которых находится на границе между субъединицами α1 и δ, а другой находится на границе между субъединицами α1 и γ или ε. Среди антагонистов nAChR, разработанных специально для нервно-мышечной системы, есть нервно-паралитические газы и другие яды, предназначенные для быстрого уничтожения людей или других животных и насекомых. [12]
Связывание
ACh связывается с nAChR из-за разницы зарядов между молекулой и поверхностью рецептора. При связывании с nAChR ACh помещается в связывающий карман, образованный петлями A, B и C, которые принадлежат α-субъединице и соседней субъединице. Когда ACh помещается в связывающий карман, петли nAChR претерпевают движение, которое приводит к координации молекулы ACh в кармане, усиливая химические связи между молекулой и рецептором. После перемещения петель, которые принадлежат α-субъединице, иногда возможно, что молекула ACh образует связь, например, солевой мостик, с соседней субъединицей, еще больше усиливая связи между рецептором и ACh. [17]
Разработка лекарств
Препараты, которые влияют на nAChR, обычно являются агонистами, частичными агонистами или антагонистами . [1] Однако некоторые агонисты nAChR, такие как никотин, действуют как деполяризующие агенты в зависимости от времени (секунды или минуты) относительно концентрации и подтипа nAChR. Хроническое воздействие некоторых агонистов может привести к длительной функциональной дезактивации в результате быстрой и стойкой десенсибилизации. Частичные агонисты nAChR были исследованы в качестве потенциальных агентов для прекращения курения; считается, что они связываются с nAChR и стимулируют высвобождение дофамина в меньших дозах, чем те, которые достигаются полными агонистами, и в отсутствие никотина. [18]
Отсутствие специфичности среди некоторых никотиновых агонистов - или неспецифических агонистов - хорошо документировано как фактор смешения для лечения заболеваний, которые требуют селективности для определенных подтипов nAChR. Было показано, что многие неспецифические агонисты - такие как ACh, никотин и эпибатидин - нацелены более чем на один подтип. [19] [20]
Фармакофор

Разработка фармакофора , агониста nAChR, в 1970 году предположила, что его рецептор-связывающая активность зависит от наличия положительно заряженного атома азота и водородной связывающей способности, придаваемой либо карбонильной, либо нитрогруппой, т. е. карбонильным кислородом в ацетилхолине или азотом в ( S )-никотине. Недавние исследования выявили структурные и стереохимические элементы, ответственные за связывающую способность и силу фармакофора; наличие катионного центра и электроотрицательных атомов, способных образовывать водородные связи с центром пиридинового кольца в ( S )-никотине, обеспечивает большую связывающую способность, в то время как ( S ) -энантиомер в 10-100 раз более силен, чем его ( R )-конформер.
Азабициклическое кольцо эпибатидина также обеспечивает благоприятные стерические взаимодействия с рецептором nAChR из-за его специфического межазотного расстояния, N + -N, которое было предложено в качестве существенного фактора для сродства агониста, однако некоторые споры относительно его влияния остаются. Современные теории предполагают, что разница в 7-8 Å между точками, комплементарными протонированному атому азота и акцептору водородной связи, может усилить эффективность. Низкая электронная плотность вблизи протонированного азота и более высокая электронная плотность по направлению к пиридиновому кольцу благоприятны в протонированных никотиновых лигандах, содержащих пиридиновое кольцо.
Недавние исследования были сосредоточены на подтипах рецепторов α7 и α4β2 для разработки препаратов для лечения никотиновой зависимости и когнитивных нарушений, таких как болезнь Альцгеймера. [21]
Взаимоотношения структуры и активности
Взаимосвязь структуры и активности: агонисты мышечных нАХР
Различные модели были использованы для проверки сродства агонистов nAChR к подтипам рецепторов путем идентификации молекул и их структур - т.е. составляющих групп и стерической конформации - которые обеспечивают большее сродство. Используя модель для подтипа мышечного рецептора nAChR (α1) 2 β1δγ, были получены следующие результаты:
- анатоксин > эпибатидин > ацетилхолин > DMPP >> цитизин > пирантел > никотин > кониин > тубокураре > лобелин ,
где анатоксин имел самую высокую эффективность активности, а тубокураре самую низкую. Напротив, ацетилхолин индуцировал гораздо более длительное время открытия рецептора, однако анатоксин оказался более мощным. Эти результаты предполагают, что производные анатоксина могут улучшить понимание взаимосвязей структуры и активности (SAR) для мышечных nAChR. [22]
Сукцинилхолин хлорид , который является препаратом, который уже есть на рынке, является эфиром бисхолина и миорелаксантом короткого действия. Эфиры бисхолина являются соединениями, которые могут действовать как конкурентные агонисты на мышечных типах nAChR и использовались в исследованиях SAR. В модели Torpedo (α1) 2 β1δγ nAChR было показано, что эффективность агонистов эфиров бисхолина зависит от длины цепи, поскольку эффективность увеличивается с увеличением длины цепи. Эффективность, по-видимому, не зависит от длины цепи, поскольку наибольшая эффективность наблюдается у эфиров бисхолина с четырьмя-семью CH
2единиц и ниже для обоих меньше CH
2единиц и более. [23]
Взаимосвязь структуры и активности: агонисты α4β2 nAChR

Объединение структурных элементов ACh и никотина, таким образом, уменьшая конформационную гибкость с циклопропановым кольцом, привело к открытию мощных и селективных лигандов α4β2 nAChR. Модуляция трех структурных элементов — линкера и замена либо аминогруппы, либо пиридинового кольца — может быть использована для определения влияния лигандов на мощность и селективность.
Факторы, которые ингибируют связывание, включают стерические препятствия в аминогруппе и/или насыщенных/ненасыщенных углеродных цепных линкерах - отсюда предпочтение короткоцепочечных эфирных линкеров. Повышенное сродство связывания часто достигается, если пиридиновое кольцо либо моно-, либо дизамещено галогенами. Замещение аминогруппы тремя различными амидами увеличило связывание; там, где метиламид имел наибольшее значение, другие замещенные амиды показали снижение сродства связывания из-за стерических препятствий и/или отсутствия метильной группы, что привело к потере гидрофобного взаимодействия. Стереохимия азота пиридина и/или пиридинового кольца, как стереоэлектронные эффекты, показывает положительные, хотя и тонкие эффекты на связывание с α4β2 nAChR. Лиганд пиридилового эфира с бромзамещенным пиридином и аминогруппой, замещенной метиламидом, показал самую высокую эффективность. [24]
Взаимосвязь структуры и активности: агонисты α7 nAChR


Поиск селективных и мощных агонистов α7 nAChR привел к появлению ряда потенциальных кандидатов на роль лекарственных препаратов; например, SEN12333 / WAY-317538 и другие соединения с желаемыми фармакокинетическими профилями, для которых были предложены соотношения структура-активность, демонстрируют селективность в отношении α7 nAChR (по сравнению с α1, α3 и α4β2 nAChR). [15]
Оптимальный фармакофор агониста α7 nAChR включает в себя базовую часть, присоединенную через углеродную цепь, связанную через амидный мостик с ароматической частью. Амидный мостик может быть инвертирован без влияния на эффективность агониста. Биарильные группы проявляют большую эффективность, чем моноарильные группы, из-за наличия ароматической части и замещения биарильной арильной группы в положении 2; эффективность выше для агонистов с донором/акцептором H + на биарильной арильной группе. Большее количество акцепторов водородных связей , вероятно, снижает проницаемость через гематоэнцефалический барьер (ГЭБ) из-за полярной площади поверхности и должно учитываться при разработке агонистов, нацеленных на α7 nAChR. [15]
Различные циклические аминогруппы - например, арилпиперазин , пиперидин и морфолин - могут быть использованы в качестве основного фрагмента, при этом имея ограниченное влияние на агонистическую активность. Ациклические третичные амины вполне достаточны в качестве основных фрагментов, однако более крупные группы отрицательно влияют на переносимость из-за их стерических свойств. [15]
Многие производные хинуклидина , такие как амид хинуклидина, известны как агонисты α7 nAChR. Исследования SAR для амида хинуклидина выявили факторы, влияющие на эффективность и сродство этих агонистов. Предпочтительны пара -замещение кольца хинуклидина и 3-( R ) стереохимическая конфигурация. Повышенная активность наблюдается, когда 5-членное кольцо слито с ароматическим фрагментом. Дальнейшее усиление может быть достигнуто, если слитое кольцо поставляет электронный резонанс амидному карбонилу, тогда как активность снижается, если кольцо содержит доноры водородных связей.
Жесткость хинуклидина и ортогональность азотного мостика относительно амидного карбонила были предложены как важные для оптимального связывания. Стабильность хинуклидинамида - более мощного производного - в моделях крыс in vitro была низкой, однако добавление метильной группы в положение 2 на кольце хинуклидина значительно увеличило его стабильность. [25]
Разработка лекарств
Разработка агонистов никотиновых ацетилхолиновых рецепторов началась в начале 1990-х годов после открытия положительного влияния никотина на память животных. [3] [4] С тех пор разработка агонистов никотиновых ацетилхолиновых рецепторов прошла долгий путь. Агонисты никотиновых ацетилхолиновых рецепторов привлекают все большее внимание как кандидаты на лекарственные средства для лечения множества расстройств центральной нервной системы, таких как болезнь Альцгеймера , шизофрения , синдром дефицита внимания и гиперактивности (СДВГ) и никотиновая зависимость . [26] [27] Никотиновые ацетилхолиновые рецепторы — это рецепторы, обнаруженные в центральной нервной системе , периферической нервной системе и скелетных мышцах. Они представляют собой лиганд-зависимые ионные каналы с сайтами связывания для ацетилхолина, а также других агонистов . Когда агонисты связываются с рецептором, это стабилизирует открытое состояние ионного канала, позволяя приток катионов . [9]
В 2009 году на рынке насчитывалось не менее пяти препаратов, воздействующих на никотиновые ацетилхолиновые рецепторы.
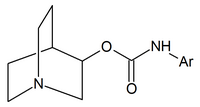 |  | 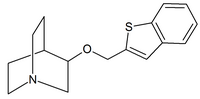 |
| Карбаматы хинуклидина | Амиды хинуклидина | Эфиры хинуклидина |
Продукция никотинового агониста
| Действующее вещество | Название продукта | Химическое название | Лекарственная форма | Фармакодинамические свойства | Терапевтическое использование | Структура |
|---|---|---|---|---|---|---|
| Варениклина тартрат | Шампикс, Шантикс | 7,8,9,10-тетрагидро-6,10-метано-6H-пиразино[2,3-h][3]бензазепин [27] | Таблетка, покрытая пленочной оболочкой | Частичный агонист никотинового ацетилхолинового рецептора, подтип α 4 β 2 [28] | Лечение табачной зависимости [28] |  |
| Галантамина гидробромид | Реминил, Нивалин, Разадин и Разадин ER | 4a,5,9,10,11,12-гексагидро-3-метокси-11-метил-6H-бензофуро[3a,3,2-ef][2]-бензазепин-6-ол [29] | Капсула с замедленным высвобождением, таблетка с пленочным покрытием, раствор для приема внутрь | Ингибитор холинэстеразы и неконкурентный агонист никотинового ацетилхолинового рецептора [4] | Лечение деменции, вызванной болезнью Альцгеймера [30] |  |
| никотин | Nicorette , Nicotinell, Niquitin, Boots NicAssist, Commit, Habitrol, Nicoderm CQ, Nicotrol, Thrive | 3-[(2S)-1-метилпирролидин-2-ил]пиридин | Трансдермальный пластырь, жевательная резинка, ингалятор, назальный спрей, леденцы, микротаблетки, а также в естественном виде содержится в табаке. | Агонист никотиновых рецепторов [31] как ганглиозного типа , так и α 4 β 2 [32] | Лечение табачной зависимости [33] |  |
| Карбахол | Миостат | 2-[(аминокарбонил)окси]-N,N,N-триметилэтанаминий | Внутриглазной раствор | Холинергический агонист [34] | Лечение глаукомы | 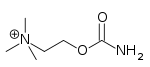 |
| Суксаметония хлорид (сукцинилхолина хлорид) | Анектин, Квелицин, Суксаметония хлорид | 2,2'-[(1,4-диоксобутан-1,4-диил)бис(окси)]бис(N,N,N-триметилэтанамин) | Внутривенная или внутримышечная инъекция | Деполяризующий нервно-мышечный блокатор [35] | Миорелаксант короткого действия [36] |  |
| Эпибатидин | Не указано | 2-(6-хлорпиридин-3-ил)-7-азабицикло[2.2.1]гептан | Не указано | Агонист никотинового ацетилхолинового рецептора [37] | Не используется как лекарство |  |
Другие агонисты никотиновых рецепторов, хотя, как правило, имеющие ограниченное клиническое применение, включают:
- Лобелин , агонист никотиновых рецепторов ганглиозного типа , а также влияет на сенсорные нервные окончания [32]
- эпибатидин , агонист ганглиозных рецепторов , α4β2 и α7 [32]
- декаметоний вызывает деполяризационную блокаду рецепторов мышечного типа , подобно суксаметонию [32]
Никотиновая и мускариновая активность
| Сравнение холинергических агонистов [38] | ||||
|---|---|---|---|---|
| Вещество | Специфичность рецептора | Гидролиз ацетилхолинэстеразой | Комментарии | |
| мускариновый | никотиновый | |||
| Холин | +++ | +++ | ++ | Незаменимое питательное вещество |
| Ацетилхолин | +++ | +++ | +++ | Эндогенный лиганд |
| Карбахол | ++ | +++ | - | Используется при лечении глаукомы |
| Метахолин | +++ | + | ++ | |
| Бетанехол | +++ | - | - | Используется при гипотонии мочевого пузыря и желудочно-кишечного тракта. |
| Мускарин | +++ | - | - | Натуральный алкалоид, содержащийся в некоторых грибах. Причина отравления грибами |
| никотин | - | +++ | - | Природный алкалоид, содержащийся в растении табака . |
| Пилокарпин | ++ | - | - | Используется при глаукоме. |
| Оксотреморин | ++ | - | - | |
Текущий статус
В настоящее время исследования агонистов никотиновых рецепторов и разработка лекарственных препаратов направлены на лечение множества заболеваний и расстройств ЦНС. [39]
У Targacept есть три препарата-кандидата, которые находятся на стадии клинических испытаний : AZD3480 (TC-1734) для лечения СДВГ, который в настоящее время проходит II фазу клинических испытаний, AZD1446 (TC-6683) для лечения болезни Альцгеймера в сотрудничестве с AstraZeneca и TC-5619 для лечения когнитивных дисфункций при шизофрении.
У Memory Pharmaceuticals совместно со своим партнером Roche есть один кандидат на препарат MEM 3454 (RG3487), частичный агонист никотинового рецептора α7 для лечения болезни Альцгеймера. [40] [41]
Abbott Laboratories в партнерстве с NeuroSearch проводят клинические испытания двух препаратов-кандидатов: ABT-894, селективный агонист никотиновых рецепторов α4β2, для лечения СДВГ, и ABT-560, нейрональный модулятор никотиновых рецепторов, который был выбран Abbott в 2006 году в качестве нового кандидата на разработку для лечения когнитивных дисфункций. [42]
У компании EnVivo Pharmaceuticals есть один кандидат на лекарственный препарат, проходящий клинические испытания, EVP-6124, селективный агонист никотиновых рецепторов α7 для лечения болезни Альцгеймера и шизофрении, и одно последующее соединение, EVP-4473, которое успешно завершило доклиническую разработку . [43]
Смотрите также
- Мускариновый ацетилхолиновый рецептор
- Агонист мускариновых рецепторов
- Антагонист мускариновых рецепторов
- Никотиновый ацетилхолиновый рецептор
- Антагонист никотина
- Парасимпатомиметический препарат
Ссылки
- ^ ab Matera, Carlo; Papotto, Claudio; Dallanoce, Clelia; De Amici, Marco (август 2023 г.). «Достижения в области селективных лигандов малых молекул для гетеромерных никотиновых ацетилхолиновых рецепторов». Pharmacological Research . 194 : 106813. doi : 10.1016/j.phrs.2023.106813. hdl : 2434/978688 . PMID 37302724.
- ^ Хеннингфилд, Джек Э.; Целлер, Митч (2006), «Исследовательский вклад психофармакологии никотина в регулирование табака в США и мире: взгляд назад и взгляд вперед», Психофармакология , 184 ( 3–4 ): 286–291 , doi :10.1007/s00213-006-0308-4, PMID 16463054, S2CID 38290573
- ^ ab Арутюнян, Ваграм; Барнс, Эдвард; Дэвис, К. Л. (1985), «Холинэргическая модуляция памяти у крыс», Психофармакология , 87 (3): 266– 271, doi : 10.1007/BF00432705, PMID 3001803, S2CID 20040918
- ^ abcde Buccafusco, JJ (2004), «Нейрональные никотиновые рецепторы подтипов: определение терапевтических целей» (PDF) , Molecular Interventions , 4 (5): 285–295 , doi :10.1124/mi.4.5.8, PMID 15471911, архивировано из оригинала (PDF) 2006-01-08 , извлечено 2009-12-21
- ^ Buccafusco, JJ; Jackson, WJ; Terry Jr, AV; Marsh, KC; Decker, MW; Arneric, SP (1995), «Улучшение выполнения задачи отложенного сопоставления с образцом обезьянами после применения ABT-418: нового активатора холинергических каналов для улучшения памяти», Psychopharmacology , 120 (3): 256–266 , doi :10.1007/BF02311172, PMID 8524972, S2CID 23215696
- ^ Людвиг, Дж.; Хёффле-Маас, А. (2010), «Локализация с помощью направленного мутагенеза участка связывания галантамина на внеклеточном домене никотинового ацетилхолинового рецептора α7», Журнал рецепторов и передачи сигналов , 30 (6): 469–483 , doi :10.3109/10799893.2010.505239, PMID 21062106, S2CID 9160835
- ^ Лю, Чжаопин; Чжан, Дж.; Берг, Дарвин К. (2007), «Роль эндогенной никотиновой сигнализации в управлении развитием нейронов», Биохимическая фармакология , 74 (8): 1112– 1119, doi : 10.1016/j.bcp.2007.05.022, PMC 2116993 , PMID 17603025
- ^ ab Gotti, C.; Clementi, F. (2004), «Нейрональные никотиновые рецепторы: от структуры к патологии», Progress in Neurobiology , 74 (6): 363–396 , doi :10.1016/j.pneurobio.2004.09.006, PMID 15649582, S2CID 24093369
- ^ abc Патерсон, Дэвид; Нордберг, Агнета (2000), «Нейрональные никотиновые рецепторы в человеческом мозге», Progress in Neurobiology , 61 (1): 75– 111, doi :10.1016/s0301-0082(99)00045-3, PMID 10759066, S2CID 27207955
- ^ Сала, Ф.; Нистри, А.; Криадо, М. (2008), «Никотиновые ацетилхолиновые рецепторы хромаффинных клеток надпочечников», Acta Physiologica , 192 (2): 203–212 , doi :10.1111/j.1748-1716.2007.01804.x, PMID 18005395, S2CID 29310750[ мертвая ссылка ]
- ^ abc Itier, Валери; Bertrand, Daniel (2001), «Нейрональные никотиновые рецепторы: от структуры белка к функции», FEBS Letters , 504 (3): 118– 125, doi : 10.1016/S0014-5793(01)02702-8 , PMID 11532443
- ^ ab Lindstrom, JM (2003), «Никотиновые ацетилхолиновые рецепторы мышц и нервов», Annals of the New York Academy of Sciences , 998 : 41–52 , doi :10.1196/annals.1254.007, PMID 14592862, S2CID 84583356[ мертвая ссылка ]
- ^ Михайлеску, Стефан; Друкер-Колин, Рене (2000), «Никотин, никотиновые рецепторы мозга и нейропсихиатрические расстройства», Архив медицинских исследований , 31 (2): 131– 144, doi :10.1016/S0188-4409(99)00087-9, PMID 10880717
- ^ Ариас, Хьюго Р. (1997), «Топология участков связывания лиганда на никотиновом ацетилхолиновом рецепторе», Brain Research Reviews , 25 (2): 133–191 , doi :10.1016/S0165-0173(97)00020-9, PMID 9403137, S2CID 26453010
- ^ abcd Хайдар, Саймон Н.; Гирон, Кьяра; Беттинетти, Лаура; Ботман, Хендрик; Комери, Томас А.; Данлоп, Джон; Ла Роза, Сальваторе; Микко, Иоланда; Полластрини, Мартина; Куинн, Джоанна; Ронкарати, Ренца; Скали, Карла; Валакки, Микела; Варроне, Маурицио; Заналетти, Риккардо (2009), «SAR и биологическая оценка SEN12333/WAY-317538: новый агонист никотинового ацетилхолинового рецептора альфа-7», Bioorganic & Medicinal Chemistry , 17 (14): 5247–5258 , doi :10.1016/j.bmc.2009.05.040, PMID 19515567
- ^ Брантон, Лоуренс Л.; Лазо, Джон С.; Паркер, Кит Л., ред. (2006), Goodman & Gilman's The Pharmacological Basis of Therapeutics (11-е изд.), McGRAW HILL, ISBN 978-0-07-142280-2
- ^ Анвин, Найджел (2004), «Уточненная структура никотинового ацетилхолинового рецептора с разрешением 4 А°», Журнал молекулярной биологии , 346 (4): 967–989 , doi :10.1016/j.jmb.2004.12.031, PMID 15701510
- ^ Касселс, Брюс К.; Бермудес, Изабель; Дахас, Федерико; Абин-Каррикири, Дж. Андрес; Воннакотт, Сьюзан (2005), «От разработки лиганда к терапевтической эффективности: проблема исследования никотиновых рецепторов», Drug Discovery Today , 10 ( 23–24 ): 1657–1665 , doi :10.1016/S1359-6446(05)03665-2, hdl : 10533/176659 , PMID 16376826
- ^ Matera, Carlo; Papotto, Claudio; Dallanoce, Clelia; De Amici, Marco (август 2023 г.). «Достижения в области селективных лигандов малых молекул для гетеромерных никотиновых ацетилхолиновых рецепторов». Pharmacological Research . 194 : 106813. doi : 10.1016/j.phrs.2023.106813. hdl : 2434/978688 . PMID 37302724.
- ^ Готти, К.; Форнасари, Д.; Клементи, Ф. (1997), «Никотиновые рецепторы нейронов человека», Progress in Neurobiology , 53 (2): 199–237 , doi :10.1016/S0301-0082(97)00034-8, PMID 9364611, S2CID 10421687
- ^ Tøndera, Janne E.; Olesena, Preben H.; Hansena, John Bondo; Begtrupb, Mikael; Petterssona, Ingrid (2001), «Улучшенный никотиновый фармакофор и стереоселективная CoMFA-модель для никотиновых агонистов, действующих на центральные никотиновые ацетилхолиновые рецепторы, меченые [3H]-N-метилкарбамилхолином», Журнал компьютерного молекулярного дизайна , 15 (3): 247– 258, Bibcode : 2001JCAMD..15..247T, doi : 10.1023/A:1008140021426, PMID 11289078, S2CID 80361
- ^ Купер, Джулия К.; Гутброд, Оливер; Витцеманн, Вайт; Метфессель, Кристоф (1996), «Фармакология никотинового ацетилхолинового рецептора из фетальной мышцы крысы, экспрессируемого в ооцитах Xenopus», Европейский журнал фармакологии , 309 (3): 287– 298, doi :10.1016/0014-2999(96)00294-4, PMID 8874153
- ^ Картер, Крис Р. Дж.; Као, Лирен; Каваи, Хидеки; Смит, Питер А.; Драйден, Уильям Ф.; Рафтери, Майкл А.; Данн, Сьюзан М. Дж. (2007), «Зависимость длины цепи взаимодействий бисчетвертичных лигандов с никотиновым ацетилхолиновым рецептором Torpedo», Биохимическая фармакология , 73 (3): 417– 426, doi : 10.1016/j.bcp.2006.10.011, PMID 17118342
- ^ Charton, Yves; Guillonneau, Claude.; Lockhart, Brian; Lestageb, Pierre; Goldsteina, Solo (2008), «Подготовка и профиль сродства новых никотиновых лигандов», Bioorganic & Medicinal Chemistry Letters , 18 (6): 2188– 2193, doi : 10.1016/j.bmcl.2007.12.075, PMID 18262785
- ^ Уокер, Дэниел П.; Вишка, Донн Г.; Пиотровски, Дэвид В.; Цзя, Шаоцзюань; Рейтц, Стивен С.; Йейтс, Карен М.; Майерс, Джейсон К.; Ветман Татьяна Н.; Марголис, Брэндон Дж.; Якобсен, Э. Джон; Акер, Брэд А.; Гроппи, Винсент Э.; Вулф, Марк Л.; Торнбург, Брюс А.; Тинхолт, Паула М.; Кортес-Бургос, Луз А.; Уолтерс, Родни Р.; Хестер, Мэтью Р.; Сист, Эрик П.; Долак, Лестер А.; Хан, Фюсен; Олсон, Барбара А.; Фицджеральд, Лаура; Стейтон, Брайан А.; Рауб, Томас Дж.; Хайос, Михай; Хоффманн, Уильям Э.; Ли, Кай С.; Хигдон, Николь Р. и др. (2006), «Разработка, синтез, взаимосвязь структуры и активности и активность in vivo азабициклических арильных амидов как агонистов никотиновых ацетилхолиновых рецепторов a7», Биоорганическая и медицинская химия , 14 (24): 8219– 8248, doi : 10.1016/j.bmc.2006.09.019, PMID 17011782
- ^ http://www.envivopharma.com - Программа агонистов никотиновых альфа-7 ацетилхолиновых рецепторов. Архивировано 07.01.2010 на Wayback Machine.
- ^ ab Rollema, H.; Chambers, LK; Coe, JW; Glowa, J.; Hurst, RS; Lebel, LA; Lu, Y.; Mansbach, RS; Mather, RJ; Rovetti, CC; Sands, SB; Schaeffer, E.; Schulz, DW; Tangley III, FD; Williams, KE (2007), "Фармакологический профиль частичного агониста никотиновых ацетилхолиновых рецепторов α 4 β 2 варениклина, эффективного средства для прекращения курения", Neuropharmacology , 52 (3): 985–994 , doi :10.1016/j.neuropharm.2006.10.016, PMID 17157884, S2CID 53267460
- ^ ab "CHAMPIX 0,5 мг таблетки, покрытые пленочной оболочкой; CHAMPIX 1 мг таблетки, покрытые пленочной оболочкой - Краткое описание характеристик продукта (SmPC) - (eMC)". emc.medicines.org.uk . Архивировано из оригинала 24.12.2012.
- ^ Гринблатт, Х. М.; Крайгер, Г.; Льюис, Т.; Силман, И.; Сассман, Дж. Л. (1999), «Структура комплекса ацетилхолинэстеразы с (-)-галантамином при разрешении 2,3 ангстрема», FEBS Letters , 463 (3): 321– 326, doi : 10.1016/S0014-5793(99)01637-3 , PMID 10606746
- ^ "Reminyl XL 8 мг, 16 мг и 24 мг капсулы пролонгированного действия - Краткое описание характеристик продукта (SmPC) - (eMC)". emc.medicines.org.uk . Архивировано из оригинала 24.12.2012.
- ^ Дани, Джон А.; Биази, Мариэлла Де (2001), «Клеточные механизмы никотиновой зависимости», Pharmacology Biochemistry and Behavior , 70 (4): 439– 446, doi :10.1016/S0091-3057(01)00652-9, PMID 11796143, S2CID 12960054
- ^ abcd Rang, HP (2003), Фармакология , Эдинбург: Черчилль Ливингстон, ISBN 978-0-443-07145-4Страница 149
- ^ XI, Чжэн-сюн; Шпиллер, Криста; Гарднер, Элиот Л. (2009), «Разработка лекарственных средств на основе механизмов для лечения никотиновой зависимости», Acta Pharmacol Sin , 30 (6): 723– 739, doi :10.1038/aps.2009.46, PMC 3713229 , PMID 19434058, ProQuest 213027402
- ^ "Миостат FDA этикетка" (PDF) . fda.gov . Декабрь 2003.
- ^ Туба, Золтан; Махо, Шандор; Визи, Э. Сильвестр (2002), «Синтез и взаимосвязь структуры и активности нейромышечных блокаторов», Current Medicinal Chemistry , 9 (16): 1507– 1536, doi : 10.2174/0929867023369466, PMID 12171561, ProQuest 215095660
- ^ "Инъекция анектина - Краткое описание характеристик продукта (SmPC) - (eMC)". emc.medicines.org.uk . Архивировано из оригинала 2012-12-24.
- ^ Кэрролл, Ф. Айви (2004), «Структура эпибатидина: взаимосвязь активности», Bioorganic & Medicinal Chemistry Letters , 14 (8): 1889– 1896, doi : 10.1016/j.bmcl.2004.02.007, PMID 15050621
- ^ Если в полях не указано иное, то ссылка: Таблица 10-3 в: Rod Flower; Humphrey P. Rang; Maureen M. Dale; Ritter, James M. (2007), Rang & Dale's pharmacology , Эдинбург: Churchill Livingstone, ISBN 978-0-443-06911-6
- ^ Matera, Carlo; Papotto, Claudio; Dallanoce, Clelia; De Amici, Marco (август 2023 г.). «Достижения в области селективных лигандов малых молекул для гетеромерных никотиновых ацетилхолиновых рецепторов». Pharmacological Research . 194 : 106813. doi : 10.1016/j.phrs.2023.106813. hdl : 2434/978688 . PMID 37302724.
- ^ "Roche - Pharmaceuticals Pipeline". Архивировано из оригинала 2009-12-25 . Получено 2009-12-21 .
- ^ "Memory Pharmaceuticals достигла цели по набору для исследования фазы 2 MEM 3454 при когнитивных нарушениях, связанных с шизофренией". Архивировано из оригинала 2009-01-09 . Получено 2009-12-21 .
- ^ "Drug Development". Архивировано из оригинала 2006-10-03 . Получено 2009-12-21 .
- ^ "Программы - EnVivo". Архивировано из оригинала 2009-08-06 . Получено 2009-12-21 .
Внешние ссылки
 Медиа, связанные с агонистами никотина на Wikimedia Commons
Медиа, связанные с агонистами никотина на Wikimedia Commons
- никотиновые+агонисты в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)
- Список агентов MeSH 82018722