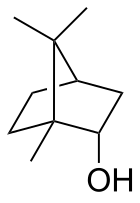
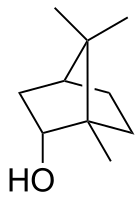
Борнеол
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК отн -(1 R ,2 S ,4 R )-1,7,7-Триметилбицикло[2.2.1]гептан-2-ол | |||
| Другие имена 1,7,7-Триметилбицикло[2.2.1]гептан-2- эндо -ол эндо -2-борнанол, борнео камфора | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.006.685 | ||
| Номер ЕС |
| ||
| |||
| КЕГГ | |||
CID PubChem |
| ||
| УНИИ | |||
| Номер ООН | 1312 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С10Н18О | |||
| Молярная масса | 154,253 г·моль −1 | ||
| Появление | бесцветные или белые комки | ||
| Запах | едкий , камфароподобный | ||
| Плотность | 1,011 г/см 3 (20 °C) [1] | ||
| Температура плавления | 208 °C (406 °F; 481 К) | ||
| Точка кипения | 213 °C (415 °F; 486 К) | ||
| слабо растворим ( D -форма) | |||
| Растворимость | растворим в хлороформе , этаноле , ацетоне , эфире , бензоле , толуоле , декалине , тетралине | ||
| −1,26 × 10−4 см 3 / моль | |||
| Опасности | |||
| Маркировка СГС : | |||
 | |||
| Предупреждение | |||
| H228 | |||
| П210 , П240 , П241 , П280 , П370+П378 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 65 °C (149 °F; 338 К) | ||
| Паспорт безопасности (SDS) | Внешний ПБС | ||
| Родственные соединения | |||
Родственные соединения | Борнан (углеводород) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Борнеол — бициклическое органическое соединение и производное терпена . Гидроксильная группа в этом соединении находится в эндо -положении. Экзо-диастереомер называется изоборнеол . Будучи хиральным, борнеол существует в виде энантиомеров , оба из которых встречаются в природе: d -борнеол (также пишется (+)-борнеол) и l -борнеол (или (−)-борнеол).
Реакции
Борнеол окисляется до кетона ( камфоры ).
Происшествие
Соединение было названо в 1842 году французским химиком Шарлем Фредериком Герхардтом . [2] Борнеол можно найти в нескольких видах Heterotheca , [3] Artemisia , Rosmarinus officinalis ( розмарин ) [4] Dipterocarpaceae , Blumea balsamifera и Kaempferia galanga . [5]
Это одно из химических соединений, содержащихся в кастореуме . Это соединение собирается из растительной пищи бобров. [6]
Синтез
Борнеол может быть синтезирован путем восстановления камфоры методом восстановления Меервейна-Понндорфа-Верлея (обратимый процесс). В промышленности используется рацемическая смесь камфоры, что приводит к рацемической смеси борнеола и изоборнеола . Хиральность можно контролировать, изменяя хиральность камфоры: (+)-камфора дает (−)-изоборнеол и (+)-борнеол. [7]
Восстановление камфоры боргидридом натрия (быстрое и необратимое) дает вместо этого диастереомер изоборнеол .
Природные источники
В промышленных масштабах натуральный (+)-борнеол производится из Cinnamomum burmanni (один специфический хемотип) [8] и Cinnamomum camphora . [9]
Природный (-)-борнеол встречается в Blumea balsamifera .
Биосинтез
Борнеол синтезируется с использованием DMAPP в качестве исходного материала. Затем DMAPP преобразуется в GPP , который подвергается воздействию борнилдифосфатсинтазы , образуя борнилдифосфат. Затем фосфатаза удаляет фосфатные группы, образуя борнеол. [10]
Хиральность борнеола в растении зависит от предпочтительной хиральности борнилдифосфатсинтазы. Синтазы для каждой хиральности были секвенированы. [10] [11]
Продуктом нисходящего потока является камфора любой хиральности, реакция катализируется (+)-борнеолдегидрогеназой или (−)-борнеолдегидрогеназой .
Использует
Если раньше d -борнеол был наиболее доступным в продаже энантиомером , то сейчас более доступным в продаже является l -борнеол, который также встречается в природе.
(+)-Борнеол из Dipterocarpus spp. используется в традиционной китайской медицине . Раннее описание найдено в Bencao Gangmu .
Борнеол является компонентом многих эфирных масел [12] и является натуральным репеллентом от насекомых . [13] Он также создает охлаждающее ощущение, опосредованное TRPM8, похожее на ментол . [14]
Лево-борнеол используется в парфюмерии. Имеет бальзамический тип запаха с сосновыми, древесными и камфарными оттенками.
Декстроборнеол (дексборнеол) используется в эдаравоне/дексборнеоле, препарате, одобренном в Китае для лечения инсульта. [15]
Токсикология
Борнеол может вызывать раздражение глаз, кожи и дыхательных путей; он вреден при проглатывании. [16] Острое воздействие может вызвать головную боль, тошноту, рвоту, головокружение, предобморочное состояние и обмороки. Воздействие в более высоких концентрациях или в течение более длительного периода времени может вызвать беспокойство, трудности с концентрацией внимания, раздражительность и судороги. [17]
Раздражение кожи
Было показано, что борнеол не вызывает раздражения при нанесении на кожу человека в дозах, используемых в составе изысканных духов. [18] Воздействие на кожу может привести к сенсибилизации и будущей аллергической реакции даже на небольшие количества. [17]
Производные
Группа борнила представляет собой одновалентный радикал C10H17 , полученный из борнеола путем удаления гидроксила, и также известна как 2-борнил. [ 19] Изоборнил представляет собой одновалентный радикал C10H17 , полученный из изоборнеола. [20] Структурный изомер фенхол также является широко используемым соединением, полученным из некоторых эфирных масел .
Борнилацетат — это ацетатный эфир борнеола.
Примечания и ссылки
- ^ Lide, DR, ред. (2005). CRC Handbook of Chemistry and Physics (86-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 3.56. ISBN 0-8493-0486-5.
- ^ Герхардт, К. (1842). «Sur la Transformation de l'essence de valériane en Camphre de Bornéo et en Camphre des laurinées» [О превращении сущности валерианы в камфору Борнео и в лавровую камфору]. Comptes rendus . 14 : 832–835.
Из стр. 834: «Je donne, par Cette raison, à l’Hydrogene Carboné de l’Essence de Valériane, le nom de Bornéène , et, au Camphre lui-même, celui de Bornéol ». (По этой причине (а именно потому, что соединение, которое Герхардт получил из масла валерианы, было идентично тому, которое получил Пелуз из камфоры с Борнео), углеводороду из эссенции валерианы название борнеен , а самой камфоре - борнеол . ) - ^ Линкольн, Д.Э.; Лоуренс, Б.М. (1984). «Летучие компоненты камфары, Heterotheca subaxillaris ». Фитохимия . 23 (4): 933–934.
- ^ Бегум, А.; Сандхья, С.; Шаффат Али, С.; Винод, КР; Редди, С.; Банджи, Д. (2013). «Углубленный обзор лекарственной флоры Rosmarinus officinalis (Lamiaceae)». Acta Scientiarum Polonorum: Technologia Alimentaria . 12 (1): 61–73 . PMID 24584866.
- ^ Вонг, К. К.; Онг, К. С.; Лим, К. Л. (2006). «Состав эфирного масла корневищ Kaempferia galanga L.». Flavour and Fragrance Journal . 7 (5): 263– 266. doi :10.1002/ffj.2730070506.
- ^ Бобер: его жизнь и влияние. Dietland Muller-Schwarze, 2003, стр. 43 (книга в Google Books)
- ^ Ян, Мин-Йе; Кхин, да, да; Лю, Джен-Вэй; Ченг, Хуэй-Чен; Ху, Анрен; Чен, Хао-Пин; Ши, Ценге-Лиен (ноябрь 2018 г.). «Разрешение изоборнеола и его изомеров с помощью ГХ/МС для идентификации «синтетических» и «полусинтетических» продуктов борнеола». Хиральность . 30 (11): 1233–1239 . doi :10.1002/чир.23017. ПМИД 30222211.
- ^ Ли, Фанпин; Хуан, Шилинь; Мэй, Юй; У, Бинци; Хоу, Чжуанвэй; Чжань, Пэнлинь; Хоу, Чжихао; Хуан, Вэньцзе; Чжао, Цзюньлян; Ван, Цзихуа (октябрь 2022 г.). «Сборка генома предоставила новые сведения об эволюции Cinnamomum burmannii и различиях в биосинтезе D -борнеола между хемотипами». Промышленные культуры и продукты . 186 : 115181. doi :10.1016/j.indcrop.2022.115181.
- ^ Синсин, Лю; Си, Чжан; Сяли, Го; Шанцзи, Гун; Сянмэй, Цзян; Юйсинь, Фу; Липин, Ло (2014). «Многомерный анализ летучего химического состава листьев различных хемотипов Cinnamomumcamphora ». Китайский бюллетень ботаники . 49 (2): 161. doi :10.3724/SP.J.1259.2014.00161.
- ^ ab Ma, Rui; Su, Ping; Ma, Qing; Guo, Juan; Chen, Suiqing; Jin, Baolong; Zhang, Haiyan; Tang, Jinfu; Zhou, Tao; Xiao, Chenghong; Cui, Guanghong; Huang, Luqi (март 2022 г.). «Идентификация (−)-борнилдифосфатсинтазы из Blumea balsamifera и ее применение для биосинтеза (−)-борнеола в Saccharomyces cerevisiae». Synthetic and Systems Biotechnology . 7 (1): 490– 497. doi :10.1016/j.synbio.2021.12.004. PMC 8671873. PMID 34977393 .
- ^ Ян, Цзэруй; Ан, Вэньли; Лю, Шаньшань; Хуан, Юйин; Се, Чуньчжу; Хуан, Сун; Чжэн, Сяшэн (10 июня 2020 г.). «Изучение генов-кандидатов, участвующих в биосинтезе правовращающего борнеола в Cinnamomum burmannii, с помощью транскриптомного анализа трех хемотипов». PeerJ . 8 : e9311. doi : 10.7717/peerj.9311 . PMC 7293187 . PMID 32566406.
- ^ Растения, содержащие борнеол. Архивировано 23 сентября 2015 г. на Wayback Machine (База данных фитохимических и этноботанических веществ доктора Дьюка)]
- ^ "Химическая информация". sun.ars-grin.gov. Архивировано из оригинала 2004-11-07 . Получено 2008-03-02 .
- ^ Чен, GL; Лей, M; Чжоу, LP; Цзэн, B; Цзоу, F (2016). «Борнеол — агонист TRPM8, увеличивающий влажность глазной поверхности». PLOS One . 11 (7): e0158868. Bibcode : 2016PLoSO..1158868C. doi : 10.1371/journal.pone.0158868 . PMC 4957794. PMID 27448228 .
- ^ Сюй, Цзе; Ван, Анксин; Мэн, Ся; Ялкун, Гульбахрам; Сюй, Аньдин; Гао, Чжицян; Чен, Хуэйшэн; Джи, Ён; Сюй, Цзюнь; Гэн, Дэцинь; Чжу, Жуньсю; Лю, Бо; Донг, Айцинь; Му, Хуа; Лу, Чжихун; Ли, Шуя; Чжэн, Хуагуан; Чен, Ся; Ван, Илун; Чжао, Синцюань; Ван, Юнджун; Ван, Юнджун; Сюй, Аньдин; Чжао, Синцюань; Чен, Ся; Ван, Юнджун; Мэн, Ся; Ван, Илун; Сюй, Цзе; Ван, Анксин; Чжэн, Хуагуан; Гао, Чжицян; Дуань, Лей; Чжан, Цзинхуа; Ли, Шуя; Лу, Дунхуа; Гао, Чжицян; Чен, Хуэйшэн; Джи, Ён; Сюй, Цзюнь; Гэн, Дэцинь; Чжу, Жуньсю; Лю, Бо; Донг, Айцинь; Лян, Цинчэн; Ян, Хун; Го, Цунджу; Ли, Синь; Он, Мингли; Тянь, Сянъян; Цуй, Ён; Чжоу, Цзюньшань; Ван, Нин; Ван, Лей; Чжан, Синьцзян; Гао, Сяопин; Лу, Липин; Ли, Тонг; Ченг, Ян; Лю, Кайсян; Си, Сяокунь; Ван, Баоцзюнь; Сунь, Лин; Чжао, Шиган; Чу, Сяофань; Лиан, Яджун; Ян, Фулин; Ван, Сяошань; Ван, Донг; Шао, Бэй; Цзяо, Цзиньсун; Ву, Хэн; Ли, Гуанлай; Го, Либинь; Ван, Юнджун; Пан, Суюэ; Сюй, Аньдин; Ли, Хэн; Чжуан, Цзяньхуа; Ли, Синь; Ву, Цзюнь; Ван, Анксин; Лу, Дунхуа; Цзо, Интинг; Чжан, Ицзюнь; Чжан, Сяоли; Фэн, Сяофэй; Мэн, Ся; Ван, Дэвид; Донг, Кэхуэй; Лю, Яньфан; Ли, Хао; Чен, Давэй; Льв, Цюши (март 2021 г.). «Эдаравон дексборнеол по сравнению с одним эдаравоном для лечения острого ишемического инсульта: фаза III, рандомизированное двойное слепое сравнительное исследование». Гладить . 52 (3): 772–780 . doi :10.1161/STROKEAHA.120.031197. ПМИД 33588596.
- ^ Паспорт безопасности материала. Fisher Scientific .
- ^ ab ИНФОРМАЦИОННЫЙ ЛИСТОК ОБ ОПАСНЫХ ВЕЩЕСТВАХ (PDF)
- ^ Bhatia, SP; Letizia, CS; Api, AM (ноябрь 2008 г.). «Обзор ароматизирующих материалов на основе борнеола». Пищевая и химическая токсикология . 46 (11): S77 – S80 . doi :10.1016/j.fct.2008.06.031. PMID 18640181.
- ^ «Определение БОРНИЛА». www.merriam-webster.com .
- ^ «Определение ИЗОБОРНИЛА». www.merriam-webster.com .
Внешние ссылки
- Лист данных NIST, включающий полные спектроскопические данные
- Борнеол в китайской медицине