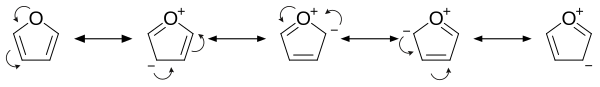Фуран
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Фуран [1] | |||
| Систематическое название ИЮПАК 1,4-Эпоксибута-1,3-диен 1-Оксациклопента-2,4-диен | |||
| Другие имена Оксол Окса[5]аннулен 1,4-эпокси-1,3-бутадиен 5-оксациклопента-1,3-диен 5-оксацикло-1,3-пентадиен Фурфуран Дивиниленоксид | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 103221 | |||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.003.390 | ||
| Номер ЕС |
| ||
| 25716 | |||
| КЕГГ | |||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 2389 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С4Н4О | |||
| Молярная масса | 68,075 г·моль −1 | ||
| Появление | Бесцветная, летучая жидкость | ||
| Плотность | 0,936 г/мл | ||
| Температура плавления | −85,6 °C (−122,1 °F; 187,6 К) | ||
| Точка кипения | 31,3 °C (88,3 °F; 304,4 К) | ||
| -43,09·10 −6 см 3 /моль | |||
| Опасности | |||
| Маркировка СГС : | |||
   | |||
| Опасность | |||
| Н224 , Н302 , Н315 , Н332 , Н341 , Н350 , Н373 , Н412 | |||
| Р201 , Р202 , Р210 , Р233 , Р240 , Р241 , Р242 , Р243 , Р260 , Р261 , Р264 , Р270 , Р271 , Р273 , Р280 , Р281 , Р301+Р312 , Р302+Р352 , Р303+Р361+Р353 , Р304+Р312 , Р304 +Р340 , Р308+Р313 , Р312 , Р314 , Р321 , Р330 , Р332+Р313 , Р362 , Р370+Р378 , Р403+Р235 , Р405 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | −36 °C (−33 °F; 237 K) | ||
| 390 °C (734 °F; 663 К) | |||
| Пределы взрывоопасности | Нижний: 2,3% Верхний: 14,3% при 20 °C | ||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LD 50 ( средняя доза ) | > 2 г/кг (крыса) | ||
| Паспорт безопасности (SDS) | Пеннакем | ||
| Родственные соединения | |||
Родственные гетероциклы | Пиррол Тиофен | ||
Родственные соединения | Тетрагидрофуран (ТГФ) 2,5-диметилфуран Бензофуран Дибензофуран | ||
| Структура | |||
| С 2в | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Фуран — гетероциклическое органическое соединение , состоящее из пятичленного ароматического кольца с четырьмя атомами углерода и одним атомом кислорода . Химические соединения, содержащие такие кольца, также называются фуранами.
Фуран — бесцветная, легковоспламеняющаяся , высоколетучая жидкость с температурой кипения, близкой к комнатной температуре. Он растворим в обычных органических растворителях , включая спирт , эфир и ацетон , и слабо растворим в воде . [2] Его запах «сильный, эфирный; хлороформоподобный ». [3] Он токсичен и может быть канцерогенным для человека. Фуран используется в качестве исходной точки для других специальных химикатов . [4]
История
Название «фуран» происходит от латинского furfur , что означает отруби [5] ( фурфурол производится из отрубей). Первым производным фурана, которое было описано, была 2-фуроевая кислота , Карлом Вильгельмом Шееле в 1780 году. Другое важное производное, фурфурол , было описано Иоганном Вольфгангом Дёберейнером в 1831 году и охарактеризовано девятью годами позже Джоном Стенхаусом . Сам фуран был впервые получен Генрихом Лимприхтом в 1870 году, хотя он назвал его «тетрафенолом» (как будто это был четырехуглеродный аналог фенола , C 6 H 5 OH). [6] [7]
Производство
В промышленности фуран производится путем катализируемого палладием декарбонилирования фурфурола или катализируемого медью окисления 1,3-бутадиена : [4]
В лабораторных условиях фуран можно получить из фурфурола путем окисления до 2-фурановой кислоты с последующим декарбоксилированием . [8] Его также можно получить непосредственно путем термического разложения пентозосодержащих материалов и целлюлозных твердых веществ, особенно сосновой древесины .
Синтез фуранов
Синтез Фейста-Бенари является классическим способом синтеза фуранов. Реакция включает алкилирование 1,3- дикетонов α-бромкетонами с последующей дегидратацией промежуточного гидроксидигидрофурана . [ 9] Другой традиционный путь включает реакцию 1,4-дикетонов с пентоксидом фосфора (P 2 O 5 ) в синтезе Пааля-Кнорра . [10]
Существует много путей синтеза замещенных фуранов. [11] [12]
- Фуран в природе и торговле
- Препарат Зантак, также известный как ранитидин .
- Розефуран , ароматическое соединение, содержащееся в розовом масле. [10]
- Фурфурол , получаемый из сахаров, является основным источником фуранов.
- метанофуран является кофактором метаногенеза .
Структура и связь
Фуран имеет ароматический характер, потому что одна из неподеленных пар электронов на атоме кислорода делокализована в кольцо, создавая ароматическую систему 4 n + 2 (см. правило Хюккеля ). Ароматичность скромна по сравнению с ароматичностью бензола и родственных гетероциклов тиофена и пиррола . Резонансные энергии бензола , пиррола , тиофена и фурана составляют соответственно 152, 88, 121 и 67 кДж/моль (36, 21, 29 и 16 ккал/моль). Таким образом, эти гетероциклы, особенно фуран, гораздо менее ароматичны, чем бензол, что проявляется в лабильности этих колец. [13] Молекула плоская, но группы C=C, присоединенные к кислороду, сохраняют значительный характер двойной связи . Другая неподеленная пара электронов атома кислорода простирается в плоскости плоской кольцевой системы.
Изучение резонансных вкладчиков показывает повышенную электронную плотность кольца, что приводит к увеличению скорости электрофильного замещения. [14]
Реактивность
Из-за своего частично ароматического характера поведение фурана является промежуточным между поведением енольного эфира и ароматического кольца. Он отличается от эфиров, таких как тетрагидрофуран .
Подобно енольным эфирам, 2,5-дизамещенные фураны подвержены гидролизу с обратимым образованием 1,4-дикетонов.
Фуран служит диеном в реакциях Дильса-Альдера с электронодефицитными диенофилами , такими как этил ( E )-3-нитроакрилат. [15] Продукт реакции представляет собой смесь изомеров с предпочтением эндо- изомера :
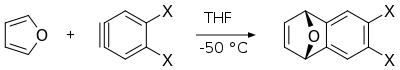
Реакция Дильса-Альдера фурана с аринами дает соответствующие производные дигидронафталинов, которые являются полезными промежуточными продуктами в синтезе других полициклических ароматических соединений . [16]
- Он значительно более реактивен, чем бензол , в реакциях электрофильного замещения из-за электронодонорного эффекта гетероатома кислорода. Он реагирует с бромом при 0 °C, давая 2-бромфуран.
- Гидрирование фуранов последовательно дает дигидрофураны и тетрагидрофураны . [ требуется ссылка ]
- В реакции Ахматовича фураны превращаются в дигидропирановые соединения.
- Пиррол можно получить в промышленных масштабах путем обработки фурана аммиаком в присутствии твердых кислотных катализаторов , таких как SiO 2 и Al 2 O 3 . [17]
Безопасность
Фуран содержится в термообработанных коммерческих продуктах питания и образуется в результате термической деградации натуральных пищевых компонентов. [18] [19] Его можно найти в жареном кофе , растворимом кофе и обработанном детском питании . [19] [20] [21] Исследования показали, что кофе, приготовленный в кофеварках эспрессо и кофе, приготовленный из капсул, содержит больше фурана, чем кофе, приготовленный в традиционных капельных кофеварках , хотя его уровень все еще находится в пределах безопасного для здоровья. [22]
Воздействие фурана в дозах, примерно в 2000 раз превышающих прогнозируемый уровень воздействия на человека из продуктов питания, увеличивает риск возникновения гепатоцеллюлярных опухолей у крыс и мышей, а также опухолей желчных протоков у крыс. [23] Поэтому фуран включен в список возможных канцерогенов для человека . [23]
Смотрите также
- BS 4994 – Фурановая смола как термореактивный стеклопластик для оборудования химических заводов
- Фуранокумарин
- Фуранофлавоноид
- Фураноза
- Фурантетракарбоновая кислота
- Простые ароматические кольца
- Фурановые жирные кислоты
- Тетрагидрофуран
Ссылки
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 392. doi :10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Якубке, Ганс Дитер; Йешкейт, Ганс (1994). Краткая энциклопедия химии . Вальтер де Грюйтер. стр. 1–1201. ISBN 0-89925-457-8.
- ^ DHHS (NIOSH) Публикация № 2016–171, стр. 2, доступ получен в ноябре 2019 г.
- ^ Аб Хойдонкс, HE; Ван Рейн, ВМ; Ван Рейн, В.; Де Вос, Делавэр; Джейкобс, П.А. «Фурфурол и его производные». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a12_119.pub2. ISBN 978-3527306732.
- ^ Сеннинг, Александр (2006). Словарь хемоэтимологии Elsevier . Elsevier. ISBN 0-444-52239-5.
- ^ Лимприхт, Х. (1870). «Ueber das Tetraphenol C4H4O». Berichte der Deutschen Chemischen Gesellschaft . 3 (1): 90–91. дои : 10.1002/cber.18700030129.
- ^ Родд, Эрнест Гарри (1971). Химия углеродных соединений: современный всеобъемлющий трактат . Elsevier.
- ^ Wilson, WC (1941). «Фуран». Органические синтезы; Собрание томов , т. 1, стр. 274.
- ^ Хоу, XL; Чунг, HY; Хон, TY; Кван, PL; Ло, TH; Тонг, SY; Вонг, HN (1998). «Региоселективные синтезы замещенных фуранов». Тетраэдр . 54 (10): 1955–2020. doi :10.1016/S0040-4020(97)10303-9.
- ^ ab Gilchrist, Thomas L. (1997). Гетероциклическая химия (3-е изд.). Ливерпуль: Longman. стр. 209-212.
- ^ Адам Сниади, Марко С. Морреале, Роман Дембински (2007). "Электрофильная циклизация с N-йодосукцинимидом: получение 5-(4-бромфенил)-3-йод-2-(4-метилфенил)фурана". Органические синтезы . 84 : 199. doi :10.15227/orgsyn.084.0199.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Джеймс А. Маршалл, Кларк А. Сехон (1999). "Изомеризация b-алкинилаллиловых спиртов в фураны, катализируемая нитратом серебра на силикагеле: 2-пентил-3-метил-5-гептилфуран". Органические синтезы . 76 : 263. doi :10.15227/orgsyn.076.0263.
- ^ Смит, Майкл Б.; Марч, Джерри (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 62, ISBN 978-0-471-72091-1
- ^ Bruice, Paula Y. (2007). Органическая химия (5-е изд.). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-196316-0.
- ^ Masesane, I.; Batsanov, A.; Howard, J.; Modal, R.; Steel, P. (2006). «Оксанорборненовый подход к 3-гидрокси, 3,4-дигидрокси и 3,4,5-тригидроксипроизводным 2-аминоциклогексанкарбоновой кислоты». Beilstein Journal of Organic Chemistry . 2 (9): 9. doi : 10.1186/1860-5397-2-9 . PMC 1524792. PMID 16674802 .
- ^ Филатов, МА; Балущев, С.; Илиева, И.З.; Энкельманн, В.; Митева, Т.; Ландфестер, К .; Алещенков, С.Е.; Чепраков, АВ (2012). "Тетраарилтетраантра[2,3]порфирины: синтез, структура и оптические свойства" (PDF) . J. Org. Chem . 77 (24): 11119–11131. doi :10.1021/jo302135q. PMID 23205621. Архивировано из оригинала (PDF) 2020-02-19.
- ^ Харреус, Альбрехт Людвиг. «Пиррол». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_453. ISBN 978-3527306732.
- ^ Anese, M.; Manzocco, L.; Calligaris, S.; Nicoli, MC (2013). «Промышленно применимые стратегии снижения содержания акриламида, фурана и 5-гидроксиметилфурфурола в пищевых продуктах» (PDF) . Журнал сельскохозяйственной и пищевой химии . 61 (43): 10209–14. doi :10.1021/jf305085r. PMID 23627283. Архивировано из оригинала (PDF) 2017-08-08.
- ^ ab Moro, S.; Chipman, JK; Wegener, JW; Hamberger, C.; Dekant, W.; Mally, A. (2012). «Фуран в термически обработанных продуктах: образование, воздействие, токсичность и аспекты оценки риска» (PDF) . Molecular Nutrition & Food Research . 56 (8): 1197–1211. doi :10.1002/mnfr.201200093. hdl :1871/41889. PMID 22641279. S2CID 12446132.
- ^ Европейское агентство по безопасности пищевых продуктов (2011). «Обновленная информация об уровнях фурана в пищевых продуктах по результатам мониторинга 2004–2010 гг. и оценка воздействия». Журнал EFSA . 9 (9): 2347. doi : 10.2903/j.efsa.2011.2347 .

- ^ Waizenegger, J.; Winkler, G.; Kuballa, T.; Ruge, W.; Kersting, M.; Alexy, U.; Lachenmeier, DW (2012). «Анализ и оценка риска фурана в кофейных продуктах, предназначенных для подростков». Пищевые добавки и загрязнители: Часть A. 29 ( 1): 19–28. doi :10.1080/19440049.2011.617012. PMID 22035212. S2CID 29027966.
- ^ "Эспрессо-машины: Кофе в капсулах содержит больше фурана, чем остальное". Science Daily . 14 апреля 2011 г.
- ^ ab Bakhiya, N.; Appel, KE (2010). "Токсичность и канцерогенность фурана в рационе человека" (PDF) . Архивы токсикологии . 84 (7): 563–578. doi :10.1007/s00204-010-0531-y. PMID 20237914. S2CID 19389984.
Внешние ссылки
- Современные методы синтеза







![Розефуран, ароматическое соединение, содержащееся в розовом масле.[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b6/Rosefuran-2D-skeletal.png/180px-Rosefuran-2D-skeletal.png)