Кубическая кристаллическая система



В кристаллографии кубическая (или изометрическая ) кристаллическая система — это кристаллическая система , в которой элементарная ячейка имеет форму куба . Это одна из наиболее распространенных и простейших форм, встречающихся в кристаллах и минералах .
Существует три основных разновидности этих кристаллов:
- Примитивная кубическая (сокращенно cP и альтернативно называемая простой кубической )
- Объемно-центрированная кубическая (сокращенно cI или bcc )
- Гранецентрированная кубическая (сокращенно cF или fcc )
Примечание: термин fcc часто используется в качестве синонима для кубической плотноупакованной или ccp- структуры, встречающейся в металлах. Однако fcc обозначает гранецентрированную кубическую решетку Браве, которая не обязательно плотноупакована, когда мотив установлен на узлах решетки. Например, решетки алмаза и цинковой обманки являются fcc , но не плотноупакованными. Каждая из них подразделяется на другие варианты, перечисленные ниже. Хотя элементарные ячейки в этих кристаллах традиционно считаются кубами, примитивные элементарные ячейки часто таковыми не являются.
Решетки Браве
Три латекса Браве в кубической кристаллической системе:
| решетка Бравэ | Примитивный кубический | Объемно-центрированная кубическая | Гранецентрированная кубическая |
|---|---|---|---|
| символ Пирсона | сП | CI | сФ |
| Элементарная ячейка |  |  |  |
Примитивная кубическая решетка (cP) состоит из одной точки решетки на каждом углу куба; это означает, что каждая простая кубическая элементарная ячейка имеет в общей сложности одну точку решетки. Каждый атом в точке решетки затем делится поровну между восемью соседними кубами, и поэтому элементарная ячейка содержит в общей сложности один атом ( 1 ⁄ 8 × 8). [1]
Объемно-центрированная кубическая решетка (cI) имеет одну точку решетки в центре элементарной ячейки в дополнение к восьми угловым точкам. Она имеет чистую сумму из двух точек решетки на элементарную ячейку ( 1 ⁄ 8 × 8 + 1). [1]
Гранецентрированная кубическая решетка (cF) имеет точки решетки на гранях куба, каждая из которых дает ровно половинный вклад, в дополнение к угловым точкам решетки, что дает в общей сложности четыре точки решетки на элементарную ячейку ( 1 ⁄ 8 × 8 от углов плюс 1 ⁄ 2 × 6 от граней).
Гранецентрированная кубическая решетка тесно связана с гексагональной плотноупакованной (ГПУ) системой, где две системы отличаются только относительным расположением их гексагональных слоев. Плоскость [111] гранецентрированной кубической решетки представляет собой гексагональную сетку.
Попытка создать кубическую решетку с центром в основании (т. е. поместить дополнительную точку решетки в центр каждой горизонтальной грани) приводит к простой тетрагональной решетке Браве .
Координационное число (КЧ) — это число ближайших соседей центрального атома в структуре. [1] Каждая сфера в решетке cP имеет координационное число 6, в решетке cI — 8, а в решетке cF — 12.
Коэффициент атомной упаковки (APF) — это доля объема, занимаемая атомами. Решетка cP имеет APF около 0,524, решетка cI — APF около 0,680, а решетка cF — APF около 0,740.
Кристаллические классы
Названия классов изометрических кристаллических систем , точечные группы (в нотации Шёнфлиса , нотации Германа–Могена , орбифолда и нотации Коксетера ), тип, примеры, международные таблицы для кристаллографического номера пространственной группы [2] и пространственные группы перечислены в таблице ниже. Всего существует 36 кубических пространственных групп.
| Нет. | Группа точек | Тип | Пример | Космические группы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Имя [3] | Шён. | Международный | Шар. | Кокс. | Примитивный | Лицо-центрированный | Тело-центрированный | |||
| 195–197 | Тетартоидный | Т | 23 | 332 | [3,3] + | энантиоморфный | Ульманнит , Хлорат натрия | П23 | Ф23 | И23 |
| 198–199 | П2 1 3 | И2 1 3 | ||||||||
| 200–204 | Диплоидный | Т ч | 2/м 3 (м 3 ) | 3*2 | [3 + ,4] | центросимметричный | Пирит | Пм3, Пн 3 | Фм 3 , Фд 3 | Я 3 |
| 205–206 | Па 3 | Иа 3 | ||||||||
| 207–211 | Гироидальный | О | 432 | 432 | [3,4] + | энантиоморфный | Петцит | П432 , П4 2 32 | Ф432, Ф4 1 32 | И432 |
| 212–214 | П4 3 32, П4 1 32 | И4 1 32 | ||||||||
| 215–217 | Гекстетраэдрический | Т д | 4 3м | *332 | [3,3] | Сфалерит | П 4 3м | Ф43м | Я 4 3м | |
| 218–220 | П 4 3н | Ф 4 3с | Я 4 3д | |||||||
| 221–230 | Гексоктаэдрический | Ой | 4/м 3 2/м (м 3 м) | *432 | [3,4] | центросимметричный | Галена , Галит | Пм 3 м, Пн 3 н, Пм3н, Пн 3 м | Фм3м, Фм 3 с, Фд 3 м, Фд 3 с | Им 3 м, Иа 3 д |
Другие термины для гексаоктаэдра: нормальный класс, голоэдрический, дитессеральный центральный класс, тип галенита .
Одноэлементные конструкции

Как правило, поскольку атомы в твердом теле притягиваются друг к другу, более плотно упакованные расположения атомов, как правило, встречаются чаще. (Хотя встречаются и неплотно упакованные расположения, например, если орбитальная гибридизация требует определенных углов связи .) Соответственно, примитивная кубическая структура с особенно низким коэффициентом упаковки атомов встречается в природе редко, но встречается в полонии . [4] [ 5] ОЦК и ГЦК , с их более высокими плотностями, обе довольно распространены в природе. Примерами ОЦК являются железо , хром , вольфрам и ниобий . Примерами ГЦК являются алюминий , медь , золото и серебро .
Другая важная кубическая кристаллическая структура — это кубическая структура алмаза , которая может встречаться в углероде , кремнии , германии и олове . В отличие от fcc и bcc, эта структура не является решеткой, поскольку содержит несколько атомов в своей примитивной ячейке . Другие кубические элементарные структуры включают структуру A15, обнаруженную в вольфраме , и чрезвычайно сложную структуру марганца .
Многоэлементные конструкции
Соединения, состоящие из более чем одного элемента (например, бинарные соединения ), часто имеют кристаллические структуры, основанные на кубической кристаллической системе. Некоторые из наиболее распространенных из них перечислены здесь. Эти структуры можно рассматривать как две или более взаимопроникающих подрешеток, где каждая подрешетка занимает интерстициальные позиции других.
Структура хлорида цезия

Одна из структур — это «взаимопроникающая примитивная кубическая» структура, также называемая «структурой хлорида цезия» или структурой B2. Эту структуру часто путают с объемно-центрированной кубической структурой, поскольку расположение атомов одинаково. Однако структура хлорида цезия имеет основу, состоящую из двух различных видов атомов. В объемно-центрированной кубической структуре будет трансляционная симметрия вдоль направления [111]. В структуре хлорида цезия трансляция вдоль направления [111] приводит к изменению вида. Структуру также можно рассматривать как две отдельные простые кубические структуры, по одной каждого вида, которые наложены друг на друга. Угол куба хлорида является центром куба цезия, и наоборот. [6]

Это работает так же для структуры NaCl, описанной в следующем разделе. Если вы удалите атомы Cl, оставшиеся атомы Na все еще образуют структуру FCC, а не простую кубическую структуру.
В элементарной ячейке CsCl каждый ион находится в центре куба ионов противоположного вида, поэтому координационное число равно восьми. Центральный катион координируется с 8 анионами в углах куба, как показано, и аналогично центральный анион координируется с 8 катионами в углах куба. С другой стороны, можно рассматривать эту решетку как простую кубическую структуру с вторичным атомом в ее кубической пустоте .
Помимо самого хлорида цезия, эта структура также появляется в некоторых других галогенидах щелочных металлов , полученных при низких температурах или высоких давлениях. [7] Как правило, эта структура, скорее всего, образуется из двух элементов, ионы которых имеют примерно одинаковый размер (например, ионный радиус Cs + = 167 пм, а Cl − = 181 пм).
Пространственная группа структуры хлорида цезия (CsCl) называется Pm 3 m (в нотации Германа–Могена ), или «221» (в Международных таблицах кристаллографии). Обозначение Strukturbericht — «B2». [8]
Существует около сотни редкоземельных интерметаллических соединений , которые кристаллизуются в структуре CsCl, включая множество бинарных соединений редкоземельных элементов с магнием , [9] и элементами групп 11 , 12 , [10] [11] и 13. Другие соединения, демонстрирующие структуру, подобную хлориду цезия, — это CsBr , CsI , высокотемпературный RbCl , AlCo, AgZn, BeCu, MgCe, RuAl и SrTl. [ требуется ссылка ]
Каменно-соляная структура
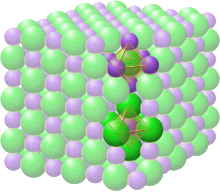
Пространственная группа структуры каменной соли или галита (хлорида натрия) обозначается как Fm 3 m (в нотации Германа–Могена ), или «225» (в Международных таблицах кристаллографии). Обозначение Strukturbericht — «B1». [12]
В структуре каменной соли каждый из двух типов атомов образует отдельную гранецентрированную кубическую решетку, причем две решетки взаимопроникают так, чтобы сформировать трехмерный шахматный узор. Структура каменной соли имеет октаэдрическую координацию : ближайшие соседи каждого атома состоят из шести атомов противоположного типа, расположенных как шесть вершин правильного октаэдра . В хлориде натрия соотношение атомов натрия и хлора составляет 1:1. Структуру также можно описать как решетку ГЦК натрия с хлором, занимающим каждую октаэдрическую пустоту , или наоборот. [6]
Примерами соединений с такой структурой являются сам хлорид натрия, а также почти все другие галогениды щелочных металлов и «многие оксиды, сульфиды, селениды и теллуриды двухвалентных металлов». [7] Согласно правилу соотношения радиусов , эта структура с большей вероятностью образуется, если катион несколько меньше аниона (соотношение радиусов катиона и аниона составляет от 0,414 до 0,732).
Межатомное расстояние (расстояние между катионом и анионом, или половина длины элементарной ячейки a ) в некоторых кристаллах со структурой каменной соли составляет: 2,3 Å (2,3 × 10−10 м ) для NaF [13] , 2,8 Å для NaCl [14] и 3,2 Å для SnTe [15] . Большинство гидридов и галогенидов щелочных металлов имеют структуру каменной соли, хотя некоторые имеют структуру хлорида цезия .
| Гидриды | Фториды | Хлориды | Бромиды | Иодиды | |
|---|---|---|---|---|---|
| Литий | Гидрид лития | Фторид лития [16] | Хлорид лития | Бромистый литий | Литий йодистый |
| Натрий | Гидрид натрия | Фторид натрия [16] | Хлорид натрия | Бромистый натрий | Йодид натрия |
| Калий | Гидрид калия | Фторид калия [16] | Хлорид калия | Бромистый калий | Йодид калия |
| Рубидий | Гидрид рубидия | Фторид рубидия | Хлорид рубидия | бромистый рубидий | Иодид рубидия |
| Цезий | Гидрид цезия | Фторид цезия | (Структура CsCl) | ||
| Оксиды | сульфиды | Селениды | Теллуриды | Полониды | |
|---|---|---|---|---|---|
| Магний | Оксид магния | Сульфид магния | Селенид магния [17] | Теллурид магния [18] | (структура NiAs) |
| Кальций | Оксид кальция | сульфид кальция | Селенид кальция [19] | Теллурид кальция | Полонид кальция [20] |
| Стронций | Оксид стронция | Сульфид стронция | Селенид стронция | Теллурид стронция | Полонид стронция [20] |
| Барий | Оксид бария | Сульфид бария | Селенид бария | Теллурид бария | Полонид бария [20] |
| Нитриды | Фосфиды | Арсениды | Антимониды | Висмутиды | |
|---|---|---|---|---|---|
| Скандий | Нитрид скандия | Фосфид скандия | Арсенид скандия [22] | Антимонид скандия [23] | Скандийвисмутид [24] |
| Иттрий | Нитрид иттрия | фосфид иттрия | Арсенид иттрия [25] | Антимонид иттрия | Висмутид иттрия [26] |
| Лантан | Нитрид лантана [27] | Фосфид лантана [28] | Арсенид лантана [25] | Антимонид лантана | Лантана висмутид [29] |
| Церий | Нитрид церия [27] | Фосфид церия [28] | Арсенид церия [25] | Антимонид церия | Висмутид церия [29] |
| Празеодим | Нитрид празеодима [27] | Фосфид празеодима [28] | Арсенид празеодима [25] | Антимонид празеодима [30] | Висмутид празеодима [29] |
| неодимовый | Нитрид неодима [27] | Фосфид неодима [28] | Арсенид неодима [25] | Антимонид неодима [30] | Висмутид неодима [29] |
| Прометий | ? | ? | ? | ? | ? |
| Самарий | Нитрид самария [27] | Фосфид самария [28] | Арсенид самария [25] | Самарий антимонид [30] | Самарий висмутид [29] |
| европий | Нитрид европия [27] | фосфид европия | ( Структура Na2O2 ) [ 31 ] | (нестабильный) [32] | |
| Гадолиний | Нитрид гадолиния [27] | Фосфид гадолиния | Арсенид гадолиния [25] | Антимонид гадолиния [30] | Гадолиний висмутид [29] |
| Тербий | Нитрид тербия [27] | фосфид тербия | Арсенид тербия [25] | Антимонид тербия [30] | Тербий висмутид [29] |
| Диспрозий | Нитрид диспрозия [27] | Фосфид диспрозия | Арсенид диспрозия | Антимонид диспрозия | Диспрозия висмутид [29] |
| Гольмий | Нитрид гольмия [27] | Фосфид гольмия | Арсенид гольмия [25] | Антимонид гольмия | Гольмий висмутид [29] |
| Эрбий | Нитрид эрбия [27] | фосфид эрбия | Арсенид эрбия [25] | Эрбий антимонид | Эрбий висмутид [29] |
| Тулий | Нитрид тулия [27] | Фосфид тулия | Арсенид тулия | Антимонид тулия | Тулий висмутид [29] |
| Иттербий | Нитрид иттербия [27] | Фосфид иттербия | Арсенид иттербия [25] | Антимонид иттербия | (нестабильный) [33] [34] |
| Лютеций | Нитрид лютеция [27] | Фосфид лютеция | Арсенид лютеция | Антимонид лютеция | Лютеций висмутид |
| Актиний | ? | ? | ? | ? | ? |
| Торий | Нитрид тория [35] | Фосфид тория [35] | Арсенид тория [35] | Антимонид тория [35] | (Структура CsCl) |
| Протактиний | ? | ? | ? | ? | ? |
| Уран | Нитрид урана [35] | Монофосфид урана [35] | Арсенид урана [35] | Антимонид урана [35] | Висмутид урана [36] |
| Нептуний | Нитрид нептуния | Фосфид нептуния | Арсенид нептуния | Антимонид нептуния | Висмутид нептуния [36] |
| Плутоний | Нитрид плутония [35] | Фосфид плутония [35] | Арсенид плутония [35] | Антимонид плутония [35] | Висмутид плутония [36] |
| Америций | Нитрид америция [36] | Фосфид америция [36] | Арсенид америция [36] | Антимонид америция [36] | Висмутид америция [36] |
| Кюрий | Нитрид кюрия [37] | Фосфид кюрия [37] | Арсенид кюрия [37] | Антимонид кюрия [37] | Кюрий висмутид [37] |
| Берклий | Нитрид берклия [37] | Фосфид берклия [37] | Арсенид берклия [37] | ? | Висмутид берклия [37] |
| калифорний | ? | ? | Арсенид калифорния [37] | ? | Калифорнийвисмутид [37] |
| Оксиды | сульфиды | Селениды | Теллуриды | Полониды | |
|---|---|---|---|---|---|
| Скандий | (нестабильный) [38] | Моносульфид скандия | |||
| Иттрий | Моносульфид иттрия [39] | ||||
| Лантан | Моносульфид лантана [40] | ||||
| Церий | Моносульфид церия [40] | Моноселенид церия [41] | Монотеллурид церия [41] | ||
| Празеодим | Моносульфид празеодима [40] | Моноселенид празеодима [41] | Монотеллурид празеодима [41] | ||
| неодимовый | Моносульфид неодима [40] | Моноселенид неодима [41] | Монотеллурид неодима [41] | ||
| Прометий | ? | ? | ? | ? | |
| Самарий | Моносульфид самария [40] | Самарий моноселенид | Монотеллурид самария | Самарий монополонид [42] | |
| европий | оксид европия | Моносульфид европия [40] | Моноселенид европия [43] | Монотеллурид европия [43] | Монополонид европия [42] |
| Гадолиний | (нестабильный) [38] | Моносульфид гадолиния [40] | |||
| Тербий | Моносульфид тербия [40] | Монополонид тербия [42] | |||
| Диспрозий | Моносульфид диспрозия [40] | Диспрозиймонополонид [42] | |||
| Гольмий | Моносульфид гольмия [40] | Монополонид гольмия [42] | |||
| Эрбий | Моносульфид эрбия [40] | ||||
| Тулий | Моносульфид тулия [40] | Монополонид тулия [42] | |||
| Иттербий | Окись иттербия | Моносульфид иттербия [40] | Монополонид иттербия [42] | ||
| Лютеций | (нестабильный) [38] [44] | Моносульфид лютеция [40] | Монополонид лютеция [42] | ||
| Актиний | ? | ? | ? | ? | |
| Торий | Моносульфид тория [35] | Моноселенид тория [35] | (Структура CsCl) [45] | ||
| Протактиний | ? | ? | ? | ? | |
| Уран | Моносульфид урана [35] | Моноселенид урана [35] | Монотеллурид урана [35] | ||
| Нептуний | Моносульфид нептуния | Моноселенид нептуния | Монотеллурид нептуния | ||
| Плутоний | Моносульфид плутония [35] | Моноселенид плутония [35] | Монотеллурид плутония [35] | ||
| Америций | Моносульфид америция [36] | Моноселенид америция [36] | Монотеллурид америция [36] | ||
| Кюрий | Моносульфид кюрия [37] | Моноселенид кюрия [37] | Монотеллурид кюрия [37] |
| Карбиды | Нитриды | |
|---|---|---|
| Титан | Карбид титана | Нитрид титана |
| Цирконий | Карбид циркония | Нитрид циркония |
| Гафний | Карбид гафния | Нитрид гафния [46] |
| Ванадий | Карбид ванадия | Нитрид ванадия |
| ниобий | Карбид ниобия | Нитрид ниобия |
| Тантал | Карбид тантала | (структура CoSn) |
| Хром | (нестабильный) [47] | Нитрид хрома |
Многие оксиды переходных металлов также имеют структуру каменной соли ( TiO , VO , CrO , MnO , FeO , CoO , NiO , CdO ). Ранние актиноидные монокарбиды также имеют эту структуру ( ThC , PaC, UC , NpC, PuC ). [37]
Структура флюорита
Подобно структуре каменной соли, структура флюорита (AB 2 ) также является структурой Fm 3 m , но имеет соотношение ионов 1:2. Структура антифлюорита почти идентична, за исключением того, что позиции анионов и катионов в структуре поменялись местами. Они обозначены как позиции Вайкоффа 4a и 8c, тогда как позиции структуры каменной соли — 4a и 4b. [48] [49]
Структура цинковой обманки

Пространственная группа структуры цинковой обманки называется F 4 3m (в нотации Германа–Могена ), или 216. [50] [51] Обозначение Strukturbericht — «B3». [52]
Структура цинковой обманки (также пишется «цинковая обманка») названа в честь минерала цинковой обманки ( сфалерита ), одной из форм сульфида цинка (β-ZnS). Как и в структуре каменной соли, два типа атомов образуют две взаимопроникающие гранецентрированные кубические решетки. Однако она отличается от структуры каменной соли тем, как две решетки расположены относительно друг друга. Структура цинковой обманки имеет тетраэдрическую координацию : ближайшие соседи каждого атома состоят из четырех атомов противоположного типа, расположенных как четыре вершины правильного тетраэдра . В сульфиде цинка соотношение цинка к сере составляет 1:1. [6] В целом, расположение атомов в структуре цинковой обманки такое же, как и в кубической структуре алмаза, но с чередующимися типами атомов в разных узлах решетки. Структуру также можно описать как решетку ГЦК цинка с атомами серы, занимающими половину тетраэдрических пустот , или наоборот. [6]
Примерами соединений с такой структурой являются сама цинковая обманка, нитрат свинца(II) , многие полупроводниковые соединения (такие как арсенид галлия и теллурид кадмия ) и широкий спектр других бинарных соединений. [ требуется ссылка ] Пниктогениды группы бора обычно имеют структуру цинковой обманки, хотя нитриды более распространены в структуре вюрцита , а их формы цинковой обманки являются менее известными полиморфами . [53] [54]
| Фториды | Хлориды | Бромиды | Иодиды | |
|---|---|---|---|---|
| Медь | Фторид меди(I) | Хлорид меди(I) | Бромид меди(I) | Иодид меди(I) |
| сульфиды | Селениды | Теллуриды | Полониды | |
|---|---|---|---|---|
| Бериллий | Сульфид бериллия | Селенид бериллия | Теллурид бериллия | Полонид бериллия [55] [56] |
| Цинк | Сульфид цинка | Селенид цинка | Теллурид цинка | Полонид цинка |
| Кадмий | Сульфид кадмия | Селенид кадмия | Теллурид кадмия | Кадмий полонид |
| Меркурий | сульфид ртути | Селенид ртути | Теллурид ртути | – |
Эта группа также известна как семейство соединений II-VI , большинство из которых могут быть получены как в форме цинковой обманки (кубической), так и в форме вюрцита (гексагональной).
| Нитриды | Фосфиды | Арсениды | Антимониды | |
|---|---|---|---|---|
| Бор | Нитрид бора * | Фосфид бора | Арсенид бора | Антимонид бора |
| Алюминий | Нитрид алюминия * | Фосфид алюминия | Арсенид алюминия | Антимонид алюминия |
| Галлий | Нитрид галлия * | Фосфид галлия | Арсенид галлия | Антимонид галлия |
| Индий | Нитрид индия * | фосфид индия | Арсенид индия | Антимонид индия |
Эта группа также известна как семейство соединений III-V .

Структура Гейслера
Структура Гейслера, основанная на структуре Cu 2 MnAl, является общей структурой для тройных соединений с участием переходных металлов . Она имеет пространственную группу Fm 3 m (№ 225), а обозначение Strukturbericht — L2 1 . Вместе с тесно связанными полу-Гейслеровыми и обратными-Хейслеровыми соединениями существуют сотни примеров.
Структура моносилицида железа

Пространственная группа структуры моносилицида железа — P2 1 3 (№ 198), а обозначение Strukturbericht — B20. Это хиральная структура, и иногда ее связывают с гелимагнитными свойствами. В элементарной ячейке содержится четыре атома каждого элемента, всего восемь атомов.
Примерами служат силициды и германиды переходных металлов, а также некоторые другие соединения, такие как палладид галлия .
| Силициды | Германиды | |
|---|---|---|
| Марганец | Моносилицид марганца | германид марганца |
| Железо | Моносилицид железа | Германид железа |
| Кобальт | Моносилицид кобальта | Германид кобальта |
| Хром | Силицид хрома(IV) | Германид хрома(IV) |
Структура Уэйра–Фелана

Структура Уэйра–Фелана имеет симметрию Pm 3 n (223).
Он имеет три ориентации сложенных тетрадекаэдров с пиритоэдрическими ячейками в зазорах. Он встречается как кристаллическая структура в химии , где его обычно называют « клатратной структурой типа I». Газовые гидраты, образованные метаном, пропаном и углекислым газом при низких температурах, имеют структуру, в которой молекулы воды лежат в узлах структуры Уэйра–Фелана и связаны водородными связями , а более крупные молекулы газа заключены в полиэдрические клетки.
Смотрите также
- Атомиум : здание, представляющее собой модель элементарной ячейки ОЦК с вертикальной диагональю тела.
- Плотная упаковка
- Вывихи
- Обратная решетка
Ссылки
- ^ abc De Wolff, PM; Belov, NV; Bertaut, EF; Buerger, MJ; Donnay, JDH; Fischer, W.; Hahn, Th.; Koptsik, VA; MacKay, AL; Wondratschek, H.; Wilson, AJC; Abrahams, SC (1985). "Номенклатура семейств кристаллов, типов решеток Браве и арифметических классов. Отчет Специального комитета Международного союза кристаллографии по номенклатуре симметрии". Acta Crystallographica Section A. 41 ( 3): 278. doi : 10.1107/S0108767385000587 .
- ^ Принс, Э., ред. (2006). Международные таблицы для кристаллографии . doi :10.1107/97809553602060000001. ISBN 978-1-4020-4969-9. S2CID 146060934.
- ^ Кристаллография и минералы, упорядоченные по форме кристаллов, Webmineral
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ↑ Первоначальное открытие было сделано в J. Chem. Phys. 14 , 569 (1946).
- ^ abcd "Кубические решетки и плотная упаковка". 3 октября 2013 г. Архивировано из оригинала 01.11.2020.
- ^ ab Seitz, Современная теория твердых тел (1940), стр.49
- ^ Структура CsCl (B2) Архивировано 15 сентября 2008 г. на Wayback Machine
- ^ Saccone, A.; Delfino, S.; Macció, D.; Ferro, R. (1993). «Фазовые диаграммы магний-редкоземельные элементы: экспериментальное исследование системы Ho-Mg». Journal of Phase Equilibria . 14 (3): 280–287. doi :10.1007/bf02668225. S2CID 95011597.
- ^ Канемату, К.; Т. Альфьери, Г.; Бэнкс, Э. (1969). «Магнитные исследования соединений редкоземельного цинка со структурой CsCl». Журнал Физического общества Японии . 26 (2): 244–248. Bibcode : 1969JPSJ...26..244K. doi : 10.1143/jpsj.26.244.
- ^ Бушоу, KHJ (1974). «Магнитные свойства редкоземельных соединений кадмия типа CsCl». Журнал химической физики . 61 (11): 4666–4670. Bibcode : 1974JChPh..61.4666B. doi : 10.1063/1.1681788.
- ^ Структура NaCl (B1) Архивировано 19 октября 2008 г. на Wayback Machine
- ^ Sundquist, JJ; Lin, CC (1981). «Электронная структура центра F в кристалле фторида натрия». Journal of Physics C: Solid State Physics . 14 (32): 4797–4805. Bibcode : 1981JPhC...14.4797S. doi : 10.1088/0022-3719/14/32/016.
- ^ Абрахамс, SC; Бернстайн, JL (1965). «Точность автоматического дифрактометра. Измерение структурных факторов хлорида натрия». Acta Crystallogr. 18 (5): 926–932. doi :10.1107/S0365110X65002244.
- ^ Као, В.; Перетти, Э. (1970). «Тройная подсистема Sn4As3-SnAs-SnTe». Журнал менее распространенных металлов . 22 : 39–50. doi :10.1016/0022-5088(70)90174-8.
- ^ abc J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, JP Cuer, «Соединения фтора, неорганические» (раздел 4) в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Weinheim, 2005. doi :10.1002/14356007.a11_307.
- ^ Брох, Эйнар (1927-06-01). «Präzisionsbestimmungen der Gitterkonstanten der Verbindungen MgO, MgS, MgSe, MnO и MnSe». Zeitschrift für Physikalische Chemie (на немецком языке). 127У (1): 446–454. дои : 10.1515/zpch-1927-12724. S2CID 100227546.
- ^ Мир, Шоукат Х.; Джа, Пракаш Ч.; Дабхи, Швета; Джа, Прафулла К. (2016). « Изучение ab initio фазовой стабильности, динамики решетки и термодинамических свойств халькогенидов магния». Химия и физика материалов . 175 : 54–61. doi :10.1016/j.matchemphys.2016.02.066.
- ^ Луай, Л.; Хаддади, К.; Мауш, Д.; Али Сахрауи, Ф.; Хашеми, А. (2008). «Электронная зонная структура селенида кальция под давлением». Physica B: Condensed Matter . 403 (18): 3022–3026. Bibcode : 2008PhyB..403.3022L. doi : 10.1016/j.physb.2008.03.009.
- ^ abc Brown, SA; Brown, PL (2019). Водная химия полония и практическое применение его термохимии. Elsevier Science. стр. 25. ISBN 978-0-12-819309-9.
- ^ Hulliger, F. (1979). "Глава 33 Редкоземельные пниктиды". Справочник по физике и химии редких земель . Том 4. Elsevier. С. 153–236. doi :10.1016/s0168-1273(79)04006-x. ISBN 9780444852168.
- ^ Gschneidner, KA; Calderwood, FW (1986). "Система As−Sc (мышьяк-скандий)". Бюллетень фазовых диаграмм сплавов . 7 (4): 348–349. doi :10.1007/bf02873011.
- ^ Хаяси, Дж.; Широтани, И.; Хирано, К.; Ишимацу, Н.; Шимомура, О.; Кикегава, Т. (2003). «Структурный фазовый переход ScSb и YSb со структурой типа NaCl при высоких давлениях». Solid State Communications . 125 (10): 543–546. Bibcode : 2003SSCom.125..543H. doi : 10.1016/s0038-1098(02)00889-x.
- ^ Хоровиц, CT (2012). Скандий, его местонахождение, химия, физика, металлургия, биология и технология. Elsevier Science. стр. 273. ISBN 978-0-323-14451-3.
- ^ abcdefghijk Оно, С.; Деспаулт, Дж. Г.; Калверт, Л. Д.; Тейлор, Дж. Б. (1970). «Арсениды редкоземельных элементов». Журнал менее распространенных металлов . 22 (1): 51–59. doi :10.1016/0022-5088(70)90175-x.
- ^ Шмидт, ФА; Макмастерс, О.Д.; Лихтенберг, Р.Р. (1969). «Система сплава иттрий-висмут». Журнал менее распространенных металлов . 18 (3): 215–220. doi :10.1016/0022-5088(69)90159-3.
- ^ abcdefghijklmn Натали, Ф.; Рак, Б. Дж.; Планк, НОВ; Тродаль, Х. Дж.; Гранвиль, С.; Мейер, К.; Ламбрехт, В. Р. Л. (2013). «Мононитриды редкоземельных элементов». Progress in Materials Science . 58 (8): 1316–1360. arXiv : 1208.2410 . doi :10.1016/j.pmatsci.2013.06.002. S2CID 118566136.
- ^ abcde Оно, С.; Номура, К.; Хаякава, Х. (1974). «Синтезы новых редкоземельных фосфидов». Журнал Less Common Metals . 38 (2–3): 119–130. doi :10.1016/0022-5088(74)90055-1.
- ^ abcdefghijk Ёсихара, К.; Тейлор, Дж. Б.; Калверт, Л. Д.; Деспо, Дж. Г. (1975). «Редкоземельные висмутиды». Журнал менее распространенных металлов . 41 (2): 329–337. doi :10.1016/0022-5088(75)90038-7.
- ^ abcde Hayashi, J.; Shirotani, I.; Tanaka, Y.; Adachi, T.; Shimomura, O.; Kikegawa, T. (2000). "Фазовые переходы LnSb (Ln=лантаноид) со структурой типа NaCl при высоких давлениях". Solid State Communications . 114 (11): 561–565. Bibcode :2000SSCom.114..561H. doi :10.1016/s0038-1098(00)00113-7.
- ^ Gschneidner, KA; Calderwood, FW (1986). "Система As−Eu (мышьяк-европий)". Бюллетень фазовых диаграмм сплавов . 7 (3): 279–283. doi :10.1007/bf02869009.
- ^ Тейлор, Дж. Б.; Калверт, Л. Д.; Ванг, И. (1979). «Порошковые данные для некоторых новых антимонидов и висмутидов европия». Журнал прикладной кристаллографии . 12 (2): 249–251. doi :10.1107/s0021889879012309.
- ^ Окамото, Х. (1999). «Би-Yb (висмут-иттербий)». Журнал фазовых равновесий . 20 (4): 453. дои : 10.1361/105497199770335640.
- ^ Дуань, Сюй; У, Фань; Чэнь, Цзя; Чжан, Пэйран; Лю, Ян; Юань, Хуэйцю; Цао, Чао (2018). "Настраиваемая электронная структура и топологические свойства LnPn (Ln=Ce, Pr, Sm, Gd, Yb; Pn=Sb, Bi)". Communications Physics . 1 (1): 71. arXiv : 1802.04554 . Bibcode :2018CmPhy...1...71D. doi : 10.1038/s42005-018-0074-8 .
- ^ abcdefghijklmnopqrst Кругер, OL; Мозер, JB (1967). "Константы решетки и точки плавления соединений актинидной группы IVA-VIA со структурами типа NaCl". Журнал физики и химии твердого тела . 28 (11): 2321–2325. Bibcode :1967JPCS...28.2321K. doi :10.1016/0022-3697(67)90257-0.
- ^ abcdefghijk Vogt, O.; Mattenberger, K. (1995). «Магнетизм локализованных или почти локализованных 4f и 5f оболочек». Журнал сплавов и соединений . 223 (2): 226–236. doi :10.1016/0925-8388(94)09005-x.
- ^ abcdefghijklmno Бенедикт, У.; Хольцапфель, В. Б. (1993). "Глава 113 Исследования при высоких давлениях — Структурные аспекты". Лантаниды/актиниды: Физика I. Справочник по физике и химии редкоземельных элементов. Том 17. Elsevier. С. 245–300. doi :10.1016/s0168-1273(05)80030-3. ISBN 9780444815026.
- ^ abc Leger, JM; Yacoubi, N.; Loriers, J. (1981). «Синтез редкоземельных монооксидов». Журнал химии твердого тела . 36 (3): 261–270. Bibcode : 1981JSSCh..36..261L. doi : 10.1016/0022-4596(81)90436-9.
- ^ Roedhammer, P.; Reichardt, W.; Holtzberg, F. (1978). «Поведение мягкого режима в дисперсии фононов YS». Physical Review Letters . 40 (7): 465–468. Bibcode : 1978PhRvL..40..465R. doi : 10.1103/physrevlett.40.465.
- ^ abcdefghijklmn Дидченко, Р.; Горцема, Ф.П. (1963). «Некоторые электрические и магнитные свойства редкоземельных моносульфидов и нитридов». Журнал физики и химии твердого тела . 24 (7): 863–870. Bibcode :1963JPCS...24..863D. doi :10.1016/0022-3697(63)90062-3.
- ^ abcdef Смоленский, ГА; Адамян, ВЕ; Логинов, ГМ (1968). «Антиферромагнитные свойства легких редкоземельных монохалькогенидов». Журнал прикладной физики . 39 (2): 786–790. Bibcode :1968JAP....39..786S. doi :10.1063/1.2163619.
- ^ abcdefgh Кершнер, CJ; ДеСандо, RJ; Гейдельберг, RF; Штайнмейер, RH (1966). «Редкоземельные полониды». Журнал неорганической и ядерной химии . 28 (8): 1581–1588. doi :10.1016/0022-1902(66)80054-4.
- ^ ab Wachter, P. (1972). «Оптические электрические и магнитные свойства халькогенидов европия и редкоземельных пниктидов». CRC Critical Reviews in Solid State Sciences . 3 (2): 189–241. doi :10.1080/10408437208244865.
- ^ Мейер, Г. (1991). Синтез соединений лантаноидов и актинидов . Дордрехт: Springer Netherlands. стр. 237. ISBN 978-94-011-3758-4. OCLC 840310000.
- ^ D'Eye, RWM; Sellman, PG (1954). «Система торий–теллур». J. Chem. Soc. : 3760–3766. doi :10.1039/jr9540003760.
- ^ Фридрих, Александра; Винклер, Бьёрн; Хуарес-Ареллано, Эрик А.; Баярджаргал, Лхамсурен (2011). «Синтез бинарных нитридов, карбидов и боридов переходных металлов из элементов в ячейке с лазерным нагревом алмазной наковальни и их соотношение структура-свойства». Материалы . 4 (10): 1648–1692. Bibcode : 2011Mate....4.1648F. doi : 10.3390/ma4101648 . PMC 5448873. PMID 28824101 .
- ^ Венкатраман, М.; Нойманн, Дж. П. (1990). «Система C-Cr (углерод-хром)». Бюллетень фазовых диаграмм сплавов . 11 (2): 152–159. doi :10.1007/bf02841701.
- ^ "Флюорит". aflow.org . Получено 2020-05-22 .
- ^ "Rock Salt". aflow.org . Получено 2020-05-22 .
- ^ Канторович, Л. (2004). Квантовая теория твердого тела. Springer. стр. 32. ISBN 1-4020-2153-4.
- ^ Биркбек-колледж, Лондонский университет
- ↑ Структура цинковой обманки (B3). Военно-морская исследовательская лаборатория, США. Архивировано 19 октября 2008 г., Wayback Machine
- ^ Wang, LD; Kwok, HS (2000). «Тонкие пленки кубического нитрида алюминия и нитрида галлия, полученные методом импульсного лазерного осаждения». Applied Surface Science . 154–155 (1–4): 439–443. Bibcode :2000ApSS..154..439W. doi :10.1016/s0169-4332(99)00372-4.
- ^ Осеки, Масааки; Окубо, Кана; Кобаяши, Ацуши; Охта, Дзицуо; Фудзиока, Хироши (2014). «Полевые транзисторы на основе кубического нитрида индия». Scientific Reports . 4 (1): 3951. Bibcode :2014NatSR...4E3951O. doi :10.1038/srep03951. PMC 3912472 . PMID 24492240.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press . стр. 899. ISBN 978-0-08-022057-4..
- ^ Мойер, Харви В. (1956). «Химические свойства полония». В Мойер, Харви В. (ред.). Полоний (отчет). Ок-Ридж, Теннесси: Комиссия по атомной энергии США. стр. 33–96. doi : 10.2172/4367751 . TID-5221..
Дальнейшее чтение
- Херлбат, Корнелиус С.; Кляйн, Корнелис, 1985, Руководство по минералогии , 20-е изд., Wiley, ISBN 0-471-80580-7
Внешние ссылки
- Моделирование JMol , проведенное Университетом Граца :
- Простая кубическая
- ВСС
- ФКС
- HCP
- Создание кристаллической структуры с помощью Molview