Карбид циркония
 | |
 | |
| Имена | |
|---|---|
| Другие имена Карбид циркония(IV) | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| Информационная карта ECHA | 100.031.920 |
| Номер ЕС |
|
CID PubChem |
|
| Номер RTECS |
|
| Номер ООН | 3178 |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| ZrC | |
| Молярная масса | 103,235 г·моль −1 |
| Появление | Серый огнеупорный твердый материал |
| Запах | Без запаха |
| Плотность | 6,73 г/см 3 (24 °C) [1] |
| Температура плавления | 3532–3540 °C (6390–6404 °F; 3805–3813 K) [1] [2] |
| Точка кипения | 5100 °C (9210 °F; 5370 K) [2] |
| Нерастворимый | |
| Растворимость | Растворим в концентрированных H 2 SO 4 , HF , [1] HNO 3 |
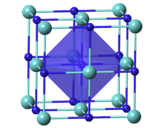
| Структура | |
| Кубический , cF8 [3] | |
| Фм 3 м, № 225 [3] | |
а = 4,6976(4) Å [3] α = 90°, β = 90°, γ = 90° | |
| Октаэдрический [3] | |
| Термохимия | |
Теплоемкость ( С ) | 37,442 Дж/моль·К [4] |
Стандартная молярная энтропия ( S ⦵ 298 ) | 33,14 Дж/моль·К [4] |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −207 кДж/моль (экстраполировано до стехиометрического состава) [5] −196,65 кДж/моль [4] |
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | Пирофорный |
| Маркировка СГС : | |
  [6] [6] | |
| Опасность | |
| Н228 , Н302 , Н312 , Н332 [6] | |
| П210 , П280 [6] | |
| NFPA 704 (огненный алмаз) | |
| Родственные соединения | |
Другие анионы | Нитрид циркония Оксид циркония |
Другие катионы | Карбид титана Карбид гафния Карбид ванадия Карбид ниобия Карбид тантала Карбид хрома Карбид молибдена Карбид вольфрама |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Карбид циркония ( Zr C ) — чрезвычайно твёрдый огнеупорный керамический материал, [7] коммерчески используемый в наконечниках режущих инструментов. Обычно его обрабатывают методом спекания .
Характеристики
| Коэффициенты теплового расширения ZrC [2] | |
|---|---|
| Т | α V |
| 100 °С | 0,141 |
| 200 °С | 0,326 |
| 400 °С | 0,711 |
| 800 °С | 1.509 |
| 1200 °С | 2.344 |
Он выглядит как серый металлический порошок с кубической кристаллической структурой . Он обладает высокой коррозионной стойкостью. Этот карбид переходного металла IV группы также является членом сверхвысокотемпературной керамики или (UHTC). Благодаря наличию металлических связей ZrC имеет теплопроводность 20,5 Вт/м·К и электропроводность (удельное сопротивление ~43 мкОм·см), обе из которых аналогичны показателям металлического циркония. Сильная ковалентная связь Zr-C придает этому материалу очень высокую температуру плавления (~3530 °C), высокий модуль (~440 ГПа) и твердость (25 ГПа). ZrC имеет более низкую плотность (6,73 г/см3 ) по сравнению с другими карбидами, такими как WC (15,8 г/см3 ) , TaC (14,5 г/см3 ) или HfC (12,67 г/см3 ) . ZrC, по-видимому, подходит для использования в возвращаемых аппаратах , ракетных / прямоточных воздушно-реактивных двигателях или сверхзвуковых аппаратах , в которых критически важными требованиями являются низкая плотность и способность выдерживать высокие температуры . [ необходима цитата ]
Как и большинство карбидов тугоплавких металлов , карбид циркония является субстехиометрическим, т. е. содержит вакансии углерода. При содержании углерода выше, чем приблизительно ZrC 0,98, материал содержит свободный углерод. [5] ZrC стабилен при соотношении углерода к металлу от 0,65 до 0,98.
Карбиды металлов группы IVA , TiC , ZrC и SiC , практически инертны к воздействию сильных водных кислот (HCl) и сильных водных оснований (NaOH) даже при 100° C, однако ZrC реагирует с HF.
Смесь карбида циркония и карбида тантала является важным металлокерамическим материалом. [ необходима цитата ]
Использует
Карбид циркония и карбид ниобия, не содержащие гафния , могут использоваться в качестве огнеупорных покрытий в ядерных реакторах . Из-за низкого сечения поглощения нейтронов и слабой чувствительности к повреждениям при облучении он находит применение в качестве покрытия частиц диоксида урана и диоксида тория ядерного топлива . Покрытие обычно наносится методом термического химического осаждения из паровой фазы в реакторе с псевдоожиженным слоем . Он также обладает высокой излучательной способностью и высокой токовой емкостью при повышенных температурах, что делает его перспективным материалом для использования в термофотоэлектрических радиаторах и наконечниках и решетках полевых эмиттеров. [ необходима цитата ]
Он также используется в качестве абразива , в плакировании , в металлокерамике , нитях накаливания и режущих инструментах. [ необходима ссылка ]
Производство
Карбид циркония может быть изготовлен несколькими способами. Один из методов — карботермическая реакция циркония с графитом. В результате получается порошок. Уплотненный ZrC затем может быть получен путем спекания порошка ZrC при температуре свыше 2000 °C. Горячее прессование ZrC может снизить температуру спекания и, следовательно, способствует получению мелкозернистого полностью уплотненного ZrC. Искровое плазменное спекание также использовалось для получения полностью уплотненного ZrC. [8]
Карбид циркония также может быть изготовлен методом обработки в растворе. [9] Это достигается путем кипячения оксида металла с ацетилацетоном.
Другим методом изготовления является химическое осаждение из паровой фазы. [10] Это достигается путем нагрева циркониевой губки и пропускания через нее галогенидного газа.
Низкая стойкость к окислению свыше 800 °C ограничивает применение ZrC. Одним из способов повышения стойкости ZrC к окислению является изготовление композитов. Важными предлагаемыми композитами являются композиты ZrC-ZrB 2 и ZrC-ZrB 2 -SiC. Эти композиты могут работать до 1800 °C. [ необходима цитата ] Другим методом улучшения является использование другого материала в качестве барьерного слоя, например, в топливных частицах TRISO.
Ссылки
- ^ abc Lide, David R., ред. (2009). CRC Handbook of Chemistry and Physics (90-е изд.). Бока-Ратон, Флорида : CRC Press . ISBN 978-1-4200-9084-0.
- ^ abc Перри, Дейл Л. (2011). Справочник по неорганическим соединениям (2-е изд.). CRC Press. стр. 472. ISBN 978-1-4398-1461-1.
- ^ abcd Кемптер, CP; Фрайз, RJ (1960). "Кристаллографические данные. 189. Карбид циркония". Аналитическая химия . 32 (4): 570. doi :10.1021/ac60160a042.
- ^ abc Карбид циркония в Linstrom, Peter J.; Mallard, William G. (ред.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Национальный институт стандартов и технологий, Гейтерсберг (Мэриленд) (получено 30 июня 2014 г.)
- ^ ab Baker, FB; Storms, EK; Holley, CE (1969). "Энтальпия образования карбида циркония". Journal of Chemical & Engineering Data . 14 (2): 244. doi :10.1021/je60041a034.
- ^ abc Sigma-Aldrich Co. , Карбид циркония (IV). Получено 30.06.2014.
- ^ Измерение и теория твердости карбидов переходных металлов, особенно карбида тантала. Шваб, ГМ; Кребс, А. Phys.-Chem. Inst., Univ. Muenchen, Munich, Fed. Rep. Ger. Planseeberichte fuer Pulvermetallurgie (1971), 19(2), 91-110
- ^ Вэй, Сялу; Бэк, Кристина; Ижванов, Олег; Хейнс, Кристофер; Олевский, Евгений (2016). «Карбид циркония, полученный методом искрового плазменного спекания и горячего прессования: кинетика уплотнения, рост зерна и термические свойства». Материалы . 9 ( 7): 577. Bibcode : 2016Mate....9..577W. doi : 10.3390/ma9070577 . PMC 5456903. PMID 28773697.
- ^ Сакс, Майкл Д.; Ван, Чан-Ан; Ян, Чжаохуэй; Джейн, Анубхав (2004). «Карботермический восстановительный синтез нанокристаллических порошков карбида циркония и карбида гафния с использованием прекурсоров, полученных из раствора». Журнал материаловедения . 39 (19): 6057–6066. Bibcode : 2004JMatS..39.6057S. doi : 10.1023/B:JMSC.0000041702.76858.a7. S2CID 94979802.
- ^ Yiguang Wang; Qiaomu Liu; Jinling Liu; Litong Zhang; Laifei Cheng (январь 2008 г.). «Механизм осаждения покрытий из карбида циркония методом химического осаждения из паровой фазы». Журнал Американского керамического общества . 91 (4): 1249–1252. doi :10.1111/j.1551-2916.2007.02253.x . Получено 27.12.2021 .



