бензойная кислота
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Бензойная кислота [1] | |||
| Систематическое название ИЮПАК Бензолкарбоновая кислота | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| 636131 | |||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Информационная карта ECHA | 100.000.562 | ||
| Номер ЕС |
| ||
| Номер E | E210 (консерванты) | ||
| 2946 | |||
| КЕГГ | |||
| МеШ | бензойная+кислота | ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| |||
| Характеристики | |||
| С7Н6О2 | |||
| Молярная масса | 122,123 г/моль | ||
| Появление | Бесцветное кристаллическое вещество. | ||
| Запах | Слабый, приятный запах | ||
| Плотность | 1,2659 г/см 3 (15 °C) 1,0749 г/см 3 (130 °C) [2] | ||
| Температура плавления | 122 °C (252 °F; 395 К) [7] | ||
| Точка кипения | 250 °C (482 °F; 523 К) [7] | ||
| 1,7 г/л (0 °C) 2,7 г/л (18 °C) 3,44 г/л (25 °C) 5,51 г/л (40 °C) 21,45 г/л (75 °C) 56,31 г/л (100 °C) [2] [3] | |||
| Растворимость | Растворим в ацетоне , бензоле , CCl4 , CHCl3 , спирте , этиловом эфире , гексане , фенилах , жидком аммиаке , ацетатах . | ||
| Растворимость в метаноле | 30 г/100 г (−18 °C) 32,1 г/100 г (−13 °C) 71,5 г/100 г (23 °C) [2] | ||
| Растворимость в этаноле | 25,4 г/100 г (−18 °C) 47,1 г/100 г (15 °C) 52,4 г/100 г (19,2 °C) 55,9 г/100 г (23 °C) [2] | ||
| Растворимость в ацетоне | 54,2 г/100 г (20 °C) [2] | ||
| Растворимость в оливковом масле | 4,22 г/100 г (25 °C) [2] | ||
| Растворимость в 1,4-диоксане | 55,3 г/100 г (25 °C) [2] | ||
| лог P | 1.87 | ||
| Давление пара | 0,16 Па (25 °C) 0,19 кПа (100 °C) 22,6 кПа (200 °C) [4] | ||
| Кислотность ( pK a ) |
| ||
| −70,28·10 −6 см 3 /моль | |||
Показатель преломления ( nD ) | 1,5397 (20 °С) 1,504 (132 °С) [2] | ||
| Вязкость | 1,26 мПа (130 °С) | ||
| Структура | |||
| Моноклинный | |||
| Плоский | |||
| 1,72 D в диоксане | |||
| Термохимия | |||
Теплоемкость ( С ) | 146,7 Дж/моль·К [4] | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 167,6 Дж/моль·К [2] | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −385,2 кДж/моль [2] | ||
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | −3228 кДж/моль [4] | ||
| Опасности | |||
| Охрана труда и техника безопасности (OHS/OSH): | |||
Основные опасности | Раздражающее | ||
| Маркировка СГС : | |||
  [8] [8] | |||
| Опасность | |||
| Н318 , Н335 [8] | |||
| П261 , П280 , П305+П351+П338 [8] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 121,5 °C (250,7 °F; 394,6 К) [7] | ||
| 571 °C (1060 °F; 844 K) [7] | |||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LD 50 ( средняя доза ) | 1700 мг/кг (крыса, перорально) | ||
| Паспорт безопасности (SDS) | Дж. Т. Бейкер | ||
| Родственные соединения | |||
Другие катионы | Бензоат натрия , Бензоат калия | ||
Родственные карбоновые кислоты | Гидроксибензойные кислоты Аминобензойные кислоты , Нитробензойные кислоты , Фенилуксусная кислота | ||
Родственные соединения | Бензальдегид , Бензиловый спирт , Бензоилхлорид , Бензиламин , Бензамид , Бензонитрил | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Бензойная кислота ( / b ɛ n ˈ z oʊ . ɪ k / ) — белое (или бесцветное) твёрдое органическое соединение с формулой C 6 H 5 COOH , структура которого состоит из бензольного кольца ( C 6 H 6 ) с карбоксильным ( −C(=O)OH ) заместителем . Бензоильная группа часто сокращается как «Bz» (не путать с «Bn», которое используется для бензила ), поэтому бензойную кислоту также обозначают как BzOH , поскольку бензоильная группа имеет формулу – C 6 H 5 CO . Это простейшая ароматическая карбоновая кислота. Название происходит от камеди бензоина , которая долгое время была её единственным источником.
Бензойная кислота встречается в природе во многих растениях [9] и служит промежуточным продуктом в биосинтезе многих вторичных метаболитов . Соли бензойной кислоты используются в качестве пищевых консервантов . Бензойная кислота является важным предшественником для промышленного синтеза многих других органических веществ. Соли и эфиры бензойной кислоты известны как бензоаты ( / ˈ b ɛ n z oʊ . eɪ t / ).
История
Бензойная кислота была открыта в шестнадцатом веке. Сухая перегонка камеди бензоина была впервые описана Нострадамусом (1556), а затем Алексиусом Педемонтаном (1560) и Блезом де Виженером (1596). [10]
Юстус фон Либих и Фридрих Вёлер определили состав бензойной кислоты. [11] Последние также исследовали, как гиппуровая кислота связана с бензойной кислотой.
В 1875 году Сальковский открыл противогрибковые свойства бензойной кислоты, что объясняет сохранение плодов морошки , содержащих бензоат . [12] [ оспаривается – обсудить ]
Производство
Промышленные препараты
Бензойная кислота производится в коммерческих целях путем частичного окисления толуола кислородом . Процесс катализируется нафтенатами кобальта или марганца . Процесс использует обильные материалы и протекает с высоким выходом. [ 13 ]
Первый промышленный процесс включал реакцию бензотрихлорида (трихлорметилбензола) с гидроксидом кальция в воде с использованием железа или солей железа в качестве катализатора . Полученный бензоат кальция преобразуется в бензойную кислоту с помощью соляной кислоты . Продукт содержит значительные количества хлорированных производных бензойной кислоты. По этой причине бензойная кислота для потребления человеком была получена путем сухой перегонки камеди бензоина . Пищевая бензойная кислота теперь производится синтетически.
Лабораторный синтез
Бензойная кислота дешева и легкодоступна, поэтому лабораторный синтез бензойной кислоты практикуется в основном из-за ее педагогической ценности. Это обычная подготовка студентов.
Бензойную кислоту можно очистить перекристаллизацией из воды из-за ее высокой растворимости в горячей воде и плохой растворимости в холодной воде. Избегание органических растворителей для перекристаллизации делает этот эксперимент особенно безопасным. Этот процесс обычно дает выход около 65%. [14]
Путем гидролиза
Как и другие нитрилы и амиды , бензонитрил и бензамид могут гидролизоваться до бензойной кислоты или ее сопряженного основания в кислых или основных условиях.
Из реактива Гриньяра
Бромбензол может быть преобразован в бензойную кислоту путем «карбоксилирования» промежуточного фенилмагнийбромида . [15] Этот синтез предлагает удобное упражнение для студентов по проведению реакции Гриньяра , важного класса реакций образования углерод-углеродной связи в органической химии. [16] [17] [18] [19] [20]
Окисление бензильных соединений
Бензиловый спирт [21] и бензилхлорид , а также практически все производные бензила легко окисляются до бензойной кислоты.
Использует
Бензойная кислота в основном расходуется на производство фенола путем окислительного декарбоксилирования при температуре 300−400 °C: [22]
- C 6 H 5 CO 2 H + ½ O 2 → C 6 H 5 OH + CO 2
Требуемая температура может быть снижена до 200 °C путем добавления каталитических количеств солей меди(II). Фенол может быть преобразован в циклогексанол , который является исходным материалом для синтеза нейлона .
Прекурсор пластификаторов
Бензоатные пластификаторы , такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаются путем переэтерификации метилбензоата соответствующим диолом . [22] Эти пластификаторы, которые используются аналогично тем, которые получены из эфира терефталевой кислоты , представляют собой альтернативу фталатам . [22]
Предшественник бензоата натрия и родственных консервантов
Бензойная кислота и ее соли используются в качестве пищевых консервантов , представленных номерами E210 , E211 , E212 и E213 . Бензойная кислота подавляет рост плесени , дрожжей [23] и некоторых бактерий . Она либо добавляется напрямую, либо создается в результате реакций с ее натриевой , калиевой или кальциевой солью . Механизм начинается с поглощения бензойной кислоты клеткой. Если внутриклеточный pH изменяется до 5 или ниже, анаэробная ферментация глюкозы через фосфофруктокиназу снижается на 95%. Таким образом, эффективность бензойной кислоты и бензоата зависит от pH пищи. [24] Бензойная кислота, бензоаты и их производные используются в качестве консервантов для кислых продуктов и напитков, таких как соки цитрусовых фруктов ( лимонная кислота ), газированные напитки ( углекислый газ ), безалкогольные напитки ( фосфорная кислота ), соленья ( уксус ) и другие подкисленные продукты.
Типичные концентрации бензойной кислоты в качестве консерванта в пищевых продуктах составляют от 0,05 до 0,1%. Пищевые продукты, в которых может использоваться бензойная кислота, и максимальные уровни ее применения контролируются местными законами о пищевых продуктах. [25] [26]
Высказывается обеспокоенность тем, что бензойная кислота и ее соли могут реагировать с аскорбиновой кислотой (витамином С) в некоторых безалкогольных напитках, образуя небольшие количества канцерогенного бензола . [27]
Лекарственный
Бензойная кислота входит в состав мази Уитфилда , которая используется для лечения грибковых заболеваний кожи, таких как стригущий лишай и грибок стопы . [28] [29] Как основной компонент бензойной смолы , бензойная кислота также является основным ингредиентом как настойки бензоина, так и бальзама Фрайара. Такие продукты имеют долгую историю использования в качестве местных антисептиков и ингаляционных противоотечных средств .
Бензойная кислота использовалась как отхаркивающее , обезболивающее и антисептическое средство в начале 20-го века. [30]
Нишевое и лабораторное применение
В учебных лабораториях бензойная кислота является общепринятым стандартом для калибровки бомбового калориметра . [31]
Биология и влияние на здоровье
Бензойная кислота встречается в природе, как и ее эфиры, во многих видах растений и животных. Значительные количества обнаружены в большинстве ягод (около 0,05%). Спелые плоды нескольких видов Vaccinium (например, клюква , V. vitis macrocarpon ; черника , V. myrtillus ) содержат до 0,03–0,13% свободной бензойной кислоты. Бензойная кислота также образуется в яблоках после заражения грибком Nectria galligena . Среди животных бензойная кислота была обнаружена в основном у всеядных или фитофагических видов, например, во внутренних органах и мышцах тундряной куропатки ( Lagopus muta ), а также в железистых выделениях самцов овцебыков ( Ovibos moschatus ) или азиатских слонов-самцов ( Elephas maximus ). [32] Бензоиновая камедь содержит до 20% бензойной кислоты и 40% эфиров бензойной кислоты. [33]
С точки зрения биосинтеза , бензоат производится в растениях из коричной кислоты . [34] Был выявлен путь из фенола через 4-гидроксибензоат . [35]
Реакции
Реакции бензойной кислоты могут происходить как по ароматическому кольцу , так и по карбоксильной группе .
Ароматическое кольцо
Реакция электрофильного ароматического замещения будет происходить в основном в 3-м положении из-за электроноакцепторной карбоксильной группы ; т.е. бензойная кислота является мета- направленной . [36]
Карбоксильная группа
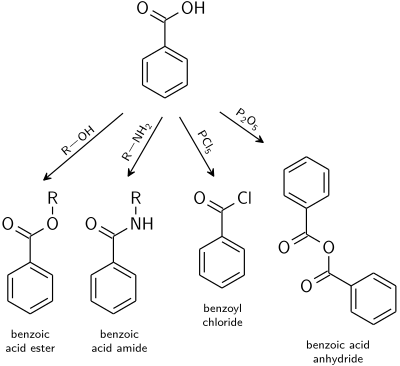
Реакции, типичные для карбоновых кислот, применимы и к бензойной кислоте. [22]
- Эфиры бензойной кислоты являются продуктом реакции со спиртами, катализируемой кислотой .
- Амиды бензойной кислоты обычно получают из бензоилхлорида .
- Дегидратация до бензойного ангидрида осуществляется уксусным ангидридом или пентоксидом фосфора .
- Высокореакционноспособные производные кислот, такие как галогенангидриды, легко получаются путем смешивания с галогенирующими агентами, такими как хлориды фосфора или тионилхлорид .
- Ортоэфиры можно получить реакцией спиртов в кислых условиях без воды с бензонитрилом .
- Восстановление до бензальдегида и бензилового спирта возможно с использованием DIBAL-H , LiAlH4 или борогидрида натрия .
- Декарбоксилирование до бензола можно осуществить нагреванием в хинолине в присутствии солей меди. Декарбоксилирование по Хунсдикеру можно осуществить нагреванием соли серебра.
Безопасность и метаболизм млекопитающих
Выводится из организма в виде гиппуровой кислоты . [37] Бензойная кислота метаболизируется бутират-КоА-лигазой в промежуточный продукт, бензоил-КоА , [38] который затем метаболизируется глицин- N -ацилтрансферазой в гиппуровую кислоту. [39] Люди метаболизируют толуол , который также выводится из организма в виде гиппуровой кислоты. [40]
Для людей Международная программа по химической безопасности Всемирной организации здравоохранения (МПХБ) предполагает, что предварительная допустимая доза составит 5 мг/кг веса тела в день. [32] Кошки имеют значительно более низкую толерантность к бензойной кислоте и ее солям , чем крысы и мыши . Летальная доза для кошек может составлять всего 300 мг/кг веса тела. [41] Оральная LD 50 для крыс составляет 3040 мг/кг, для мышей — 1940–2263 мг/кг. [32]
В Тайбэе , Тайвань, исследование здоровья города в 2010 году показало, что 30% сушеных и маринованных пищевых продуктов содержали бензойную кислоту. [42]
Смотрите также
- Никотиновая кислота – органическое соединение и форма витамина B3.
Ссылки
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга) . Кембридж: Королевское химическое общество . 2014. стр. 745. doi :10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ abcdefghij "бензойная кислота". chemister.ru . Получено 24 октября 2018 г. .
- ^ Сейделл, Атертон; Линке, Уильям Ф. (1952). Растворимость неорганических и органических соединений. Ван Ностранд.
- ^ abc Benzoic acid в Linstrom, Peter J.; Mallard, William G. (ред.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Национальный институт стандартов и технологий, Гейтерсберг (Мэриленд) (получено 23 мая 2014 г.)
- ^ Харрис, Дэниел (2010). Количественный химический анализ (8-е изд.). Нью-Йорк: WH Freeman and Company. стр. AP12. ISBN 9781429254366.
- ^ Олмстед, Уильям Н.; Бордвелл, Фредерик Г. (1980). «Константы ассоциации ионных пар в диметилсульфоксиде». Журнал органической химии . 45 (16): 3299– 3305. doi :10.1021/jo01304a033.
- ^ abcd Запись в базе данных веществ GESTIS Института охраны труда и здоровья
- ^ abc Sigma-Aldrich Co. , Бензойная кислота. Получено 23.05.2014.
- ^ «Ученые раскрывают последние шаги в создании бензойной кислоты в растениях». Purdue Agriculture News.
- ^ Ноймюллер О.А. (1988). Römpps Chemie-Lexikon (6-е изд.). Штутгарт: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- ^ Либих Дж ; Велер Ф (1832). «Untersuchungen über das Radikal der Benzoesäure». Аннален дер Хими . 3 (3): 249–282 . doi :10.1002/jlac.18320030302. hdl : 2027/hvd.hxdg3f .
- ^ Салковский Э (1875). Берл Клин Вохеншр . 12 : 297–298 .
{{cite journal}}: Отсутствует или пусто|title=( помощь ) - ^ Уэйд, Лерой Г. (2014). Органическая химия (Pearson new international ed.). Харлоу: Pearson Education Limited. стр. 985. ISBN 978-1-292-02165-2.
- ^ DD Perrin; WLF Armarego (1988). Очистка лабораторных химикатов (3-е изд.). Pergamon Press. стр. 94. ISBN 978-0-08-034715-8.
- ^ Дональд Л. Павиа (2004). Введение в органические лабораторные методы: подход в малых масштабах . Thomson Brooks/Cole. стр. 312–314 . ISBN 978-0-534-40833-6.
- ^ Ширли, ДА (1954). «Синтез кетонов из галогенидов кислот и металлоорганических соединений магния, цинка и кадмия». Org. React. 8 : 28–58 .
- ^ Huryn, DM (1991). "Карбанионы щелочных и щелочноземельных катионов: (ii) Селективность реакций присоединения карбонила". В Trost, BM ; Fleming, I. (ред.). Comprehensive Organic Synthesis, Volume 1: Additions to C—X π-Bonds, Part 1 . Elsevier Science . стр. 49–75 . doi :10.1016/B978-0-08-052349-1.00002-0. ISBN 978-0-08-052349-1.
- ^ "Реакция Гриньяра. Приготовление бензойной кислоты" (PDF) . Portland Community College. Архивировано из оригинала (PDF) 26 февраля 2015 г. . Получено 12 марта 2015 г. .>
- ^ "Эксперимент 9: Синтез бензойной кислоты с помощью карбонилирования реактива Гриньяра" (PDF) . Университет Висконсин-Мэдисон. Архивировано из оригинала (PDF) 23 сентября 2015 г. . Получено 12 марта 2015 г. .
- ^ "Эксперимент 3: Приготовление бензойной кислоты" (PDF) . Университет Тоусона. Архивировано из оригинала (PDF) 13 апреля 2015 г. . Получено 12 марта 2015 г. .>
- ^ Сантонастасо, Марко; Фрикли, Саймон Дж.; Медзяк, Питер Дж.; Бретт, Джемма Л.; Эдвардс, Дженнифер К.; Хатчингс, Грэм Дж. (21 ноября 2014 г.). «Окисление бензилового спирта с использованием in situ полученной перекиси водорода». Organic Process Research & Development . 18 (11): 1455– 1460. doi :10.1021/op500195e. ISSN 1083-6160.
- ^ abcd Маки, Такао; Такеда, Казуо (2000). "Бензойная кислота и ее производные". Энциклопедия промышленной химии Ульмана . Weinheim: Wiley-VCH. doi :10.1002/14356007.a03_555. ISBN 978-3527306732..
- ^ AD Warth (1 декабря 1991 г.). «Механизм действия бензойной кислоты на Zygosaccharomyces bailii: влияние на уровни гликолитических метаболитов, выработку энергии и внутриклеточный pH». Appl Environ Microbiol . 57 (12): 3410– 4. Bibcode : 1991ApEnM..57.3410W. doi : 10.1128/AEM.57.12.3410-3414.1991. PMC 183988. PMID 1785916.
- ^ Pastrorova I, de Koster CG, Boom JJ (1997). "Аналитическое исследование свободных и связанных эфиров бензойных и коричных кислот смол бензойной смолы методом ГХ-МС ВЭЖХ-фритт FAB-MS". Phytochem Anal . 8 (2): 63– 73. doi :10.1002/(SICI)1099-1565(199703)8:2<63::AID-PCA337>3.0.CO;2-Y.
- ^ Подробности группы GSFA Online Food Additive Group: Бензоаты (2006) Архивировано 26 сентября 2007 г. на Wayback Machine
- ^ ДИРЕКТИВА ЕВРОПЕЙСКОГО ПАРЛАМЕНТА И СОВЕТА № 95/2/EC от 20 февраля 1995 г. о пищевых добавках, кроме красителей и подсластителей (версии Consleg не содержат последних изменений в законе) Архивировано 19 апреля 2003 г. на Wayback Machine
- ^ "Указания на возможное образование бензола из бензойной кислоты в пищевых продуктах, экспертное заключение BfR № 013/2006" (PDF) . Немецкий федеральный институт оценки рисков. 1 декабря 2005 г. Архивировано (PDF) из оригинала 26 апреля 2006 г. . Получено 30 марта 2022 г. .
- ^ "Whitfield Ointment". Архивировано из оригинала 9 октября 2007 г. Получено 15 октября 2007 г.
- ^ Чарльз Оуэнс Уилсон; Оле Гисволд; Джон Х. Блок (2004). Учебник органических лекарственных и фармацевтических препаратов Уилсона и Гисволда . Липпинкотт Уильямс и Уилкинс. стр. 234. ISBN 978-0-7817-3481-3.
- ^ Лиллард, Бенджамин (1919). «Лекарственные таблетки бензойной кислоты». Практический аптекарь и фармацевтический обзор обзоров .
- ↑ Эксперимент 2: использование бомбовой калориметрии для определения резонансной энергии бензола. Архивировано 9 марта 2012 г. на Wayback Machine.
- ^ abc "Краткий международный документ по химической оценке 26: БЕНЗОЙНАЯ КИСЛОТА И БЕНЗОАТ НАТРИЯ".
- ^ Томокуни К, Огата М (1972). «Прямое колориметрическое определение гиппуровой кислоты в моче». Clin Chem . 18 (4): 349–351 . doi : 10.1093/clinchem/18.4.349 . PMID 5012256.
- ^ Vogt, T. (2010). «Биосинтез фенилпропаноидов». Molecular Plant . 3 : 2–20 . doi : 10.1093/mp/ssp106 . PMID 20035037.
- ^ Жуто, Пьер; Валери Коте; Мари-Франс Дакетт; Режан Боде; Франсуа Лепин; Ричард Виллемур; Жан-Ги Бисайон (январь 2005 г.). «Cryptanaerobacterphenolicus gen. nov., sp. nov., анаэроб, который превращает фенол в бензоат через 4-гидроксибензоат». Международный журнал систематической и эволюционной микробиологии . 55 (1): 245–250 . doi : 10.1099/ijs.0.02914-0 . ПМИД 15653882.
- ^ Брюстер, Р. К.; Уильямс, Б.; Филлипс, Р. (1955). "3,5-динитробензойная кислота". Органические синтезы; Собрание томов , т. 3, стр. 337.
- ^ Группа экспертов по обзору косметических ингредиентов Бинду Наир (2001). «Окончательный отчет по оценке безопасности бензилового спирта, бензойной кислоты и бензоата натрия». Int J Tox . 20 (Suppl. 3): 23– 50. doi :10.1080/10915810152630729. PMID 11766131. S2CID 13639993.
- ^ «Бутират-КоА-лигаза». БРЕНДА . Технический университет Брауншвейга . Проверено 7 мая 2014 г.Субстрат/Продукт
- ^ «глицин-N-ацилтрансфераза» . БРЕНДА . Технический университет Брауншвейга . Проверено 7 мая 2014 г.Субстрат/Продукт
- ^ Krebs HA, Wiggins D, Stubbs M (1983). «Исследования механизма противогрибкового действия бензоата». Biochem J . 214 (3): 657– 663. doi :10.1042/bj2140657. PMC 1152300 . PMID 6226283.
- ^ Бедфорд ПГ, Кларк ЭГ (1972). «Экспериментальное отравление кошек бензойной кислотой». Vet Rec . 90 (3): 53–58 . doi :10.1136/vr.90.3.53 (неактивен 1 ноября 2024 г.). PMID 4672555. S2CID 2553612.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка ) - ^ Чэнь, Цзянь; Й. Л. Као (18 января 2010 г.). «Почти 30% сушеных, маринованных продуктов не проходят проверки безопасности». The China Post .
Внешние ссылки
- Международная карта химической безопасности 0103
- Первоначальный отчет об оценке SIDS для бензойной кислоты от Организации экономического сотрудничества и развития (ОЭСР)
- ChemicalLand