Ареколин
 | |
 | |
| Клинические данные | |
|---|---|
| Другие имена | Арекалин; Арехолин; Ареколин; Основание ареколина; Ареколин; Метиларекаидин |
| код АТС |
|
| Правовой статус | |
| Правовой статус |
|
| Идентификаторы | |
| |
| Номер CAS | |
| CID PubChem |
|
| ИУФАР/БПС |
|
| DrugBank | |
| ChemSpider | |
| УНИИ |
|
| КЕГГ | |
| ЧЭБИ | |
| ChEMBL | |
| Панель инструментов CompTox ( EPA ) |
|
| Информационная карта ECHA | 100.000.514 |
| Химические и физические данные | |
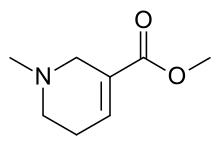
| Формула | С8Н13Н2 |
| Молярная масса | 155,197 г·моль −1 |
| 3D модель ( JSmol ) |
|
| Плотность | 1,0495 г/см 3 |
| Температура плавления | 27 °C (81 °F) |
| Точка кипения | 209 °C (408 °F) |
| |
 Н Н И (что это?) (проверить) И (что это?) (проверить) | |
Ареколин ( / ə ˈ rɛ k ə l iː n / ) — это слабый парасимпатомиметический стимулятор на основе никотиновой кислоты, содержащийся в орехе ареки , плоде пальмы арека ( Areca catechu ). [2] Это маслянистая жидкость без запаха. Он может вызывать чувство повышенной бдительности и энергии, а также легкие чувства эйфории и расслабления.
Химия
Ареколин является основанием , а его сопряженная кислота имеет pK a ~ 6,8. [3] Ареколин летуч в паре, смешивается с большинством органических растворителей и водой, но извлекается из воды эфиром в присутствии растворенных солей. Будучи основным, ареколин образует соли с кислотами. Соли кристаллические, но обычно расплывающиеся : гидрохлорид, ареколин•HCl, образует иглы, т. пл. 158 °C; [3] гидробромид, ареколин•HBr, образует тонкие призмы, т. пл. 177–179 °C из горячего метанола ; аурихлорид , ареколин•HAuCl 4 , представляет собой масло, но платинихлорид , ареколин 2 •H 2 PtCl 6 , т. пл. 176 °C, кристаллизуется из воды в оранжево-красные ромбоэдры. Метиодид образует блестящие призмы , т.пл. 173-174 °С.
Фармакология
Ареколин является основным активным ингредиентом, ответственным за эффекты ореха арека на центральную нервную систему. Ареколин сравнивают с никотином ; однако никотин агонизирует никотиновые ацетилхолиновые рецепторы , тогда как ареколин в первую очередь является частичным агонистом мускариновых ацетилхолиновых рецепторов , [4] [5] что приводит к его парасимпатическим эффектам. У лягушек ареколин также действует как антагонист (или очень слабый частичный агонист) на α4 и α6 -содержащих никотиновых ацетилхолиновых рецепторах и как молчаливый антагонист на α7 никотиновых рецепторах , что может объяснять его противовоспалительную активность. [6] Ареколин также ингибирует AMPK посредством генерации ROS в нескольких типах клеток. [7]
Нервная система
Ареколин способствует возбуждению у людей. Отдельные сообщения указывают на то, что он имеет кратковременный эффект против шизофрении. Среди пациентов мужского пола, страдающих шизофренией, более высокое потребление орехов арека связано с более слабыми симптомами. Это вдохновило на разработку ксаномелина (см. § Лекарственные препараты ниже). [8]
Он улучшает способность к обучению и память у грызунов. [9]
Сердечно-сосудистая система
AN (орех ареки) является вазодилататором, в основном из-за присутствия ареколина. Он также обладает антитромбозным и антиатерогенным эффектом, увеличивая оксид азота в плазме, eNos и экспрессию мРНК и уменьшая IL-8 наряду с другими понижающими регуляциями. [9]
Эндокринная система
Он повышает уровень тестостерона, стимулируя клетки Лейдига, а также уровни ФСГ и ЛГ. [10] [11] Он также активирует ось HPA и стимулирует высвобождение CRH. Он предотвращает дисфункцию В-клеток поджелудочной железы из-за высокого потребления фруктозы. [9]
Пищеварительная система
Ареколин обладает способностью стимулировать пищеварительную систему посредством активации мускариновых рецепторов . Водный экстракт ореха ареки может значительно усиливать сокращения гладких мышц желудка и мышечных полосок двенадцатиперстной кишки, подвздошной кишки и толстой кишки. Эта активность может быть вызвана ареколином. [9]
Ареколин парализует ленточных червей. [9]
Фармакокинетика
Ареколин метаболизируется как почками, так и печенью. [12] В настоящее время документировано 11 метаболитов ареколина, среди которых было обнаружено, что N-метилнипекотиновая кислота является основным метаболитом как ареколина, так и арекаидина . [13] Говорят, что известь, которую традиционно смешивают с измельченными орехами ареки перед употреблением, гидролизует почти весь ареколин до арекаидина , ингибитора обратного захвата ГАМК. [14] Арекаидин также образуется в процессе метаболизма ареколина в печени у крыс. [13]
Ареколин очень эффективно всасывается через оральную мусоку, с 85% биодоступностью. Максимальная концентрация в плазме достигается в течение 3 минут. [15]
Перорально принятый ареколин интенсивно метаболизируется у крыс, при этом большая часть дозы преобразуется в арекаидин и N -оксид ареколина. [16]
Использует
Во многих азиатских культурах орех арека жуют вместе с листьями бетеля для получения стимулирующего эффекта. [17]
Благодаря своим свойствам мускаринового и никотинового агониста ареколин продемонстрировал улучшение способности к обучению у здоровых добровольцев. Поскольку одним из признаков болезни Альцгеймера является снижение когнитивных способностей, ареколин был предложен в качестве лечения для замедления этого процесса. Ареколин, вводимый внутривенно, действительно показал скромное улучшение вербальной и пространственной памяти у пациентов с болезнью Альцгеймера, [18] хотя из-за возможных канцерогенных свойств ареколина (см. § Токсичность) он не является первым препаратом выбора для этого дегенеративного заболевания. [18]
Ареколин также использовался в медицине как противоглистное средство (препарат против паразитических червей). [19]
Токсичность
LD 50 : 100 мг/кг, подкожно вводится мышам. [3] Кроме того, минимальная летальная доза (MLD) ареколина для мышей, собак и лошадей составляет 100 мг/кг, 5 мг/кг и 1,4 мг/кг соответственно. [9]
Он вызывает оральный подслизистый фиброз , стимулируя коллаген, интерлейкин 6, фактор роста кератиноцитов-1, IGF-1, цистатин C, тканевой ингибитор матриксных металлопротеиназ во рту. Современная наука уверена, что жевание ореха арека является канцерогенным. Исследования показывают, что это, вероятно, по крайней мере частично из-за самого ареколина, хотя это может быть также из-за других компонентов ореха, некоторые из которых являются предшественниками нитрозаминов , которые образуются во рту во время жевания. Раздел 5.5 Оценка на странице 238 Монографии МАИР 85-6 гласит следующее: [20]
- [...]
- Имеются достаточные доказательства канцерогенности бетеля без табака у людей. Бетель без табака вызывает рак полости рта.
- Имеются достаточные доказательства канцерогенности бетельной жидкости без табака в экспериментах на животных.
- Имеются достаточные доказательства канцерогенности смеси бетеля с табаком в ходе экспериментов на животных.
- Имеются достаточные доказательства канцерогенности ореха арека на экспериментальных животных.
- Имеются достаточные доказательства канцерогенности ореха арека в сочетании с табаком в ходе экспериментов на животных.
- Имеются ограниченные данные о канцерогенности ареколина на экспериментальных животных.
- Нет достаточных данных о канцерогенности арекаидина в экспериментах на животных.
- [...]
Токсичность ареколина у мышей можно частично смягчить с помощью витаминов С и Е. [21]
Механизмы токсичности
Ареколин «явно цитотоксичен» по отношению к культурам гепатоцитов, клеток костного мозга, лимфоцитов, нейрональных клеток, миобластов и эндотелиальных клеток. [9]
Ареколин генерирует избыточное количество активных форм кислорода (ROS) в ряде типов клеток, включая эпителиальные клетки полости рта и нейрональные клетки. У взрослых мышей ареколин токсичен для яичек и печени через генерацию ROS. [9]
Ареколин также генотоксичен, поскольку способен вызывать повреждение ДНК и мутации в нескольких клеточных культурах. [9] У мышей, хронически подвергавшихся воздействию ареколина, наблюдается релаксация структуры хроматина . [22]
Синтез
Хотя в патентной литературе описан более старый метод [23] , он менее привлекателен, чем современные методы.

Этерификация по Фишеру никотиновой кислоты (ниацина) ( 1 ) дает метилникотинат ( 2 ). Алкилирование метилиодидом дает 3-метоксикарбонил-1-метилпиридинийиодид ( 3 ). Восстановление гидрида таким агентом, как боргидрид калия, дает тетрагидропиридин ( 4 ). Образование соли с HBr завершает синтез ( 5 ).

Двойная реакция Манниха между метиламином ( 1 ), ацетальдегидом ( 2 ) и формальдегидом ( 3 ) в присутствии гидрохлорида гидроксиламина , как предполагается, дала гидрохлорид оксима 1-метил-1,2,5,6-тетрагидропиридин-3-карбальдегида ( 4 ) в качестве продукта. Дегидратация альдоксима в нитрил происходит при обработке уксусным ангидридом, давая 3-циано-1-метил-1,2,5,6-тетрагидропиридин ( 5 ). Затем происходит взаимопревращение функциональных групп нитрила в метилкарбоксилатный эфир при кислотно-катализируемой обработке в метаноле, а затем преобразование в соль HBr завершает синтез.
Наркотики
Ареколин используется в синтезе следующих препаратов:
- Пароксетин [28] [29]
- Фемоксетин
- Нокаин
- Пиквиндон [30]
- PC10058081 ( тип эпибоксидина ).
- ФТ-0731096 [114724-56-0]
- Пайпер -Бразофензин [31]
- Пайпер -Тезофензин [32]
- БРН 0023391 [102206-67-7].
Ксаномелин , противошизоферный компонент в одобренном препарате ксаномелин/троспия хлорид , имеет структурное сходство с ареколином. [8]
Смотрите также
Ссылки
- ^ "Стандарт по ядам, октябрь 2020 г.". Федеральный реестр законодательства . Правительство Австралии. 30 сентября 2020 г.
- ^ Гелардини С., Галеотти Н., Лелли С., Бартолини А. (2001). «Активация рецептора М1 является необходимым условием для аналгезии ареколином». Фармако . 56 ( 5–7 ): 383–385 . doi :10.1016/S0014-827X(01)01091-6. HDL : 2158/327019 . ПМИД 11482763.
- ^ abc Windholz M (1983). Индекс Merck: энциклопедия химикатов, лекарств и биологических препаратов (10-е изд.). Rahway, NJ, USA: Merck & Co. стр. 113. ISBN 978-0-911910-27-8.
- ^ Фишер SK, Снайдер RM (июль 1987). «Требования к дифференциальной занятости рецепторов для мускариновой холинергической стимуляции гидролиза липидов инозитола в мозге и нейробластомах». Молекулярная фармакология . 32 (1): 81–90 . PMID 3600615.
- ^ Mei L, Lai J, Yamamura HI, Roeske WR (февраль 1991 г.). «Фармакологическое сравнение выбранных агонистов мускаринового рецептора M1 в трансфицированных клетках мышиных фибробластов (B82)». Журнал фармакологии и экспериментальной терапии . 256 (2): 689–694 . PMID 1704434.
- ^ Папке Р. Л., Хоренштейн Н. А., Стоукс К. (2015). «Никотиновая активность ареколина, психоактивного элемента «орехов бетеля», предполагает основу для привычного использования и противовоспалительной активности». PLOS ONE . 10 (10): e0140907. Bibcode : 2015PLoSO..1040907P. doi : 10.1371/journal.pone.0140907 . PMC 4619380. PMID 26488401. S2CID 7207479 .
- ^ Yen CY, Lin MH, Liu SY, Chiang WF, Hsieh WF, Cheng YC и др. (май 2011 г.). «Ингибирование протеинкиназы, активируемой AMP, посредством активных форм кислорода, опосредованное ареколином, необходимо для индукции апоптоза». Oral Oncology . 47 (5): 345–351 . doi :10.1016/j.oraloncology.2011.02.014. PMID 21440488.
- ^ ab Paul SM, Yohn SE, Popiolek M, Miller AC, Felder CC (сентябрь 2022 г.). «Агонисты мускариновых ацетилхолиновых рецепторов как новые методы лечения шизофрении». Американский журнал психиатрии . 179 (9): 611– 627. doi : 10.1176/appi.ajp.21101083. PMID 35758639. S2CID 250070840.
- ^ abcdefghi Liu YJ, Peng W, Hu MB, Xu M, Wu CJ (ноябрь 2016 г.). «Фармакология, токсикология и потенциальное применение ареколина: обзор». Pharmaceutical Biology . 54 (11): 2753– 2760. doi : 10.3109/13880209.2016.1160251 . PMID 27046150. S2CID 43564006.
- ^ Wang SW, Hwang GS, Chen TJ, Wang PS (август 2008 г.). «Влияние ареколина на высвобождение тестостерона у крыс». Американский журнал физиологии. Эндокринология и метаболизм . 295 (2): E497 – E504 . doi :10.1152/ajpendo.00045.2008. PMID 18559981.
- ^ Saha I, Das J, Maiti B, Chatterji U (2015). «Защитная роль гидробромида ареколина у самцов крыс с экспериментально вызванным диабетом». BioMed Research International . 2015 : 136738. doi : 10.1155/2015/136738 . PMC 4324734. PMID 25695047 .
- ^ Cox S, Ullah M, Zoellner H (январь 2016 г.). «Оральные и системные эффекты компульсивного использования орехов ареки для здоровья». В Preedy VR (ред.). Нейропатология наркомании и злоупотребления веществами; Том 3: Общие процессы и механизмы, Рецептурные препараты, Кофеин и арека, Полинаркомания, Новые зависимости и ненаркотические зависимости . Academic Press. стр. 785–793 . doi :10.1016/B978-0-12-800634-4.00078-0. ISBN 978-0-12-800634-4.
Животные модели показывают, что основными местами метаболизма ареколина являются печень (Giri et al., 2006; Nery, 1971) и почки (IARC, 2004).
- ^ ab Giri S, Idle JR, Chen C, Zabriskie TM, Krausz KW, Gonzalez FJ (июнь 2006 г.). «Метаболомный подход к метаболизму алкалоидов ореха арека ареколина и арекаидина у мышей». Chemical Research in Toxicology . 19 (6): 818– 827. doi :10.1021/tx0600402. PMC 1482804. PMID 16780361 .
- ^ Johnston GA, Krogsgaard-Larsen P, Stephanson A (декабрь 1975 г.). «Составные части ореха бетеля как ингибиторы поглощения гамма-аминомасляной кислоты». Nature . 258 (5536): 627– 628. Bibcode :1975Natur.258..627J. doi :10.1038/258627a0. PMID 1207742. S2CID 4147760.
- ^ Cox S, Ullah M, Zoellner H (2016). «Оральные и системные эффекты для здоровья компульсивного употребления орехов ареки». В Preedy VR (ред.). Neuropathology of Drug Addictions and Substance Misuse . стр. 785–793 . doi :10.1016/B978-0-12-800634-4.00078-0. ISBN 978-0-12-800634-4.
- ^ Pan H, Li Y, Huang L, Zhou X, Lu Y, Shi F (май 2018 г.). «Разработка и валидация быстрого метода ЖХ-МС/МС для одновременного количественного определения ареколина и его двух активных метаболитов в плазме крыс и его применение в фармакокинетическом исследовании». Журнал фармацевтического и биомедицинского анализа . 154 : 397– 403. doi : 10.1016/j.jpba.2018.03.033. PMID 29573735.
- ^ Gupta PC, Ray CS (июль 2004 г.). «Эпидемиология использования бетеля» (PDF) . Annals of the Academy of Medicine, Singapore . 33 (4 Suppl): 31– 36. doi :10.47102/annals-acadmedsg.V33N4p31S. PMID 15389304. Архивировано из оригинала (PDF) 2009-06-12.
- ^ ab Кристи Дж. Э., Шеринг А., Фергюсон Дж., Глен А.И. (январь 1981 г.). «Физостигмин и ареколин: эффекты внутривенных инфузий при пресенильной деменции Альцгеймера». Британский журнал психиатрии . 138 (1): 46–50 . doi :10.1192/bjp.138.1.46. PMID 7023592. S2CID 24009415.
- ^ Юсуф Х, Йонг СЛ (июль 2002 г.). «Оральный подслизистый фиброз у 12-летнего мальчика из Бангладеш: отчет о случае и обзор литературы». Международный журнал детской стоматологии . 12 (4): 271– 276. doi :10.1046/j.1365-263X.2002.00373.x. PMID 12121538.
- ^ Международное агентство по изучению рака (2005). Жевание бетеля и ореха ареки. Монография МАИР 85-6 (PDF) . МАИР. ISBN 978-92-832-1285-0.
- ^ Zhou J, Sun Q, Yang Z, Zhang J (апрель 2014 г.). «Гепатотоксичность и тестикулярная токсичность, вызванная ареколином у мышей, и защитные эффекты витаминов C и e». Корейский журнал физиологии и фармакологии . 18 (2): 143– 148. doi :10.4196/kjpp.2014.18.2.143. PMC 3994301. PMID 24757376 .
- ^ Saikia JR, Schneeweiss FH, Sharan RN (май 1999). «Изменения поли-АДФ-рибозилирования клеточных белков, вызванные ареколином, и его влияние на организацию хроматина». Cancer Letters . 139 (1): 59– 65. doi :10.1016/S0304-3835(99)00008-7. PMID 10408909.
- ↑ US 2506458, Howland KL, выданный 2 мая 1950 г., переданный Nopco Chemical Co.
- ^ Козелло ИА, Гашева АЮ, Хмелевский ВИ (ноябрь 1976). «Усовершенствование синтеза ареколина из никотиновой кислоты». Журнал фармацевтической химии . 10 (11): 1515– 1516. doi :10.1007/BF00760390.
- ^ Волгин АД, Баширзаде А, Амстиславская ТГ, Яковлев ОА, Демин КА, Хо ЙДж и др. (Май 2019). "DARK Classics in Chemical Neuroscience: Arecoline". ACS Chemical Neuroscience . 10 (5): 2176– 2185. doi :10.1021/acschemneuro.8b00711. PMID 30664352. S2CID 58554172.
- ^ CN 105439941, Liu N, Li J, Liu C, опубликовано 30 марта 2016 г., передано QINGDAO KANGYUAN PHARMACEUTICAL CO Ltd.
- ^ Козелло ИА, Хмелевский ВИ, Гашева АЮ, Бирбаева ГН (ноябрь 1979). «Усовершенствованный метод получения ареколина, исходя из ацетальдегида (обмен опытом)». Pharmaceutical Chemistry Journal . 13 (11): 1158– 1159. doi :10.1007/BF00778093.
- ^ Уорд; Нил, Процесс изготовления пароксетина, патент США 6,172,233 , 2001.
- ^ Уорд Нил, процесс получения 3-замещенных-4-арилпиперидиновых соединений, WO 0232870, 2002.
- ^ Коффен, Дэвид Л.; Хенгартнер, Урс; Катонак, Дэвид А.; Маллиган, Мэри Э.; Бердик, Дэвид К.; Олсон, Гэри Л.; Тодаро, Луис Дж. (1984). «Синтез антипсихотического пирроло[2,3-g]изохинолина из алкалоидов ареки». Журнал органической химии 49 (26): 5109–5113. doi:10.1021/jo00200a019.
- ^ Питер Молдт, Франк Ватьен и Йорген Шил-Крюгер, WO1998051668 (для NTG Nordic Transport Group AS).
- ^ Франк Ватьен и др. WO2004039778 (в NTG Nordic Transport Group AS).