Этилендиамин
 | |||
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Этан-1,2-диамин [2] | |||
| Другие имена Эдамин, [1] 1,2-диаминоэтан, «en», когда лиганд | |||
| Идентификаторы | |||
3D модель ( JSmol ) |
| ||
| Сокращения | ru | ||
| 605263 | |||
| ЧЭБИ | |||
| ChEMBL | |||
| ChemSpider | |||
| Информационная карта ECHA | 100.003.154 | ||
| Номер ЕС |
| ||
| 1098 | |||
| КЕГГ | |||
| МеШ | этилендиамин | ||
CID PubChem |
| ||
| Номер RTECS |
| ||
| УНИИ | |||
| Номер ООН | 1604 | ||
Панель инструментов CompTox ( EPA ) |
| ||
| |||
| Характеристики | |||
| С2Н8Н2 | |||
| Молярная масса | 60.100 г·моль −1 | ||
| Появление | Бесцветная жидкость [3] | ||
| Запах | Аммиачный [3] | ||
| Плотность | 0,90 г/см 3 [3] | ||
| Температура плавления | 8 °C (46 °F; 281 К) [3] | ||
| Точка кипения | 116 °C (241 °F; 389 K) [3] | ||
| смешивающийся | |||
| лог P | −2.057 | ||
| Давление пара | 1,3 кПа (при 20 °C) | ||
Константа закона Генри ( k H ) | 5,8 моль Па −1 кг −1 | ||
| |||
Показатель преломления ( nD ) | 1.4565 | ||
| Термохимия | |||
Теплоемкость ( С ) | 172,59 Дж К −1 моль −1 | ||
Стандартная молярная энтропия ( S ⦵ 298 ) | 202,42 Дж К −1 моль −1 | ||
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −63,55 до −62,47 кДж моль −1 | ||
Стандартная энтальпия сгорания (Δ c H ⦵ 298 ) | −1,8678 до −1,8668 МДж моль −1 | ||
| Опасности | |||
| Маркировка СГС : | |||
    | |||
| Опасность | |||
| Н226 , Н302 , Н311 , Н314 , Н317 , Н332 , Н334 , Н412 | |||
| Р101 , Р102 , Р260 , Р273 , Р280 , Р305+Р351+Р338 , Р308+Р313 , Р405 , Р501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 34 °C (93 °F; 307 К) [3] | ||
| 385 °C (725 °F; 658 К) [3] | |||
| Пределы взрывоопасности | 2,7–16% | ||
| Смертельная доза или концентрация (ЛД, ЛК): | |||
LD 50 ( средняя доза ) | 500 мг/кг (перорально, крыса) 470 мг/кг (перорально, морская свинка) 1160 мг/кг (перорально, крыса) [5] | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
PEL (допустимый) | TWA 10 частей на миллион (25 мг/м 3 ) [4] | ||
РЕЛ (рекомендуется) | TWA 10 частей на миллион (25 мг/м 3 ) [4] | ||
IDLH (Непосредственная опасность) | 1000 частей на миллион [4] | ||
| Родственные соединения | |||
Родственные алканоамины | 1,2-Диаминопропан , 1,3-Диаминопропан | ||
Родственные соединения | Этиламин , Этилендинитрамин | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Этилендиамин (сокращенно en , когда лиганд ) — органическое соединение с формулой C2H4 (NH2 ) 2 . Эта бесцветная жидкость с запахом, похожим на аммиак, является основным амином . Это широко используемый строительный блок в химическом синтезе, в 1998 году было произведено около 500 000 тонн . [6] Этилендиамин — первый член так называемых полиэтиленаминов .
Синтез
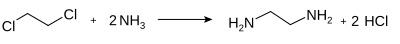
Этилендиамин получают в промышленности путем обработки 1,2-дихлорэтана аммиаком под давлением при 180 °C в водной среде: [6] [7]
В этой реакции образуется хлористый водород , который образует соль с амином. Амин высвобождается путем добавления гидроксида натрия и затем может быть извлечен фракционной перегонкой . Диэтилентриамин (ДЭТА) и триэтилентетрамин (ТЭТА) образуются в качестве побочных продуктов.
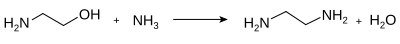
Другой промышленный путь получения этилендиамина включает реакцию этаноламина и аммиака: [8]
Этот процесс включает пропускание газообразных реагентов через слой никелевых гетерогенных катализаторов .
Его можно получить в лаборатории путем реакции этиленгликоля или этаноламина и мочевины с последующим декарбоксилированием промежуточного продукта этиленмочевины. [9]
Этилендиамин можно очистить обработкой гидроксидом натрия для удаления воды с последующей перегонкой. [10]
Приложения
Этилендиамин используется в больших количествах для производства многих промышленных химикатов. Он образует производные с карбоновыми кислотами (включая жирные кислоты ), нитрилами , спиртами (при повышенных температурах), алкилирующими агентами, сероуглеродом , альдегидами и кетонами . Благодаря своей бифункциональной природе, имея две аминогруппы, он легко образует гетероциклы, такие как имидазолидины .
Предшественник хелатирующих агентов, лекарств и агрохимикатов
Наиболее известным производным этилендиамина является хелатирующий агент ЭДТА , который получают из этилендиамина через синтез Штрекера с участием цианида и формальдегида . Гидроксиэтилэтилендиамин является еще одним коммерчески значимым хелатирующим агентом. [6] Многочисленные биоактивные соединения и препараты содержат связь N–CH 2 –CH 2 –N, включая некоторые антигистаминные препараты . [11] Соли этиленбисдитиокарбамата являются коммерчески значимыми фунгицидами под торговыми марками Maneb , Mancozeb, Zineb и Metiram. Некоторые имидазолинсодержащие фунгициды получают из этилендиамина. [6]
Фармацевтический ингредиент
Этилендиамин является ингредиентом в распространенном бронходилататорном препарате аминофиллине , где он служит для растворения активного ингредиента теофиллина . Этилендиамин также использовался в дерматологических препаратах, но был удален из некоторых из-за того, что вызывал контактный дерматит. [12] При использовании в качестве фармацевтического вспомогательного вещества после перорального приема его биодоступность составляет около 0,34 из-за существенного эффекта первого прохождения . Менее 20% выводится почками . [13]
Антигистаминные препараты , полученные из этилендиамина, являются старейшими из пяти классов антигистаминных препаратов первого поколения, начиная с пипероксана , также известного как бенодаин, открытого в 1933 году в Институте Пастера во Франции, а также включая мепирамин , трипеленнамин и антазолин . Другие классы являются производными этаноламина, алкиламина , пиперазина и других (в первую очередь трициклических и тетрациклических соединений, связанных с фенотиазинами , трициклическими антидепрессантами , а также семейством ципрогептадина - фениндамина )
Роль в полимерах
Этилендиамин, поскольку он содержит две аминогруппы, является широко используемым предшественником различных полимеров. Конденсаты, полученные из формальдегида, являются пластификаторами. Он широко используется в производстве полиуретановых волокон. Класс дендримеров ПАМАМ получен из этилендиамина. [6]
Тетраацетилэтилендиамин
Активатор отбеливания тетраацетилэтилендиамин образуется из этилендиамина. Производное N , N -этиленбис(стеарамид) (EBS) является коммерчески значимым средством для удаления форм и поверхностно-активным веществом в бензине и моторном масле.
Другие приложения
- как растворитель , он смешивается с полярными растворителями и используется для растворения белков, таких как альбумины и казеин . Он также используется в некоторых гальванических ваннах.
- в качестве ингибитора коррозии в красках и охлаждающих жидкостях .
- Этилендиаминдигидройодид (ЭДДИ) добавляется в корма для животных в качестве источника йодида.
- химикаты для проявки цветной фотографии , связующие вещества , клеи , кондиционеры для белья , отвердители для эпоксидных смол и красители .
- как соединение для сенсибилизации нитрометана во взрывчатое вещество. Эта смесь использовалась в Пикатинни-Арсенале во время Второй мировой войны, дав смеси нитрометана и этилендиамина прозвище PLX , или Пикатинни-жидкое взрывчатое вещество.
Координационная химия
Этилендиамин — хорошо известный бидентатный хелатирующий лиганд для координационных соединений , в котором два атома азота отдают свои неподеленные пары электронов, когда этилендиамин действует как лиганд. В неорганической химии его часто сокращают до «en». Комплекс [Co(en) 3 ] 3+ — хорошо изученный пример. Лиганды на основе Шиффа легко образуются из этилендиамина. Например, диамин конденсируется с 4-трифторметилбензальдегидом , давая диимин. [14] Лиганды сален , некоторые из которых используются в катализе, получаются в результате конденсации салициловых альдегидов и этилендиамина.
Родственные лиганды
Родственные производные этилендиамина включают этилендиаминтетрауксусную кислоту (ЭДТА) , тетраметилэтилендиамин (ТМЭДА) и тетраэтилэтилендиамин (ТЭЭДА). Хиральные аналоги этилендиамина включают 1,2-диаминопропан и транс -диаминоциклогексан .
Безопасность
Этилендиамин, как и аммиак и другие низкомолекулярные амины, является раздражителем кожи и дыхательных путей. Если его не герметично закрыть, жидкий этилендиамин будет выделять токсичные и раздражающие пары в окружающую среду, особенно при нагревании. Пары поглощают влагу из влажного воздуха, образуя характерный белый туман, который чрезвычайно раздражает кожу, глаза, легкие и слизистые оболочки.
Ссылки
- ^ "32007R0129". Европейский союз. 12 февраля 2007 г. Приложение II . Получено 3 мая 2012 г.
- ^ Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013. Королевское химическое общество . стр. 676. doi :10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ abcdefg Запись в базе данных веществ GESTIS Института охраны труда.
- ^ abc NIOSH Карманный справочник по химическим опасностям. "#0269". Национальный институт охраны труда и здоровья (NIOSH).
- ^ "Этилендиамин". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда (NIOSH).
- ^ abcde Эллер, Карстен; Хенкес, Эрхард; Россбахер, Роланд; Хёке, Хартмут (2005). «Амины алифатические». Амины Алифатические . Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH Verlag. дои : 10.1002/14356007.a02_001. ISBN 3-527-30673-0.
- ^ Арпе, Ханс-Юрген (2007). Industrielle Organische Chemie (6-е изд.). Вили ВЧ. п. 245.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Ханс-Юрген Арпе, Industrielle Organische Chemie, 6. Auflage (2007), Seite 275, Wiley VCH
- ^ Швейцер, Карл Э. (1950). «ЭТИЛЕНМОЧЕВИНА.II. Синтез из этиленгликоля или этаноламина и мочевины (или диоксида углерода и аммиака)». Журнал органической химии . Т. 15. С. 475–480 . doi :10.1021/jo01149a006.
- ^ Роллинсон, Карл Л.; Бейлар, Джон К. младший (1946). "Соли три(этилендиамин)хрома(III)". Неорганические синтезы . Том 2. С. 196–200 . doi :10.1002/9780470132333.ch60. ISBN 978-0-470-13233-3.
- ^ Котти, SRSS; Тиммонс, C.; Ли, G. (2006). «Вицинальные диаминофункциональные группы как привилегированные структурные элементы в биологически активных соединениях и использование их синтетической химии». Химическая биология и дизайн лекарств . 67 (2): 101– 114. doi :10.1111/j.1747-0285.2006.00347.x. PMID 16492158. S2CID 37177899.
- ^ Hogan DJ (январь 1990). «Аллергический контактный дерматит на этилендиамин. Продолжающаяся проблема». Dermatol Clin . 8 (1): 133– 6. doi :10.1016/S0733-8635(18)30536-9. PMID 2137392.
- ^ Zuidema, J. (1985-08-23). «Этилендиамин, профиль сенсибилизирующего вспомогательного вещества». Pharmacy World & Science . 7 (4): 134– 140. doi :10.1007/BF02097249. PMID 3900925. S2CID 11016366.
- ^ Хабиби, Мохаммад Хоссейн; Монтазерозохори, Мортеза; Лалегани, Араш; Харрингтон, Росс В.; Клегг, Уильям (2006). «Синтез, структурные и спектроскопические свойства нового лиганда основания Шиффа N,N′-бис(трифторметилбензилиден)этилендиамина». Журнал химии фтора . 127 (6): 769– 773. doi :10.1016/j.jfluchem.2006.02.014.
Внешние ссылки
 Медиа, связанные с этилендиамин на Wikimedia Commons
Медиа, связанные с этилендиамин на Wikimedia Commons
- IRIS EPA Этилендиамин
- CDC - Карманный справочник NIOSH по химическим опасностям
- Химические данные