Ацетат натрия
 | |
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК Ацетат натрия | |
| Систематическое название ИЮПАК Этаноат натрия | |
| Другие имена Горячий лед (тригидрат ацетата натрия) | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| 3595639 | |
| ХЭБИ | |
| ChEMBL | |
| ChemSpider | |
| DrugBank |
|
| Информационная карта ECHA | 100.004.386 |
| Номер ЕС |
|
| Номер E | E262 (консерванты) |
| 20502 | |
| КЕГГ |
|
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С2Н3NaО2 | |
| Молярная масса | 82,034 г·моль −1 |
| Появление | Белый расплывающийся порошок или кристаллы |
| Запах | Запах уксуса (уксусной кислоты) при нагревании до разложения [1] |
| Плотность | 1,528 г/см 3 (20 °C, безводный) 1,45 г/см 3 (20 °C, тригидрат) [2] |
| Температура плавления | 324 °C (615 °F; 597 K) (безводный) 58 °C (136 °F; 331 K) (тригидрат) |
| Точка кипения | 881,4 °C (1,618.5 °F; 1,154.5 K) (безводный) 122 °C (252 °F; 395 K) (тригидрат) разлагается |
| Безводный: 119 г/100 мл (0 °C) 123,3 г/100 мл (20 °C) 125,5 г/100 мл (30 °C) 137,2 г/100 мл (60 °C) 162,9 г/100 мл (100 °C) Тригидрат: 32,9 г/100 мл (-10 °C) 36,2 г/100 мл (0 °C) 46,4 г/100 мл (20 °C) 82 г/100 мл (50 °C) [3] | |
| Растворимость | Растворим в спирте , гидразине , SO2 [4 ] |
| Растворимость в метаноле | 16 г/100 г (15 °C) 16,55 г/100 г (67,7 °C) [4] |
| Растворимость в этаноле | Тригидрат: 5,3 г/100 мл |
| Растворимость в ацетоне | 0,5 г/кг (15 °C) [4] |
| Кислотность ( pK a ) | 24 (20 °C) [4] 4,75 (при смешивании с CH 3 COOH в качестве буфера) [5] |
| Основность (p K b ) | 9.25 |
| −37,6·10 −6 см 3 /моль | |
Показатель преломления ( nD ) | 1.464 |
| Структура | |
| Моноклинный | |
| Термохимия | |
Теплоемкость ( С ) | 100,83 Дж/(моль·К) (безводный) [6] 229 Дж/(моль·К) (тригидрат) [7] |
Стандартная молярная энтропия ( S ⦵ 298 ) | 138,1 Дж/(моль·К) (безводный) [6] 262 Дж/(моль·К) (тригидрат) [2] |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −709,32 кДж/моль (безводный) [4] −1604 кДж/моль (тригидрат) [2] |
Свободная энергия Гиббса (Δ f G ⦵ ) | −607,7 кДж/моль (безводный) [4] |
| Фармакология | |
| B05XA08 ( ВОЗ ) | |
| Опасности | |
| Охрана труда и техника безопасности (OHS/OSH): | |
Основные опасности | Раздражающее |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | >250 °C (482 °F; 523 К) [5] |
| 607 °C (1125 °F; 880 K) [5] | |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 3530 мг/кг (перорально, крыса) >10000 мг/кг (кролик, дермально) |
LC 50 ( средняя концентрация ) | >30 г/м 3 (крыса, 1 ч) |
| Паспорт безопасности (SDS) | Фишер Сайентифик |
| Родственные соединения | |
Другие анионы | Формиат натрия Пропионат натрия |
Другие катионы | Ацетат калия Ацетат кальция |
Родственные соединения | Диацетат натрия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Ацетат натрия , CH3COONa , также сокращенно NaOAc , [8] — натриевая соль уксусной кислоты . Эта соль бесцветна , расплывается и гигроскопична .
Приложения
Биотехнологический
Ацетат натрия используется в качестве источника углерода для культивирования бактерий . Ацетат натрия также может быть полезен для увеличения выхода выделения ДНК путем осаждения этанолом .
Промышленный
Ацетат натрия используется в текстильной промышленности для нейтрализации сернокислотных отходов, а также в качестве фоторезиста при использовании анилиновых красителей . Он также является травильным агентом при хромовом дублении и помогает препятствовать вулканизации хлоропрена в производстве синтетического каучука . Он также используется для снижения статического электричества при производстве одноразовых ватных дисков.
Долговечность бетона
Ацетат натрия используется для смягчения ущерба, наносимого бетону водой, действуя как герметик для бетона , при этом он также является экологически безопасным и более дешевым, чем обычно используемая эпоксидная альтернатива для герметизации бетона от проникновения воды . [9]
Еда
Ацетат натрия (безводный) широко используется в качестве агента, продлевающего срок годности, и агента, контролирующего pH. [10] Он безопасен для употребления в пищу в низкой концентрации. [11]
Буферный раствор
Раствор ацетата натрия (основная соль уксусной кислоты) и уксусной кислоты может действовать как буфер для поддержания относительно постоянного уровня pH. Это особенно полезно в биохимических приложениях, где реакции зависят от pH в слабокислом диапазоне (pH 4–6).
Электрогрелка

Ацетат натрия также используется в электрогрелках , грелках для рук и горячем льде. Пересыщенный раствор ацетата натрия в воде поставляется с устройством для инициирования кристаллизации, процесса, который выделяет значительное количество тепла.

Кристаллы тригидрата ацетата натрия плавятся при температуре 58–58,4 °C (136,4–137,1 °F), [12] [13] и жидкий ацетат натрия растворяется в выделившейся кристаллизационной воде . При нагревании выше точки плавления и последующем охлаждении водный раствор становится перенасыщенным . Этот раствор способен охлаждаться до комнатной температуры без образования кристаллов. При нажатии на металлический диск внутри грелки образуется центр зародышеобразования , в результате чего раствор снова кристаллизуется в твердый тригидрат ацетата натрия. Процесс кристаллизации является экзотермическим . [14] Скрытая теплота плавления составляет около 264–289 кДж/кг. [12] В отличие от некоторых типов тепловых пакетов, таких как те, которые зависят от необратимых химических реакций, тепловой пакет с ацетатом натрия можно легко использовать повторно, погрузив пакет в кипящую воду на несколько минут, пока кристаллы полностью не растворятся, и дав пакету медленно остыть до комнатной температуры. [15]
Подготовка

Для лабораторного использования ацетат натрия недорог и обычно покупается, а не синтезируется. Иногда его получают в лабораторном эксперименте путем реакции уксусной кислоты , обычно в 5–18% растворе, известном как уксус , с карбонатом натрия («стиральная сода»), бикарбонатом натрия («пищевая сода») или гидроксидом натрия («щелочь», или «едкий натр»). Любая из этих реакций производит ацетат натрия и воду. Когда в качестве реагента используется соединение, содержащее натрий и карбонат-ион, карбонат-анион из бикарбоната или карбоната натрия реагирует с водородом из карбоксильной группы (-COOH) в уксусной кислоте, образуя угольную кислоту . Угольная кислота легко разлагается при нормальных условиях на газообразный диоксид углерода и воду. Это реакция, происходящая в хорошо известном «вулкане», который возникает при смешивании бытовых продуктов, пищевой соды и уксуса.
- CH 3 COOH + NaHCO 3 → CH 3 COONa + H 2 CO
3 - Н2СО
3→ КО
2+ Н
2О
В промышленных масштабах тригидрат ацетата натрия получают путем взаимодействия уксусной кислоты с гидроксидом натрия с использованием воды в качестве растворителя .
- CH 3 COOH + NaOH → CH 3 COONa + H 2 O.
Для промышленного производства безводного ацетата натрия используется процесс Niacet. Слитки металлического натрия экструдируются через фильеру для формирования ленты металлического натрия , обычно в атмосфере инертного газа, например N2 , затем погружаются в безводную уксусную кислоту .
- 2 CH 3 COOH + 2 Na →2 CH 3 COONa + H 2 .
Водородный газ обычно является ценным побочным продуктом.
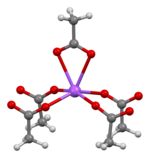
Структура
Кристаллическая структура безводного ацетата натрия описывается как чередующиеся слои карбоксилата натрия и метильной группы . [16] Структура тригидрата ацетата натрия состоит из искаженной октаэдрической координации в натрии. Соседние октаэдры делят ребра, образуя одномерные цепи. Водородные связи в двух измерениях между ионами ацетата и водой гидратации объединяют цепи в трехмерную сеть. [17] [18]
Реакции
Ацетат натрия можно использовать для образования эфира с алкилгалогенидом, таким как бромэтан :
- CH 3 COONa + BrCH 2 CH 3 → CH 3 COOCH 2 CH 3 + NaBr
Ацетат натрия подвергается декарбоксилированию с образованием метана (CH4 ) в форсированных условиях (пиролиз в присутствии гидроксида натрия):
- CH 3 COONa + NaOH → CH 4 + Na 2 CO 3
Типичным катализатором для этой реакции является оксид кальция. Соли цезия также катализируют эту реакцию. [ необходима цитата ]
Ссылки
- ^ "Ацетат натрия". Международные карты химической безопасности . Национальный институт охраны труда. 2018-09-18.
- ^ abc "тригидрат ацетата натрия". chemister.ru .
- ^ Сейделл, Атертон; Линке, Уильям Ф. (1952). Растворимость неорганических и органических соединений . Ван Ностранд.
- ^ abcdef "ацетат натрия". chemister.ru .
- ^ abc Sigma-Aldrich Co. , Ацетат натрия. Получено 07.06.2014.
- ^ ab Уксусная кислота, натриевая соль в Linstrom, Peter J.; Mallard, William G. (ред.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Национальный институт стандартов и технологий, Гейтерсберг (Мэриленд) (получено 25 мая 2014 г.).
- ^ Уксусная кислота, натриевая соль, гидрат (1:1:3) в Linstrom, Peter J.; Mallard, William G. (ред.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Национальный институт стандартов и технологий, Гейтерсберг (Мэриленд) (получено 25 мая 2014 г.).
- ^ Клейден, Джонатан ; Гривз, Ник; Уоррен, Стюарт ; Уотерс, Питер (2001). Органическая химия (1-е изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ "Ароматизатор картофельных чипсов увеличивает долговечность бетона". Science Daily . 8 августа 2007 г.
- ^ "Пищевая добавка "Ацетат натрия (безводный)"". Mitsubishi Chemical Corporation . Получено 16 сентября 2020 г. .
- ^ Mohammadzadeh-Aghdash, Hossein; Sohrabi, Yousef; Mohammadi, Ali; Shanehbandi, Dariush; Dehghan, Parvin; Ezzati Nazhad Dolatabadi, Jafar (15 августа 2018 г.). «Оценка безопасности пищевых добавок ацетата натрия, диацетата натрия и сорбата калия». Пищевая химия . 257 : 211– 215. doi :10.1016/j.foodchem.2018.03.020. ISSN 0308-8146. PMID 29622200. S2CID 4596295. Получено 16 сентября 2020 г.
- ^ ab Ибрагим Динсер и Марк А. Розен. Хранение тепловой энергии: системы и приложения, стр. 155.
- ^ Корти Ж.-М., Кирлик Э. (01 декабря 2008 г.). «Химические шоферы». Pour la Science (на французском языке). С. 108–110 .
- ^ "Кристаллизация пересыщенного ацетата натрия". Журнал химического образования . 2015-07-19.
- ^ "Как работают грелки с ацетатом натрия?". HowStuffWorks . Апрель 2000. Получено 03.09.2007 .
- ^ ab Hsu, Leh-Yeh; Nordman, CE (1983). "Структуры двух форм ацетата натрия, Na + .C 2 H 3 O 2 − ". Acta Crystallogr. C . 39 (6): 690– 694. Bibcode :1983AcCrC..39..690H. doi :10.1107/S0108270183005946.
- ^ ab Cameron, TS; Mannan, KM; Rahman, MO (1976). «Кристаллическая структура тригидрата ацетата натрия». Acta Crystallogr. B . 32 (1): 87– 90. Bibcode :1976AcCrB..32...87C. doi :10.1107/S0567740876002367.
- ^ ab Wei, K.-T.; Ward, DL (1977). «Тригидрат ацетата натрия: переопределение». Acta Crystallogr. B . 33 (2): 522– 526. Bibcode :1977AcCrB..33..522W. doi :10.1107/S0567740877003975.
Внешние ссылки
- Горячий лед – инструкции, фотографии и видео
- Как работают грелки с ацетатом натрия
- Лаварс, Ник (15.09.2021). «Ацетат натрия действует как потенциальный источник молодости для стареющих костей». Новый Атлас . Получено 16.09.2021 .