Хлорид ртути(I)
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Дихлорид диртути | |
| Другие имена | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ЧЭБИ | |
| ChemSpider | |
| Информационная карта ECHA | 100.030.266 |
| Номер ЕС |
|
| 25976 | |
CID PubChem |
|
| Номер RTECS |
|
| УНИИ | |
| Номер ООН | 3077 |
Панель инструментов CompTox ( EPA ) |
|
| |
| Характеристики | |
| Hg2Cl2 | |
| Молярная масса | 472,09 г/моль |
| Появление | Белое твердое вещество |
| Плотность | 7.150 г/см 3 |
| Температура плавления | 383 °C (721 °F; 656 K) (возгоняется) |
| 0,2 мг/100 мл | |
Произведение растворимости ( K sp ) | 1,43 × 10−18 [1 ] |
| Растворимость | нерастворим в этаноле , эфире |
| −26,0·10 −6 см 3 /моль | |
Показатель преломления ( nD ) | 1.973 |
| Структура | |
| четырехугольный | |
| Термохимия | |
Стандартная молярная энтропия ( S ⦵ 298 ) | 196 Дж·моль −1 ·К −1 [2] |
Стандартная энтальпия образования (Δ f H ⦵ 298 ) | −265 кДж·моль −1 [2] |
| Опасности | |
| Маркировка СГС : | |
  | |
| Предупреждение | |
| Х302 , Х315 , Х319 , Х335 , Х410 | |
| Р261 , Р264 , Р270 , Р271 , Р273 , Р280 , Р301+Р312 , Р302+Р352 , Р304+Р340 , Р305+Р351+Р338 , Р312 , Р321 , Р330 , Р332+Р313 , Р337+Р313 , Р362 , Р391 , Р403+Р233 , Р405 , Р501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (ЛД, ЛК): | |
LD 50 ( средняя доза ) | 210 мг/кг (крыса, перорально) [3] |
| Паспорт безопасности (SDS) | МКХС 0984 |
| Родственные соединения | |
Другие анионы | Фторид ртути(I) Бромид ртути(I) Йодид ртути(I) |
Родственные соединения | Хлорид ртути(II) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид ртути(I) — это химическое соединение с формулой Hg 2 Cl 2 . Также известный как минерал каломель [4] (редкий минерал) или хлорид ртути , это плотное белое или желтовато-белое твердое вещество без запаха является основным примером соединения ртути (I). Он является компонентом эталонных электродов в электрохимии . [5] [6]
История
Название каломель, как полагают, происходит от греческого καλός «красивый» и μέλας «черный»; или καλός и μέλι «мед» из-за его сладкого вкуса. [4] «Черное» название (несколько удивительное для белого соединения), вероятно, связано с его характерной реакцией диспропорционирования с аммиаком , которая дает эффектную черную окраску из-за образующейся тонкодисперсной металлической ртути . Его также называют минералом роговой ртутью или роговой ртутью . [4]
Каломель принимали внутрь и использовали как слабительное, [4] например, для лечения Георга III в 1801 году, и как дезинфицирующее средство, а также при лечении сифилиса, до начала 20-го века. До недавнего времени, [ когда? ] его также использовали как садовый фунгицид, в частности, для обработки корней, чтобы предотвратить появление килы среди культур семейства Brassicaceae . [7]
Ртуть стала популярным средством от различных физических и психических недугов в эпоху « героической медицины ». Она прописывалась врачами в Америке на протяжении всего XVIII века и во время революции, чтобы заставить пациентов срыгивать и освобождать свое тело от «нечистот». Бенджамин Раш был известным сторонником ртути в медицине и использовал каломель для лечения больных желтой лихорадкой во время ее вспышки в Филадельфии в 1793 году. Каломель давали пациентам как слабительное или катарсическое средство до тех пор, пока они не начинали выделять слюну, и часто ее давали пациентам в таких больших количествах, что у них выпадали волосы и зубы. [8]
Желтую лихорадку также лечили каломелью. [9]
Льюис и Кларк взяли с собой в экспедицию каломель. Исследователи использовали ту же ртуть, найденную глубоко в выгребных ямах, чтобы отследить местоположение своих соответствующих мест и лагерей. [10]
Характеристики
Ртуть является уникальной среди металлов 12-й группы по своей способности легко образовывать связь М–М. Hg 2 Cl 2 — линейная молекула. Минерал каломель кристаллизуется в тетрагональной системе с пространственной группой I4/m 2/m 2/m. Элементарная ячейка кристаллической структуры показана ниже:
 | 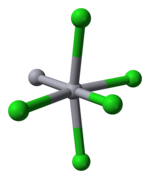 |
| элементарная ячейка | искаженная октаэдрическая координация Hg |
Длина связи Hg–Hg составляет 253 пм (Hg–Hg в металле составляет 300 пм), а длина связи Hg–Cl в линейной единице Hg 2 Cl 2 составляет 243 пм. [11] Общая координация каждого атома Hg является октаэдрической, поскольку, в дополнение к двум ближайшим соседям, есть еще четыре атома Cl на расстоянии 321 пм. Существуют более длинные поликатионы ртути .
Приготовление и реакции
Хлорид ртути образуется в результате реакции элементарной ртути и хлорида ртути:
- Hg + HgCl 2 → Hg 2 Cl 2
Его можно получить с помощью реакции метатезиса с участием водного раствора нитрата ртути(I) с использованием различных источников хлорида, включая NaCl или HCl.
- 2HCl + Hg2 ( NO3 ) 2 → Hg2Cl2 + 2HNO3
Аммиак вызывает диспропорционирование Hg 2 Cl 2 :
- Hg2Cl2 + 2NH3 → Hg + Hg (NH2 ) Cl + NH4Cl
Каломельный электрод
Хлорид ртути широко применяется в электрохимии , используя легкость его реакций окисления и восстановления. Каломельный электрод является электродом сравнения , особенно в старых публикациях. За последние 50 лет его заменил электрод из серебра/хлорида серебра (Ag/AgCl). Хотя ртутные электроды были широко заброшены из-за опасной природы ртути , многие химики считают, что они все еще более точны и не опасны, если с ними правильно обращаться. Различия в экспериментальных потенциалах мало отличаются от литературных значений. Другие электроды могут отличаться на 70–100 милливольт. [ необходима цитата ]
Фотохимия
Под воздействием ультрафиолетового света хлорид ртути разлагается на хлорид ртути (II) и элементарную ртуть.
- Hg2Cl2 → HgCl2 + Hg
Образование Hg можно использовать для расчета числа фотонов в световом луче методом актинометрии .
При использовании легкой реакции в присутствии хлорида ртути (II) и оксалата аммония получают хлорид ртути (I), хлорид аммония и диоксид углерода .
- 2HgCl2 + ( NH4 ) 2C2O4 Свет→Hg 2 Cl 2(т) + 2 [ NH+
4][Cl − ] + 2 CO 2
Эта конкретная реакция была открыта Дж. М. Эдером (отсюда и название реакция Эдера ) в 1880 году и повторно исследована В. Э. Розеваером в 1929 году. [12]
Родственные соединения ртути(I)
Бромид ртути(I) , Hg 2 Br 2 , имеет светло-желтый цвет, тогда как иодид ртути(I) , Hg 2 I 2 , имеет зеленоватый цвет. Оба плохо растворимы. Фторид ртути(I) нестабилен в отсутствие сильной кислоты.
Соображения безопасности
Хлорид ртути токсичен , хотя из-за своей низкой растворимости в воде он, как правило, менее опасен, чем его аналог хлорид ртути . Он использовался в медицине как мочегонное и слабительное средство в Соединенных Штатах с конца 1700-х до 1860-х годов. Каломель также была распространенным ингредиентом в зубных порошках в Великобритании вплоть до 1954 года, вызывая широко распространенное отравление ртутью в форме розовой болезни , которая в то время имела уровень смертности 1 из 10. [13] Это медицинское использование было позже прекращено, когда была обнаружена токсичность соединения.
Он также нашел применение в косметике в качестве мыла и кремов для осветления кожи , но эти препараты в настоящее время запрещены к производству или импорту во многих странах, включая США, Канаду, Японию и Европейский союз. [14] Исследование рабочих, участвующих в производстве этих препаратов, показало, что натриевая соль 2,3-димеркапто-1-пропансульфоновой кислоты (DMPS) эффективна для снижения содержания ртути в организме и снижения концентрации ртути в моче до нормального уровня. [15]
Ссылки
- ↑ Джон Рамбл (18 июня 2018 г.). CRC Handbook of Chemistry and Physics (99-е изд.). CRC Press. стр. 5–188. ISBN 978-1138561632.
- ^ ab Zumdahl, Steven S. (2009). Химические принципы 6-е изд . Houghton Mifflin Company. стр. A22. ISBN 978-0-618-94690-7.
- ^ "Соединения ртути [кроме (органо)алкилов] (как Hg)". Концентрации, представляющие немедленную опасность для жизни или здоровья (IDLH) . Национальный институт охраны труда и техники безопасности (NIOSH).
- ^ abcd Чисхолм, Хью , ред. (1911). . Encyclopaedia Britannica (11-е изд.). Cambridge University Press.
- ^ Housecroft, CE; Sharpe, AG (2004). Неорганическая химия (2-е изд.). Prentice Hall. стр. 696–697. ISBN 978-0-13-039913-7.
- ^ Скуг, Дуглас А.; Холлер, Ф. Джеймс; Ниман, Тимоти А. (1998). Принципы инструментального анализа (5-е изд.). Saunders College Pub. стр. 253–271. ISBN 978-0-03-002078-0.
- ^ Буцацки, С., Вредители, болезни и расстройства садовых растений , Коллинз, 1998, стр. 449-50. ISBN 0-00-220063-5
- ^ Koehler, Christopher SW (январь 2001). «Heavy Metal Medicine». Today's Chemist at Work . 10 (1): 61–65. ISSN 1062-094X . Получено 2009-02-02 .
- ^ Джонстон, Элизабет Лихтенштейн (1901). Воспоминания лоялиста Джорджии...написанные в 1836 году. Нью-Йорк: Mansfield & Company. стр. 82.стр. 82-83.
- ^ Инглис-Аркелл, Эстер. «Археологи выследили Льюиса и Кларка, проследив их след слабительных». io9 . Получено 09.11.2018 .
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Roseveare, WE (1930). «Рентгеновская фотохимическая реакция между оксалатом калия и хлоридом ртути». J. Am. Chem. Soc. 52 (7): 2612–2619. doi :10.1021/ja01370a005.
- ^ Снидер, Уолтер (2005). Drug Discovery: A History. John Wiley and Sons . стр. 45–46. ISBN 978-0-471-89980-8. Получено 2009-02-02 .
- ^ "Директива Комиссии 86/199/EEC, OJ L 149, стр. 38 от 3.6.1986".
- ^ D. Gonzalez-Ramirez; M. Zuniga-Charles; A. Narro-Juarez; Y. Molina-Recio; KM Hurlbut; RC Dart; HV Aposhian (1 октября 1998 г.). "DMPS (2,3-димеркаптопропан-1-сульфонат, Dimaval) уменьшает содержание ртути в организме людей, подвергшихся воздействию хлорида ртути" (бесплатный полный текст) . Журнал фармакологии и экспериментальной терапии . 287 (1): 8–12. PMID 9765315.
Внешние ссылки
- Международная карта химической безопасности 0984
- Национальный реестр загрязняющих веществ - Информационный бюллетень по ртути и ее соединениям
- Карманный справочник NIOSH по химическим опасностям




