Стимулятор генов интерферона
| СТИНГ1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | STING1 , ERIS, MITA, MPYS, NET23, SAVI, STING, hMITA, hSTING, Стимулятор генов интерферона, трансмембранный белок 173, STING-бета, TMEM173, стимулятор интерферонового ответа cGAMP-интерактор 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 612374; МГИ : 1919762; Гомологен : 18868; GeneCards : STING1; OMA :STING1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Стимулятор генов интерферона ( STING ), также известный как трансмембранный белок 173 ( TMEM173 ) и MPYS / MITA / ERIS, представляет собой белок , который у человека кодируется геном STING1 . [5]
STING играет важную роль во врожденном иммунитете . STING индуцирует выработку интерферона I типа , когда клетки инфицированы внутриклеточными патогенами, такими как вирусы , микобактерии и внутриклеточные паразиты . [6] Интерферон I типа , опосредованный STING, защищает инфицированные клетки и близлежащие клетки от локальной инфекции, связываясь с той же клеткой, которая его секретирует ( аутокринная сигнализация), и близлежащими клетками ( паракринная сигнализация). Таким образом, он играет важную роль, например, в контроле норовирусной инфекции. [7]
STING работает как прямой цитозольный ДНК-сенсор (CDS) и адаптерный белок в сигнальной системе интерферона I типа через различные молекулярные механизмы. Было показано, что он активирует нисходящие факторы транскрипции STAT6 и IRF3 через TBK1 , которые отвечают за противовирусный ответ и врожденный иммунный ответ против внутриклеточного патогена . [8]
Структура

Аминокислоты 1–379 человеческого STING включают 4 трансмембранных области (TM) и C-концевой домен . C-концевой домен (CTD: аминокислоты 138–379) содержит домен димеризации (DD) и карбоксиконцевой хвост (CTT: аминокислоты 340–379). [8]
STING образует симметричный димер в клетке. Димер STING напоминает бабочку с глубокой щелью между двумя протомерами. Гидрофобные остатки каждого протомера STING образуют гидрофобные взаимодействия друг с другом на границе раздела. [8] [9]
Выражение
STING экспрессируется в кроветворных клетках периферических лимфоидных тканей , включая Т-лимфоциты , NK-клетки , миелоидные клетки и моноциты . Также было показано, что STING высоко экспрессируется в легких, яичниках , сердце, гладких мышцах , сетчатке , костном мозге и влагалище. [10] [11]
Локализация
Субклеточная локализация STING была выяснена как белок эндоплазматического ретикулума . Также, вероятно, что STING ассоциируется в непосредственной близости с мембраной ER, ассоциированной с митохондриями (MAM) - интерфейсом между митохондрией и ER. [12] Во время внутриклеточной инфекции STING способен перемещаться из эндоплазматического ретикулума в перинуклеарные везикулы, потенциально вовлеченные в транспорт, опосредованный экзоцистой . [12] Также было показано, что STING колокализуется с белками аутофагии, легкой цепью 3 белка, ассоциированного с микротрубочками (LC3) , и белком 9A, связанным с аутофагией , после стимуляции двухцепочечной ДНК, что предполагает его присутствие в аутофагосоме . [13]
Функция
STING опосредует выработку интерферона I типа в ответ на внутриклеточную ДНК и различные внутриклеточные патогены, включая вирусы , внутриклеточные бактерии и внутриклеточные паразиты . [14] После заражения STING из инфицированных клеток может ощущать присутствие нуклеиновых кислот от внутриклеточных патогенов, а затем индуцировать выработку интерферона β и более 10 форм интерферона α . Интерферон I типа , вырабатываемый инфицированными клетками, может находить и связываться с рецептором интерферона-альфа/бета близлежащих клеток, чтобы защитить клетки от локальной инфекции.
Противовирусный иммунитет
STING вызывает мощный иммунитет интерферона I типа против вирусной инфекции. После проникновения вируса вирусные нуклеиновые кислоты присутствуют в цитозоле инфицированных клеток. Несколько сенсоров ДНК, такие как DAI , РНК-полимераза III , IFI16 , DDX41 и cGAS , могут обнаруживать чужеродные нуклеиновые кислоты . После распознавания вирусной ДНК сенсоры ДНК инициируют нисходящие сигнальные пути, активируя опосредованный STING ответ интерферона. [15]
Было показано, что аденовирус , вирус простого герпеса , HSV-1 и HSV-2, а также вирус с отрицательной цепью РНК , вирус везикулярного стоматита (VSV), способны активировать врожденный иммунный ответ , зависящий от STING . [14]
Дефицит STING у мышей привел к летальной восприимчивости к инфекции HSV-1 из-за отсутствия успешного ответа интерферона I типа. [16]
Точечная мутация серина -358 подавляет активацию STING-IFN у летучих мышей и, как предполагается, дает летучим мышам способность служить резервуарными хозяевами. [17]
Против внутриклеточных бактерий
Было показано, что внутриклеточные бактерии Listeria monocytogenes стимулируют иммунный ответ хозяина через STING. [18] STING может играть важную роль в выработке хемокинов MCP-1 и CCL7 . Моноциты с дефицитом STING изначально дефектны в миграции в печень во время инфекции Listeria monocytogenes . Таким образом, STING защищает хозяина от инфекции Listeria monocytogenes , регулируя миграцию моноцитов . Активация STING, вероятно, опосредована циклическим ди-АМФ, секретируемым внутриклеточными бактериями. [18] [19]
Другой
STING может быть важной молекулой для защитного иммунитета против инфекционных организмов. Например, животные, которые не могут экспрессировать STING, более восприимчивы к инфекции VSV , HSV-1 и Listeria monocytogenes , что предполагает его потенциальную связь с инфекционными заболеваниями человека. [20]
Роль в иммунитете хозяина
Хотя IFN типа I абсолютно необходим для устойчивости к вирусам, появляется все больше литературы об отрицательной роли интерферона типа I в иммунитете хозяина, опосредованном STING. Было показано, что AT-богатый мотив стебель-петля ДНК в геноме Plasmodium falciparum и Plasmodium berghei и внеклеточная ДНК из Mycobacterium tuberculosis активируют интерферон типа I через STING. [21] [22] Перфорация мембраны фагосомы, опосредованная системой секреции ESX1, позволяет внеклеточной микобактериальной ДНК получать доступ к цитозольным ДНК-сенсорам хозяина, тем самым вызывая выработку интерферона типа I в макрофагах. Высокая сигнатура интерферона типа I приводит к патогенезу M. tuberculosis и продолжительной инфекции. [22] Опосредованный STING-TBK1-IRF ответ интерферона типа I играет центральную роль в патогенезе экспериментальной церебральной малярии у лабораторных животных, инфицированных Plasmodium berghei . Лабораторные мыши с дефицитом ответа интерферона типа I устойчивы к экспериментальной церебральной малярии. [21]
Механизмы сигнализации STING
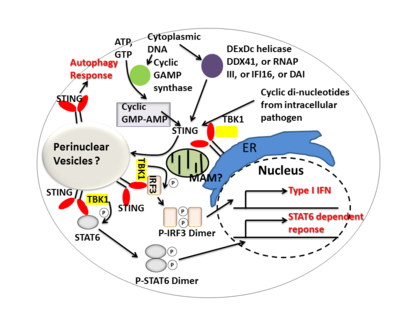
STING опосредует иммунный ответ интерферона I типа , функционируя как прямой сенсор ДНК и сигнальный адаптерный белок . После активации STING стимулирует активность TBK1 для фосфорилирования IRF3 или STAT6 . Фосфорилированные IRF3 и STAT6 димеризуются, а затем проникают в ядро, чтобы стимулировать экспрессию генов, участвующих в иммунном ответе хозяина, таких как IFNB , CCL2 , CCL20 и т. д. [8] [23]
В нескольких отчетах предполагалось, что STING связан с активацией селективной аутофагии. [13] Было показано, что Mycobacterium tuberculosis продуцирует цитозольные ДНК-лиганды, которые активируют STING, что приводит к убиквитинированию бактерий и последующему привлечению белков, связанных с аутофагией , все из которых необходимы для «селективного» аутофагического нацеливания и врожденной защиты от M. tuberculosis . [24]
Подводя итог, можно сказать, что STING координирует множественные иммунные реакции на инфекцию, включая индукцию интерферонов и STAT6-зависимую реакцию, а также селективную реакцию аутофагии. [8]
Как цитозольный ДНК-сенсор
Циклические динуклеотиды - вторичные сигнальные молекулы, продуцируемые различными видами бактерий, были обнаружены в цитозоле клеток млекопитающих во время внутриклеточной патогенной инфекции; это приводит к активации TBK1 - IRF3 и последующей продукции интерферона I типа . [8] [25] Было показано, что STING напрямую связывается с циклическим ди-ГМФ , и это распознавание приводит к продукции цитокинов , таких как интерферон I типа , которые необходимы для успешного устранения патогена. [26]
Как сигнальный адаптер
DDX41 , член семейства геликаз DEXDc , в миелоидных дендритных клетках распознает внутриклеточную ДНК и опосредует врожденный иммунный ответ посредством прямой ассоциации со STING. [27] Было также показано, что другие сенсоры ДНК — DAI , РНК-полимераза III , IFI16 — активируют STING посредством прямых или косвенных взаимодействий. [15]
Циклическая GMP-AMP-синтаза (cGAS), которая принадлежит к семейству нуклеотидилтрансфераз , способна распознавать содержимое цитозольной ДНК и вызывать STING-зависимый ответ интерферона путем производства вторичного мессенджера циклического гуанозинмонофосфата-аденозинмонофосфата (циклического GMP-AMP или cGAMP). После активации циклического GMP-AMP- связанного STING он усиливает активность TBK1 для фосфорилирования IRF3 и STAT6 для последующего ответа интерферона типа I. [28] [29]
Было высказано предположение, что внутриклеточный кальций играет важную роль в реакции пути STING. [30]
Смотрите также
- Агонист STING – компонент врожденной иммунной системыСтраницы, отображающие краткие описания целей перенаправления
Ссылки
- ^ abc ENSG00000288243 GRCh38: Ensembl выпуск 89: ENSG00000184584, ENSG00000288243 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000024349 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "STING1 стимулятор интерферонового ответа cGAMP-интерактор 1 [ Homo sapiens (человек) ]".
- ^ Nakhaei P, Hiscott J, Lin R (июнь 2010 г.). «STING-ing the antiviral pathway». Журнал молекулярной клеточной биологии . 2 (3): 110– 2. doi : 10.1093/jmcb/mjp048 . PMID 20022884.
- ^ NYu P, Miao Z, Li Y, Bansal R, Peppelenbosch MP, Pan Q (2021). "cGAS-STING эффективно ограничивает мышиную норовирусную инфекцию, но противодействует противовирусному действию N-конца RIG-I в макрофагах мышей". Gut Microbes . 13 (1): 1959839. doi : 10.1080/19490976.2021.1959839 . ISSN 1949-0976. PMC 8344765 . PMID 34347572.
- ^ abcdef Burdette DL, Vance RE (январь 2013 г.). «STING и врожденный иммунный ответ на нуклеиновые кислоты в цитозоле». Nature Immunology . 14 (1): 19– 26. doi :10.1038/ni.2491. PMID 23238760. S2CID 7968532.
- ^ Shu C, Yi G, Watts T, Kao CC, Li P (июль 2012 г.). «Структура STING, связанного с циклическим ди-ГМФ, раскрывает механизм распознавания циклического динуклеотида иммунной системой». Nature Structural & Molecular Biology . 19 (7): 722– 4. doi :10.1038/nsmb.2331. PMC 3392545 . PMID 22728658.
- ^ "Профиль экспрессии EST TMEM173". biogps org . biogps.org.
- ^ "NCBI TMEM173 expression GEOprofile". NCBI . www.ncbi.nlm.nih.gov/geoprofiles.
- ^ ab Ishikawa H, Barber GN (октябрь 2008 г.). "STING — это адаптер эндоплазматического ретикулума, который облегчает врожденную иммунную сигнализацию". Nature . 455 (7213): 674– 8. Bibcode :2008Natur.455..674I. doi :10.1038/nature07317. PMC 2804933 . PMID 18724357.
- ^ ab Saitoh T, Fujita N, Hayashi T, Takahara K, Satoh T, Lee H, Matsunaga K, Kageyama S, Omori H, Noda T, Yamamoto N, Kawai T, Ishii K, Takeuchi O, Yoshimori T, Akira S (декабрь 2009 г.). "Atg9a контролирует динамическую транслокацию STING, управляемую двухцепочечной ДНК, и врожденный иммунный ответ". Труды Национальной академии наук Соединенных Штатов Америки . 106 (49): 20842– 6. Bibcode : 2009PNAS..10620842S. doi : 10.1073/pnas.0911267106 . PMC 2791563. PMID 19926846 .
- ^ ab Barber GN (февраль 2011 г.). «Пути восприятия ДНК врожденного иммунитета: STING, AIMII и регуляция продукции интерферона и воспалительных реакций». Current Opinion in Immunology . 23 (1): 10– 20. doi :10.1016/j.coi.2010.12.015. PMC 3881186. PMID 21239155 .
- ^ ab Keating SE, Baran M, Bowie AG (декабрь 2011 г.). «Цитозольные сенсоры ДНК, регулирующие индукцию интерферона I типа» (PDF) . Trends in Immunology . 32 (12): 574– 81. doi : 10.1016/j.it.2011.08.004. hdl : 2262/68041 . PMID 21940216.
- ^ Ma Z, Damania B (февраль 2016 г.). «Защитный путь cGAS-STING и его противодействие вирусами». Cell Host & Microbe . 19 (2): 150– 8. doi :10.1016/j.chom.2016.01.010. PMC 4755325 . PMID 26867174.
- ^ Xie J, Li Y, Shen X, Got G, Zhu Y, Cui J, Wang L, Shi Z, Zhou P (март 2018 г.). «Затухающая активация интерферона, зависящая от STING, у летучих мышей». Cell Host & Microbe . 23 (3): 297–301.e4. doi : 10.1016/j.chom.2018.01.006 . PMC 7104992 . PMID 29478775.
- ^ ab Jin L, Getahun A, Knowles HM, Mogan J, Akerlund LJ, Packard TA, Perraud AL, Cambier JC (март 2013 г.). «STING/MPYS опосредует защиту хозяина от инфекции Listeria monocytogenes путем регулирования миграции моноцитов Ly6C(hi)». Журнал иммунологии . 190 (6): 2835– 43. doi :10.4049/jimmunol.1201788. PMC 3593745. PMID 23378430 .
- ^ Woodward JJ, Iavarone AT, Portnoy DA (июнь 2010 г.). "c-di-AMP, секретируемый внутриклеточным Listeria monocytogenes, активирует реакцию интерферона хозяина I типа". Science . 328 (5986): 1703– 5. Bibcode :2010Sci...328.1703W. doi :10.1126/science.1189801. PMC 3156580 . PMID 20508090.
- ^ Ishikawa H, Ma Z, Barber GN (октябрь 2009 г.). «STING регулирует внутриклеточный ДНК-опосредованный, интерферонзависимый врожденный иммунитет типа I». Nature . 461 (7265): 788– 92. Bibcode :2009Natur.461..788I. doi :10.1038/nature08476. PMC 4664154 . PMID 19776740.
- ^ ab Sharma S, DeOliveira RB, Kalantari P, Parroche P, Goutagny N, Jiang Z, Chan J, Bartholomeu DC, Lauw F, Hall JP, Barber GN, Gazzinelli RT, Fitzgerald KA, Golenbock DT (август 2011 г.). "Врожденное иммунное распознавание богатого AT мотива стебель-петля ДНК в геноме Plasmodium falciparum". Immunity . 35 (2): 194– 207. doi :10.1016/j.immuni.2011.05.016. PMC 3162998 . PMID 21820332.
- ^ ab Manzanillo PS, Shiloh MU, Portnoy DA, Cox JS (май 2012 г.). «Mycobacterium tuberculosis активирует ДНК-зависимый цитозольный путь наблюдения в макрофагах». Cell Host & Microbe . 11 (5): 469– 80. doi :10.1016/j.chom.2012.03.007. PMC 3662372 . PMID 22607800.
- ^ Chen H, Sun H, You F, Sun W, Zhou X, Chen L, Yang J, Wang Y, Tang H, Guan Y, Xia W, Gu J, Ishikawa H, Gutman D, Barber G, Qin Z, Jiang Z (октябрь 2011 г.). «Активация STAT6 с помощью STING имеет решающее значение для противовирусного врожденного иммунитета». Cell . 147 (2): 436– 46. doi : 10.1016/j.cell.2011.09.022 . PMID 22000020.
- ^ Watson RO, Manzanillo PS, Cox JS (август 2012 г.). «Внеклеточная ДНК M. tuberculosis нацеливает бактерии на аутофагию, активируя путь восприятия ДНК хозяина». Cell . 150 (4): 803– 15. doi :10.1016/j.cell.2012.06.040. PMC 3708656 . PMID 22901810.
- ^ McWhirter SM, Barbalat R, Monroe KM, Fontana MF, Hyodo M, Joncker NT, Ishii KJ, Akira S, Colonna M, Chen ZJ, Fitzgerald KA, Hayakawa Y, Vance RE (август 2009 г.). «Интерфероновый ответ хозяина I типа индуцируется цитозольным восприятием вторичного мессенджера бактерий циклического ди-ГМФ». Журнал экспериментальной медицины . 206 (9): 1899– 911. doi :10.1084/jem.20082874. PMC 2737161. PMID 19652017 .
- ^ Burdette DL, Monroe KM, Sotelo-Troha K, Iwig JS, Eckert B, Hyodo M, Hayakawa Y, Vance RE (октябрь 2011 г.). "STING — это прямой врожденный иммунный сенсор циклического ди-ГМФ". Nature . 478 (7370): 515– 8. Bibcode :2011Natur.478..515B. doi :10.1038/nature10429. PMC 3203314 . PMID 21947006.
- ^ Zhang Z, Yuan B, Bao M, Lu N, Kim T, Liu YJ (октябрь 2011 г.). «Геликаза DDX41 распознает внутриклеточную ДНК, опосредованную адаптером STING в дендритных клетках». Nature Immunology . 12 (10): 959– 65. doi :10.1038/ni.2091. PMC 3671854 . PMID 21892174.
- ^ Wu J, Sun L, Chen X, Du F, Shi H, Chen C, Chen ZJ (февраль 2013 г.). «Циклический GMP-AMP является эндогенным вторичным мессенджером в врожденной иммунной сигнализации цитозольной ДНК». Science . 339 (6121): 826– 30. Bibcode :2013Sci...339..826W. doi :10.1126/science.1229963. PMC 3855410 . PMID 23258412.
- ^ Sun L, Wu J, Du F, Chen X, Chen ZJ (февраль 2013 г.). «Циклическая GMP-AMP-синтаза — это цитозольный сенсор ДНК, который активирует путь интерферона I типа». Science . 339 (6121): 786– 91. Bibcode :2013Sci...339..786S. doi :10.1126/science.1232458. PMC 3863629 . PMID 23258413.
- ^ Ким С., Кох П., Ли Л., Пешкин Л., Митчисон Т.Дж. (4 июня 2017 г.). «Доказательства роли кальция в передаче сигналов STING». bioRxiv 10.1101/145854 .
Дальнейшее чтение
- Wang Y, Tong X, Omoregie ES, Liu W, Meng S, Ye X (октябрь 2012 г.). «Тетраспанин 6 (TSPAN6) отрицательно регулирует иммунную сигнализацию, опосредованную индуцируемым ретиноевой кислотой геном I-подобного рецептора, зависимым от убиквитинирования образом». Журнал биологической химии . 287 (41): 34626– 34. doi : 10.1074/jbc.M112.390401 . PMC 3464568. PMID 22908223 .
- Инь Ц, Тянь Ю, Кабалисваран В, Цзян Х, Ту Д, Эк МДж, Чен ЗДж, Ву Х (июнь 2012 г.). «Циклическое определение ди-ГМФ с помощью врожденного иммунного сигнального белка STING». Молекулярная клетка . 46 (6): 735–45 . doi :10.1016/j.molcel.2012.05.029. ПМЦ 3697849 . ПМИД 22705373.
- Aguirre S, Maestre AM, Pagni S, Patel JR, Savage T, Gutman D, Maringer K, Bernal-Rubio D, Shabman RS, Simon V, Rodriguez-Madoz JR, Mulder LC, Barber GN, Fernandez-Sesma A (2012). "DENV ингибирует выработку IFN типа I в инфицированных клетках путем расщепления человеческого STING". PLOS Pathogens . 8 (10): e1002934. doi : 10.1371/journal.ppat.1002934 . PMC 3464218. PMID 23055924 .
- Li Y, Li C, Xue P, Zhong B, Mao AP, Ran Y, Chen H, Wang YY, Yang F, Shu HB (май 2009 г.). «ISG56 — это регулятор отрицательной обратной связи вирус-индуцируемой сигнализации и клеточного противовирусного ответа». Труды Национальной академии наук Соединенных Штатов Америки . 106 (19): 7945– 50. Bibcode : 2009PNAS..106.7945L. doi : 10.1073/pnas.0900818106 . PMC 2683125. PMID 19416887 .
- Conlon J, Burdette DL, Sharma S, Bhat N, Thompson M, Jiang Z, Rathinam VA, Monks B, Jin T, Xiao TS, Vogel SN, Vance RE, Fitzgerald KA (май 2013 г.). «Мышиный, но не человеческий STING связывается и подает сигналы в ответ на сосудистый разрушающий агент 5,6-диметилксантенон-4-уксусную кислоту». Журнал иммунологии . 190 (10): 5216– 25. doi :10.4049/jimmunol.1300097. PMC 3647383. PMID 23585680 .
- Abe T, Harashima A, Xia T, Konno H, Konno K, Morales A, Ahn J, Gutman D, Barber GN (апрель 2013 г.). «Распознавание цитоплазматической ДНК методом STING стимулирует клеточную защиту». Molecular Cell . 50 (1): 5– 15. doi :10.1016/j.molcel.2013.01.039. PMC 3881179 . PMID 23478444.
- Nazmi A, Mukhopadhyay R, Dutta K, Basu A (2012). "STING опосредует нейрональный врожденный иммунный ответ после заражения вирусом японского энцефалита". Scientific Reports . 2 : 347. Bibcode :2012NatSR...2E.347N. doi :10.1038/srep00347. PMC 3317237 . PMID 22470840.
- Zhang J, Hu MM, Wang YY, Shu HB (август 2012 г.). «Белок TRIM32 модулирует индукцию интерферона I типа и клеточный противовирусный ответ, нацеливаясь на белок MITA/STING для убиквитинирования, связанного с K63». Журнал биологической химии . 287 (34): 28646– 55. doi : 10.1074/jbc.M112.362608 . PMC 3436586. PMID 22745133 .
- Ishikawa H, Barber GN (октябрь 2008 г.). "STING — это адаптер эндоплазматического ретикулума, который облегчает передачу сигналов врожденного иммунитета". Nature . 455 (7213): 674– 8. Bibcode :2008Natur.455..674I. doi :10.1038/nature07317. PMC 2804933 . PMID 18724357.





