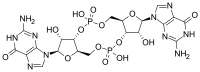
Циклический ди-ГМФ
 | |
| Имена | |
|---|---|
| Систематическое название ИЮПАК (2 R ,3 R ,3a S ,7a R ,9 R ,10 R ,10a S ,14a R )-2,9-Бис(2-амино-6-оксо-1,6-дигидро-9 H -пурин-9-ил)-3,5,10,12-тетрагидроксиоктагидро-2 H ,5 H ,7 H ,12 H -5λ 5 ,12λ 5 -дифуро[3,2- d :3′,2′- j ][1,3,7,9,2,8]тетраоксадифосфациклододецин-5,12-дион | |
| Другие имена Циклический дигуанилат; 3',5'-циклическая дигуанилиновая кислота; c-di-GMP; 5GP-5GP | |
| Идентификаторы | |
3D модель ( JSmol ) |
|
| ChemSpider | |
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| С20Н24Н10О14П2 | |
| Молярная масса | 690,09 г/моль |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Циклический ди-ГМФ (также называемый циклическим дигуанилатом и c-ди- ГМФ ) является вторичным мессенджером , используемым в передаче сигнала у самых разных бактерий . [1] Циклический ди-ГМФ, как известно, не используется археями и был обнаружен только у эукариот в Dictyostelium . [2] Биологическая роль циклического ди-ГМФ была впервые раскрыта, когда он был идентифицирован как аллостерический активатор целлюлозосинтазы, обнаруженной в Gluconacetobacter xylinus , для производства микробной целлюлозы . [3]
По своей структуре это цикл, содержащий только два основания гуанина , связанных рибозой и фосфатом .
Функция
Контакт с поверхностями увеличивает c-di-GMP, что увеличивает транскрипцию , трансляцию и посттрансляцию экзополисахаридов (EPS) и других компонентов внеклеточного полимерного вещества матрицы (см. обзор Jenal et al 2017). [4] У бактерий определенные сигналы передаются путем синтеза или деградации циклического di-GMP. Циклический di-GMP синтезируется белками с активностью дигуанилатциклазы . Эти белки обычно имеют характерный мотив GGDEF , который относится к консервативной последовательности из пяти аминокислот . Деградация циклического di-GMP зависит от белков с активностью фосфодиэстеразы . Эти белки имеют либо мотив аминокислот EAL, либо HD-GYP. Процессы, которые, как известно, регулируются циклическим ди-ГМФ, по крайней мере, в некоторых организмах, включают образование биопленки (например, матрицы ЭПС, обнаруженные Штайнером и др. в 2013 г.), [4] подвижность (особенно переход от подвижного к сидячему положению, см. обзор Дженала и др. в 2017 г.) [4] и продукцию факторов вирулентности .
Регулирование
Уровни циклического ди-ГМФ регулируются с помощью различных механизмов. Многие белки с доменами GGDEF, EAL или HD-GYP обнаружены с другими доменами, которые могут получать сигналы, такими как домены PAS . Считается, что ферменты, которые расщепляют или синтезируют циклический ди-ГМФ, локализуются в определенных областях клетки, где они влияют на приемники в ограниченном пространстве. [1] В Gluconacetobacter xylinus c-di-GMP стимулирует полимеризацию глюкозы в целлюлозу как высокоаффинный аллостерический активатор фермента целлюлозосинтазы. [3] Некоторые ферменты дигуанилатциклазы аллостерически ингибируются циклическим ди-ГМФ.
Уровни циклического ди-ГМФ регулируют другие процессы посредством ряда механизмов. Синтаза целлюлозы Gluconacetobacter xylinus аллостерически стимулируется циклическим ди-ГМФ, представляя механизм, посредством которого циклический ди-ГМФ может регулировать активность синтазы целлюлозы. Было показано, что домен PilZ связывает циклический ди-ГМФ и, как полагают, участвует в циклической ди-ГМФ-зависимой регуляции, но механизм, посредством которого он это делает, неизвестен. Недавние структурные исследования доменов PilZ двух видов бактерий продемонстрировали, что домены PilZ радикально меняют конформацию при связывании с циклическим ди-ГМФ. [5] [6] Это приводит к убедительному выводу о том, что конформационные изменения в доменах PilZ позволяют регулировать активность целевых эффекторных белков (таких как синтаза целлюлозы) циклическим ди-ГМФ. Рибопереключатели, называемые рибопереключателем циклического ди-ГМФ-I и рибопереключателем циклического ди-ГМФ-II, регулируют экспрессию генов в ответ на концентрации циклического ди-ГМФ у различных бактерий, но не у всех бактерий, которые, как известно, используют циклический ди-ГМФ.
Ассоциация хостов
Циклический ди-ГМФ был связан с ассоциацией хозяина у нескольких видов Pseudomonas . В эксперименте, где Pseudomonas lurida выращивалась в ассоциации с хозяином-нематодой Caenorhabditis elegans, генетические мутации были обнаружены в определенных генах, которые повышали регуляцию c-di-GMP, вызывая появление специализированного морфотипа хозяина. Мутации, влияющие на регуляцию c-di-GMP, были обнаружены с помощью секвенирования всего генома. Гены wspE и wspF из оперона wsp показали мутации, которые повышали регуляцию c-di-GMP. Кроме того, было установлено, что мутации в гене rph также влияют на экспрессию c-di-GMP, что является новым открытием, поскольку rph ранее не был связан с регуляцией c-di-GMP. [7]
Обзор ролей c-di-GMP в Caulobacter crescentus , Pseudomonas aeruginosa , Komagataeibacter xylinus / Gluconacetobacter xylinus , Myxococcus xanthus , Bdellovibrio бактериоворус и Pseudomonas fluorescens см. Jenal et al 2017. [4]
Смотрите также
Ссылки
- ^ ab Tamayo R, Pratt JT, Camilli A (2007). «Роль циклического дигуанилата в регуляции бактериального патогенеза». Annual Review of Microbiology . 61 : 131–148. doi : 10.1146/annurev.micro.61.080706.093426. PMC 2776827. PMID 17480182 .
- ^ Chen ZH, Schaap P (август 2012 г.). «Прокариотический мессенджер c-di-GMP запускает дифференциацию клеток стебля у Dictyostelium». Nature . 488 (7413): 680–683. Bibcode :2012Natur.488..680C. doi :10.1038/nature11313. PMC 3939355 . PMID 22864416.
- ^ ab Ross P, Weinhouse H, Aloni Y, Michaeli D, Weinberger-Ohana P, Mayer R и др. (1987). «Регуляция синтеза целлюлозы в Acetobacter xylinum циклической дигуаниловой кислотой». Nature . 325 (6101): 279–281. Bibcode :1987Natur.325..279R. doi :10.1038/325279a0. PMID 18990795. S2CID 4305512.
- ^ abcd Laventie BJ, Jenal U (сентябрь 2020 г.). «Surface Sensing and Adaptation in Bacteria». Annual Review of Microbiology . 74 (1). Annual Reviews : 735–760. doi : 10.1146/annurev-micro-012120-063427. PMID 32905753. S2CID 221622525.
- ^ Benach J, Swaminathan SS, Tamayo R, Handelman SK, Folta-Stogniew E, Ramos JE и др. (декабрь 2007 г.). «Структурная основа передачи сигнала циклического дигуанилата доменами PilZ». Журнал EMBO . 26 (24). Европейская организация молекулярной биологии: 5153–5166. doi :10.1038/sj.emboj.7601918. PMC 2140105. PMID 18034161 .
- ^ Ko J, Ryu KS, Kim H, Shin JS, Lee JO, Cheong C и др. (апрель 2010 г.). «Структура PP4397 раскрывает молекулярную основу для различных режимов связывания c-di-GMP белками домена Pilz». Журнал молекулярной биологии . 398 (1): 97–110. doi :10.1016/j.jmb.2010.03.007. PMID 20226196.
- ^ Obeng N, Czerwinski A, Schütz D, Michels J, Leipert J, Bansept F и др. (октябрь 2023 г.). «Бактериальный c-di-GMP играет ключевую роль в установлении симбиоза хозяин-микроб». Nature Microbiology . 8 (10): 1809–1819. doi :10.1038/s41564-023-01468-x. PMC 10522488 . PMID 37653009.


