Neisseria gonorrhoeae
| Neisseria gonorrhoeae | |
|---|---|
 | |
| Окраска по Граму гонококкового уретрита . Обратите внимание на распределение нейтрофилов и наличие как внутриклеточных , так и внеклеточных бактерий. ( CDC ) | |
| Научная классификация | |
| Домен: | Бактерии |
| Тип: | Псевдомонадоты |
| Сорт: | Бетапротеобактерии |
| Заказ: | Нейссериалы |
| Семья: | Нейссериевые |
| Род: | Нейссерия |
| Разновидность: | N. гонорея |
| Биномиальное имя | |
| Neisseria gonorrhoeae | |
| Синонимы | |
Neisseria gonorrhoeae , также известная как гонококк (единственное число) или гонококки (множественное число), является видом грамотрицательных диплококковых бактерий, впервые выделенных Альбертом Нейссером в 1879 году. [3] Облигатный патоген человека, он в первую очередь колонизирует слизистую оболочку мочеполового тракта; однако он также способен прилипать к слизистой оболочке носа, [4] глотки, прямой кишки и конъюнктивы . [5] Он вызывает передающуюся половым путем урогенитальную инфекцию гонорею [6], а также другие формы гонококкового заболевания, включая диссеминированную гонококкемию, септический артрит и гонококковую офтальмию новорожденных.
N. gonorrhoeae является оксидазоположительным и микроаэрофилом , способным выживать при фагоцитозе и расти внутри нейтрофилов . [6] Для его культивирования требуется добавление углекислого газа и обогащенный агар ( шоколадный агар ) с различными антибиотиками ( Тейер-Мартин ). Он проявляет антигенную изменчивость посредством генетической рекомбинации своих пилей и поверхностных белков, которые взаимодействуют с иммунной системой . [3]
Половой путь передачи — вагинальный, анальный или оральный секс. [7] Половой путь передачи можно предотвратить с помощью барьерной защиты. [8] Перинатальная передача может произойти во время родов, хотя ее можно предотвратить с помощью лечения матери антибиотиками до рождения и нанесения антибактериального глазного геля на глаза новорожденного. [8] Гонококковые инфекции не вызывают защитного иммунитета; поэтому люди могут быть инфицированы многократно. Повторное заражение возможно из-за способности N. gonorrhoeae уклоняться от иммунной системы, изменяя свои поверхностные белки. [9]
Бессимптомная инфекция распространена как среди мужчин, так и среди женщин. [8] [10] Нелеченая инфекция может распространиться на остальные части тела (диссеминированная гонорея), особенно на суставы (септический артрит). Нелеченая инфекция у женщин может вызвать воспалительные заболевания органов малого таза и возможное бесплодие из-за образующихся рубцов. [11] Гонорея диагностируется с помощью посевов , окрашивания по Граму или тестов на нуклеиновые кислоты (например, полимеразной цепной реакции ) образцов мочи, мазков из уретры или мазков из шейки матки. [12] [13] Рекомендуется совместное тестирование на хламидиоз и тестирование на другие ИППП из-за высоких показателей коинфекции. [14]
Устойчивость к антибиотикам у N. gonorrhoeae становится все более серьезной проблемой общественного здравоохранения, особенно учитывая его склонность к легкому развитию устойчивости. [15] Эта способность N. gonorrhoeae быстро адаптироваться к новым методам лечения антимикробными препаратами наблюдалась несколько раз с 1930-х годов, что сделало многочисленные планы лечения устаревшими. Некоторые штаммы продемонстрировали устойчивость к текущему лечению цефтриаксоном. [16]
Микробиология

Виды Neisseria — это прихотливые грамотрицательные кокки (хотя некоторые виды имеют палочковидную форму и встречаются парами или короткими цепочками), которым для роста в лабораторных культурах требуются питательные добавки. [18] Они являются факультативными внутриклеточными патогенами, то есть они способны сохраняться и колонизировать клетки хозяина, но также могут размножаться вне клеточной среды хозяина. [19] [20] [21] Обычно они появляются парами (диплококки), напоминая по форме кофейные зерна. [21] Представители этого рода не образуют эндоспор и неподвижны, за исключением патогенных видов, которые способны двигаться с помощью подергивания ; [22] большинство из них также являются облигатными аэробами . [23] [24] Из 17 видов, которые колонизируют людей, только два являются патогенными: N. gonorrhoeae, вызывающий гонорею, и N. meningitidis , основная причина бактериального менингита . [25] [26]
Культура и идентификация
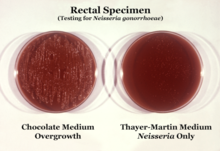
N. gonorrhoeae можно выделить на агаре Тайера-Мартина (или VPN) в атмосфере, обогащенной 3-7% углекислого газа. [12] Агар Тайера-Мартина представляет собой шоколадную агаровую пластину (нагретый кровяной агар), содержащую питательные вещества и противомикробные препараты ( ванкомицин , колистин , нистатин и триметоприм ). Этот препарат агара способствует росту видов Neisseria , одновременно подавляя рост загрязняющих бактерий и грибков. Агар Мартина-Льюиса и Нью-Йорк-Сити — другие типы селективного шоколадного агара, обычно используемые для роста Neisseria . [12] N. gonorrhoeae является оксидазоположительным (обладает цитохром с оксидазой) и каталазоположительным (способен преобразовывать перекись водорода в кислород). [ 12] При инкубации с углеводами лактозой, мальтозой , сахарозой и глюкозой N. gonorrhoeae будет окислять только глюкозу. [12]
Метаболизм
Углерод
В отличие от других видов Neisseria , которые также могут метаболизировать мальтозу, N. gonorrhoeae способна использовать только глюкозу, пируват и лактат в качестве основных источников углерода, а глюкоза катаболизируется как по пути Энтнера-Дудорова (ED), так и по пути пентозофосфата (PP), а путь ED является основным окислительным методом. [19] [27] Использование этих путей необходимо, поскольку N. gonorrhoeae не способна катаболизировать глюкозу по пути Эмбдена-Мейерхофа-Парнаса (EMP) из-за отсутствия у нее гена фосфофруктокиназы (PFK); однако фермент фруктозо-1,6-бисфосфатаза присутствует, что позволяет происходить глюконеогенезу . [19]
Глюкоза сначала метаболизируется через путь ED с образованием пирувата и глицеральдегид-3-фосфата, последний из которых затем может далее метаболизироваться ферментами пути EMP с образованием другой молекулы пирувата. [28] Полученные молекулы пирувата затем преобразуются в ацетил-КоА , который затем может быть включен в качестве субстрата для цикла лимонной кислоты (CAC) для получения высокоэнергетических переносчиков электронов, которые будут использоваться цепью переноса электронов (ETC) для производства АТФ; однако CAC в основном используется для генерации биосинтетических предшественников, а не для катаболических целей. [19] [29] Это частично связано с ингибированной экспрессией нескольких ферментов CAC в присутствии глюкозы, пирувата или лактата. Эти ферменты, а именно цитратсинтаза , аконитаза и изоцитратдегидрогеназа , необходимы для включения ацетата. Вместо этого наблюдался частичный CAC, где α-кетоглутарат образуется глутаматдегидрогеназой или трансаминированием оксалоацетата и глутамата аспартатаминотрансферазой (давая аспартат и α-кетоглутарат). [27] [29] Затем CAC продолжает оттуда, чтобы произвести оксалоацетат, который является важной молекулой-предшественником для ряда биосинтетических путей. [29] Другим отличительным аспектом гонококкового CAC является отсутствие малатдегидрогеназы, которая вместо этого заменена мембраносвязанной малат:хинон-оксидоредуктазой, которая действует независимо от НАД + , напрямую перенося электроны на убихинон. [19]
Наоборот, ацетил-КоА, который не попадает в CAC, но попадает в путь фосфотрансацетилаза - ацетаткиназа (PTA-AckA), где он может быть преобразован в ацетат путем фосфорилирования (для образования ацетилфосфата и высвобождения кофермента А) и дефосфорилирования с образованием АТФ. [30] Хотя этот ацетат может поступать в CAC для дальнейшего окисления, этого не происходит до тех пор, пока присутствуют другие источники углерода, такие как глюкоза или лактат, в этом случае он выводится из клетки или включается в синтез липидов. [28] [31] У N. gonorrhoeae отсутствует глиоксилатный шунт , что не позволяет им использовать ацетат для образования промежуточных продуктов CAC для пополнения цикла. [28] [27]
Значительная часть глицеральдегид-3-фосфата, образующегося в гонококках, перерабатывается через глюконеогенный путь для реформирования глюкозо-6-фосфата, а также промежуточного фруктозо-6-фосфата. Оба они затем могут быть использованы для синтеза пентозы в пути PP через окислительный и неокислительный пути, соответственно, для последующего образования нуклеотидов, а также для производства энергии. [27]
N. gonorrhoeae , как и другие патогенные представители рода Neisseria , являются капнофилами , то есть им для роста требуются концентрации углекислого газа (CO 2 ) выше нормы, либо в форме CO 2 , либо бикарбоната (HCO 3 − ) в зависимости от штамма бактерий. Это требование должно быть выполнено экзогенно во время фаз задержки и стационарного роста, хотя, по-видимому, оно выполняется за счет высокого метаболического производства CO 2 в экспоненциальной фазе. Усвоение этого CO 2 у видов Neisseria осуществляется ферментами карбоангидразы и фосфоенолпирувата в периплазматическом пространстве и цитоплазме соответственно. [27]
Катаболизм лактата также имеет особое значение для гонококков, как для патогенности, так и для роста. [19] Внешний лактат транспортируется в клетку через лактатпермеазу (LctP). [19] Геном N. gonorrhoeae кодирует три фермента лактатдегидрогеназы (ЛДГ), которые обеспечивают метаболизм как L -лактата, так и D -лактата: цитоплазматическую НАД + -зависимую D -лактатдегидрогеназу (LdhA), которая отвечает за два связанных с мембраной ЛДГ, один из которых специфичен для L -лактата (LldD), а другой - для D -лактата (LdhD). [19] [32] Было установлено, что связанные с мембраной ЛДГ представляют собой флавопротеинсодержащие дыхательные ферменты, которые напрямую окисляют лактат для восстановления убихинона . Хотя эти ферменты не перекачивают протоны (ионы H + ) напрямую в периплазматическое пространство, предполагается, что восстановление убихинона этими ферментами способно поступать в более крупную цепь электронов. [32]
Цепь переноса электронов и окислительное фосфорилирование
Как облигатный патоген человека и факультативный анаэробный капнофил , Neisseria gonorrhoeae обычно колонизирует слизистые поверхности в микроаэробных средах, таких как мочеполовой тракт. [19] Рост в областях, где концентрация кислорода ограничена, требует терминальной оксидазы с высоким сродством к кислороду; у гонококков восстановление кислорода осуществляется цитохромоксидазой типа ccb 3. В дополнение к аэробному дыханию гонококки также могут осуществлять анаэробное дыхание посредством восстановления нитрита (NO 2 ) до оксида азота (NO), а также восстановления NO до оксида азота (N 2 O). [19] [33]
Существует несколько ферментов, которые вносят электроны во внутримембранный пул убихинона, первый шаг в ETC. К ним относятся связанные с мембраной LDH (LldD и LdhD), NADH:убихинон оксидоредуктаза (она же NADH дегидрогеназа; комплекс Nuo I), Na + -транслоцирующая NADH дегидрогеназа (Nqr), сукцинатдегидрогеназа (SDH) и связанная с мембраной NAD + -независимая малат:хинон-оксидоредуктаза (MqR). [19]
После первоначального переноса электронов на убихинон, предлагаемые схемы организации гонококковой ETC предполагают, что электроны могут далее передаваться по цепи путем восстановления комплекса цитохрома bc 1 или могут быть напрямую переданы NO как конечному акцептору электронов NO-редуктазой (NorB). [19] [34] В первом случае электроны затем могут передаваться из комплекса bc 1 по двум альтернативным путям через восстановление либо цитохрома c 4 , либо c 5 . Оба этих цитохрома передают электроны на конечную цитохромную оксидазу ccb 3 для восстановления O 2 с образованием H 2 O в аэробных условиях. [19] [33]
Гонококки также восстанавливают NO 2 через индуцируемую наружную мембрану, содержащую медь, нитритредуктазу (AniA, член семейства белков NirK) в анаэробных условиях, хотя этот процесс также был отмечен в микроаэробных условиях как средство дополнительного роста. [34] Это приводит к образованию NO, который впоследствии восстанавливается до N 2 O в частичном пути денитрификации. [19] [33] [ 34] Оксидаза ccb 3 N. gonorrhoeae , в отличие от других членов рода Neisseria , является трехгемовым белком, который может переносить электроны не только на O 2 (сохраняется среди видов Neisseria ), но и на AniA для восстановления NO 2. Это в дополнение к типичному процессу получения электронов, переданных от цитохрома c 5 . [34] [35]
Общей целью ETC является формирование электрохимического градиента ионов водорода (H + или протонов), возникающих в результате разницы концентраций на плазматической мембране, необходимого для обеспечения производства АТФ в процессе, известном как окислительное фосфорилирование . [36] У гонококков перемещение протонов в периплазматическое пространство осуществляется комплексом Nuo I, комплексом цитохрома bc 1 и цитохромом ccb 3. [19] [ 34] [37] Впоследствии синтез АТФ осуществляется F 1 F 0 АТФ-синтазой , двухкомпонентным белковым комплексом, присутствующим у гонококков, а также у многочисленных других видов в филогенетических доменах. [38] Этот комплекс связывает транслокацию протонов обратно в цитоплазму вдоль своего градиента с механическим вращением для генерации АТФ. [39]
Железо
Общей целью ETC является формирование электрохимического градиента ионов водорода (H + или протонов), возникающих в результате разницы концентраций на плазматической мембране, необходимого для обеспечения производства АТФ в процессе, известном как окислительное фосфорилирование . [36] У гонококков перемещение протонов в периплазматическое пространство осуществляется комплексом Nuo I, комплексом цитохрома bc 1 и цитохромом ccb 3. [19] [ 34] [37] Впоследствии синтез АТФ осуществляется F 1 F 0 АТФ-синтазой , двухкомпонентным белковым комплексом, присутствующим у гонококков, а также у многочисленных других видов в филогенетических доменах. [38] Этот комплекс связывает транслокацию протонов обратно в цитоплазму вдоль своего градиента с механическим вращением для генерации АТФ. [39]
Чтобы получить необходимое железо, гонококки производят TonB-зависимые транспортеры (TDTs) на поверхности своей внешней мембраны, которые способны напрямую извлекать железо вместе с другими металлами из соответствующих им белков-носителей. Некоторые из них включают трансферрин-связывающие белки A (TbpA) и B (TbpB), лактоферрин-связывающие белки A (LbpA) и B (LbpB), а также гемоглобин/гемоглобин-гаптоглобин-связывающие белки HpuB и HpuA. [19] [40] В дополнение к этим белкам гонококки также способны использовать сидерофоры , или соединения, способные хелатировать железо в окружающей среде, которые производятся другими бактериями; однако гонококковые клетки не способны синтезировать сидерофоры сами. Эти ксеносидерофоры поглощаются TDT FetA через внешнюю мембрану, а затем переносятся в клетку транспортной системой fetBCDEF . [19] [40]
Наряду с защитой от секвестрации, которая может быть дополнительно усилена воспалением хозяина, люди также вырабатывают сидерокалины , которые способны хелатировать сидерофоры в качестве дополнительного метода ингибирования роста патогенных бактерий. Иногда они неэффективны против N. gonorrhoeae , которая способна колонизировать внутриклеточно, особенно в фагоцитарных клетках, таких как макрофаги и нейтрофилы. Увеличение внутриклеточного железа хозяина также подавляет некоторые внутриклеточные механизмы уничтожения патогенов; по совпадению, патогенные Neisseria способны изменять несколько механизмов клетки хозяина, что в конечном итоге позволяет патогену забирать большую часть доступного железа из иммунной клетки хозяина. [40]
Поверхностные молекулы
На своей поверхности N. gonorrhoeae несет волосовидные пили , поверхностные белки с различными функциями и сахара, называемые липоолигосахаридами . Пили опосредуют адгезию, движение и обмен ДНК. Белки, ассоциированные с непрозрачностью (Opa), взаимодействуют с иммунной системой, как и порины . Липоолигосахарид — это эндотоксин , который вызывает иммунный ответ. Все они являются антигенными и демонстрируют антигенную изменчивость . Пили, белки Opa, порины и даже липоолигосахарид обладают механизмами ингибирования иммунного ответа, что делает возможным бессимптомное инфицирование. [41]
Опа-белки
Белки адгезина, ассоциированные с фазово-переменной непрозрачностью (Opa), используются N. gonorrhoeae как часть уклонения от иммунного ответа в клетке-хозяине. Известно не менее 12 белков Opa, а многочисленные вариации поверхностных белков затрудняют распознавание N. gonorrhoeae и создание защиты иммунными клетками. [42] Белки Opa находятся во внешней мембране и способствуют ответу, когда бактерии взаимодействуют с различными клетками-хозяевами. Эти белки связываются с различными эпителиальными клетками и позволяют N. gonorrhoeae увеличивать продолжительность инфекции, а также увеличивать объем вторжения в другие клетки-хозяева. [43]
Тип IV пили

Динамические полимерные белковые нити, называемые пилями типа IV, позволяют N. gonorrhoeae выполнять множество бактериальных процессов, включая адгезию к поверхностям, способность к трансформации, подергивание подвижности и уклонение от иммунного ответа. [19] Чтобы проникнуть в хозяина, бактерия использует пили для прикрепления к слизистым поверхностям и проникновения в них. Пили являются ключевым фактором вирулентности для N. gonorrhoeae ; без них бактерия не способна способствовать колонизации. [44] Для подвижности отдельные бактерии используют свои пили таким образом, который напоминает крюк для захвата: сначала они вытягиваются с поверхности клетки и прикрепляются к субстрату . Последующее втягивание пилей тянет клетку вперед. Результирующее движение называется подергиванием подвижности. N. gonorrhoeae способна тянуть в 100 000 раз больше собственного веса, [45] и пили, используемые для этого, являются одними из самых мощных биологических двигателей, известных на сегодняшний день, прилагая один наноньютон . [45] Белки АТФазы PilF и PilT отвечают за обеспечение расширения и ретракции пилей типа IV соответственно. Адгезивные функции гонококковых пилей играют роль в агрегации микроколоний и образовании биопленки . Эти пили также используются для избежания иммунных реакций со стороны клетки, в которую они вторгаются, за счет антигенной вариации их пилей типа IV. Основная нить пилей очень часто заменяется переменными последовательностями ДНК. [19] Быстро выполняя этот процесс, они способны создавать на своей поверхности разнообразные пили и избегать иммунного ответа клетки-хозяина. [44]
Липоолигосахарид
Липоолигосахарид — это низкомолекулярная версия липополисахарида, присутствующая на поверхности большинства других грамотрицательных бактерий. Это боковая цепь сахара (сахарида), прикрепленная к липиду А (следовательно, «липо-») во внешней мембране, покрывающей клеточную стенку бактерий. Корень «олиго» относится к тому факту, что он на несколько сахаров короче типичного липополисахарида. [6] Как эндотоксин, он вызывает воспаление. Выделение липоолигосахарида бактериями иногда является причиной проблем, связанных с воспалительными заболеваниями органов малого таза. [6] Хотя он функционирует в первую очередь как эндотоксин, липоолигосахарид может маскироваться под сиаловую кислоту хозяина и блокировать инициацию каскада комплемента . [6]
Антигенная вариация
N. gonorrhoeae уклоняется от иммунной системы с помощью процесса, называемого антигенной изменчивостью . [46] Этот процесс позволяет N. gonorrhoeae рекомбинировать свои гены и изменять антигенные детерминанты , которые украшают его поверхность, [6], такие как пили типа IV. [47] Проще говоря, химический состав молекул изменяется из-за изменений на генетическом уровне. [9] N. gonorrhoeae способен изменять состав своих пилей и липоолигосахаридов. Из них пили демонстрируют наибольшую антигенную изменчивость из-за хромосомной перестройки. [11] [6] Ген pilS является примером этой способности к перестройке, поскольку его сочетание с геном pilE, как оценивается, производит более 100 вариантов белка PilE. [9] Эти изменения позволяют приспосабливаться к локальным различиям окружающей среды в месте заражения, уклоняться от распознавания целевыми антителами и подавлять формирование эффективной вакцины. [9]
В дополнение к перестройке генов, он также обладает естественной компетентностью , то есть может приобретать внеклеточную ДНК из окружающей среды через свои пили типа IV, в частности белки PilQ и PilT. [48] Эти процессы позволяют N. gonorrhoeae приобретать и распространять новые гены, маскироваться с помощью различных поверхностных белков и предотвращать развитие иммунологической памяти — способности, которая способствовала устойчивости к антибиотикам и препятствовала разработке вакцин. [49]
Изменение фазы
Фазовая вариация похожа на антигенную вариацию, но вместо изменений на генетическом уровне, изменяющих состав молекул, эти генетические изменения приводят к активации или деактивации гена. [9] Фазовая вариация чаще всего возникает из-за сдвига рамки считывания в экспрессируемом гене. [9] Белки Opa N. gonorrhoeae строго зависят от фазовой вариации. [9] Каждый раз, когда бактерии реплицируются, они могут включать или выключать несколько белков Opa посредством неправильного спаривания со смещенной цепью . То есть, бактерии вносят мутации сдвига рамки считывания, которые вводят гены в рамку или выводят их из нее. В результате каждый раз транслируются разные гены Opa. [6] Пили различаются антигенной вариацией, но также и фазовой вариацией. [9] Сдвиги рамки происходят как в генах pilE , так и в генах pilC , эффективно отключая экспрессию пилей в ситуациях, когда они не нужны, например, во время внутриклеточной колонизации в отличие от адгезии к поверхности внеклеточных слизистых клеток. [9]
Выживаемость гонококков
После того, как гонококки проникают в эпителиальные клетки хозяина и трансцитируют их, они попадают в подслизистую оболочку, где нейтрофилы быстро их поглощают. [6] Пили и белки Opa на поверхности могут мешать фагоцитозу, [11] но большинство гонококков оказываются в нейтрофилах. Экссудаты инфицированных людей содержат много нейтрофилов с проглоченными гонококками. Нейтрофилы выделяют окислительный выброс активных форм кислорода в своих фагосомах, чтобы убить гонококки. [50] Однако значительная часть гонококков может противостоять убийству благодаря действию своей каталазы [6], которая расщепляет активные формы кислорода и способна размножаться внутри нейтрофильных фагосом. [51]
Бактериальный белок RecA, который опосредует восстановление повреждений ДНК, играет важную роль в выживании гонококков. [52] N. gonorrhoeae может заменять ДНК, поврежденную в нейтрофильных фагосомах, ДНК соседних гонококков. [53] Процесс, в котором реципиентные гонококки интегрируют ДНК соседних гонококков в свой геном, называется трансформацией. [54]
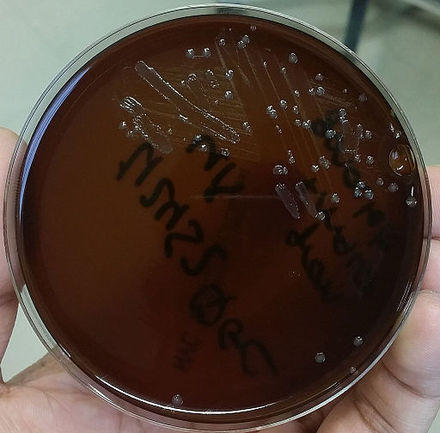
Геном
Геномы нескольких штаммов N. gonorrhoeae были секвенированы. Большинство из них имеют размер около 2,1 Мб и кодируют от 2100 до 2600 белков (хотя большинство, по-видимому, находятся в нижнем диапазоне). [ 55] Например, штамм NCCP11945 состоит из одной кольцевой хромосомы (2 232 025 п.н.), кодирующей 2 662 предсказанных открытых рамок считывания (ORF), и одной плазмиды (4 153 п.н.), кодирующей 12 предсказанных ORF. Расчетная плотность кодирования по всему геному составляет 87%, а среднее содержание G+C составляет 52,4%, значения, которые аналогичны значениям штамма FA1090. Геном NCCP11945 кодирует 54 тРНК и четыре копии оперонов 16S-23S-5S рРНК. [56]
Горизонтальный перенос генов
Горизонтальный перенос генов , также называемый латеральным переносом генов, представляет собой обмен генетической информацией между живыми организмами. [57] Эта передача информации является движущей силой устойчивости к антибиотикам у N. gonorrhoeae . [58] [59] Исследования показали, что N. gonorrhoeae приобрела методы устойчивости к противомикробным препаратам посредством горизонтального переноса генов от других видов Neisseria, включая N. lactamica , N. macacae и N. mucosa. [60]
Трансформация в N. gonorrhoeae осуществляется пилями типа IV, где ДНК связывается и переносится в клетку, после чего происходит процессинг и гомологичная рекомбинация. [61]
Найденный в некоторых геномах Neisseria gonorrhoeae , гонококковый генетический остров (GGI), геномный остров (GI), специфичный для гонококков, был идентифицирован как мобильный генетический элемент, который приобретается горизонтально. [62] [63] GGI участвует в устойчивости к противомикробным препаратам, передаче генетической информации и приобретении железа. [62] Гены в гонококковом генетическом острове кодируют печально известную систему секреции типа IV (T4SS), которая отвечает за секрецию ДНК и необходима для образования биопленки. [62] [64]
В 2011 году исследователи из Северо-Западного университета обнаружили доказательства наличия фрагмента человеческой ДНК в геноме N. gonorrhoeae , что стало первым примером горизонтального переноса генов от человека к бактериальному патогену. [65] [66]
Болезнь
Симптомы
Симптомы заражения N. gonorrhoeae различаются в зависимости от места заражения, и многие инфекции протекают бессимптомно независимо от пола. [67] [41] [7] В зависимости от пути передачи N. gonorrhoeae может вызывать инфекцию горла ( фарингит ) или инфекцию заднего прохода/прямой кишки ( проктит ). [68] [11]
Диссеминированные гонококковые инфекции могут возникнуть, когда N. gonorrhoeae попадает в кровоток, часто распространяясь на суставы и вызывая сыпь (синдром дерматита-артрита). [68] Синдром дерматита-артрита приводит к болям в суставах ( артрит ), воспалению сухожилий ( теносиновит ) и безболезненному незудящему (не зудящему) дерматиту . [11] Диссеминированная инфекция и воспалительные заболевания органов малого таза у женщин, как правило, начинаются после менструации из-за рефлюкса во время менструации, что облегчает распространение. [68] В редких случаях диссеминированная инфекция может вызвать инфекцию оболочек головного и спинного мозга ( менингит ) или инфекцию клапанов сердца ( эндокардит ). [68] [69]
Мужской
У мужчин с симптомами основным симптомом инфекции мочеполовой системы является уретрит — жжение при мочеиспускании ( дизурия ), учащенные позывы к мочеиспусканию и гнойные выделения из полового члена. Выделения могут иметь неприятный запах. [68] При отсутствии лечения рубцевание уретры может привести к затруднению мочеиспускания. Инфекция может распространиться из уретры в половой член на близлежащие структуры, включая яички ( эпидидимит / орхит ) или на простату ( простатит ). [68] [11] [70]
Женский
.jpg/440px-Neisseria_gonorrhoeae_and_pus_cells_in_a_vaginal_swab_(Gram_stain).jpg)
У женщин с симптомами основными симптомами инфекции мочеполовой системы являются повышенные выделения из влагалища, жжение при мочеиспускании ( дизурия ), повышенные позывы к мочеиспусканию, боль при половом акте или нарушения менструального цикла. Воспалительное заболевание органов малого таза возникает, если N. gonorrhoeae поднимается в брюшину малого таза (через шейку матки , эндометрий и маточные трубы ). Возникающее в результате воспаление и рубцевание маточных труб может привести к бесплодию и повышенному риску внематочной беременности. [68] Воспалительное заболевание органов малого таза развивается у 10–20 % женщин, инфицированных N. gonorrhoeae . [68]
Новорожденные (перинатальная инфекция)
При перинатальной инфекции первичным проявлением является инфекция глаза (неонатальный конъюнктивит или ophthalmia neonatorum ), когда новорожденный подвергается воздействию N. gonorrhoeae в родовых путях. Инфекция глаза может привести к рубцеванию или перфорации роговицы, что в конечном итоге приводит к слепоте. Если новорожденный подвергается воздействию во время родов, конъюнктивит возникает в течение 2–5 дней после рождения и является тяжелым. [68] [69] Гонококковая ophthalmia neonatorum, когда-то распространенная у новорожденных, предотвращается нанесением эритромицинового (антибиотического) геля на глаза младенцев при рождении в качестве меры общественного здравоохранения. Нитрат серебра больше не используется в Соединенных Штатах. [69] [68]
Передача инфекции
N. gonorrhoeae чаще всего передается через вагинальный, оральный или анальный секс; неполовой путь передачи маловероятен при инфицировании взрослых. [7] Он также может передаваться новорожденному во время прохождения через родовые пути, если у матери есть нелеченная инфекция мочеполовой системы. Учитывая высокий уровень бессимптомной инфекции, рекомендуется, чтобы беременные женщины проходили тестирование на гонококковую инфекцию до родов. [7] Общие ванны, общие полотенца или ткани, ректальные термометры и ненадлежащая гигиена рук лицами, осуществляющими уход, были определены как потенциальные средства передачи в педиатрических условиях. [71]
Традиционно считалось, что бактерия перемещается, прикрепляясь к сперматозоидам, но эта гипотеза не объясняла передачу заболевания от женщины к мужчине. Недавнее исследование предполагает, что вместо того, чтобы «плыть» по шевелящейся сперме , бактерии N. gonorrhoeae используют пили для закрепления на белках в сперме и перемещения через коитальную жидкость. [72]
Инфекция
Успешная передача сопровождается прилипанием к эпителиальным клеткам , обнаруженным на инфицированном участке слизистой оболочки, пилями типа IV бактерии . Способность пилей прикрепляться и впоследствии втягиваться тянет N. gonorrhoeae к эпителиальной мембране на поверхности клетки слизистой оболочки. [15] После прикрепления N. gonorrhoeae реплицирует свой геном и делится, образуя микроколонии . [15] Гонококковой инфекции иногда способствует мембранный кофакторный белок CD46, поскольку он, как известно, действует как рецептор для гонококковых пилей. [41] Кроме того, было показано, что взаимодействие с пилями вызывает перестройку цитоскелета клетки-хозяина, что дополнительно демонстрирует, что вовлечение гонококковых пилей нарушает реакцию клетки-хозяина и увеличивает вероятность успешного инфицирования. [41] Во время роста и колонизации N. gonorrhoeae стимулирует высвобождение провоспалительных цитокинов и хемокинов из иммунных клеток хозяина, что приводит к привлечению нейтрофилов в эту область. [9] Эти фагоцитарные клетки обычно поглощают чужеродные патогены и уничтожают их, однако способность N. gonorrhoeae манипулировать реакцией клеток хозяина позволяет патогену выживать внутри этих иммунных клеток и избегать элиминации. [9]
Лабораторная диагностика
Основными методами обнаружения Neisseria gonorrhoeae являются тесты амплификации нуклеиновых кислот , которые являются наиболее чувствительными из имеющихся методов. [73] [74] Другие методы обнаружения включают микроскопию и культивирование. [73]
Профилактика
Передача снижается за счет использования латексных барьеров (например, презервативов или зубных прокладок ) во время секса и ограничения числа сексуальных партнеров. [8] Презервативы и зубные прокладки следует использовать также во время орального и анального секса. Спермициды, вагинальные пены и спринцевания не являются эффективными методами профилактики передачи. [6]
Вакцина
Вакцина против N. gonorrhoeae становится все более необходимой из-за растущей заболеваемости, повышения устойчивости к противомикробным препаратам и ее влияния на репродуктивное здоровье. [75] Существуют проблемы, которые препятствуют разработке вакцины, в том числе: отсутствие иммунитета после заражения, исключительно человеческие хозяева и антигенная и фазовая изменчивость потенциальных мишеней вакцины. [76] В настоящее время разрабатывается несколько вакцин против N. gonorrhoeae , включая вакцину на основе везикул внешней мембраны. [76] К ним относятся вакцины-кандидаты NGoXIM, нативная OMV и Bexsero/4CMenB, которые все находятся на поздних клинических стадиях разработки. [77] Создание вакцины против N. gonorrhoeae имеет несколько потенциальных последствий для общественного здравоохранения. По одной из оценок, вакцина для гетеросексуального населения, вводимая до начала половой жизни, показала, что распространенность N. gonorrhoeae может быть снижена на 90% через 20 лет. [76]
Уход
В настоящее время CDC рекомендует однократную дозу инъекционного цефалоспорина , цефтриаксона , в качестве первой линии защиты от гонококковых инфекций. [78] Людям с массой тела менее 150 кг обычно назначают концентрацию цефтриаксона 500 мг, в то время как людям с массой тела более 150 кг обычно назначают дозу 1 г. Хотя цефтриаксон — не единственный цефалоспорин, который эффективен при лечении гонореи, он наиболее выгоден. [75] В случае аллергии на цефалоспорины CDC рекомендует двойное лечение гентамицином и азитромицином . Каждый препарат следует вводить в виде однократной дозы, при этом гентамицин вводят внутримышечно в концентрации 240 мг вместе с 2 г азитромицина, принимаемого перорально. [75] Если у человека нет аллергии на цефалоспорины, но цефтриаксон недоступен, альтернативным лечением является однократная доза 800 мг цефиксима, принимаемая перорально. [75] Во всех этих случаях рекомендуется комбинированная терапия и совместное лечение хламидиоза, поскольку одновременные инфекции являются обычным явлением. [79]
Устойчивость к антибиотикам
Устойчивость к антибиотикам при гонорее была впервые выявлена в 1940-х годах. Гонорею лечили пенициллином, но дозы приходилось постепенно увеличивать, чтобы они оставались эффективными. К 1970-м годам гонорея, устойчивая к пенициллину и тетрациклину, появилась в Тихоокеанском бассейне. Затем эти устойчивые штаммы распространились на Гавайи, в Калифорнию, остальную часть Соединенных Штатов, Австралию и Европу. Фторхинолоны были следующей линией обороны, но вскоре появилась и устойчивость к этому антибиотику. С 2007 года стандартным лечением стали цефалоспорины третьего поколения, такие как цефтриаксон, которые считаются нашей «последней линией обороны». [80] [81] Недавно в Японии был обнаружен штамм гонореи с высокой устойчивостью к цефтриаксону под названием H041. Лабораторные тесты показали, что он устойчив к высоким концентрациям цефтриаксона, а также к большинству других протестированных антибиотиков. В N. gonorrhoeae существуют гены, которые обеспечивают устойчивость к каждому антибиотику, используемому для лечения гонореи, но до сих пор они не сосуществуют в пределах одного гонококка. Однако из-за высокой способности N. gonorrhoeae к горизонтальному переносу генов, гонорея, устойчивая к антибиотикам, рассматривается как новая угроза общественному здравоохранению. [81]
До 2007 года фторхинолоны были распространенной рекомендацией по лечению гонореи. CDC прекратили предлагать эти системные бактериальные агенты, как только в Соединенных Штатах появился резистентный штамм N. gonorrhoeae . Удаление фторхинолонов как потенциального лечения оставило цефалоспорины как единственный жизнеспособный антимикробный вариант лечения гонореи. Опасаясь дальнейшей гонококковой резистентности, рекомендации CDC в 2010 году изменились на стратегию двойной терапии — цефалоспорин либо с азитромицином , либо с доксициклином . Несмотря на эти усилия, к 2011 году резистентные N. gonorrhoeae были зарегистрированы на пяти континентах, что еще больше ограничило варианты лечения и рекомендации. Устойчивость к противомикробным препаратам не является универсальной, и штаммы N. gonorrhoeae в Соединенных Штатах продолжают реагировать на комбинированный режим цефтриаксона и азитромицина. [82]
Устойчивость к сыворотке
Как грамотрицательная бактерия, N. gonorrhoeae требует защитных механизмов для защиты себя от системы комплемента (или каскада комплемента), компоненты которой обнаружены в сыворотке человека . [41] Существует три различных пути, которые активируют эту систему, однако все они приводят к активации белка комплемента 3 (C3). [83] Расщепленная часть этого белка, C3b , откладывается на патогенных поверхностях и приводит к опсонизации , а также к последующей активации комплекса мембранной атаки . [83] N. gonorrhoeae имеет несколько механизмов, чтобы избежать этого действия. [15] В целом эти механизмы называются сывороточной резистентностью. [15]
История
Происхождение имени
Neisseria gonorrhoeae названа в честь Альберта Нейссера, который выделил ее как возбудителя гонореи в 1878 году. [15] [3] Гален (130 г. н. э.) ввел термин «гонорея» от греческого gonos , что означает «семя» и rhoe , что означает «поток». [84] [9] Таким образом, гонорея означает «поток семени», описание, относящееся к белым выделениям из полового члена, предположительно, семенной жидкости, наблюдаемым при мужском заражении. [15]
Открытие
В 1878 году Альберт Нейссер выделил и визуализировал диплококки N. gonorrhoeae в образцах гноя от 35 мужчин и женщин с классическими симптомами мочеполовой инфекции гонореей — двое из которых также имели инфекции глаз. [9] В 1882 году Лейстиков и Леффлер смогли вырастить организм в культуре. [15] Затем в 1883 году Макс Бокхарт окончательно доказал, что бактерия, выделенная Альбертом Нейссером, была возбудителем заболевания, известного как гонорея, путем инокуляции полового члена здорового мужчины бактериями. [9] У мужчины развились классические симптомы гонореи через несколько дней, что удовлетворяло последнему из постулатов Коха . До этого момента исследователи спорили, являются ли сифилис и гонорея проявлениями одного и того же заболевания или двумя разными сущностями. [85] [9] Один из таких исследователей 18-го века, Джон Хантер, попытался урегулировать спор в 1767 году [9] , привив мужчине гной, взятый у пациента с гонореей. Он ошибочно заключил, что сифилис и гонорея действительно были одним и тем же заболеванием, когда у мужчины появилась сыпь медного цвета, которая является классической для сифилиса. [83] [85] Хотя многие источники повторяют, что Хантер привил себя сам, [83] [15] другие утверждали, что на самом деле это был другой мужчина. [86] После эксперимента Хантера другие ученые пытались опровергнуть его выводы, прививая других мужчин-врачей, студентов-медиков [15] и заключенных мужчин гонорейным гноем, у всех из которых развилось жжение и выделение гонореи. Один исследователь, Рикорд, взял на себя инициативу провести 667 прививок гонорейного гноя пациентам психиатрической больницы, при этом не было ни одного случая сифилиса. [9] [15] Примечательно, что появление пенициллина в 1940-х годах сделало доступным эффективное лечение гонореи. [87]
Смотрите также
Ссылки
- ^ Euzéby JP, Parte AC. "Genus Neisseria". Список прокариотических названий со стоянием в номенклатуре (LPSN) . Получено 7 июля 2017 г.
- ^ Нейссер А (1879). «Ueber eine der Gonorrhoe eigentümliche Micrococusform» [О форме микрокока, свойственной гонорее]. Centralblatt für die medizinischen Wissenschaften (на немецком языке). 17 (28): 497–500 .
- ^ abc O'Donnell JA, Gelone SP (2009). "Бактериальная причина PID: Gonorrhoeae". Воспалительные заболевания органов малого таза . Infobase Publishing. ISBN 978-1-4381-0159-0.
- ^ Инаба С., Айзава Ю., Катаока С., Сайто А. (декабрь 2023 г.). «Гнойные выделения из носа при гонококковом назофарингите у новорожденного». Журнал инфекции и химиотерапии . 29 (12): 1164–1166 . doi :10.1016/j.jiac.2023.08.005. ПМИД 37558089.
- ^ Махапуре К, Сингх А (август 2023 г.). «Обзор последних достижений в нашем понимании Neisseria gonorrhoeae». Cureus . 15 (8): e43464. doi : 10.7759/cureus.43464 . PMC 10498933 . PMID 37711920.
- ^ abcdefghijk Райан К.Дж., Рэй К.Г., ред. (2004). Sherris Medical Microbiology (4-е изд.). McGraw Hill. ISBN 978-0-8385-8529-0.[ нужна страница ]
- ^ abcd "Подробные факты о ЗППП - Гонорея". www.cdc.gov . 26 сентября 2017 г. . Получено 7 декабря 2017 г. .
- ^ abcd "2015 Sexually Transmitted Diseases Treatment Guidelines". CDC . Центры по контролю и профилактике заболеваний, Министерство здравоохранения и социальных служб США. Архивировано из оригинала 22 декабря 2015 г.
- ^ abcdefghijklmnopq Hill SA, Masters TL, Wachter J (сентябрь 2016 г.). «Гонорея — развивающееся заболевание нового тысячелетия». Microbial Cell . 3 (9): 371– 389. doi : 10.15698 /mic2016.09.524 (неактивен 1 ноября 2024 г.). PMC 5354566. PMID 28357376.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка ) - ^ "Заключительное заявление о рекомендациях: хламидиоз и гонорея: скрининг". Целевая группа профилактических служб США . Получено 7 декабря 2017 г.
- ^ abcdef Левинсон В. (2014). Обзор медицинской микробиологии и иммунологии . McGraw-Hill Education. ISBN 978-0-07-181811-7. OCLC 871305336.[ нужна страница ]
- ^ abcde Ng LK, Martin IE (январь 2005 г.). «Лабораторная диагностика Neisseria gonorrhoeae». Канадский журнал инфекционных заболеваний и медицинской микробиологии . 16 (1): 15– 25. doi : 10.1155/2005/323082 . PMC 2095009. PMID 18159523 .
- ^ "Гонококковые инфекции - Руководство по лечению ЗППП 2015". 4 января 2018 г.
- ^ MacKenzie CR, Henrich B, ред. (2012). Диагностика заболеваний, передающихся половым путем: методы и протоколы . Humana Press. ISBN 978-1-61779-936-5. OCLC 781681739.
- ^ abcdefghijk Quillin SJ, Seifert HS (апрель 2018 г.). «Адаптация и патогенез Neisseria gonorrhoeae к хозяину». Nature Reviews. Microbiology . 16 (4): 226– 240. doi : 10.1038 /nrmicro.2017.169. PMC 6329377. PMID 29430011.
- ^ Коста-Лоренсо AP, Баррос Дос Сантос КТ, Морейра Б.М., Fracalanzza SE, Бонелли RR (1 октября 2017 г.). «Устойчивость Neisseria gonorrhoeae к противомикробным препаратам: история, молекулярные механизмы и эпидемиологические аспекты возникающей глобальной угрозы». Бразильский журнал микробиологии . 48 (4): 617–628 . doi :10.1016/j.bjm.2017.06.001. ПМЦ 5628311 . ПМИД 28754299.
- ^ Sell J, Nasir M, Courchesne C (май 2021 г.). «Уретрит: быстрый обзор доказательств». American Family Physician . 103 (9): 553–558 . PMID 33929174.
- ^ Ван Путтен Дж., Тоньюм Т. (2010). «Нейсерия». Инфекционные болезни . стр. 1676–1689 . doi : 10.1016/b978-0-323-04579-7.00168-4. ISBN 978-0-323-04579-7.
- ^ abcdefghijklmnopqrst Green LR, Cole J, Parga EF, Shaw JG (2022). Физиология и патогенез Neisseria gonorrhoeae . Достижения в микробной физиологии. Т. 80. С. 35–83 . doi :10.1016/bs.ampbs.2022.01.002. ISBN 978-0-323-98869-8. PMID 35489793.
- ^ Silva MT (2012). «Классическая маркировка бактериальных патогенов в соответствии с их образом жизни в хозяине: несоответствия и альтернативы». Frontiers in Microbiology . 3 : 71. doi : 10.3389/fmicb.2012.00071 . PMC 3289908. PMID 22393329 .
- ^ ab Yeshanew AG, Geremew RA (17 июля 2018 г.). "Neisseria Gonorrhoae и их антимикробные паттерны восприимчивости среди симптоматических пациентов из города Гондар, северо-западная Эфиопия". Antimicrobial Resistance and Infection Control . 7 (1): 85. doi : 10.1186/s13756-018-0376-3 . PMC 6050735. PMID 30026943 .
- ^ Тоньюм Т, Ван Путтен Дж (2017). «Нейсерия». Инфекционные болезни . стр. 1553–1564.д1. дои : 10.1016/B978-0-7020-6285-8.00179-9. ISBN 978-0-7020-6285-8.
Эндоспоры и экзотоксины не обнаружены, жгутики отсутствуют. Некоторые Neisseria spp., включая N. gonorrhoeae и N. meningitidis, могут демонстрировать поверхностно-связанную подергивающуюся подвижность из-за ретракции пилей.
- ^ Gray-Owen SD, Dehio C, Rudel T, Naumann M, Meyer TF (2001). "Neisseria". Принципы бактериального патогенеза . С. 559–618 . doi :10.1016/b978-012304220-0/50013-3. ISBN 978-0-12-304220-0.
- ^ Eriksson J, Eriksson OS, Maudsdotter L, Palm O, Engman J, Sarkissian T, et al. (Апрель 2015). "Характеристика подвижности и пилиации у патогенных Neisseria". BMC Microbiology . 15 (1): 92. doi : 10.1186/s12866-015-0424-6 . PMC 4449605 . PMID 25925502.
- ^ Ladhani SN, Lucidarme J, Parikh SR, Campbell H, Borrow R, Ramsay ME (июнь 2020 г.). «Менингококковая инфекция и ее половая передача: урогенитальные и аноректальные инфекции и инвазивное заболевание, вызванное Neisseria meningitidis». Lancet . 395 (10240): 1865–1877 . doi :10.1016/S0140-6736(20)30913-2. PMID 32534649. S2CID 219701418.
- ^ Гройсман EA, ред. (2001). Принципы бактериального патогенеза . Сан-Диего, Калифорния: Academic Press. ISBN 978-0-12-304220-0.
- ^ abcde Morse SA, Cacciapuoti AF, Lysko PG (1 января 1980 г.). "Физиология Neisseria gonorrhoeae". В Rose AH, Morris JG (ред.). Advances in Microbial Physiology Volume 20. Vol. 20. Academic Press. pp. 251– 320. doi :10.1016/s0065-2911(08)60209-x. ISBN 978-0-12-027720-9. PMID 43667.
- ^ abc Morse SA, Stein S, Hines J (ноябрь 1974 г.). «Метаболизм глюкозы у Neisseria gonorrhoeae». Журнал бактериологии . 120 (2): 702–714 . doi :10.1128/jb.120.2.702-714.1974. PMC 245830. PMID 4156358 .
- ^ abc Hebeler BH, Morse SA (октябрь 1976 г.). "Физиология и метаболизм патогенных нейссерий: активность цикла трикарбоновых кислот в Neisseria gonorrhoeae". Журнал бактериологии . 128 (1): 192– 201. doi :10.1128/jb.128.1.192-201.1976. PMC 232843. PMID 824268 .
- ^ Ингрэм-Смит К., Мартин СР, Смит КС (июнь 2006 г.). «Ацетаткиназа: не просто бактериальный фермент». Тенденции в микробиологии . 14 (6): 249– 253. doi :10.1016/j.tim.2006.04.001. PMID 16678422.
- ^ Leighton MP, Kelly DJ, Williamson MP, Shaw JG (июнь 2001 г.). «Исследование метаболизма углерода Neisseria meningitidis с помощью ЯМР и ферментов». Микробиология . 147 (ч. 6): 1473–1482 . doi : 10.1099/00221287-147-6-1473 . PMID 11390678.
- ^ ab Atack JM, Ibranovic I, Ong CL, Djoko KY, Chen NH, Vanden Hoven R, et al. (Октябрь 2014). «Роль лактатдегидрогеназ в выживании Neisseria gonorrhoeae в полиморфноядерных лейкоцитах человека и эпителиальных клетках шейки матки». Журнал инфекционных заболеваний . 210 (8): 1311– 1318. doi :10.1093/infdis/jiu230. PMC 4215069. PMID 24737798 .
- ^ abc Li Y, Hopper A, Overton T, Squire DJ, Cole J, Tovell N (май 2010 г.). «Организация цепи переноса электронов на кислород у облигатного человеческого патогена Neisseria gonorrhoeae: роли цитохромов c4 и c5, но не цитохрома c2, в восстановлении кислорода». Журнал бактериологии . 192 (9): 2395– 2406. doi :10.1128/JB.00002-10. PMC 2863483. PMID 20154126 .
- ^ abcdef Aspholm M, Aas FE, Harrison OB, Quinn D, Vik A, Viburiene R и др. (август 2010 г.). «Структурные изменения в компоненте цитохром с оксидазы и молекулярная эволюция патогенных нейссерий у людей». PLOS Pathogens . 6 (8): e1001055. doi : 10.1371/journal.ppat.1001055 . PMC 2924362. PMID 20808844 .
- ^ Hopper A, Tovell N, Cole J (декабрь 2009 г.). "Физиологически значимая роль в восстановлении нитрита субъединицы CcoP цитохромоксидазы cbb 3 из Neisseria gonorrhoeae". FEMS Microbiology Letters . 301 (2): 232– 240. doi :10.1111/j.1574-6968.2009.01824.x. PMID 19889029.
- ^ ab Anraku Y (июнь 1988). «Бактериальные цепи переноса электронов». Annual Review of Biochemistry . 57 (1): 101– 132. doi :10.1146/annurev.bi.57.070188.000533. PMID 3052268.
- ^ ab Trumpower BL (июнь 1990). «Цитохромные bc1 комплексы микроорганизмов». Microbiological Reviews . 54 (2): 101– 129. doi :10.1128/mr.54.2.101-129.1990. PMC 372766. PMID 2163487 .
- ^ ab "UniProt". www.uniprot.org . Получено 18 ноября 2024 г. .
- ^ ab Capaldi RA, Aggeler R (март 2002). «Механизм синтазы АТФ типа F(1)F(0), биологического роторного двигателя». Trends in Biochemical Sciences . 27 (3): 154– 160. doi :10.1016/s0968-0004(01)02051-5. PMID 11893513.
- ^ abc Stoudenmire JL, Greenawalt AN, Cornelissen CN (15 сентября 2022 г.). «Скрытые микробы: как Neisseria gonorrhoeae захватывает защищенное железо во время инфекции». Frontiers in Cellular and Infection Microbiology . 12 : 1017348. doi : 10.3389/fcimb.2022.1017348 . PMC 9519893. PMID 36189345.
- ^ abcde Edwards JL, Apicella MA (октябрь 2004 г.). «Молекулярные механизмы, используемые Neisseria gonorrhoeae для инициирования инфекции, различаются у мужчин и женщин». Clinical Microbiology Reviews . 17 (4): 965–81 , оглавление. doi :10.1128/CMR.17.4.965-981.2004. PMC 523569 . PMID 15489357.
- ^ "Осведомленность об ИППП: гонорея". Planned Parenthood Advocates of Arizona. 11 апреля 2011 г. Архивировано из оригинала 3 ноября 2012 г. Получено 31 августа 2011 г.
- ^ Садарангани М., Поллард А.Дж., Грей-Оуэн С.Д. (май 2011 г.). «Opa-белки и CEACAM: пути иммунного взаимодействия для патогенных Neisseria». FEMS Microbiology Reviews . 35 (3): 498– 514. doi :10.1111/j.1574-6976.2010.00260.x. PMID 21204865.
- ^ ab Hu LI, Yin S, Ozer EA, Sewell L, Rehman S, Garnett JA и др. (октябрь 2020 г.). Justice S (ред.). «Открытие нового фактора сборки пилей Neisseria gonorrhoeae типа IV, TfpC». mBio . 11 (5). doi :10.1128/mBio.02528-20. PMC 7593972 . PMID 33109763.
- ^ ab Merz AJ, So M, Sheetz MP (сентябрь 2000 г.). «Ретракция пилуса обеспечивает бактериальную подергивающуюся подвижность». Nature . 407 (6800): 98– 102. Bibcode :2000Natur.407...98M. doi :10.1038/35024105. PMID 10993081.
- ^ Stern A, Brown M, Nickel P, Meyer TF (октябрь 1986 г.). «Гены непрозрачности в Neisseria gonorrhoeae: контроль фазы и антигенной изменчивости». Cell . 47 (1): 61– 71. doi :10.1016/0092-8674(86)90366-1. PMID 3093085. S2CID 21366517.
- ^ Cahoon LA, Seifert HS (сентябрь 2011 г.). «Фокусирование гомологичной рекомбинации: антигенная вариация пилина у патогенных Neisseria». Молекулярная микробиология . 81 (5): 1136– 1143. doi :10.1111/j.1365-2958.2011.07773.x. PMC 3181079. PMID 21812841 .
- ^ Obergfell KP, Seifert HS (февраль 2015 г.). «Подвижная ДНК патогенных Neisseria». Microbiology Spectrum . 3 (3). doi :10.1128/microbiolspec.MDNA3-0015-2014. PMC 4389775. PMID 25866700 .
- ^ Aas FE, Wolfgang M, Frye S, Dunham S, Løvold C, Koomey M (ноябрь 2002 г.). «Компетентность к естественной трансформации у Neisseria gonorrhoeae: компоненты связывания и поглощения ДНК, связанные с экспрессией пилей IV типа». Молекулярная микробиология . 46 (3): 749–760 . doi : 10.1046/j.1365-2958.2002.03193.x . PMID 12410832. S2CID 21854666.
- ^ Simons MP, Nauseef WM, Apicella MA (апрель 2005 г.). «Взаимодействие Neisseria gonorrhoeae с адгезивными полиморфноядерными лейкоцитами». Инфекция и иммунитет . 73 (4): 1971– 1977. doi :10.1128/iai.73.4.1971-1977.2005. PMC 1087443. PMID 15784537 .
- ^ Escobar A, Rodas PI, Acuña-Castillo C (2018). «Взаимодействие макрофагов и Neisseria gonorrhoeae: лучшее понимание патогенных механизмов иммуномодуляции». Frontiers in Immunology . 9 : 3044. doi : 10.3389/fimmu.2018.03044 . PMC 6309159. PMID 30627130 .
- ^ Stohl EA, Seifert HS (ноябрь 2006 г.). «Ферменты рекомбинации и восстановления ДНК Neisseria gonorrhoeae защищают от окислительного повреждения, вызванного перекисью водорода». Журнал бактериологии . 188 (21): 7645– 7651. doi :10.1128/JB.00801-06. PMC 1636252. PMID 16936020 .
- ^ Michod RE, Bernstein H, Nedelcu AM (май 2008). «Адаптивное значение пола у микробных патогенов». Инфекция, генетика и эволюция . 8 (3): 267– 285. Bibcode :2008InfGE...8..267M. doi :10.1016/j.meegid.2008.01.002. PMID 18295550.
- ^ Blokesch M (ноябрь 2016 г.). «Естественная компетентность для трансформации». Current Biology . 26 (21): R1126 – R1130 . Bibcode : 2016CBio...26R1126B. doi : 10.1016/j.cub.2016.08.058 . PMID 27825443.
- ^ "Статистика генома Neisseria gonorrhoeae". Broad Institute . Получено 8 апреля 2017 г.
- ^ Chung GT, Yoo JS, Oh HB, Lee YS, Cha SH, Kim SJ, et al. (сентябрь 2008 г.). «Полная последовательность генома Neisseria gonorrhoeae NCCP11945». Journal of Bacteriology . 190 (17): 6035– 6036. doi : 10.1128/JB.00566-08. PMC 2519540. PMID 18586945.
- ^ Burmeister AR (июль 2015 г.). «Горизонтальный перенос генов». Эволюция, медицина и общественное здравоохранение . 2015 (1): 193– 194. doi :10.1093/emph/eov018. PMC 4536854. PMID 26224621 .
- ^ Unemo M, Shafer WM (август 2011 г.). «Устойчивость к антибиотикам у Neisseria gonorrhoeae: происхождение, эволюция и уроки, извлеченные на будущее». Annals of the New York Academy of Sciences . 1230 (1): E19 – E28 . Bibcode : 2011NYASA1230E..19U. doi : 10.1111/j.1749-6632.2011.06215.x. PMC 4510988. PMID 22239555 .
- ^ Spencer-Smith R, Roberts S, Gurung N, Snyder LA (август 2016 г.). «Последовательности поглощения ДНК в Neisseria gonorrhoeae как внутренние терминаторы транскрипции и маркеры горизонтального переноса генов». Microbial Genomics . 2 (8): e000069. doi : 10.1099/mgen.0.000069 . PMC 5320588 . PMID 28348864.
- ^ Manoharan-Basil SS, González N, Laumen JG, Kenyon C (17 марта 2022 г.). «Горизонтальный перенос генов устойчивости к фторхинолонам от комменсальной Neisseria к Neisseria gonorrhoeae: глобальный филогенетический анализ 20 047 изолятов». Frontiers in Microbiology . 13 : 793612. doi : 10.3389/fmicb.2022.793612 . PMC 8973304 . PMID 35369513.
- ^ Hamilton HL, Dillard JP (январь 2006 г.). «Естественная трансформация Neisseria gonorrhoeae: от донорства ДНК до гомологичной рекомбинации». Молекулярная микробиология . 59 (2): 376–385 . doi :10.1111/j.1365-2958.2005.04964.x. PMID 16390436.
- ^ abc Cehovin A, Lewis SB (август 2017 г.). «Мобильные генетические элементы в Neisseria gonorrhoeae: движение за изменение». Патогены и болезни . 75 (6). doi :10.1093/femspd/ftx071. PMID 28645177.
- ^ Кравцов Д, Грядунов Д, Шаскольский Б (июнь 2023 г.). «Генетический остров гонококков в глобальной популяции Neisseria gonorrhoeae: модель генетического разнообразия и ассоциации с устойчивостью к антимикробным препаратам». Микроорганизмы . 11 (6): 1547. doi : 10.3390/microorganisms11061547 . PMC 10301925. PMID 37375049 .
- ^ Zweig M, Schork S, Koerdt A, Siewering K, Sternberg C, Thormann K и др. (апрель 2014 г.). «Секретируемая одноцепочечная ДНК участвует в начальной фазе формирования биопленки Neisseria gonorrhoeae» (PDF) . Environmental Microbiology . 16 (4): 1040–1052 . Bibcode :2014EnvMi..16.1040Z. doi :10.1111/1462-2920.12291. PMID 24119133.
- ^ Anderson MT, Seifert HS (май 2011). «Neisseria gonorrhoeae и люди исполняют эволюционный танец LINE». Mobile Genetic Elements . 1 (1): 85– 87. doi :10.4161/mge.1.1.15868. PMC 3190277. PMID 22016852 .
- ^ Anderson MT, Seifert HS (2011). «Возможность и средства: горизонтальный перенос генов от человека-хозяина к бактериальному патогену». mBio . 2 (1): e00005 – e00011 . doi :10.1128/mBio.00005-11. PMC 3042738 . PMID 21325040.
- ^ Detels R, Green AM, Klausner JD, Katzenstein D, Gaydos C, Handsfield H и др. (июнь 2011 г.). «Частота и корреляты симптоматических и бессимптомных инфекций Chlamydia trachomatis и Neisseria gonorrhoeae в отдельных популяциях в пяти странах». Заболевания, передаваемые половым путем . 38 (6): 503–509 . doi :10.1097/OLQ.0b013e318206c288. PMC 3408314. PMID 22256336 .
- ^ abcdefghij Райан К.Дж., Рэй К.Г., ред. (2004). Sherris Medical Microbiology (4-е изд.). McGraw Hill. ISBN 978-0-8385-8529-0.[ нужна страница ]
- ^ abc "Гонококковые инфекции - Руководство по лечению ЗППП 2015". www.cdc.gov . Получено 7 декабря 2017 г. .
- ^ "Симптомы гонореи (триппера)". std-gov.org. 2 апреля 2015 г.
- ^ Goodyear-Smith F (ноябрь 2007 г.). «Каковы доказательства неполовой передачи гонореи у детей после неонатального периода? Систематический обзор». Журнал судебной и юридической медицины . 14 (8): 489– 502. doi :10.1016/j.jflm.2007.04.001. PMID 17961874.
- ^ Anderson MT, Dewenter L, Maier B, Seifert HS (март 2014 г.). «Семенная плазма инициирует состояние передачи Neisseria gonorrhoeae». mBio . 5 (2): e01004 – e01013 . doi :10.1128/mBio.01004-13. PMC 3958800 . PMID 24595372.
- ^ ab Meyer T, Buder S (январь 2020 г.). «Лабораторная диагностика Neisseria gonorrhoeae: текущее тестирование и будущие требования». Pathogens . 9 (2): 91. doi : 10.3390/pathogens9020091 . PMC 7169389 . PMID 32024032.
- ^ Cosentino LA, Campbell T, Jett A, Macio I, Zamborsky T, Cranston RD и др. (июнь 2012 г.). «Использование тестирования амплификации нуклеиновых кислот для диагностики аноректальных инфекций, передающихся половым путем». Журнал клинической микробиологии . 50 (6): 2005–2008 . doi :10.1128/JCM.00185-12. PMC 3372150. PMID 22493338 .
- ^ abcd «Гонококковые инфекции среди подростков и взрослых — Руководство по лечению ИППП». www.cdc.gov . 5 декабря 2022 г. . Получено 19 ноября 2024 г. .
- ^ abc Williams E, Seib KL, Fairley CK, Pollock GL, Hocking JS, McCarthy JS и др. (март 2024 г.). Forrest GN (ред.). «Вакцины против гонореи Neisseria: современный обзор». Clinical Microbiology Reviews . 37 (1): e0009423. doi :10.1128/cmr.00094-23. PMC 10938898. PMID 38226640 .
- ^ Номер клинического исследования NCT05630859 для «Безопасность и эффективность экспериментальной вакцины GSK Neisseria Gonorrhoeae GMMA (NgG) при введении здоровым взрослым в возрасте от 18 до 50 лет». на ClinicalTrials.gov
- ^ CDC (16 мая 2024 г.). "Лекарственно-устойчивая гонорея". Гонорея . Получено 20 ноября 2024 г. .
- ^ St Cyr S, Barbee L, Workowski KA, Bachmann LH, Pham C, Schlanger K и др. (декабрь 2020 г.). «Обновление рекомендаций CDC по лечению гонококковой инфекции, 2020 г.». MMWR. Еженедельный отчет о заболеваемости и смертности . 69 ( 50): 1911– 1916. doi :10.15585/mmwr.mm6950a6. PMC 7745960. PMID 33332296.
- ^ "Британские врачи сообщили, что гонорея стала устойчивой к лекарствам". BBC News . 10 октября 2011 г.
- ^ ab "Осведомленность об ИППП: гонорея, устойчивая к антибиотикам". Planned Parenthood Advocates of Arizona. 6 марта 2012 г. Архивировано из оригинала 5 ноября 2012 г. Получено 6 марта 2012 г.
- ^ Tuddenham S, Hamill MM, Ghanem KG (январь 2022 г.). «Диагностика и лечение инфекций, передающихся половым путем: обзор». JAMA . 327 (2): 161– 172. doi :10.1001/jama.2021.23487. PMID 35015033.
- ^ abcd Charles A Janeway J, Travers P, Walport M, Shlomchik MJ (2001). "Система комплемента и врожденный иммунитет". Иммунобиология: иммунная система в здоровье и болезни. 5-е издание . Garland Science.
- ^ "гонорея | Происхождение и значение слова гонорея по данным словаря этимологии онлайн". www.etymonline.com . Получено 5 декабря 2017 г. .
- ^ ab Singal A, Grover C (2016). Комплексный подход к инфекциям в дерматологии . JP Medical. стр. 470. ISBN 978-93-5152-748-0.
- ^ Гладштейн Дж. (июль 2005 г.). «Шанкр Хантера: заразил ли хирург себя сифилисом?». Клинические инфекционные заболевания . 41 (1): 128, ответ автора 128-128, ответ автора 129. doi : 10.1086/430834 . PMID 15937780.
- ^ Jose PP, Vivekanandan V, Sobhanakumari K (15 октября 2020 г.). «Гонорея: исторический взгляд». Журнал кожных и сексуально передаваемых заболеваний . 2 : 110– 114. doi : 10.25259/JSSTD_4_2020 .
Внешние ссылки
- Тодар К. «Патогенные нейссерии: гонорея, неонатальная офтальмия и менингококковый менингит». Онлайн-учебник по бактериологии Тодара .
- Гонорея в eMedicine
- «Neisseria gonorrhoeae». Браузер таксономии NCBI . 485.
- Типовой штамм Neisseria gonorrhoeae в BacDive – базе метаданных бактериального разнообразия
