Сидерокалин
| Липокалин, ассоциированный с нейтрофильной желатиназой/липокалин-12, специфичный для придатка яичка | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | LCN2/LCN12IPR003087Сидерокалин | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | GeneCards : [1]; OMA :- ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Сидерокалин (Scn) , липокалин-2 , NGAL , 24p3 — это белок млекопитающих типа липокалина , который может предотвращать захват железа патогенными бактериями путем связывания сидерофоров , которые являются связывающими железо хелаторами, вырабатываемыми микроорганизмами. [1] [2] Железо служит ключевым питательным веществом во взаимодействиях хозяина и патогена , и патогены могут получать железо из организма хозяина посредством синтеза и высвобождения сидерофоров, таких как энтеробактин . [3] Сидерокалин является частью защитного механизма млекопитающих и действует как антибактериальное средство . [1] [4] [5] [6] [7] Кристаллографические исследования Scn показали, что он включает чашечку, домен связывания лиганда , который выстлан полярными катионными группами. [8] Центральное место в механизме распознавания сидерофора/сидерокалина занимают гибридные электростатические/ катионно - пи взаимодействия . [5] [9] Чтобы обойти защиту хозяина, патогены эволюционировали и стали производить структурно разнообразные сидерофоры, которые не распознаются сидерокалином, что позволяет бактериям получать железо. [1]
Потребность организмов-хозяев в железе
Организмам требуется железо для различных химических реакций . [10] Хотя железо можно найти по всей биосфере , свободное трехвалентное железо образует нерастворимые гидроксиды при физиологическом pH , ограничивая его доступность в аэробных условиях для живых организмов. [10] [11] Для сохранения гомеостаза организмы развили особые белковые сети с белками и рецепторами , транслируемыми в соответствии с внутриклеточными уровнями железа. [10] [12] Экспорт и импорт дополняются циклическим процессом между двухвалентным железом Fe(II), доступным в восстановительной среде клетки , и трехвалентным железом Fe(III), обнаруженным в основном в аэробных условиях. [13] [14] Механизмы получения железа патогенными бактериями демонстрируют роль железа как ключевого компонента на границе между патогенами и хозяевами. [13] [14]
Семейство липокалинов железосвязывающих белков
Семейство связывающих белков липокалина вырабатывается иммунной системой и секвестрирует комплексы сидерофоров железа из рецепторов сидерофоров бактерий. [15] [16] Семейство связывающих белков липокалина обычно имеет консервативную восьмицепочечную β-бочкообразную складку с участком связывания чашечки , [16] [17] которая выстлана положительно заряженными аминокислотными остатками, что позволяет осуществлять связывающие взаимодействия с сидерофорами. [ необходима ссылка ]
Клиническое значение
Микобактериальные инфекции
Липокалин сидерокалин обнаруживается в гранулах нейтрофилов , маточных выделениях и в особенно высоких концентрациях в сыворотке во время бактериальной инфекции . [4] При инфицировании патогены используют сидерофоры для захвата железа из организма хозяина. [18] Однако эта стратегия осложняется человеческим белком сидерокалином, который может изолировать сидерофоры и предотвращать их использование патогенными бактериями в качестве агентов доставки железа. [19] Этот эффект был продемонстрирован в исследованиях с мышами, нокаутированными по сидерокалину , которые более чувствительны к инфекциям в условиях ограничения железа. [4] [5]
Вирулентность микобактерий
Сидерофоры являются хелаторами железа, позволяя организмам получать железо из окружающей среды. В случае патогенов железо может быть получено из организма-хозяина. [20] Сидерофоры и трехвалентное железо могут ассоциироваться, образуя стабильные комплексы. [10] [21] [22] Сидерофоры связывают железо с помощью различных лигандов , чаще всего в виде α-гидроксикарбоксилатов (например, цитрата), катехолатов и гидроксаматов . [5] [10] [23] [24] В качестве защитного механизма сидерокалин может заменять комплексы бис-катехола железа (образующиеся в физиологических условиях) третьим катехолом, чтобы получить гексакоординированный комплекс трехвалентного железа, что приводит к более высокому сродству связывания. [5] [18] [25]
Как посредник в транспорте железа у млекопитающих
Сидерофоры млекопитающих, в частности катехолы , можно обнаружить в кишечнике человека и в сидерофорах, таких как энтеробактин , и они служат в качестве железосвязывающих фрагментов . [5] [26] Молекулы, напоминающие катехол, могут действовать как лиганды железа в клетке и в системном кровообращении , позволяя сидерокалину связываться с комплексом железо-катехин. [27] Катехолы могут быть связаны сидерокалином в форме свободных лигандов или в комплексе железа. [28] 24p3 — это рецептор липокалина-2 позвоночных , который позволяет импортировать комплекс сидерофора железа в клетки млекопитающих. [27] Во время эмбриогенеза почек происходит опосредованный сидерокалином транспорт железа, поскольку концентрация железа должна строго контролироваться для ограничения воспаления . [4] [11] После секреции нейтрофилами сидерокалин может связываться с патогенными сидерофорами, такими как бациллибактин , и предотвращать перемещение сидерофоров. [29] Сидерокалин был связан с различными клеточными процессами , помимо транспорта железа, включая апоптоз , клеточную дифференциацию , опухолеобразование и метастазирование . [10] [30]
Структура
Птичьи ортологи сидерокалина (Q83 и Ex-FABP) и NGAL ( нейтрофильный желатиназа -ассоциированный липокалин - 2) содержат чашечки с положительно заряженными боковыми цепями лизина и аргинина . [8] [30] [31] [32] [33] Эти боковые цепи взаимодействуют посредством катион-пи и кулоновских взаимодействий с отрицательно заряженными сидерофорами, которые содержат ароматические катехолатные группы. [10] [30] Кристаллографические исследования сидерокалина показали, что лиганд- связывающий домен Scn, известный как чашечка, является неглубоким и широким и выстлан полярными катионными группами из трех положительно заряженных остатков Arg81, Lys125 и Lys134. [5] [8] [34] Scn также может связывать нежелезные комплексы и был идентифицирован как потенциальный транспортер тяжелых ионов актинида. Были получены кристаллические структуры Scn, содержащие тяжелые металлы (торий, плутоний, америций, кюрий и калифорний). [35] [36] Scn был обнаружен в виде мономера , гомодимера или тримера в плазме человека. [5] Складка сидерокалина исключительно стабильна. [4] [5] Чашечка структурно стабильна и жестка, и конформационные изменения обычно не происходят при изменении pH , ионной силы или связывания лиганда. [5]
Карман для переплета
Структурная стабильность чашечки объясняется тремя связывающими карманами внутри чашечки, которые стерически ограничивают, какие лиганды совместимы с сидерокалином. [5] [8] Чашечка Scn может вмещать три ароматических кольца катехолатных фрагментов в трех доступных связывающих карманах. [5] [28] Результаты твердофазных и растворных структурных исследований показали, что энтеробактин, полученный из бактерий, связан с связывающим карманом Scn, что позволяет Scn участвовать в остром иммунном ответе на бактериальную инфекцию. [5] [21] Одним из методов, с помощью которого патогены могут обойти механизмы иммунитета, является изменение химической структуры сидерофора для предотвращения взаимодействия с Scn. [24] Одним из примеров является добавление молекул глюкозы к энтеробактиновому остову сальмохелина (C- глюкозилированный энтеробактин) с целью увеличения гидрофильности и объемности сидерофора и ингибирования связывания с Scn. [24] [37]
Связывающие взаимодействия
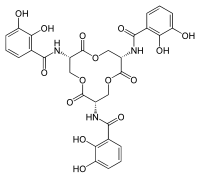
Сидерофоры обычно связываются с сидерокалином с субнаномолярным сродством и специфически взаимодействуют с сидерокалином. [10] [25] Значение Kd взаимодействия сидерокалина/сидерофора, измеренное путем тушения флуоресценции (Kd = 0,4 нМ), указывает на то, что сидерокалин может захватывать сидерофоры с высоким сродством. [31] [38] Это значение Kd аналогично значению бактериального рецептора FepA (Kd = 0,3 нМ). [5] Связывание сидерофора/сидерокалина направляется электростатическими взаимодействиями. [5] [38] В частности, механизм включает гибридные электростатические и катион-пи взаимодействия в положительно заряженной белковой чашечке. [25] Сидерофор расположен в центре чашечки сидерокалина и связан с несколькими прямыми полярными взаимодействиями. [25] Структурный анализ взаимодействия сидерокалина и сидерофора показал, что сидерофор сопровождается плохим и диффузным качеством электронной плотности , при этом большая часть лиганда подвергается воздействию растворителя , когда сидерофор помещается в чашечку. [5] [6] Сидерокалин обычно не связывает сидерофоры на основе гидроксамата , поскольку эти субстраты не имеют необходимой ароматической электронной структуры для взаимодействий катион-пи. [5] [25] Для того чтобы получить железо в присутствии сидерокалина, патогенные бактерии используют несколько сидерофоров, которые не связываются с сидерокалином или структурно модифицируют сидерофоры, чтобы ингибировать связывание сидерокалина. [5] [39] Сидерокалин может связывать растворимые сидерофоры микобактерий , включая карбоксимикобактины. [5] [6] Исследования in vivo показали, что связывающие взаимодействия между карбоксимикобактином и сидерокалином служат для защиты организма хозяина от микобактериальных инфекций, при этом сидерокалин ингибирует поглощение железа микобактериями. [5] [28] [40] Сидерокалин может изолировать карбоксимикобактины железа , используя полиспецифический механизм распознавания. [5] Механизм распознавания сидерофора/сидерокалина в первую очередь включает гибридные электростатические/катион-пи взаимодействия. [ 5] [9] [11] Жирнокислотные хвосты карбоксимикобактина находятся в конформации «хвост внутрь» или «хвост наружу» внутри кармана 2.[5] Конформация «хвоста» цепей жирных кислот вносит значительное взаимодействие между чашечкой и лигандом, увеличивая сродство чашечки сидерокалина и карбоксимикобактина. [5] Короткие хвосты жирных кислот имеют соответственно менее благоприятное связывание с сидерокалином и не могут поддерживать необходимое взаимодействие с карманом связывания. [5] Поскольку липокалин-2 не может связывать длинные цепи жирных кислот карбоксимикобактинов микобактерий, очевидно, что ряд патогенов эволюционировали, чтобы избегать активности липокалина-2. [41]
Механизм распознавания
Электростатическое взаимодействие играет ключевую роль в механизме распознавания сидерофоров сидерокалином. [1] Связывание сидерофора и кармана связывания сидерокалина в первую очередь направляется взаимодействиями катион-пи, при этом положительно заряженный карман связывания сидерокалина притягивает отрицательно заряженный комплекс. [1] Структурный фактор, участвующий в опосредованном сидерокалином механизме распознавания сидерофоров фенолятного / катехолатного типа, включает в себя линкер основной цепи, который позволяет сидерокалину взаимодействовать с различными фенолятными/катехолатными сидерофорами. [4] [42] В то время как на распознавание сидерокалина минимально влияет замена различных металлов, метилирование трех катехолатных колец энтеробактина может препятствовать распознаванию сидерокалина. [5] [34] [38] [43] Стратегия, используемая патогенами для преодоления иммунного ответа , заключается в производстве сидерофоров, которые не будут распознаваться сидерокалином. [19] [44] Например, сидерокалин не может распознавать сидерофоры C-глюкозилированного аналога энтеробактина, поскольку донорные группы гликозилированы , что приводит к стерическим взаимодействиям в положении 5 атомов углерода катехольных групп. [1] [24]
История
Потребность в железе у людей и патогенов известна уже много лет. [10] Связь между железом и микобактинами, железо-хелатирующими факторами роста микобактерий , была впервые установлена в 1960-х годах. [5] В то время рос интерес к решению вопроса применения микобактинов в качестве целевых молекул для рационального противотуберкулезного средства . [5] [45] Эксперименты 1960-х и 1970-х годов показали, что дефицит железа у микобактерий является причиной « анемичных » клеток . [46] Большинство генов и систем, необходимых для высокоаффинного получения железа, были идентифицированы у патогенных и сапрофитных микобактерий. [5] Эти гены кодируют белки для хранения железа, поглощения железо-сидерофоров и гема . [5] [47] Люди выработали защиту от опосредованного сидерофорами получения железа путем выработки сидерокалина. Для борьбы с этим различные патогены выработали сидерофоры, которые могут избегать распознавания сидерокалина. [5] Было показано, что сидерокалин связывается с сидерофорами и ингибирует усвоение железа, а также предотвращает рост Mycobacterium tuberculosis во внеклеточных культурах; однако влияние сидерокалина на этот патоген внутри макрофагов остается неясным. [24] [31]
Смотрите также
Ссылки
- ^ abcdef van Eldik R, Hubbard CD (2009). Advances in Inorganic Chemistry Volume 61 (1-е изд.). Лондон, Великобритания: Elsevier. С. 237– 239. ISBN 9780123750334. Получено 16 февраля 2015 г.
- ^ Корренти С., Ричардсон В., Сиа А.К., Бандаранаяке А.Д., Руис М., Сурьо Рахманто Ю., Ковачевич Ж., Клифтон М.С., Холмс М.А., Кайзер Б.К., Бараш Дж., Раймонд К.Н., Ричардсон Д.Р., Стронг РК (2012). «Сидерокалин/Lcn2/NGAL/24p3 не вызывает апоптоз за счет вывода железа, опосредованного гентизиновой кислотой, в линиях гемопоэтических клеток». ПЛОС ОДИН . 7 (8): е43696. Бибкод : 2012PLoSO...743696C. дои : 10.1371/journal.pone.0043696 . ПМЦ 3424236 . ПМИД 22928018.
- ^ Cherayil BJ (май 2011). «Роль железа в иммунном ответе на бактериальную инфекцию». Immunologic Research . 50 (1): 1– 9. doi :10.1007/s12026-010-8199-1. PMC 3085559. PMID 21161695 .
- ^ abcdef Парагас Н., Цю А., Холлмен М., Николас Т.Л., Девараджан П., Бараш Дж. (сентябрь 2012 г.). «НГАЛ-Сидерокалин при заболеваниях почек». Biochimica et Biophysical Acta (BBA) - Исследования молекулярных клеток . 1823 (9): 1451– 8. doi :10.1016/j.bbamcr.2012.06.014. ПМЦ 3664277 . ПМИД 22728330.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae Байерс BR (2013). Приобретение железа родом Mycobacterium . SpringerBriefs in Molecular Science. Springer. стр. 1– 88. doi :10.1007/978-3-319-00303-0. ISBN 978-3-319-00303-0. S2CID 12666634.
- ^ abc Holmes MA, Paulsene W, Jide X, Ratledge C, Strong RK (январь 2005 г.). «Сидерокалин (Lcn 2) также связывает карбоксимикобактины, потенциально защищая от микобактериальных инфекций посредством секвестрации железа». Структура . 13 (1): 29– 41. doi : 10.1016/j.str.2004.10.009 . PMID 15642259.
- ^ Sige l A, Sigel H, Sige l RK (2013). Взаимосвязи между ионами основных металлов и заболеваниями человека. Гейдельберг, Германия: Springer. С. 282–283 . ISBN 9789400774995. Получено 14 февраля 2015 г.
- ^ abcd Sia AK, Allred BE, Raymond KN (апрель 2013 г.). «Сидерокалины: белки, связывающие сидерофоры, эволюционировали для первичной защиты хозяина патогена». Current Opinion in Chemical Biology . 17 (2): 150– 7. doi :10.1016/j.cbpa.2012.11.014. PMC 3634885. PMID 23265976 .
- ^ ab Abergel RJ, Wilson MK, Arceneaux JE, Hoette TM, Strong RK, Byers BR, Raymond KN (декабрь 2006 г.). «Возбудитель сибирской язвы обходит иммунную систему млекопитающих посредством скрытого производства сидерофоров». Труды Национальной академии наук Соединенных Штатов Америки . 103 (49): 18499– 503. Bibcode : 2006PNAS..10318499A. doi : 10.1073/pnas.0607055103 . PMC 1693691. PMID 17132740 .
- ^ abcdefghi Correnti C, Strong RK (апрель 2012 г.). «Сидерофоры млекопитающих, липокалины, связывающие сидерофоры, и пул лабильного железа». Журнал биологической химии . 287 (17): 13524– 31. doi : 10.1074/jbc.R111.311829 . PMC 3340207. PMID 22389496 .
- ^ abc Чакраборти Р., Браун В., Хантке К., Корнелис П. (2013). Поглощение железа бактериями с акцентом на E. coli и Pseudomonas . SpringerBriefs in Biometals. стр. 31–66 . ISBN 978-94-007-6087-5.
- ^ Ganz T (октябрь 2013 г.). «Системный гомеостаз железа». Physiological Reviews . 93 (4): 1721– 41. doi :10.1152/physrev.00008.2013. PMID 24137020.
- ^ ab Doherty CP (май 2007). «Взаимодействие хозяина и патогена: роль железа». Журнал питания . 137 (5): 1341– 4. doi : 10.1093/jn/137.5.1341 . PMID 17449603.
- ^ ab Skaar EP (2010). «Битва за железо между бактериальными патогенами и их позвоночными хозяевами». PLOS Pathogens . 6 (8): e1000949. doi : 10.1371/journal.ppat.1000949 . PMC 2920840. PMID 20711357 .
- ^ Сэнди М., Батлер А. (октябрь 2009 г.). «Микробное получение железа: морские и наземные сидерофоры». Chemical Reviews . 109 (10 ) : 4580– 95. doi :10.1021/cr9002787. PMC 2761978. PMID 19772347.
- ^ ab Flower DR (август 1996). «Семейство белков липокалина: структура и функция». The Biochemical Journal . 318 (1): 1– 14. doi :10.1042/bj3180001. PMC 1217580. PMID 8761444 .
- ^ Fuentes-Prior P, Noeske-Jungblut C, Donner P, Schleuning WD, Huber R, Bode W (октябрь 1997 г.). «Структура комплекса тромбина с триабином, ингибитором связывания экзосайта с липокалином, полученным из триатомового клопа». Труды Национальной академии наук Соединенных Штатов Америки . 94 (22): 11845– 50. Bibcode : 1997PNAS ...9411845F. doi : 10.1073/pnas.94.22.11845 . PMC 23629. PMID 9342325.
- ^ ab Miethke M, Marahiel MA (сентябрь 2007 г.). «Получение железа на основе сидерофоров и контроль патогенов». Microbiology and Molecular Biology Reviews . 71 (3): 413– 51. doi :10.1128/MMBR.00012-07. PMC 2168645. PMID 17804665 .
- ^ ab Allred BE, Correnti C, Clifton MC, Strong RK, Raymond KN (сентябрь 2013 г.). «Сидерокалин перехитрил координационную химию вибриобактина, сидерофора Vibrio cholerae». ACS Chemical Biology . 8 (9): 1882– 7. doi :10.1021/cb4002552. PMC 3783644 . PMID 23755875.
- ^ Miethke M (январь 2013). «Молекулярные стратегии микробной ассимиляции железа: от высокоаффинных комплексов до систем сборки кофакторов». Metallomics . 5 (1): 15–28 . doi : 10.1039/C2MT20193C . PMID 23192658.
- ^ ab Abergel RJ, Clifton MC, Pizarro JC, Warner JA, Shuh DK, Strong RK, Raymond KN (август 2008 г.). «Взаимодействие сидерокалина и энтеробактина: связь между иммунитетом млекопитающих и бактериальным транспортом железа». Журнал Американского химического общества . 130 (34): 11524– 34. Bibcode : 2008JAChS.13011524A. doi : 10.1021/ja803524w. PMC 3188318. PMID 18680288 .
- ^ Fukushima T, Allred BE, Sia AK, Nichiporuk R, Andersen UN, Raymond KN (август 2013 г.). «Грамположительный сидерофорный челнок с обменом железа с Fe-сидерофора на апо-сидерофор Bacillus cereus YxeB». Труды Национальной академии наук Соединенных Штатов Америки . 110 (34): 13821– 6. Bibcode : 2013PNAS..11013821F. doi : 10.1073/pnas.1304235110 . PMC 3752266. PMID 23924612 .
- ^ Dhungana S, Harrington JM, Gebhardt P, Möllmann U, Crumbliss AL (октябрь 2007 г.). "Равновесия хелатирования железа, окислительно-восстановительная и сидерофорная активность аналога феррихрома на основе сахаридной платформы" (PDF) . Неорганическая химия . 46 (20): 8362–71 . doi :10.1021/ic070158l. PMID 17824601.
- ^ abcde Yehuda S, Mostofsky DI (2010). Дефицит железа и перегрузка: от базовой биологии к клинической медицине. Нью-Йорк, Нью-Йорк: Humana Press. С. 66–69 . ISBN 9781934115220. Получено 14 февраля 2015 г.
- ^ abcde Hoette TM, Abergel RJ, Xu J, Strong RK, Raymond KN (декабрь 2008 г.). «Роль электростатики в распознавании сидерофоров иммунопротеином сидерокалином». Журнал Американского химического общества . 130 (51): 17584– 92. Bibcode : 2008JAChS.13017584H. doi : 10.1021/ja8074665. PMC 2778733. PMID 19053425 .
- ^ Rogers HJ (март 1973). «Катехины, связывающие железо, и вирулентность в Escherichia coli». Инфекция и иммунитет . 7 (3): 445–56 . doi :10.1128/IAI.7.3.445-456.1973. PMC 422698. PMID 16558077.
- ^ ab Anderson GJ, McLaren GD (2012). Физиология и патофизиология железа у людей. Нью-Йорк, Нью-Йорк: Springer. С. 237–239 , 658. ISBN 9781603274845. Получено 14 февраля 2015 г.
- ^ abc Бао Г, Клифтон М, Хетте ТМ, Мори К, Денг SX, Цю А, Вилтард М, Уильямс Д, Парагас Н, Лите Т, Кулкарни Р, Ли Х, Ли Б, Каландадзе А, Ратнер А.Дж., Писарро Дж.К., Шмидт-Отт К.М., Лэндри Д.В., Раймонд К.Н., Стронг РК, Бараш Дж. (август 2010 г.). «Трафик железа в обращении связан с комплексом сидерокалин (Нгал)-катехин». Химическая биология природы . 6 (8): 602–9 . doi : 10.1038/nchembio.402. ПМК 2907470 . ПМИД 20581821.
- ^ Бергман НХ (2011). Bacillus anthracis и сибирская язва. Хобокен, Нью-Джерси: Wiley. стр. Глава 7. ISBN 9781118148082. Получено 14 февраля 2015 г.
- ^ abc Correnti C, Clifton MC, Abergel RJ, Allred B, Hoette TM, Ruiz M, Cancedda R, Raymond KN, Descalzi F, Strong RK (декабрь 2011 г.). "Galline Ex-FABP является антибактериальным сидерокалином и сенсором лизофосфатидной кислоты, функционирующим через двойную лигандную специфичность". Structure . 19 (12): 1796– 806. doi :10.1016/j.str.2011.09.019. PMC 3240821 . PMID 22153502.
- ^ abc Ashton Acton Q (2012). Достижения в исследовании и применении серина (2012: ScholarlyBrief ed.). Атланта, Джорджия: ScholarlyEditions. стр. 42–43 . ISBN 9781481614276. Получено 14 февраля 2015 г.
- ^ Thongboonkerd V (2007). Протеомика жидкостей человеческого организма: принципы, методы и приложения. Тотова, Нью-Джерси: Humana Press. С. 338–339 . ISBN 9781597454322. Получено 16 февраля 2015 г.
- ^ Clifton MC, Corrent C, Strong RK (август 2009 г.). «Сидерокалины: белки, связывающие сидерофоры, врожденной иммунной системы» (PDF) . Биометаллы . 22 (4): 557– 64. doi :10.1007/s10534-009-9207-6. PMID 19184458. S2CID 8776376.
- ^ ab Hoette TM, Clifton MC, Zawadzka AM, Holmes MA, Strong RK, Raymond KN (декабрь 2011 г.). «Иммунная интерференция при внутриклеточном получении железа Mycobacterium tuberculosis посредством распознавания сидерокалином карбоксимикобактинов». ACS Chemical Biology . 6 (12): 1327– 31. doi :10.1021/cb200331g. PMC 3241878 . PMID 21978368.
- ^ Deblonde, Gauthier J.-P.; Sturzbecher-Hoehne, Manuel; Rupert, Peter B.; Dahlia, An D.; Illy Marie-Claire; Ralston, Corie Y.; Brabec, Jiri; de Jong, Wide A.; Strong, Roland (сентябрь 2017 г.). "Хелатирование и стабилизация берклия в степени окисления +IV" (PDF) . Nature Chemistry . 9 (9): 843– 849. Bibcode : 2017NatCh...9..843D. doi : 10.1038/nchem.2759. ISSN 1755-4349. OSTI 1436161. PMID 28837177.
- ^ Капитан, Илья; Деблонде, Готье Ж.-П.; Руперт, Питер Б.; Ан, Далия Д.; Илли, Мари-Клер; Ростан, Эмелин; Ралстон, Кори И.; Стронг, Роланд К.; Абергель, Ребекка Дж. (2016-11-21). «Инженерное распознавание четырехвалентного циркония и тория системами хелаторов и белков: на пути к гибким платформам лучевой терапии и визуализации». Неорганическая химия . 55 (22): 11930– 11936. doi :10.1021/acs.inorgchem.6b02041. ISSN 0020-1669. OSTI 1458481. PMID 27802058.
- ^ Альварес МВ (2007). Выделение, структура и обнаружение сальмохелинов: новые сидерофоры в энтеробактериях. Геттинген, Германия: Cuvillier Verlag. С. 29–34 . ISBN 9783867271097. Получено 14 февраля 2015 г.
- ^ abc Abergel RJ, Moore EG, Strong RK, Raymond KN (август 2006 г.). «Микробное уклонение от иммунной системы: структурные модификации энтеробактина ухудшают распознавание сидерокалина». Журнал Американского химического общества . 128 (34): 10998– 9. Bibcode : 2006JAChS.12810998A . doi : 10.1021/ja062476+. PMC 3188317. PMID 16925397.
- ^ Allela L, Boury O, Pouillot R, Délicat A, Yaba P, Kumulungui B, Rouquet P, Gonzalez JP, Leroy EM (март 2005 г.). «Распространенность антител к вирусу Эбола у собак и риск для человека». Emerging Infectious Diseases . 11 (3): 385–90 . doi :10.3201/eid1103.040981. PMC 3298261. PMID 15757552 .
- ^ Окерстрем Б (2006). Липокалины . Остин, Техас: Landes Bioscience. п. 92. ИСБН 9781587062971.
- ^ Kidd SP (2011). Реакция на стресс у патогенных бактерий, том 19 Advances in Molecular and Cellular Microbiology. Уоллингфорд, Великобритания: CABI. стр. 287–290 . ISBN 9781845937775. Получено 14 февраля 2015 г.
- ^ Стронг, РК; Акерстром, Б.; Боррегаард, Н.; Флауэр, Д.Р.; Салье, Ж.-П. (ред.). "Сидерокалины" (PDF) . Центр исследований рака Фреда Хатчинсона.
- ^ Abergel RJ, Warner JA, Shuh DK, Raymond KN (июль 2006 г.). «Протонирование энтеробактина и высвобождение железа: структурная характеристика сдвига координации салицилата в железном энтеробактине». Журнал Американского химического общества . 128 (27): 8920– 31. Bibcode : 2006JAChS.128.8920A. doi : 10.1021/ja062046j. PMC 3188320. PMID 16819888 .
- ^ Stintzi A, Barnes C, Xu J, Raymond KN (сентябрь 2000 г.). «Микробный транспорт железа через шаттл сидерофора: парадигма мембранного транспорта ионов». Труды Национальной академии наук Соединенных Штатов Америки . 97 (20): 10691– 6. Bibcode : 2000PNAS...9710691S. doi : 10.1073/pnas.200318797 . PMC 27084. PMID 10995480 .
- ^ Barclay R, Ratledge C (март 1983). «Железосвязывающие соединения Mycobacterium avium, M. intracellulare, M. scrofulaceum и микобактин-зависимые M. paratuberculosis и M. avium». Журнал бактериологии . 153 (3): 1138– 46. doi :10.1128/JB.153.3.1138-1146.1983. PMC 221756. PMID 6826517 .
- ^ Jamison DT, Breman JG, Measham AR, Alleyne G, Claeson M, Evans DB, Jha P, Mills A, Musgrove P (2006). Приоритеты контроля заболеваний в развивающихся странах (2-е изд.). Вашингтон, округ Колумбия: Всемирный банк. стр. Глава 16. ISBN 978-0-8213-6179-5. Получено 16 февраля 2015 г.
- ^ Caza M, Kronstad JW (2013). «Общие и различные механизмы получения железа бактериальными и грибковыми патогенами человека». Frontiers in Cellular and Infection Microbiology . 3 (80): 80. doi : 10.3389/fcimb.2013.00080 . PMC 3832793. PMID 24312900 .