δ-опиоидный рецептор
| ОПР1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | OPRD1 , OPRD, Δ-опиоидный рецептор, опиоидный рецептор дельта 1, DOP, DOR1, DOR | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | ОМИМ : 165195; МГИ : 97438; гомологен : 20252; GeneCards : OPRD1; OMA :OPRD1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
δ -опиоидный рецептор , также известный как дельта-опиоидный рецептор или просто дельта-рецептор , сокращенно DOR или DOP , является ингибирующим 7-трансмембранным рецептором, сопряженным с G-белком , сопряженным с G-белком G i /G 0, и имеет энкефалины в качестве своих эндогенных лигандов . [5] Области мозга, в которых δ - опиоидный рецептор в значительной степени экспрессируется, варьируются от модели к модели вида. У людей δ-опиоидный рецептор наиболее сильно экспрессируется в базальных ганглиях и неокортексных областях мозга. [6]
Функция
Эндогенная система опиоидных рецепторов хорошо известна своим анальгетическим потенциалом; однако точная роль активации δ-опиоидных рецепторов в модуляции боли во многом является предметом дискуссий. Это также зависит от рассматриваемой модели, поскольку известно, что активность рецепторов меняется от вида к виду. Активация дельта-рецепторов вызывает анальгезию , возможно, как существенные потенциаторы агонистов μ-опиоидных рецепторов. Однако, похоже, что дельта-агонизм обеспечивает сильное потенцирование любого мю-агонизма. Следовательно, даже селективные мю-агонисты могут вызывать анальгезию при правильных условиях, тогда как при других условиях не могут вызывать ее вообще. [7] [8] Однако также предполагается, что боль, модулируемая μ-опиоидным рецептором, и боль, модулируемая δ-опиоидным рецептором, являются разными типами, с утверждением, что DOR модулирует ноцицепцию хронической боли, в то время как MOR модулирует острую боль. [9]
Данные о том, вызывают ли дельта-агонисты угнетение дыхания , неоднозначны; высокие дозы дельта-агониста пептида DPDPE вызывали угнетение дыхания у овец. [10] Напротив, как пептидный дельта-агонист Deltorphin II, так и непептидный дельта-агонист (+)-BW373U86 фактически стимулировали дыхательную функцию и блокировали угнетающее дыхание действие сильного μ-опиоидного агониста альфентанила , не влияя на облегчение боли. [11] Таким образом, кажется вероятным, что, хотя δ-опиоидные агонисты могут вызывать угнетение дыхания в очень высоких дозах, в более низких дозах они оказывают противоположный эффект, факт, который может сделать смешанные мю/дельта-агонисты, такие как DPI-3290, потенциально очень полезными препаратами, которые могут быть намного безопаснее, чем μ-агонисты, которые в настоящее время используются для облегчения боли. Многие дельта-агонисты также могут вызывать судороги в высоких дозах, хотя не все дельта-агонисты вызывают этот эффект. [12]
Дополнительный интерес представляет потенциальная возможность разработки дельта-агонистов для использования в качестве нового класса антидепрессантов после получения надежных доказательств как антидепрессивных эффектов [13] , так и повышения выработки BDNF в мозге в животных моделях депрессии . [14] Эти антидепрессивные эффекты были связаны с эндогенными опиоидными пептидами, действующими на δ- и μ-опиоидные рецепторы, [15] и поэтому также могут быть вызваны ингибиторами энкефалиназы, такими как RB-101. [16] Однако в человеческих моделях данные об антидепрессивных эффектах остаются неубедительными. В клиническом исследовании фазы 2 компании Astra Zeneca в 2008 году, NCT00759395, 15 пациентов лечились селективным дельта-агонистом AZD 2327. Результаты не показали существенного влияния на настроение, что позволяет предположить, что модуляция δ-опиоидных рецепторов может не участвовать в регуляции настроения у людей. Однако дозы вводились в низких дозах, и фармакологические данные также остаются неубедительными. [17] [18] Необходимы дальнейшие испытания.
Другим интересным аспектом функции δ-опиоидных рецепторов является предположение о взаимодействии μ/δ-опиоидных рецепторов. Крайней точкой этого предположения является возможность олигомера μ/δ-опиоидных рецепторов. Доказательства этого вытекают из различных профилей связывания типичных мю- и дельта-агонистов, таких как морфин и DAMGO соответственно, в клетках, которые коэкспрессируют оба рецептора, по сравнению с таковыми в клетках, которые экспрессируют их по отдельности. Кроме того, работа Фана и его коллег показывает восстановление профилей связывания, когда дистальные карбоксильные концы укорочены на любом из рецепторов, что предполагает, что концы играют роль в олигомеризации. [19] Хотя это и интересно, опровержение Джавича и его коллег предполагает, что идея олигомеризации может быть преувеличена. Опираясь на RET , Джавич и его коллеги показали, что сигналы RET были более характерны для случайной близости между рецепторами, а не для фактического образования связи между рецепторами, что предполагает, что расхождения в профилях связывания могут быть результатом нисходящих взаимодействий, а не новых эффектов из-за олигомеризации. [20] Тем не менее, коэкспрессия рецепторов остается уникальной и потенциально полезной при лечении расстройств настроения и боли.
Недавние исследования показывают, что экзогенные лиганды, активирующие дельта-рецепторы, имитируют явление, известное как ишемическое прекондиционирование . [21] Экспериментально, если индуцируются короткие периоды транзиторной ишемии , то ткани ниже по течению надежно защищены, если затем происходит более длительное прерывание кровоснабжения. Опиаты и опиоиды с активностью DOR имитируют этот эффект. В модели крыс введение лигандов DOR приводит к значительной кардиопротекции. [22]
Лиганды
До сравнительно недавнего времени существовало мало фармакологических инструментов для изучения δ-рецепторов. Как следствие, наше понимание их функции гораздо более ограничено, чем у других опиоидных рецепторов, для которых селективные лиганды давно доступны.
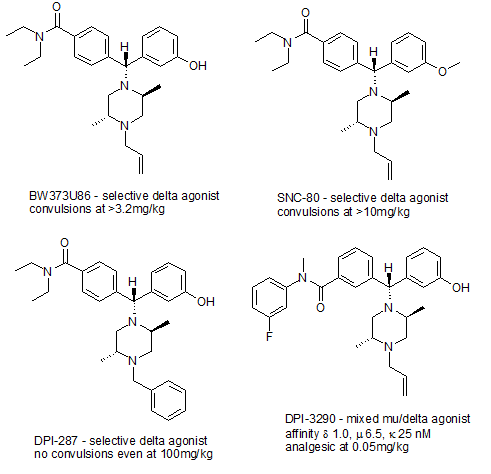
Однако в настоящее время доступно несколько селективных агонистов δ-опиоидных рецепторов, включая пептиды, такие как DPDPE и дельторфин II, и непептидные препараты, такие как SNC-80 , [23] более мощный (+)- BW373U86 , [24] более новый препарат DPI-287 , который не вызывает проблем с судорогами, наблюдавшихся при использовании более ранних агентов, [25] и смешанный агонист μ/δ DPI-3290 , который является гораздо более мощным анальгетиком, чем более высокоселективные агонисты δ. [26] Также доступны селективные антагонисты δ-рецептора, наиболее известным из которых является производное опиата налтриндол . [27]
Агонисты

- Пептиды
- Непептиды
- АДЛ-5859 [28]
- БУ-48
- BW373U86
- ДПИ-221
- ДПИ-287
- ДПИ-3290
- RWJ-394674 -
- СНС-80
- ТАН-67
- Амоксапин (частичный агонист) [29]
- Каннабидиол (аллостерический модулятор, неселективный) [30]
- Десметилклозапин
- Митрагинин [31]
- Митрагинин псевдоиндоксил [31]
- Норбупренорфин (ограничен периферически)
- N-Фенэтил-14-этоксиметопон
- 7-спироинданилоксиморфон
- Тетрагидроканнабинол (аллостерический модулятор, неселективный) [30]
- Ксорфанол
Антагонисты
Взаимодействия
Было показано, что δ-опиоидные рецепторы взаимодействуют с β2 - адренергическими рецепторами , [32] аррестином β1 [ 33] и GPRASP1 . [34]
Смотрите также
Ссылки
- ^ abc GRCh38: Ensembl выпуск 89: ENSG00000116329 – Ensembl , май 2017 г.
- ^ abc GRCm38: Ensembl выпуск 89: ENSMUSG00000050511 – Ensembl , май 2017 г.
- ^ "Human PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ "Mouse PubMed Reference:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Quock RM, Burkey TH, Varga E, Hosohata Y, Hosohata K, Cowell SM и др. (сентябрь 1999 г.). «Дельта-опиоидный рецептор: молекулярная фармакология, передача сигнала и определение эффективности лекарств». Pharmacological Reviews . 51 (3): 503–532 . PMID 10471416.
- ^ Peppin JF, Raffa RB (апрель 2015 г.). «Агонисты дельта-опиоидных рецепторов: краткое обновление потенциальных терапевтических применений». Журнал клинической фармации и терапии . 40 (2): 155–166 . doi : 10.1111/jcpt.12244 . PMID 25726896. S2CID 25483387.
- ^ Варга Е.В., Навратилова Е., Стропова Д., Джамбросич Дж., Роске В.Р., Ямамура Х.И. (декабрь 2004 г.). «Агонист-специфическая регуляция дельта-опиоидного рецептора». Науки о жизни . 76 (6): 599–612 . doi :10.1016/j.lfs.2004.07.020. ПМИД 15567186.
- ^ Альвимопан
- ^ Беррокозо Э., Санчес-Бласкес П., Гарсон Дж., Мико Х.А. (2009). «Опиаты как антидепрессанты». Текущий фармацевтический дизайн . 15 (14): 1612–1622 . doi : 10.2174/138161209788168100. hdl : 10261/62156. ПМИД 19442177.
- ^ Clapp JF, Kett A, Olariu N, Omoniyi AT, Wu D, Kim H, et al. (Февраль 1998). «Сердечно-сосудистые и метаболические реакции на два рецептор-селективных агониста опиоидов у беременных овец». Американский журнал акушерства и гинекологии . 178 (2): 397– 401. doi :10.1016/S0002-9378(98)80032-X. PMID 9500506.
- ^ Su YF, McNutt RW, Chang KJ (декабрь 1998 г.). «Дельта-опиоидные лиганды устраняют вызванную альфентанилом респираторную депрессию, но не антиноцицепцию». Журнал фармакологии и экспериментальной терапии . 287 (3): 815–823 . PMID 9864259.
- ^ Jutkiewicz EM, Baladi MG, Folk JE, Rice KC, Woods JH (июнь 2006 г.). «Судорожные и электроэнцефалографические изменения, вызванные непептидными агонистами дельта-опиоидов у крыс: сравнение с пентилентетразолом». Журнал фармакологии и экспериментальной терапии . 317 (3): 1337– 1348. doi : 10.1124/jpet.105.095810. PMID 16537798. S2CID 21838231.
- ^ Broom DC, Jutkiewicz EM, Rice KC, Traynor JR, Woods JH (сентябрь 2002 г.). «Поведенческие эффекты агонистов дельта-опиоидных рецепторов: потенциальные антидепрессанты?». Японский журнал фармакологии . 90 (1): 1– 6. doi : 10.1254/jjp.90.1 . PMID 12396021.
- ^ Torregrossa MM, Jutkiewicz EM, Mosberg HI, Balboni G, Watson SJ, Woods JH (январь 2006 г.). «Пептидные агонисты дельта-опиоидных рецепторов вызывают антидепрессантоподобные эффекты в тесте принудительного плавания и регулируют экспрессию мРНК BDNF у крыс». Brain Research . 1069 (1): 172– 181. doi :10.1016/j.brainres.2005.11.005. PMC 1780167 . PMID 16364263.
- ^ Zhang H, Torregrossa MM, Jutkiewicz EM, Shi YG, Rice KC, Woods JH и др. (февраль 2006 г.). «Эндогенные опиоиды повышают регуляцию мРНК нейротрофического фактора мозга через дельта- и микроопиоидные рецепторы независимо от эффектов, подобных антидепрессантам». The European Journal of Neuroscience . 23 (4): 984– 994. doi :10.1111/j.1460-9568.2006.04621.x. PMC 1462954 . PMID 16519663.
- ^ Jutkiewicz EM, Torregrossa MM, Sobczyk-Kojiro K, Mosberg HI, Folk JE, Rice KC и др. (февраль 2006 г.). «Поведенческие и нейробиологические эффекты ингибитора энкефалиназы RB101 относительно его антидепрессивных эффектов». European Journal of Pharmacology . 531 ( 1– 3): 151– 159. doi :10.1016/j.ejphar.2005.12.002. PMC 1828120 . PMID 16442521.
- ^ Hudzik TJ, Maciag C, Smith MA, Caccese R, Pietras MR, Bui KH и др. (Июль 2011 г.). «Доклиническая фармакология AZD2327: высокоселективный агонист δ-опиоидного рецептора». Журнал фармакологии и экспериментальной терапии . 338 (1): 195–204 . doi :10.1124/jpet.111.179432. PMID 21444630. S2CID 10313748.
- ^ "Исследование эффективности антидепрессанта селективного высокоаффинного энкефалинергического агониста при тревожном большом депрессивном расстройстве (AMDD) - Полный текстовый просмотр - ClinicalTrials.gov". clinicaltrials.gov . 10 октября 2012 г. Получено 11 декабря 2015 г.
- ^ Fan T, Varghese G, Nguyen T, Tse R, O'Dowd BF, George SR (ноябрь 2005 г.). «Роль дистальных карбоксильных хвостов в создании новой фармакологии и профиля активации G-белка гетероолигомеров мю- и дельта-опиоидных рецепторов». Журнал биологической химии . 280 (46): 38478– 38488. doi : 10.1074/jbc.M505644200 . PMID 16159882. S2CID 32785318.
- ^ Lambert NA, Javitch JA (июнь 2014 г.). «Опровержение от Невина А. Ламберта и Джонатана А. Джавича». Журнал физиологии . 592 (12): 2449. doi :10.1113/jphysiol.2014.274241. PMC 4080929. PMID 24931947 .
- ^ Zhang J, Qian H, Zhao P, Hong SS, Xia Y (апрель 2006 г.). «Быстрая гипоксическая предварительная подготовка защищает корковые нейроны от токсичности глутамата через дельта-опиоидные рецепторы». Stroke . 37 (4): 1094– 1099. doi : 10.1161/01.STR.0000206444.29930.18 . PMID 16514101. S2CID 21120257.
- ^ Guo L, Zhang L, Zhang DC (октябрь 2005 г.). «[Механизмы кардиопротекторного действия дельта-опиоидов при ишемии и их потенциальное клиническое применение]». Sheng Li Ke Xue Jin Zhan [Прогресс в физиологии] (на китайском языке). 36 (4): 333– 336. PMID 16408774.
- ^ Calderon SN, Rothman RB, Porreca F, Flippen-Anderson JL, McNutt RW, Xu H и др. (июль 1994 г.). «Зонды для явлений, опосредованных наркотическими рецепторами. 19. Синтез (+)-4-[(альфа R)-альфа-((2S,5R)-4-аллил-2,5-диметил-1-пиперазинил)-3-метоксибензил]-N,N-диэтилбензамида (SNC 80): высокоселективного непептидного агониста дельта-опиоидных рецепторов». Журнал медицинской химии . 37 (14): 2125– 2128. doi :10.1021/jm00040a002. PMID 8035418.
- ^ Calderon SN, Rice KC, Rothman RB, Porreca F, Flippen-Anderson JL, Kayakiri H и др. (февраль 1997 г.). «Зонды для явлений, опосредованных наркотическими рецепторами. 23. Синтез, связывание опиоидных рецепторов и биоанализ высокоселективного дельта-агониста (+)-4-[(альфа R)-альфа-((2S,5R)-4-аллил-2,5-диметил-1-пиперазинил)-3-метоксибензил]-N,N-диэтилбензамида (SNC 80) и родственных новых непептидных лигандов дельта-опиоидных рецепторов». Журнал медицинской химии . 40 (5): 695–704 . doi :10.1021/jm960319n. PMID 9057856.
- ^ Юткевич EM (июнь 2006 г.). «Эффекты агонистов дельта-опиоидных рецепторов, подобные антидепрессантам». Molecular Interventions . 6 (3): 162– 169. doi :10.1124/mi.6.3.7. PMID 16809477.
- ^ Ananthan S (март 2006 г.). «Опиоидные лиганды со смешанными взаимодействиями мю/дельта опиоидных рецепторов: новый подход к новым анальгетикам». Журнал AAPS . 8 (1): E118 – E125 . doi :10.1208/aapsj080114. PMC 2751430. PMID 16584118 .
- ^ Portoghese PS, Sultana M, Takemori AE (январь 1988). «Налтриндол, высокоселективный и мощный непептидный антагонист дельта-опиоидных рецепторов». European Journal of Pharmacology . 146 (1): 185– 186. doi :10.1016/0014-2999(88)90502-X. PMID 2832195.
- ^ Le Bourdonnec B, Windh RT, Ajello CW, Leister LK, Gu M, Chu GH и др. (октябрь 2008 г.). «Мощные, перорально биодоступные агонисты дельта-опиоидных рецепторов для лечения боли: открытие N,N-диэтил-4-(5-гидроксиспиро[хромен-2,4'-пиперидин]-4-ил)бензамида (ADL5859)». Журнал медицинской химии . 51 (19): 5893– 5896. doi :10.1021/jm8008986. PMID 18788723.
- ^ Onali P, Dedoni S, Olianas MC (январь 2010 г.). «Прямая агонистическая активность трициклических антидепрессантов в отношении различных подтипов опиоидных рецепторов». Журнал фармакологии и экспериментальной терапии . 332 (1): 255–265 . doi :10.1124/jpet.109.159939. PMID 19828880. S2CID 18893305.
- ^ ab Kathmann M, Flau K, Redmer A, Tränkle C, Schlicker E (февраль 2006 г.). «Каннабидиол — аллостерический модулятор мю- и дельта-опиоидных рецепторов». Архивы фармакологии Наунин-Шмидеберга . 372 (5): 354– 361. doi :10.1007/s00210-006-0033-x. PMID 16489449. S2CID 4877869.
- ^ abc Takayama H, Ishikawa H, Kurihara M, Kitajima M, Aimi N, Ponglux D и др. (апрель 2002 г.). «Исследования синтеза и агонистической активности опиоидов алкалоидов индола, связанных с митрагинином: открытие агонистов опиоидов, структурно отличающихся от других опиоидных лигандов». Журнал медицинской химии . 45 (9): 1949–1956 . doi :10.1021/jm010576e. PMID 11960505.
- ^ McVey M, Ramsay D, Kellett E, Rees S, Wilson S, Pope AJ и др. (апрель 2001 г.). «Мониторинг олигомеризации рецепторов с использованием передачи энергии резонанса флуоресценции с временным разрешением и передачи энергии резонанса биолюминесценции. Человеческий дельта-опиоидный рецептор демонстрирует конститутивную олигомеризацию на поверхности клетки, которая не регулируется занятостью рецептора». Журнал биологической химии . 276 (17): 14092– 14099. doi : 10.1074/jbc.M008902200 . PMID 11278447. S2CID 25191463.
- ^ Cen B, Yu Q, Guo J, Wu Y, Ling K, Cheng Z и др. (март 2001 г.). «Прямое связывание бета-аррестинов с двумя различными внутриклеточными доменами дельта-опиоидного рецептора». Journal of Neurochemistry . 76 (6): 1887– 1894. doi : 10.1046/j.1471-4159.2001.00204.x . PMID 11259507. S2CID 83485138.
- ^ Whistler JL, Enquist J, Marley A, Fong J, Gladher F, Tsuruda P, et al. (Июль 2002). «Модуляция постэндоцитарной сортировки рецепторов, связанных с G-белком». Science . 297 (5581): 615– 620. doi :10.1126/science.1073308. PMID 12142540. S2CID 1219372.
Дальнейшее чтение
- Narita M, Funada M, Suzuki T (январь 2001 г.). «Регулирование опиоидной зависимости по типам опиоидных рецепторов». Фармакология и терапия . 89 (1): 1– 15. doi :10.1016/S0163-7258(00)00099-1. PMID 11316510.
- Evans CJ, Keith DE, Morrison H, Magendzo K, Edwards RH (декабрь 1992 г.). «Клонирование дельта-опиоидного рецептора с помощью функциональной экспрессии». Science . 258 (5090): 1952– 1955. Bibcode :1992Sci...258.1952E. doi :10.1126/science.1335167. PMID 1335167.
- Offermanns S, Schultz G, Rosenthal W (февраль 1991 г.). «Доказательства опосредованной опиоидными рецепторами активации G-белков, Go и Gi2, в мембранах гибридных клеток нейробластомы x глиомы (NG108-15)». Журнал биологической химии . 266 (6): 3365– 3368. doi : 10.1016/S0021-9258(19)67799-9 . PMID 1671672.
- Simonin F, Befort K, Gavériaux-Ruff C, Matthes H, Nappey V, Lannes B и др. (декабрь 1994 г.). «Человеческий дельта-опиоидный рецептор: геномная организация, клонирование кДНК, функциональная экспрессия и распределение в мозге человека». Молекулярная фармакология . 46 (6): 1015–1021 . PMID 7808419.
- Befort K, Mattéi MG, Roeckel N, Kieffer B (март 1994). «Хромосомная локализация гена дельта-опиоидного рецептора в человеческих 1p34.3-p36.1 и мышиных 4D-полосах с помощью гибридизации in situ». Genomics . 20 (1): 143– 145. doi :10.1006/geno.1994.1146. PMID 8020949.
- Кнапп Р.Дж., Малатинска Э., Фанг Л., Ли Х, Бабин Э., Нгуен М. и др. (1994). «Идентификация человеческого дельта-опиоидного рецептора: клонирование и экспрессия». Науки о жизни . 54 (25): PL463 – PL469 . дои : 10.1016/0024-3205(94)90138-4. ПМИД 8201839.
- Георгусси З., Карр К., Миллиган Г. (июль 1993 г.). «Прямые измерения in situ взаимодействий опиоидных рецепторов мозга крысы с гуаниннуклеотидсвязывающим белком Go». Молекулярная фармакология . 44 (1): 62–69 . PMID 8393523.
- Bzdega T, Chin H, Kim H, Jung HH, Kozak CA, Klee WA (октябрь 1993 г.). «Региональная экспрессия и хромосомная локализация гена дельта-опиатного рецептора». Труды Национальной академии наук Соединенных Штатов Америки . 90 (20): 9305– 9309. Bibcode : 1993PNAS...90.9305B. doi : 10.1073/pnas.90.20.9305 . PMC 47556. PMID 8415697 .
- Ho MK, Wong YH (июнь 1997 г.). «Функциональная роль аминоконцевого серина 16 и серина 27 G alphaZ в рецепторном и эффекторном сопряжении». Journal of Neurochemistry . 68 (6): 2514– 2522. doi : 10.1046/j.1471-4159.1997.68062514.x . PMID 9166747. S2CID 24703413.
- Hedin KE, Bell MP, Kalli KR, Huntoon CJ, Sharp BM, McKean DJ (декабрь 1997 г.). «Дельта-опиоидные рецепторы, экспрессируемые клетками Jurkat T, усиливают секрецию IL-2 за счет увеличения комплексов AP-1 и активности элемента промотора, связывающего NF-AT/AP-1». Журнал иммунологии . 159 (11): 5431– 5440. doi : 10.4049/jimmunol.159.11.5431 . PMID 9548483.
- Jordan BA, Devi LA (июнь 1999). «Гетеродимеризация рецепторов, связанных с G-белком, модулирует функцию рецептора». Nature . 399 (6737): 697– 700. Bibcode :1999Natur.399..697J. doi :10.1038/21441. PMC 3125690 . PMID 10385123.
- Petaja-Repo UE, Hogue M, Laperriere A, Walker P, Bouvier M (май 2000 г.). «Экспорт из эндоплазматического ретикулума представляет собой ограничивающий этап созревания и экспрессии на поверхности клеток человеческого дельта-опиоидного рецептора». Журнал биологической химии . 275 (18): 13727– 13736. doi : 10.1074/jbc.275.18.13727 . PMID 10788493. S2CID 8293320.
- Gelernter J, Kranzler HR (июль 2000 г.). «Обнаружение вариантов в локусе дельта-опиоидного рецептора (OPRD1) и популяционная генетика нового варианта, влияющего на последовательность белка». Генетика человека . 107 (1): 86– 88. doi :10.1007/s004390050016. PMID 10982041.
- Guo J, Wu Y, Zhang W, Zhao J, Devi LA, Pei G и др. (ноябрь 2000 г.). «Идентификация участков фосфорилирования рецепторной киназы 2, связанной с G-белком, ответственных за стимулированное агонистом фосфорилирование дельта-опиоидных рецепторов». Молекулярная фармакология . 58 (5): 1050– 1056. doi :10.1124/mol.58.5.1050. PMID 11040053.
- Gomes I, Jordan BA, Gupta A, Trapaidze N, Nagy V, Devi LA (ноябрь 2000 г.). "Гетеродимеризация мю- и дельта-опиоидных рецепторов: роль в синергии опиатов". The Journal of Neuroscience . 20 (22): RC110. doi :10.1523/JNEUROSCI.20-22-j0007.2000. PMC 3125672 . PMID 11069979.
- Xu W, Chen C, Huang P, Li J, de Riel JK, Javitch JA и др. (ноябрь 2000 г.). «Консервативный остаток цистеина 7,38 дифференциально доступен в щелях мест связывания мю-, дельта- и каппа-опиоидных рецепторов». Биохимия . 39 (45): 13904– 13915. doi :10.1021/bi001099p. PMID 11076532.
- Hartley JL, Temple GF, Brasch MA (ноябрь 2000 г.). «Клонирование ДНК с использованием in vitro сайт-специфической рекомбинации». Genome Research . 10 (11): 1788– 1795. doi :10.1101/gr.143000. PMC 310948. PMID 11076863.
- Saeed RW, Stefano GB, Murga JD, Short TW, Qi F, Bilfinger TV и др. (декабрь 2000 г.). «Экспрессия функциональных дельта-опиоидных рецепторов в гладких мышцах сосудов». Международный журнал молекулярной медицины . 6 (6): 673– 677. doi :10.3892/ijmm.6.6.673. PMID 11078827.
- Xiang B, Yu GH, Guo J, Chen L, Hu W, Pei G и др. (февраль 2001 г.). «Гетерологичная активация протеинкиназы C стимулирует фосфорилирование дельта-опиоидного рецептора на серине 344, что приводит к интернализации рецептора, опосредованной бета-аррестином и клатрином». Журнал биологической химии . 276 (7): 4709– 4716. doi : 10.1074/jbc.M006187200 . PMID 11085981. S2CID 84945988.
- Yeo A, Samways DS, Fowler CE, Gunn-Moore F, Henderson G (март 2001 г.). «Совпадающая сигнализация между Gi/Go-связанным дельта-опиоидным рецептором и Gq-связанным м3-мускариновым рецептором на уровне внутриклеточного свободного кальция в клетках SH-SY5Y». Journal of Neurochemistry . 76 (6): 1688– 1700. doi :10.1046/j.1471-4159.2001.00185.x. PMID 11259487. S2CID 2755275.
Внешние ссылки
- "Опиоидные рецепторы: δ". База данных рецепторов и ионных каналов IUPHAR . Международный союз фундаментальной и клинической фармакологии. Архивировано из оригинала 2014-02-23 . Получено 2007-07-23 .
- delta+Opioid+Receptor в рубриках медицинских предметов Национальной медицинской библиотеки США (MeSH)