Везикулярный транспортный адаптерный белок


Везикулярные транспортные адаптерные белки — это белки, участвующие в формировании комплексов, которые функционируют в транспортировке молекул из одного субклеточного места в другое. [2] [3] [4] Эти комплексы концентрируют правильные молекулы груза в пузырьках , которые отпочковываются или выдавливаются из одной органеллы и перемещаются в другое место, куда доставляется груз. Хотя некоторые детали того, как эти адаптерные белки достигают своей транспортной специфичности, были разработаны, еще многое предстоит узнать.
Существует несколько заболеваний человека, связанных с дефектами компонентов этих комплексов [5] [6], включая болезни Альцгеймера и Паркинсона . [7]
Белки







Большинство адаптерных белков являются гетеротетрамерами . В комплексах AP есть два больших белка ( ~ 100 кДа ) и два меньших белка. Один из больших белков называется β ( бета ), с β1 в комплексе AP-1, β2 в комплексе AP-2 и так далее. [10] Другой большой белок имеет разные обозначения в разных комплексах. В AP-1 он называется γ ( гамма ), AP-2 имеет α ( альфа ), AP-3 имеет δ ( дельта ), AP-4 имеет ε ( эпсилон ) и AP-5 имеет ζ ( дзета ). [10] Два меньших белка представляют собой среднюю субъединицу, называемую μ ( мю ~50 кДа), и малую субъединицу σ ( сигма ~20 кДа), и названы от 1 до 5, что соответствует 5 комплексам AP. [10] Компоненты COPI (cop one) коатомера и TSET (T-set) комплекса мембранного транспорта имеют схожие гетеротетрамеры комплексов AP. [11]
Ретромер не является тесно связанным, был рассмотрен, [12] и его белки не будут описаны здесь. GGA (локализация Гольджи, гомология домена гамма-адаптина уха, белки связывания ARF) представляют собой группу родственных белков (три у человека), которые действуют как мономерные белки-адапторы клатрина в различных важных перемещениях мембранных везикул , [13] но не похожи ни на один из комплексов AP и не будут подробно обсуждаться в этой статье. Стонины (не показаны на главном рисунке) также являются мономерами, похожими в некоторых отношениях на GGA [4] и также не будут подробно обсуждаться в этой статье.
PTB — это белковые домены , включающие NUMB , DAB1 и DAB2 . Эпсин и AP180 в домене ANTH — это другие рассмотренные адаптерные белки. [4]
Важный транспортный комплекс COPII не показан на главном рисунке. Комплекс COPII является гетерогексамером, но не тесно связан с комплексами AP/TSET. Отдельные белки комплекса COPII называются белками SEC , поскольку они кодируются генами, идентифицированными в секреторных мутантах дрожжей. Одним из особенно интересных аспектов COPII является то, что он может образовывать типичные сферические везикулы и трубочки для транспортировки больших молекул, таких как предшественники коллагена , которые не могут поместиться внутри типичных сферических везикул. Структура COPII обсуждалась в открытой статье [14] и не будет рассматриваться в этой статье. Это примеры гораздо большего набора адаптеров груза. [3]
Эволюционные соображения
Самый последний общий предок (MRCA) эукариот должен был иметь механизм для перемещения молекул между его эндомембранами и органеллами , и вероятная идентичность задействованного комплекса адаптеров была сообщена. [11] Считается, что MRCA имел 3 белка, вовлеченных в перемещение, и что они образовали гетеротример. Этот гетеротример затем «димеризовался», чтобы сформировать 6-членный комплекс. Отдельные компоненты далее изменились в текущие комплексы, в указанном порядке, причем AP1 и AP2 были последними, кто расходился. [11]
Кроме того, один из компонентов TSET, мунисцин , также известный как белок TCUP, по-видимому, эволюционировал в часть белков опистоконтов (животных и грибов ). [11] Части комплексов AP эволюционировали в части белков GGA и стонина. [4] Имеются данные, указывающие на то, что части комплекса ядерной поры и COPII могут быть эволюционно связаны. [15]
Образование транспортных везикул

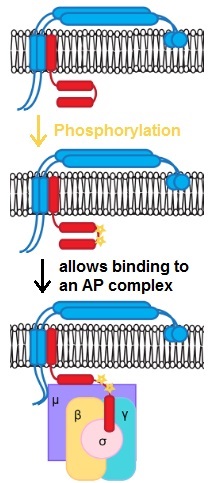
Наиболее охарактеризованным типом везикул является везикула, покрытая клатрином (CCV). Образование везикулы COPII в эндоплазматическом ретикулуме и ее транспорт в аппарат Гольджи . Участие гетеротетрамера COPI аналогично ситуации AP/клатрин, но оболочка COPI не тесно связана с оболочками CCV или везикул COPII. [16] [17] AP-5 связан с 2 белками, SPG11 и SPG15 , которые имеют некоторое структурное сходство с клатрином , и могут образовывать оболочку вокруг комплекса AP-5, [18] но ультраструктура этой оболочки неизвестна. Оболочка AP-4 неизвестна. [19] [a]
Почти универсальной особенностью сборки оболочки является привлечение различных адапторных комплексов к «донорской» мембране белком Arf1 . Единственным известным исключением является AP-2, который притягивается определенным липидом плазматической мембраны . [20]
Другой почти универсальной особенностью сборки оболочки является то, что сначала рекрутируются адаптеры, а затем они рекрутируют оболочки. Исключением является COPI, в котором 7 белков рекрутируются к мембране как гептамер. [16]
Как показано на прилагаемом изображении, образование покрытой везикулы не происходит мгновенно, и значительная часть времени созревания тратится на осуществление «бесплодных» или «бесполезных» [21] взаимодействий до тех пор, пока одновременно не произойдет достаточно взаимодействий, чтобы структура могла продолжить свое развитие. [22]
Последний шаг в формировании транспортной везикулы — «отщепление» от донорской мембраны. Это требует энергии, но даже в хорошо изученном случае CCV не всем требуется динамин . Сопроводительная иллюстрация показывает случай для AP-2 CCV, однако AP-1 и AP-3 CCV не используют динамин. [23]
Выбор молекул-грузов
Какие молекулы груза включаются в определенный тип везикулы, зависит от специфических взаимодействий. Некоторые из этих взаимодействий напрямую связаны с комплексами AP, а некоторые — косвенно с «альтернативными адаптерами», как показано на этой диаграмме. [4] Например, мембранные белки могут иметь прямые взаимодействия, в то время как белки, растворимые в просвете донорской органеллы, связываются косвенно с комплексами AP, связываясь с мембранными белками, которые пересекают мембрану и связываются на своем просветном конце с желаемой молекулой груза. Молекулы, которые не должны быть включены в везикулу, по-видимому, исключаются «молекулярной скученностью». [24]
«Сигналы» или аминокислотные «мотивы» в белках-грузах, которые взаимодействуют с белками-адаптерами, могут быть очень короткими. Например, одним из известных примеров является мотив дилейцина , в котором за остатком аминокислоты лейцина (аа) сразу следует другой остаток лейцина или изолейцина . [25] [b] Еще более простым примером является сигнал на основе тирозина , который представляет собой YxxØ (остаток розина в положении y отделен двумя остатками аа от другого объемного гидрофобного остатка аа). На сопроводительном рисунке показано, как небольшая часть белка может специфически взаимодействовать с другим белком, поэтому эти короткие сигнальные мотивы не должны вызывать удивления. [26] Вид сравнений последовательностей, используемых, в частности, для определения этих мотивов. [10]
В некоторых случаях посттрансляционные модификации , такие как фосфорилирование (показано на рисунке), важны для распознавания груза.
Заболевания
Были рассмотрены заболевания адаптеров . [6]
AP-2/CCV участвуют в аутосомно-рецессивной гиперхолестеринемии через связанный с ним белок-адаптер рецептора липопротеинов низкой плотности 1. [ 27] [28]
Ретромер участвует в переработке компонентов плазматической мембраны. Важность этой переработки в синапсе намекается на одном из рисунков в галерее. Существует по крайней мере 3 способа, которыми дисфункция ретромера может способствовать расстройствам мозга, включая болезни Альцгеймера и Паркинсона. [7]
AP-5 — это недавно описанный комплекс, и одной из причин, подтверждающих идею о том, что это подлинный комплекс адаптеров, является то, что он связан с наследственной спастической параплегией , [18] как и AP-4. [6] AP-1 связан с синдромом MEDNIK . AP-3 связан с синдромом Германски-Пудлака . COPI связан с аутоиммунным заболеванием . [29] COPII связан с кранио-лентикуло-сутуральной дисплазией . Один из белков GGA может быть вовлечен в болезнь Альцгеймера. [30]
Галерея
Смотрите также
Примечания
- ^ AP-4 гораздо менее распространен, чем другие комплексы AP, и отсутствует в нескольких модельных организмах, что затрудняет биохимический и генетический анализ.
- ^ Полный мотив «на основе дилейцина» — (D/E)XXXL(L/I), где X — это любой аминокислотный остаток, а D/E — это остатки аспарагиновой или глутаминовой кислоты .
Ссылки
- ^ Другой вид 5 комплексов AP можно увидеть здесь" Mattera R, Guardia CM, Sidhu SS, Bonifacino JS (2015). "Рисунок 1: Выделение тепсина как интерактора AP-4". J Biol Chem . 290 (52): 30736– 49. doi : 10.1074/jbc.M115.683409 . PMC 4692204. PMID 26542808 .
- ^ Bonifacino JS (2014). «Адаптерные белки, участвующие в поляризованной сортировке». Журнал клеточной биологии . 204 (1): 7– 17. doi :10.1083/jcb.201310021. PMC 3882786. PMID 24395635 .
- ^ ab Paczkowski JE, Richardson BC, Fromme JC (2015). «Адаптеры грузов: структуры освещают механизмы, регулирующие биогенез везикул». Trends in Cell Biology . 25 (7): 408– 16. doi :10.1016/j.tcb.2015.02.005. PMC 4475447 . PMID 25795254.
- ^ abcde Robinson MS (2015). «Сорок лет везикул, покрытых клатрином» (PDF) . Traffic . 16 (12): 1210– 38. doi : 10.1111/tra.12335 . PMID 26403691. S2CID 13761396.
- ^ De Matteis MA, Luini A (сентябрь 2011 г.). «Менделевские нарушения мембранного транспорта». The New England Journal of Medicine . 365 (10): 927–38 . doi :10.1056/NEJMra0910494. PMID 21899453.
- ^ abc Bonifacino J (28 января 2014 г.). «Адаптерные заболевания: на стыке клеточной биологии и медицины». videocast.nih.gov . Национальные институты здравоохранения . Получено 15 апреля 2017 г.
- ^ ab Small SA, Petsko GA (март 2015). «Ретромер при болезни Альцгеймера, болезни Паркинсона и других неврологических расстройствах». Nature Reviews. Neuroscience . 16 (3): 126– 32. doi :10.1038/nrn3896. PMID 25669742. S2CID 5166260.
- ^ "здесь".
- ^ Макмахон, Харви Т.; Галлоп, Дженнифер Л. (2005). "здесь". Nature . 438 (7068): 590– 596. doi :10.1038/nature04396. PMID 16319878. S2CID 4319503.
- ^ abcd Mattera R, Guardia CM, Sidhu SS, Bonifacino JS (2015). «Взаимодействия двухвалентного мотива и уха опосредуют ассоциацию вспомогательного белка тепсина с комплексом адаптеров AP-4». Журнал биологической химии . 290 (52): 30736– 49. doi : 10.1074/jbc.M115.683409 . PMC 4692204. PMID 26542808 .
- ^ abcd Hirst J, Schlacht A, Norcott JP, Traynor D, Bloomfield G, Antrobus R, Kay RR, Dacks JB, Robinson MS (2014). «Характеристика TSET, древнего и широко распространенного комплекса мембранного транспорта». eLife . 3 : e02866. doi : 10.7554/eLife.02866 . PMC 4031984 . PMID 24867644.
- ^ Burd C, Cullen PJ (2014). «Retromer: a master conductor of endosome sorting». Cold Spring Harbor Perspectives in Biology . 6 (2): a016774. doi :10.1101/cshperspect.a016774. PMC 3941235. PMID 24492709 .
- ^ Tan J, Evin G (2012). «Транспортировка фермента 1, расщепляющего Β-сайт APP, и патогенез болезни Альцгеймера». Журнал нейрохимии . 120 (6): 869–80 . doi : 10.1111/j.1471-4159.2011.07623.x . PMID 22171895. S2CID 44408418.
- ^ Zanetti G, Prinz S, Daum S, Meister A, Schekman R, Bacia K, Briggs JA (2013). "Структура транспортной везикулярной оболочки COPII, собранной на мембранах". eLife . 2 : e00951. doi : 10.7554/eLife.00951 . PMC 3778437 . PMID 24062940.
- ^ Promponas VJ, Katsani KR, Blencowe BJ, Ouzounis CA (2016). "Доказательства последовательности общего происхождения эукариотических эндомембранных коатомеров". Scientific Reports . 6 : 22311. Bibcode :2016NatSR...622311P. doi :10.1038/srep22311. PMC 4773986 . PMID 26931514.
- ^ ab Faini M, Beck R, Wieland FT, Briggs JA (июнь 2013 г.). «Покрытия везикул: структура, функция и общие принципы сборки». Trends in Cell Biology . 23 (6): 279–88 . doi :10.1016/j.tcb.2013.01.005. PMID 23414967.
- ^ Джексон Л.П. (август 2014 г.). «Структура и механизм биогенеза везикул COPI». Current Opinion in Cell Biology . 29 : 67–73 . doi :10.1016/j.ceb.2014.04.009. PMID 24840894.
- ^ ab Hirst J, Borner GH, Edgar J, Hein MY, Mann M, Buchholz F, Antrobus R, Robinson MS (2013). «Взаимодействие между AP-5 и белками наследственной спастической параплегии SPG11 и SPG15». Молекулярная биология клетки . 24 (16): 2558– 69. doi :10.1091/mbc.E13-03-0170. PMC 3744948. PMID 23825025 .
- ^ Frazier MN, Davies AK, Voehler M, Kendall AK, Borner GH, Chazin WJ, Robinson MS, Jackson LP (2016). «Молекулярная основа взаимодействия между AP4 β4 и его вспомогательным белком, тепсином». Traffic . 17 (4): 400– 15. doi :10.1111/tra.12375. PMC 4805503 . PMID 26756312.
- ^ Yu X, Breitman M, Goldberg J (2012). «Структурный механизм для Arf1-зависимого привлечения коатомера к мембранам». Cell . 148 (3): 530– 42. doi :10.1016/j.cell.2012.01.015. PMC 3285272 . PMID 22304919.
- ^ Кирххаузен, Том (2 августа 2012 г.). «Building Bubbles». youtube.com . harvard.edu. Архивировано из оригинала 21.12.2021 . Получено 23 апреля 2017 г. .
- ^ Cocucci E, Aguet F, Boulant S, Kirchhausen T (август 2012 г.). «Первые пять секунд в жизни ямки, покрытой клатрином». Cell . 150 (3): 495– 507. doi :10.1016/j.cell.2012.05.047. PMC 3413093. PMID 22863004 .
- ^ Курал С, Тачева-Григорова СК, Булант С, Кокуччи Э, Бауст Т, Дуарте Д, Кирххаузен Т (2012). "Динамика внутриклеточных носителей, содержащих клатрин/AP1 и клатрин/AP3". Cell Reports . 2 (5): 1111– 9. doi :10.1016/j.celrep.2012.09.025. PMC 3513667 . PMID 23103167.
- ^ Hirst J, Edgar JR, Borner GH, Li S, Sahlender DA, Antrobus R, Robinson MS (2015). «Вклад epsinR и gadkin в клатрин-опосредованный внутриклеточный транспорт». Молекулярная биология клетки . 26 (17): 3085– 103. doi :10.1091/mbc.E15-04-0245. PMC 4551321. PMID 26179914 .
- ^ Mattera R, Boehm M, Chaudhuri R, Prabhu Y, Bonifacino JS (2011). «Сохранение и диверсификация распознавания дилейцинового сигнала вариантами комплекса адаптерного белка (AP)». Журнал биологической химии . 286 (3): 2022–30 . doi : 10.1074/jbc.M110.197178 . PMC 3023499. PMID 21097499 .
- ^ Traub LM, Bonifacino JS (2013). «Распознавание грузов при эндоцитозе, опосредованном клатрином». Cold Spring Harbor Perspectives in Biology . 5 (11): a016790. doi :10.1101/cshperspect.a016790. PMC 3809577. PMID 24186068 .
- ^ Интернет-менделевское наследование у человека (OMIM): 605747
- ^ «Ген Entrez: белок-адаптер рецептора липопротеинов низкой плотности LDLRAP1 1».
- ^ Интернет-менделевское наследование у человека (OMIM): 616414
- ^ Интернет-менделевское наследование у человека (OMIM): 606006
Внешние ссылки
- Коллаж из электронных микрофотографий, показывающих COPI, COPII и клатриновые везикулы.
- структура пальто COPI из этой публикации, бесплатно при бесплатной регистрации
- Видеоописание заболевания COPII CLSD
- Видеоролики iBiology Кая Саймонса о липидах , липидных плотах и клеточном трафике
- Часть 1: Роль липидов в организации клеточного транспорта.
- Часть 2: Липидные плоты как принцип организации мембран
- Часть 3: Биогенез апикальных мембран, богатых гликолипидами



