Комплекс адаптера AP2
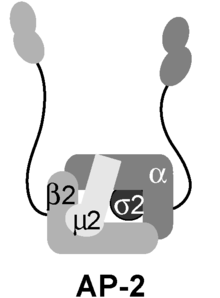
Комплекс адаптеров AP2 представляет собой мультимерный белок , который работает на клеточной мембране для интернализации груза в эндоцитозе , опосредованном клатрином . [1] Это стабильный комплекс из четырех адаптинов , которые дают начало структуре, которая имеет основной домен и два домена придатков, прикрепленных к основному домену полипептидными линкерами. Эти домены придатков иногда называют «ушками». Основной домен связывается с мембраной и грузом, предназначенным для интернализации . Домены придатков альфа и бета связываются с вспомогательными белками и клатрином . Их взаимодействие позволяет осуществлять временную и пространственную регуляцию сборки покрытых клатрином везикул и их эндоцитоза .
Комплекс AP-2 представляет собой гетеротетрамер, состоящий из двух больших адаптинов (α и β), среднего адаптина (μ) и малого адаптина (σ):
Структура
Комплекс адаптера AP2 существует в двух основных конформациях: открытая конформация (активное состояние) и закрытая конформация (неактивное состояние). [2] В активном состоянии сайт связывания клатрина, обнаруженный на субъединице β, и сайт связывания груза, обнаруженный на субъединице μ, подвергаются воздействию цитозоля, [2] что позволяет происходить их соответствующим взаимодействиям. В неактивном состоянии комплекс испытывает конформационное изменение, которое приводит к тому, что оба сайта закрываются, что препятствует его основным функциям. [3] Тяжелые цепи α и β комплекса составляют около 60% полипептидной последовательности AP2 и плотно структурированы в 14 повторов HEAT, которые образуют зигзагообразные α-спиральные структуры, которые взаимодействуют со спиральными «ногами» тримера клатрина. [4] [2]

Функция
AP2 облегчает сборку клатриновых решеток, когда должен произойти эндоцитоз, путем агрегации вместе с другими комплексами AP2 в их активной конформации. [4] Эти агрегаты AP2 взаимодействуют с отдельными клатриновыми белками посредством их β-активных участков, ориентируя их в клатриновые «клетки», которые образуют эндоцитозную оболочку. [4]
Регулирование
Регулирование активности AP2 в первую очередь осуществляется посредством конформационных перестроек структуры в две различные (и потенциальные третью и четвертую) конформации. «Открытая» конформация является активным состоянием комплекса, поскольку «ямки» или активные сайты связывания для клатринов и груза раскрыты. С другой стороны, «закрытая» конформация обозначается закрытием или недоступностью этих же сайтов. [6]
Активация
Было обнаружено, что присутствие клатринов вызывает связывание с грузом, и аналогично, присутствие груза, по-видимому, вызывает связывание клатрина. Считается, что это происходит за счет вторичной стабилизации сложной структуры, что обеспечивает частичную активацию или доступ к соответствующим ямкам. [7] [8] Фосфатидилинозитол-(4,5)-бисфосфат (PIP2) служит сигнальной последовательностью, которая связывается и распознается AP2. PIP2 можно обнаружить внутри липосом, содержащих груз, которые взаимодействуют с AP2, чтобы затем связать клатрин и выполнить свою функцию. В закрытой форме сайт связывания PIP2 открыт, что позволяет происходить конформационной регуляции. [9] Из-за этого определенный порядок небольших конформационных изменений приводит к полностью открытой конформации, начиная со связывания PIP2, затем связывания последовательности груза и, наконец, связывания клатрина. [9] Считается, что семейство белков, называемых мунисцинами, является первичными аллостерическими активаторами комплекса адаптера AP2 [10] из-за их распространенности в ямках, связанных с AP2, и их ингибирования, приводящего к снижению эндоцитоза, опосредованного AP2. [11] [12] Кроме того, было обнаружено, что комплекс регулируется и активируется фосфорилированием его (мю) субъединицы. [13] [14]
Деактивация
Деактивация или переход в «закрытую» конформацию пока неясны. Считается, что NECAP играют в этом роль, связываясь с α-субъединицей AP2. [6] Известно немного, но открытая конформация AP2, которая фосфорилируется, по-видимому, необходима для связывания NECAP1 с его ядром. [3] Процесс действия пока неизвестен, но это взаимодействие вызывает дефосфорилирование комплекса адаптера AP2, тем самым деактивируя его.
Медицинская значимость
Было установлено, что AP2 тесно участвует в аутофагических клеточных путях, ответственных за деградацию агрегированного белка. [15] Фактически, он образует комплекс с фосфатидилинозитолклатрином сборки лимфоидно-миелоидного лейкоза (PICALM), который может служить важной рецепторной группой для микротрубочковой-ассоциированного белка 1 легкой цепи 3 ( LC3 ). LC3 играет важную роль в некоторых аутофагических путях. [16] Из-за этого есть подозрение, что дефицит или дисфункция AP2 может быть предшественником развития семейной болезни Альцгеймера. [15]
Смотрите также
Ссылки
- ^ Pearse BM, Smith CJ, Owen DJ (апрель 2000 г.). «Строительство клатринового покрытия при эндоцитозе». Current Opinion in Structural Biology . 10 (2): 220– 228. doi :10.1016/S0959-440X(00)00071-3. PMID 10753805. (требуется подписка)
- ^ abc Collins BM, McCoy AJ, Kent HM, Evans PR, Owen DJ (2002-05-17). "Молекулярная архитектура и функциональная модель эндоцитарного комплекса AP2". Cell . 109 (4): 523– 535. doi : 10.1016/S0092-8674(02)00735-3 . PMID 12086608.
- ^ ab Beacham GM, Partlow EA, Lange JJ, Hollopeter G (январь 2018 г.). "NECAP являются отрицательными регуляторами комплекса адаптеров клатрина AP2". eLife . 7 : e32242. doi : 10.7554/eLife.32242 . PMC 5785209 . PMID 29345618.
- ^ abc Kirchhausen T, Owen D, Harrison SC (май 2014). «Молекулярная структура, функция и динамика мембранного трафика, опосредованного клатрином». Cold Spring Harbor Perspectives in Biology . 6 (5): a016725. doi :10.1101/cshperspect.a016725. PMC 3996469. PMID 24789820 .
- ^ Partlow EA, Baker RW, Beacham GM, Chappie JS, Leschziner AE, Hollopeter G (август 2019 г.). «Структурный механизм инактивации комплекса AP2, зависящей от фосфорилирования». eLife . 8 : e50003. doi : 10.7554/eLife.50003 . PMC 6739873 . PMID 31464684.
- ^ ab Beacham GM, Partlow EA, Hollopeter G (октябрь 2019 г.). «Конформационная регуляция комплексов адаптеров клатрина AP1 и AP2». Traffic . 20 (10): 741– 751. doi :10.1111/tra.12677. PMC 6774827 . PMID 31313456.
- ^ Ehrlich M, Boll W, Van Oijen A, Hariharan R, Chandran K, Nibert ML, Kirchhausen T (сентябрь 2004 г.). «Эндоцитоз путем случайной инициации и стабилизации ямок, покрытых клатрином». Cell . 118 (5): 591– 605. doi : 10.1016/j.cell.2004.08.017 . PMID 15339664.
- ^ Рапопорт И, Миядзаки М, Болл В, Дакворт Б, Кантли Л.К., Шоелсон С, Кирххаузен Т (май 1997). «Регуляторные взаимодействия при распознавании сигналов эндоцитарной сортировки комплексами AP-2». Журнал EMBO . 16 (9): 2240–2250 . doi :10.1093/emboj/16.9.2240. PMC 1169826. PMID 9171339 .
- ^ ab Kadlecova Z, Spielman SJ, Loerke D, Mohanakrishnan A, Reed DK, Schmid SL (январь 2017 г.). «Регулирование эндоцитоза, опосредованного клатрином, путем иерархической аллостерической активации AP2». The Journal of Cell Biology . 216 (1): 167– 179. doi :10.1083/jcb.201608071. PMC 5223608 . PMID 28003333.
- ^ Reider A, Barker SL, Mishra SK, Im YJ, Maldonado-Báez L, Hurley JH и др. (октябрь 2009 г.). «Syp1 — это консервативный эндоцитарный адаптер, содержащий домены, участвующие в выборе груза и мембранной трубчатости». The EMBO Journal . 28 (20): 3103– 3116. doi :10.1038/emboj.2009.248. PMC 2771086 . PMID 19713939.
- ^ Henne WM, Boucrot E, Meinecke M, Evergren E, Vallis Y, Mittal R, McMahon HT (июнь 2010 г.). «FCHo-белки являются нуклеаторами клатрин-опосредованного эндоцитоза». Science . 328 (5983): 1281– 1284. doi :10.1126/science.1188462. PMC 2883440 . PMID 20448150.
- ^ Cocucci E, Aguet F, Boulant S, Kirchhausen T (август 2012 г.). «Первые пять секунд в жизни ямки, покрытой клатрином». Cell . 150 (3): 495– 507. doi :10.1016/j.cell.2012.05.047. PMC 3413093. PMID 22863004 .
- ^ Ghosh P, Kornfeld S (март 2003 г.). «Связывание AP-1 с сортировочными сигналами и высвобождение из везикул, покрытых клатрином, регулируется фосфорилированием». The Journal of Cell Biology . 160 (5): 699–708 . doi : 10.1083/jcb.200211080 . PMC 2173368 . PMID 12604586.
- ^ Рикотта Д., Коннер С.Д., Шмид С.Л., фон Фигура К., Хонинг С. (март 2002 г.). «Фосфорилирование мю-субъединицы AP2 с помощью AAK1 опосредует высокоаффинное связывание с сигналами сортировки мембранных белков». Журнал клеточной биологии . 156 (5): 791– 795. doi :10.1083/jcb.200111068. PMC 2173304. PMID 11877457 .
- ^ ab Tian Y, Chang JC, Fan EY, Flajolet M, Greengard P (октябрь 2013 г.). «Адаптерный комплекс AP2/PICALM посредством взаимодействия с LC3 воздействует на APP-CTF болезни Альцгеймера для терминальной деградации посредством аутофагии». Труды Национальной академии наук Соединенных Штатов Америки . 110 (42): 17071– 17076. doi : 10.1073/pnas.1315110110 . PMC 3801056. PMID 24067654 .
- ^ Dhingra A, Alexander D, Reyes-Reveles J, Sharp R, Boesze-Battaglia K (2018). "Изоформы связанного с микротрубочками белка 1 легкой цепи 3 (LC3) в RPE и сетчатке". Retinal Degenerative Diseases . Advances in Experimental Medicine and Biology. Vol. 1074. pp. 609– 616. doi :10.1007/978-3-319-75402-4_74. ISBN 978-3-319-75401-7. PMID 29721994.
Внешние ссылки
- Модели и структуры адаптеров