Сцепление с полом

Сцепленный с полом тип описывает зависящие от пола закономерности чтения наследования и проявления , когда мутация гена ( аллель ) присутствует на половой хромосоме (аллосоме), а не на неполовой хромосоме ( аутосоме ). У людей они называются сцепленными с Х-хромосомой рецессивными , сцепленными с Х-хромосомой доминантными и сцепленными с Y-хромосомой . Наследование и проявление всех трех типов различаются в зависимости от пола как родителя, так и ребенка. Это делает их характерно отличными от аутосомно- доминантного и рецессивного .
Существует гораздо больше заболеваний, сцепленных с Х-хромосомой, чем сцепленных с Y-хромосомой, поскольку у людей в несколько раз больше генов на Х-хромосоме, чем на Y-хромосоме . Только женщины могут быть носителями заболеваний, сцепленных с Х-хромосомой; мужчины всегда будут страдать от любого заболевания, сцепленного с Х-хромосомой, поскольку у них нет второй Х-хромосомы со здоровой копией гена. Таким образом, рецессивные заболевания, сцепленные с Х-хромосомой, поражают мужчин гораздо чаще, чем женщин.
При рецессивном наследовании, сцепленном с Х-хромосомой, сын, рожденный от матери-носителя и здорового отца, имеет 50%-ный шанс быть пораженным, в то время как дочь имеет 50%-ный шанс быть носителем, однако часть носителей может демонстрировать более легкую (или даже полную) форму заболевания из-за явления, известного как перекошенная X-инактивация , при котором нормальный процесс инактивации половины X-хромосом женского организма предпочтительно нацелен на X-хромосому определенного родителя (в данном случае отца). Если отец поражен, сын не будет поражен, так как он не наследует X-хромосому отца, но дочь всегда будет носителем (и может иногда проявлять симптомы из-за вышеупомянутой перекошенной X-инактивации).
При наследовании с доминантным Х-хромосомой, сын или дочь, рожденные от больной матери и здорового отца, имеют 50% шанс быть больными (хотя некоторые доминантные Х-хромосомные состояния являются эмбрионально летальными для сына, из-за чего они, по-видимому, встречаются только у женщин). Если отец болен, сын всегда будет здоров, но дочь всегда будет больна. Сцепленное с Y-хромосомой состояние будет передаваться только от отца к сыну и всегда будет влиять на каждое поколение.
Модели наследования отличаются у животных, которые используют системы определения пола, отличные от XY . В системе определения пола ZW, используемой птицами, модель млекопитающих обратная, поскольку самец является гомогаметным полом (ZZ), а самка — гетерогаметной (ZW).
В классической генетике эксперимент по скрещиванию, называемый взаимным скрещиванием, проводится для проверки того, сцеплен ли признак животного с полом.
(А)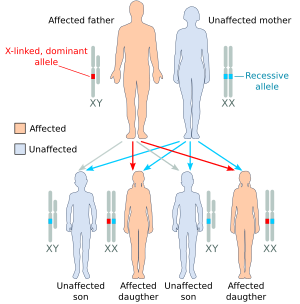 | (Б)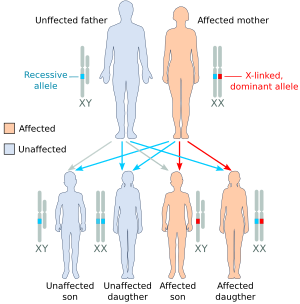 | (С) |
| Иллюстрация некоторых результатов наследственности, сцепленной с Х-хромосомой (A) пораженный отец имеет один доминантный аллель, сцепленный с Х-хромосомой, мать гомозиготна по рецессивному аллелю: только дочери (все) будут поражены. (B) пораженная мать гетерозиготна с одной копией доминантного аллеля, сцепленного с Х-хромосомой: и дочери, и сыновья будут иметь 50% вероятность быть пораженными. (C) гетерозиготная мать называется «носительницей», потому что у нее есть одна копия рецессивного аллеля: сыновья будут иметь 50% вероятность быть пораженными, 50% незараженных дочерей станут носителями, как и их мать. [2] |
Х-сцепленное доминантное наследование

Реже встречается доминантное наследование, сцепленное с Х-хромосомой . Для возникновения расстройства достаточно одной копии мутировавших аллелей на Х-хромосомах, если заболевание унаследовано от больного родителя.
В отличие от рецессивного наследования, сцепленного с Х-хромосомой, доминантные признаки, сцепленные с Х-хромосомой, могут влиять на женщин так же сильно, как и на мужчин. Пораженные отцы сами по себе не приведут к поражению сыновей. Однако, если мать также поражена, есть вероятность, что сыновья будут поражены в зависимости от того, какая из Х-хромосом (рецессивная или доминантная) унаследована. Если у сына проявляется признак, мать также должна быть поражена. Некоторые доминантные признаки, сцепленные с Х-хромосомой, такие как синдром Айкарди , вызывают эмбриональную смерть у мужчин, что приводит к их проявлению только у рожденных женщин, которые продолжают выживать с этими состояниями.
Х-сцепленное рецессивное наследование

Сцепленное с Х-хромосомой рецессивное наследование кодируется рецессивной версией гена. Мутация гена на Х-хромосоме приводит к тому, что фенотип всегда присутствует у мужчин, поскольку у них только одна Х-хромосома. Фенотип возникает только у женщин, если они гомозиготны по мутации. Женщина с одной копией мутировавшего гена считается носителем .
Женщина-носитель только с одной копией мутировавшего гена часто не выражает больной фенотип, хотя инактивация X-хромосомы (или перекошенная инактивация X), которая распространена в женской популяции, может привести к разным уровням экспрессии. [3] Существуют характерные закономерности для рецессивного наследования, сцепленного с X-хромосомой. [4] Поскольку каждый родитель вносит одну половую хромосому в свое потомство, сыновья не могут получить признак, сцепленный с X-хромосомой, от пораженных отцов, которые обеспечивают только Y-хромосому. Следовательно, пораженные мужчины должны унаследовать мутировавшую X-хромосому от своих матерей. Рецессивные признаки, сцепленные с X-хромосомой, чаще встречаются у мужчин, поскольку у них есть только одна X-хромосома, им нужна только одна мутировавшая X-хромосома, чтобы быть пораженными. Напротив, у женщин есть две X-хромосомы, и они должны унаследовать два мутировавших рецессивных аллеля X, по одному от каждого родителя, чтобы быть пораженными. Рецессивные фенотипы, сцепленные с X-хромосомой, как правило, пропускают поколения. [5] Дедушка не окажет влияния на сына, но может повлиять на внука, передав мутировавшую Х-хромосому своей дочери, которая, таким образом, является носителем.
Y-сцепленный
- Различные сбои в генах SRY
Сцепленные с полом признаки у других животных
- Белые глаза у мух Drosophila melanogaster были одним из самых ранних обнаруженных генов, сцепленных с полом . [6]
- Цвет шерсти у домашних кошек : ген, отвечающий за оранжевый пигмент, находится на Х-хромосоме; таким образом, кошка окраса «калико» или «черепаховый» , имеющая как черный (или серый), так и оранжевый пигмент, почти всегда является самкой.
- Первым сцепленным с полом геном, когда-либо обнаруженным, был рецессивный ген «lacticolor», сцепленный с Х-хромосомой, у моли Abraxas grossulariata, обнаруженный Леонардом Донкастером . [7]
Связанные термины
Важно различать сцепленные с полом признаки, которые контролируются генами на половых хромосомах, и две другие категории. [8]
Черты, зависящие от пола
Половые или обусловленные полом признаки — это фенотипы, на которые влияет то, проявляются ли они в мужском или женском организме. [9] Даже у гомозиготной доминантной или рецессивной самки состояние может не проявляться в полной мере. Пример: облысение у людей.
Черты, ограниченные полом
Это признаки, проявляющиеся только у одного пола. Они могут быть вызваны генами как на аутосомных, так и на половых хромосомах. [9] Примеры: женская стерильность у Drosophila ; и многие полиморфные признаки у насекомых, особенно в отношении мимикрии . За последнее часто отвечают тесно связанные гены на аутосомах, называемые « супергенами ». [10] [11] [12]
Генетические заболевания
Генетическое заболевание, сцепленное с Х -хромосомой , — это заболевание, наследуемое через генетический дефект в Х-хромосоме . В клетках человека есть пара несовпадающих половых хромосом , обозначенных как X и Y. Женщины несут две Х-хромосомы, тогда как мужчины имеют одну Х-хромосому и одну Y-хромосому . Заболевание или признак, определяемые геном в Х-хромосоме, демонстрируют Х-сцепленное наследование, которое можно разделить на доминантное и рецессивное .
Первое генетическое заболевание, сцепленное с Х-хромосомой, было описано на бумаге Джоном Дальтоном в 1794 году, затем, в 1910 году, после эксперимента Томаса Ханта Моргана , стало известно больше о наследовании, сцепленном с полом. В 1961 году Мэри Лион выдвинула гипотезу случайной инактивации Х-хромосомы, которая стала основой для понимания механизма наследования, сцепленного с Х-хромосомой.
В настоящее время идентифицировано 867 генов, сцепленных с Х-хромосомой, с более чем 533 заболеваниями, связанными с генами, сцепленными с Х-хромосомой. Распространенные генетические заболевания, сцепленные с Х-хромосомой, включают красно-зеленую цветовую слепоту , которая влияет на способность человека видеть красные или зеленые изображения; Х-сцепленную агаммаглобулинемию , приводящую к дефициту иммунитета ; мышечную дистрофию Дюшенна , вызывающую мышечную слабость и неподвижность; гемофилию А , приводящую к дефициту свертываемости крови . Х-сцепленные рецессивные заболевания встречаются чаще, чем доминантные, и преимущественно поражают мужчин, при этом красно-зеленая цветовая слепота имеет самую высокую распространенность среди всех.
Генетический скрининг, включая скрининг носителей , пренатальный скрининг и скрининг новорожденных, может проводиться у людей для раннего выявления генетических дефектов. Поскольку существует множество генетических заболеваний, сцепленных с Х-хромосомой, патология и механизм каждого из них значительно различаются, не существует четкой диагностики и лечения для всех заболеваний. Методы диагностики варьируются от анализов крови до генетических тестов , в то время как методы лечения варьируются от специфических лекарств до переливания крови .
Частота возникновения рецессивных заболеваний, сцепленных с Х-хромосомой, у женщин пропорциональна квадрату частоты возникновения заболеваний у мужчин: например, если 1 из 20 мужчин в популяции людей страдает дальтонизмом на красный и зеленый цвета , то ожидается, что 1 из 400 женщин в популяции будет страдать дальтонизмом ( 1 / 20 )*( 1 / 20 ). Вот несколько примеров:
- Синдром Аарскога–Скотта
- Адренолейкодистрофия (АЛД)
- агаммаглобулинемия Брутона
- Цветовая слепота
- Синдром полной нечувствительности к андрогенам
- Врожденный стеноз водопровода ( гидроцефалия )
- мышечная дистрофия Дюшенна
- болезнь Фабри
- Дефицит глюкозо-6-фосфатдегидрогеназы
- Гемофилия А и В
- синдром Хантера
- Наследственный нефрогенный несахарный диабет
- Болезнь Менкеса (синдром курчавых волос)
- Дефицит орнитинкарбамоилтрансферазы
- Синдром Вискотта–Олдрича
Существует меньше сцепленных с Х-хромосомой доминантных состояний, чем сцепленных с Х-хромосомой рецессивных, поскольку доминирование в сцеплении с Х-хромосомой требует, чтобы состояние присутствовало у женщин только с долей снижения экспрессии генов аутосомного доминирования, поскольку примерно половина (или до 90% в некоторых случаях ) Х-хромосом конкретного родителя инактивированы у женщин. [ необходима ссылка ] Вот некоторые примеры:
- синдром Альпорта
- Синдром Коффина–Лоури (СКЛ)
- Синдром ломкой Х-хромосомы
- Идиопатический гипопаратиреоз
- Недержание пигмента
- Синдром Ретта (СР)
- Витамин D -резистентный рахит ( Х-сцепленная гипофосфатемия )
Дальтонизм (нарушение восприятия красного и зеленого цветов)
Красно-зеленая слепота — это тип нарушения цветового зрения (НЦЗ), вызванный мутацией в генах, сцепленных с Х-хромосомой, которая влияет на колбочки, отвечающие за поглощение красного или зеленого света.
Восприятие красного и зеленого света приписывается длинноволновым (L) и средневолновым (M) колбочкам соответственно. [13] При красно-зеленой цветовой слепоте мутации происходят в генах OPN1LW и OPN1MW [14], кодирующих фотопигменты в колбочках. В более легких случаях у пораженных людей наблюдается сниженная чувствительность к красному или зеленому свету в результате гибридизации генов [14] , сдвигающей реакцию одной колбочки в сторону реакции другой. [13] В более экстремальных условиях происходит делеция или замена соответствующих кодирующих генов, [15] что приводит к отсутствию фотопигментов L или M колбочек и, таким образом, полной потере способности различать красный или зеленый свет.
Х-сцепленная агаммаглобулинемия
Х-сцепленная агаммаглобулинемия (ХЛА) — это первичное иммунодефицитное заболевание , которое нарушает способность организма вырабатывать антитела , представляющие собой белки, защищающие нас от болезнетворных антигенов , что приводит к тяжелым бактериальным инфекциям . [16]
XLA связан с мутацией в гене тирозинкиназы Брутона (BTK) на Х-хромосоме, [17] который отвечает за выработку BTK, фермента, регулирующего развитие B-клеток . [17] B-клетки — это тип белых кровяных клеток, необходимых для выработки антител, когда на ранней стадии, называемой пре-B-клетками , они полагаются на сигналы расширения и выживания, включающие BTK, чтобы созреть. [18]
У пораженных людей гены BTK имеют мутацию аминокислотной замены , [17] изменяющую аминокислотную последовательность и структуру BTK, делая ее дефектной. Поэтому у них нормальное количество пре-В-клеток, но они не могут развить зрелые В-клетки, что приводит к дефициту антител.
Мышечная дистрофия Дюшенна
Мышечная дистрофия Дюшенна (МДД) — это тяжелое нервно-мышечное заболевание, вызывающее прогрессирующую слабость и повреждение мышечной ткани , [19] приводящее к потере подвижности и трудностям в повседневной деятельности. На более поздней стадии МДД, когда дыхательные и сердечные мышцы начинают дегенерировать, у пораженных людей могут развиться осложнения, такие как дыхательная недостаточность , кардиомиопатия и сердечная недостаточность . [19]
МДД возникает из-за мутации, вероятно, из-за делеции экзонов [ 20] [ 21] нуклеотидной последовательности в гене МДД, которая кодирует дистрофин . Дистрофин — это белок, отвечающий за укрепление и стабилизацию мышечных волокон. [22] С потерей комплекса дистрофина мышечные клетки больше не будут защищены, что приведет к прогрессирующему повреждению или дегенерации.
Гемофилия А
Гемофилия А — это заболевание свертываемости крови, вызванное генетическим дефектом фактора свертывания VIII . Оно вызывает значительную восприимчивость как к внутренним, так и к внешним кровотечениям. У людей с более тяжелой формой гемофилии кровотечения могут быть более частыми и интенсивными.
Тяжелая форма гемофилии А поражает большинство пациентов. Пациенты с легкой формой гемофилии часто не испытывают сильного кровотечения, за исключением хирургических операций и значительных травм. [23]
Скрининг
Проверка на носительство
Скрининг на носительство направлен на выявление рецессивных заболеваний. Цели скрининга на носительство обычно не проявляют никаких симптомов , но могут иметь семейную историю заболевания или находиться на стадии планирования семьи. Скрининг на носительство проводится путем проведения анализа крови у человека для определения конкретного аллеля. [24]
Пренатальный скрининг
Пренатальный скрининг предлагается женщинам во время беременности, он включает в себя как анализы крови матери , так и ультразвуковое исследование для проверки возможных дефектных генов у развивающегося плода . [25] Результат скрининга подтверждает только возможность генетического заболевания, поэтому родители будут готовы психологически или смогут рассмотреть вариант прерывания беременности .
Скрининг новорожденных
Обычно используется тест на укол в пятку . Несколько капель крови берутся с помощью хлопковой бумаги из пятки новорожденного, которому меньше недели, [26] затем образцы анализируются на предмет различных заболеваний.
История
Красно-зеленая цветовая слепота была первым генетическим заболеванием, сцепленным с Х-хромосомой, описанным на бумаге в 1794 году Джоном Дальтоном , который сам страдал этим заболеванием. [27] Однако только позже были разработаны схема наследования и генетика. Х-хромосома была открыта в 1890 году Германом Хенкингом , [28] затем в 1910 году Томас Хант Морган обнаружил мутацию, сцепленную с Х-хромосомой, у дрозофилы , [29] который затем провел эксперименты и наблюдения, чтобы понять Х-сцепленное наследование.
В 1961 году Мэри Лион предположила, что одна из двух Х-хромосом в женских клетках млекопитающих будет подвергаться случайной инактивации (см. Инактивация Х-хромосомы ) на ранней эмбриональной стадии . [30] Согласно ее гипотезе, и у самцов, и у самок должна быть одна активная Х-хромосома. Это способствовало пониманию фундаментальных механизмов наследования, сцепленного с Х-хромосомой.
Смотрите также
- Х-сцепленное доминантное наследование
- Х-сцепленное рецессивное наследование
- Генетическая эпидемиология
- Список генетических заболеваний
Ссылки
- ^ Морган, Томас Хант 1919. Физическая основа наследственности . Филадельфия: JB Lippincott Company.
- ^ Справочник по генетике (2006), иллюстрации генетических состояний, Национальная медицинская библиотека .
- ^ Швецова, Екатерина; Софронова, Алина; Монажеми, Рамин; Гагалова Кристина; Драйсма, Хармен Х.М.; Уайт, Стефан Дж.; Сантэн, Гийс ВЕ; Чува де Соуза Лопес, Сусана М.; Хейманс, Бастиан Т.; ван Мерс, Джойс; Янсен, Рик; Франке, Люд; Келбаса, Шимон М.; ден Даннен, Йохан Т.; 'т Хоэн, Питер AC (14 декабря 2018 г.). «Искаженная Х-инактивация распространена среди женского населения». Европейский журнал генетики человека . 27 (3): 455–465 . doi : 10.1038/s41431-018-0291-3. ISSN 1018-4813. PMC 6460563. PMID 30552425 .
- ^ Альянс, Генетика; Услуги скрининга, Нью-Йоркско-Среднеатлантический консорциум по генетике и новорожденным (8 июля 2009 г.), «ОБРАЗЦЫ НАСЛЕДОВАНИЯ», Понимание генетики: Нью-Йоркское, Среднеатлантическое руководство для пациентов и медицинских работников , Генетический альянс , получено 27 марта 2024 г.
- ^ Пирс, Бенджамин А. (2020). Генетика: концептуальный подход. Macmillan Learning. стр. 154–155. ISBN 978-1-319-29714-5.
- ^ Morgan TH 1910. Ограниченное полом наследование у Drosophila. Science 32 : 120–122
- ^ Донкастер Л. и Рейнор ГХ 1906. Эксперименты по разведению чешуекрылых. Труды Лондонского зоологического общества . 1 : 125–133
- ^ Zirkle, Conway (1946). Открытие наследственности, зависящей от пола, ограниченной полом и сцепленной с полом. В Ashley Montagu MF (ред.) Исследования по истории науки и обучения, представленные в память о Джордже Сартоне по случаю его шестидесятилетия . Нью-Йорк: Schuman, стр. 167–194.
- ^ ab King RC; Stansfield WD & Mulligan PK 2006. Генетический словарь . 7-е изд., Oxford University Press. ISBN 0-19-530761-5
- ^ Mallet J. ; Joron M. (1999). «Эволюция разнообразия в предупреждающей окраске и мимикрии: полиморфизмы, смещение баланса и видообразование». Annual Review of Ecology and Systematics . 30 : 201– 233. doi :10.1146/annurev.ecolsys.30.1.201.
- ^ Форд ЭБ (1965) Генетический полиморфизм . стр. 17-25. MIT Press 1965.
- ^ Joron M, Papa R, Beltrán M и др. (2006). «Сохраняющийся локус супергена контролирует разнообразие цветового рисунка у бабочек Heliconius». PLOS Biol . 4 (10): e303. doi : 10.1371/journal.pbio.0040303 . PMC 1570757. PMID 17002517 .
- ^ ab Barton, Jason JS; Leff, Alexander; Aminoff, Michael J.; Boller, François; Swaab, DF, ред. (2021). «Цветовое зрение». Неврология зрения и зрительных расстройств. Справочник по клинической неврологии. 3-я серия. Т. 178. Амстердам, Нидерланды: Elsevier. С. 133–141 . ISBN 978-0-12-821377-3. OCLC 1237102002.
- ^ ab Deeb, Samir S (1 июля 2004 г.). «Молекулярная генетика дефицитов цветового зрения». Clinical and Experimental Optometry . 87 ( 4– 5): 224– 229. doi :10.1111/j.1444-0938.2004.tb05052.x. ISSN 0816-4622. PMID 15312026.
- ^ Neitz, J.; Neitz, M. (2011). «Генетика нормального и дефектного цветового зрения». Vision Research . 51 (7): 633– 651. doi :10.1016/j.visres.2010.12.002. PMC 3075382. PMID 21167193 .
- ^ Смит, CE; Берглёф, А. (1993), Адам, MP; Фельдман, Дж.; Мирзаа, ГМ; Пагон, РА (ред.), "X-Linked Agammaglobulinemia", GeneReviews® , Сиэтл (WA): Университет Вашингтона, Сиэтл, PMID 20301626 , получено 27 марта 2024 г.
- ^ abc Maas, A.; Hendriks, RW (2001). «Роль тирозинкиназы Брутона в развитии В-клеток». Developmental Immunology . 8 ( 3– 4): 171– 181. doi : 10.1155/2001/28962 . PMC 2276078. PMID 11785667 .
- ^ Макдональд, К.; Ксантопулос, К.; Костарели, Э. (2021). «Роль тирозинкиназы Брутона в иммунной системе и заболеваниях». Иммунология . 164 (4): 722– 736. doi :10.1111/imm.13416. ISSN 0019-2805. PMC 8561098. PMID 34534359 .
- ^ ab Venugopal, Vijay; Pavlakis, Steven (2024), "Мышечная дистрофия Дюшенна", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 29493971 , получено 27 марта 2024 г.
- ^ Yiu, Eppie M; Kornberg, Andrew J (август 2015 г.). «Мышечная дистрофия Дюшенна». Журнал педиатрии и детского здоровья . 51 (8): 759– 764. doi :10.1111/jpc.12868. ISSN 1034-4810. PMID 25752877.
- ^ Аартсма-Рус, Аннемике; Гинджар, Ике Б; Бушби, Кейт (март 2016 г.). «Важность генетической диагностики мышечной дистрофии Дюшенна». Журнал медицинской генетики . 53 (3): 145–151 . doi :10.1136/jmedgenet-2015-103387. ISSN 0022-2593. ПМЦ 4789806 . ПМИД 26754139.
- ^ Gao, QQ; McNally, EM (17 января 2011 г.). Terjung, Ronald (ред.). Comprehensive Physiology . Vol. 5 (1-е изд.). Wiley. стр. 1223–1239 . doi :10.1002/cphy.c140048. ISBN 978-0-470-65071-4. PMC 4767260 . PMID 26140716.
- ^ Конкл, Барбара А.; Накая Флетчер, Шелли (1993). «Гемофилия А». GeneReviews® . Сиэтл (WA): Университет Вашингтона, Сиэтл. PMID 20301578.
- ^ Антонаракис, Стилианос Э. (сентябрь 2019 г.). «Скрининг носителей рецессивных расстройств». Nature Reviews Genetics . 20 (9): 549– 561. doi :10.1038/s41576-019-0134-2. ISSN 1471-0056. PMID 31142809.
- ^ Cuckle, Howard; Maymon, Ron (1 февраля 2016 г.). «Развитие пренатального скрининга — исторический обзор». Семинары по перинатологии . Изменение парадигмы пренатального скрининга врожденных дефектов. 40 (1): 12– 22. doi :10.1053/j.semperi.2015.11.003. ISSN 0146-0005. PMID 26764253.
- ^ Андерсон, Р.; Ротвелл, Э.; Боткин, Дж. Р. (2011). «Скрининг новорожденных». Ежегодный обзор исследований в области сестринского дела . 29 (1): 113– 132. doi :10.1891/0739-6686.29.113. ISSN 0739-6686. PMC 7768912. PMID 22891501 .
- ^ Хант, Дэвид М.; Дулай, Канвайджит С.; Боумейкер, Джеймс К.; Моллон, Джон Д. (17 февраля 1995 г.). «Химия цветовой слепоты Джона Дальтона». Science . 267 (5200): 984– 988. Bibcode :1995Sci...267..984H. doi :10.1126/science.7863342. ISSN 0036-8075. PMID 7863342.
- ^ Шварц, Джеймс (2009). В погоне за геном: от Дарвина до ДНК (1-е издание в мягкой обложке). Кембридж, Массачусетс: Harvard Univ. Press. ISBN 978-0-674-03491-4.
- ^ Грин, ММ (1 января 2010 г.). «2010: Век генетики дрозофилы сквозь призму белого гена». Генетика . 184 (1): 3–7 . doi :10.1534/genetics.109.110015. ISSN 1943-2631. PMC 2815926. PMID 20061564 .
- ^ DISTECHE, CHRISTINE M.; BERLETCH, JOEL B. (1 декабря 2015 г.). «Инактивация и побег X-хромосомы». Journal of Genetics . 94 (4): 591– 599. doi :10.1007/s12041-015-0574-1. ISSN 0973-7731. PMC 4826282. PMID 26690513 .