Триборациклопропенил

Фрагмент триборациклопропенил представляет собой циклический структурный мотив в химии бора , названный из-за его геометрического сходства с циклопропеном . В отличие от неплоских кластеров борана , которые демонстрируют более высокие координационные числа у бора (например, через 3-центровые 2-электронные связи с мостиковыми гидридами или катионами ), структуры типа триборациклопропенил представляют собой кольца из трех атомов бора, где заместители у каждого бора также копланарны кольцу. Соединения, содержащие триборациклопропенил, являются крайними случаями неорганической ароматичности . Они являются самыми легкими и наименьшими циклическими структурами, которые, как известно, демонстрируют связывающие и магнитные свойства, которые возникают из-за полностью делокализованных электронов на орбиталях симметрии σ и π . Хотя трехчленные кольца бора часто настолько сильно напряжены , что являются экспериментально недоступными, академический интерес к их отличительной ароматичности и возможной роли в качестве промежуточных продуктов пиролиза борана мотивировал обширные вычислительные исследования химиков-теоретиков . [1] [2] [3] [4] Начиная с конца 1980-х годов с масс-спектрометрической работы Андерсона и др . на кластерах из одного бора, экспериментальные исследования триборациклопропенилов в течение десятилетий ограничивались исключительно исследованиями в газовой фазе простейших колец (ионов B 3 ). [4] [5] [6] Однако более поздние работы стабилизировали триборациклопропенильную часть посредством координации с донорными лигандами или переходными металлами , что значительно расширило сферу ее химии. [7] [8] [9] [10]
Синтез
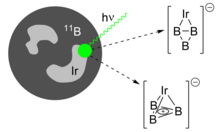
Для газофазных спектроскопических исследований триборациклопропенилсодержащие соединения получаются посредством лазерной абляции борных мишеней и коллимации полученного плазменного облака в потоке инертного газа-носителя, такого как гелий. Затем интересующие заряженные молекулы отбираются по массе с помощью времяпролетной масс-спектрометрии. Добавление газов, таких как N 2 или CO, к газовому потоку дает соответствующие аддукты , в то время как добавление металлов, таких как иридий и ванадий, к мишени B дает соответствующие легированные металлами кластеры. [11]
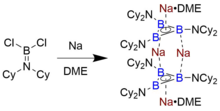
Единственный изолируемый пример триборациклопропенил-аниона, который сохраняется в растворе и в твердом состоянии, был идентифицирован Брауншвейгом и его коллегами, которые синтезировали его путем восстановления аминоборана Cl 2 B=NCy 2 (Cy = циклогексил ) тонкодисперсным металлическим натрием в диметоксиэтане (ДМЭ). [7] Охлаждение полученного оранжево-красного раствора димерных видов Na 4 [B 3 (NCy 2 ) 3 ] 2 • 2 ДМЭ привело к образованию кристаллов, пригодных для рентгеновской дифракции , с помощью которой была определена структура. Хотя подробный механизм восстановления неизвестен, было высказано предположение, что субвалентные промежуточные соединения "R 2 N−B" участвуют в образовании таких кластеров бора. [12]
Структура и связь
Из-за их особого статуса как простейших ароматических циклов электронная структура производных триборациклопропенила анализировалась с помощью различных методов вычислительной химии . Они варьировались от канонической теории молекулярных орбиталей до альтернативных формулировок связи, таких как адаптивная теория естественного распределения плотности, [13] квантовая теория атомов в молекулах , теория естественных орбиталей связи , естественные орбитали для химической валентности [14] и анализ функции локализации электронов . Расчеты NICS и кольцевого тока также использовались для характеристики ароматичности в таких системах с использованием магнитных критериев. [15] В целом, чрезвычайно малый размер этих циклов подразумевает, что их связывающие электроны испытывают существенное кулоновское отталкивание, что приводит к аномально высокой кольцевой деформации . [16] Этот эффект частично компенсируется стабилизацией, обеспечиваемой ароматической делокализацией.
Б3+
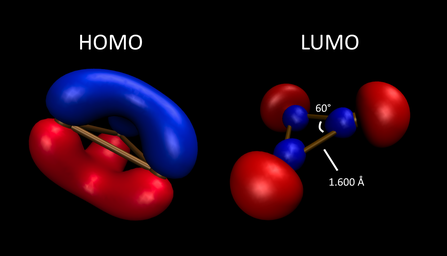
B 3 + проявляет π ароматичность, связанную с его a 2 '' -симметричной HOMO . В своем синглетном электронном основном состоянии это система электронов Хюккеля 2π, аналогичная катиону циклопропения , но она слишком реактивна, чтобы ее можно было изолировать. Она треугольная, с симметрией D 3h - все ее атомы B и расстояния связей BB химически эквивалентны. Газофазные аддукты B 3 (N 2 ) 3 + и B 3 (CO) 3 + были вычислительно изучены с помощью теории ETS-NOCV (расширенное переходное состояние - естественные орбитали для химической валентности), которая анализирует изменения энергии и электронной плотности, возникающие при приготовлении молекулы из исходного состояния невзаимодействующих фрагментов. [17] Анализ разложения энергии ETS-NOCV предполагает, что аддукты N 2 и CO в первую очередь стабилизируются (на -83,6 и -112,3 ккал/моль соответственно) посредством σ-донорства экзоциклических лигандов в борное кольцо с высоким дефицитом электронов. В результате каждый из них был интерпретирован как фрагмент B 3 + , поддерживаемый дативной связью от N 2 или CO. Плотность электронной деформации, построенная из NOCV этой системы, вместе с зарядами, полученными из естественных заселенностей орбиталей связей, указывает на поток электронов из экзоциклического лиганда в кольцо, что вызывает сокращение всех эквивалентных связей ядра B 3 + примерно на 4 пм. Взаимодействия π-симметрии наблюдаются как со слабым σ-донором N 2 , так и с сильным π-акцепторным лигандом CO. Однако обратное π-донирование вне плоскости (из π-системы кольца B 3 в π-акцепторные орбитали каждого лиганда) менее стабилизирует, чем обратное π-донирование в плоскости, с прочностью -26,7 и -19,6 ккал/моль для системы [B 3 (CO) 2 + + CO]. Это говорит о том, что минимально-энергетическая конфигурация молекулы - это та, которая сохраняет максимальную π-ароматичность в ядре B 3 + .
Так же, как ароматические виды, такие как циклопентадиенильный анион и циклопропениевый катион, могут координироваться с переходными металлами, недавно было продемонстрировано, что кольцо B 3 + может связываться с металлическими центрами. [18] Лазерная абляция смешанной мишени B/Ir производит два изомера IrB 3 − , кольцо B 3 + , координированное с формальным анионом Ir 2- . Это псевдоплоский аддукт η 2 и тетраэдрический аддукт η 3 , последний из которых содержит ароматический триборациклопропениловый фрагмент. Оба почти идентичны по энергии и сосуществуют в сгенерированном кластерном пучке.


Расчеты показывают, что B 3 + может даже связывать атомы инертных благородных газов, образуя необычное семейство соединений B 3 (Rg) 3 + (Rg = инертный/благородный газ) с существенной прочностью связи (от 15 до 30 ккал/моль), которая возникает из-за σ-доничности p-орбитали Rg и значительной степени переноса заряда от Rg к B 3 + . Возможность новых соединений благородных газов , которые образуются экзотермически и спонтанно, является возможностью для экспериментальной работы. [19] [21]
Б3
B 3 обладает однократно занятой a 1 ' HOMO (a SOMO), которая состоит из σ-симметричных орбиталей, ориентированных к ядру кольца, связанных с σ-делокализацией и немного более короткими длинами связей BB по сравнению с B 3 + . Он парамагнитен с дублетным основным состоянием. [22] Он неполярный, плоский и треугольный, имеет симметрию D 3h .
Б3−
B 3 − , с заполненной a 1 ' HOMO в симметрии D 3h , считается «дважды» ароматичным и относительно стабильным - он одновременно обладает высокоделокализованными σ и π электронами в своих HOMO и HOMO-1 соответственно. [23] [24]
Б3Р32-
B 3 R 3 2- , сформулированный с электронными связями B−R, а не дативными стрелками, является изоэлектронным по отношению к B 3 + . 8 электронов отведены триборациклопенильному ядру, 6 в σ-связывающих орбиталях и 2 в π-системе, что приводит к ароматичности Хюккеля. Единственное экспериментально охарактеризованное соединение этого класса — Na 4 [B 3 (NCy 2 ) 3 ] 2 • 2 DME, димер сложенных звеньев B 3 R 3 2- , которые сами по себе являются ароматическими. [7] Анализ естественных орбиталей связей показывает, что это соединение высоко стабилизировано (примерно на 45 ккал/моль) донорно-акцепторным взаимодействием локализованных орбиталей связей B−B с соответствующей антисвязывающей орбиталью B−N поперек кольца, в дополнение к связыванию электростатическим притяжением с мостиковыми катионами Na + , идентифицированными в кристаллической структуре. Расчеты DFT показывают, что HOMO и HOMO-1 являются антисимметричными и симметричными комбинациями π HOMO отдельного кольца соответственно — черта, общая с металлоценами . Как и ожидалось для видов со связями B−B, которые имеют формальный порядок связи MO , средняя длина связи BB 1,62 Å ближе к таковым катион-радикалов диборена (RB=BR), чем одинарные связи B−B примерно 1,75 Å.
Спектроскопия и спектрометрия
Соединения, полученные из триборациклопропенила, были впервые идентифицированы по их отношению массы к заряду как переходные виды в масс-спектрометрии сложных смесей катионных борных кластеров. [5] Вскоре последовали исследования реактивного рассеяния с O 2 , выявившие относительно сильную связь внутри легких борных кластеров. [6] Впоследствии B 3 был выделен в матрицах замороженных благородных газов, и были зарегистрированы спектры электронного парамагнитного резонанса , которые подтвердили его геометрию D 3h . [22] Сверхтонкая связь неспаренного электрона с ядром 11 B дала оценку 15% s-орбитального характера для a 1 ' HOMO. Небольшие и неполярные кольца B 3 могли свободно кувыркаться и вращаться даже будучи заключенными в матрице.
В целом, триборациклопропенилсодержащие виды были слишком короткоживущими и производились в недостаточном количестве для инфракрасной спектроскопии в режиме пропускания . Однако диссоциация B 3 (N 2 ) 3 + инфракрасным светом и наблюдение за затуханием соответствующего сигнала массы к заряду с помощью масс-спектрометрии позволили зарегистрировать эффективный инфракрасный спектр B 3 (N 2 ) 3 + . [17] [25] Этот колебательный фотодиссоциативный спектр содержал только одну обнаруживаемую вибрацию с красным смещением 98 см −1 относительно газообразного N 2 , что предполагает высокосимметричный аддукт B 3 (N 2 ) 3 + со слегка ослабленной связью N≡N.
Отрицательно заряженные ионы, содержащие триборациклопропенил, оказались пригодными для изучения с помощью фотоэлектронной спектроскопии . По теореме Купмана , пренебрегая эффектами сильной электронной корреляции , кинетические энергии электронов, оторванных рентгеновскими лучами, могут быть отображены на энергии связи отдельных орбиталей и выявить молекулярную электронную структуру. [26] [27] Расщепление полученных спектральных пиков от « колебательной прогрессии » (согласно принципу Франка-Кондона ) указывает на то, как ионизация при разных энергиях изменяет конкретные колебательные частоты молекулы, и такие эффекты на связь интерпретируются в терминах изменений электронной конфигурации. В B 3 − наблюдалась необычно высокоинтенсивная и высокоэнергетическая полоса, соответствующая многоэлектронному или «встрясочному» переходу (связанное отсоединение электронов и электронное возбуждение), что предполагает сильную электронную корреляцию, присутствующую во фрагменте триборациклопропенил. [4] Для IrB 3 − колебательная прогрессия от растягивающих и дыхательных колебаний IrB 3 может быть назначена в наложенных спектрах обоих изомеров, присутствующих в кластерном пучке. По сравнению с вычислениями, минимальная энергетическая структура IrB 3 может быть сформулирована как тетраэдр с неповрежденной ароматической частью B 3 + . [8]
Реактивность
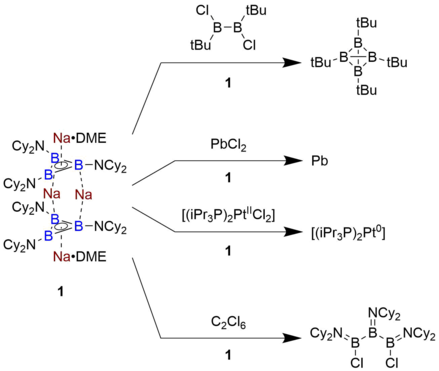
Реакционная способность соединений, содержащих триборациклопропенил, относительно недостаточно изучена, поскольку только один пример был получен в фазе раствора. Соединение, о котором сообщил Брауншвейг, Na 4 [B 3 (NCy 2 ) 3 ] 2 • 2 DME, является чрезвычайно мощным восстановителем с окислительным потенциалом -2,42 В по сравнению с парой ферроцен/ферроцений. В результате оно способно восстанавливать хлорбораны, образуя тетраэдрические кластеры B, а также восстанавливать PbCl 2 непосредственно до металлического Pb. Кроме того, оно будет подвергаться реакции раскрытия кольца в группе B 3 путем отщепления атомов хлора от гексахлорэтана . Этот уровень восстановительной способности примерно сопоставим со щелочным металлом и ранее не наблюдался ни для одной молекулы на основе органического каркаса. [7]
Хотя большинство примеров трехъядерных кластеров бора, легированных переходными металлами, не содержат ароматического триборациклопропенильного фрагмента, реакционная способность таких видов с малыми молекулами, вероятно, привлечет растущий научный интерес. В условиях масс-спектрометрии было продемонстрировано, что VB 3 + дегидрирует метан, давая продукты VB 3 CH 2 + и H 2 . Также действует второстепенная побочная реакция, которая производит VH + и устраняет B 3 CH 3 . [10]
Смотрите также
Ссылки
- ^ Макки, Майкл Л.; Буэль, Майкл; Чаркин, Олег П.; Шлейер, Пол фон Р. (1993-10-01). «Теоретическое исследование четырехцентровой двухэлектронной связи с участием производных бора». Неорганическая химия . 32 (21): 4549–4554. doi :10.1021/ic00073a014. ISSN 0020-1669.
- ^ Коркин, Анатолий А.; Шлейер, Пол фон Р.; Макки, Майкл Л. (1995-02-01). «Теоретическое ab Initio исследование нейтральных и заряженных видов B3Hn (n = 3-9). Важность ароматичности в определении структурных предпочтений». Неорганическая химия . 34 (4): 961–977. doi :10.1021/ic00108a031. ISSN 0020-1669.
- ^ Yang, C. L; Zhu, Z. H (2001-08-27). "Основной синглет и низколежащие триплетные электронные состояния B3+". Журнал молекулярной структуры: THEOCHEM . 571 (1): 225–229. doi :10.1016/S0166-1280(01)00558-9. ISSN 0166-1280.
- ^ abc Zhai, Hua-Jin; Wang, Lai-Sheng; Alexandrova, Anastassia N .; Boldyrev, Alexander I.; Zakrzewski, Vyacheslav G. (2003-11-01). "Photoelectron Spectroscopy and ab Initio Study of B3- and B4- Anions and Their Neutrals". The Journal of Physical Chemistry A. 107 ( 44): 9319–9328. Bibcode :2003JPCA..107.9319Z. doi :10.1021/jp0357119. ISSN 1089-5639.
- ^ ab Hanley, Luke.; Anderson, Scott L. (1987-09-01). «Производство и диссоциация, вызванная столкновениями, малых кластерных ионов бора». Журнал физической химии . 91 (20): 5161–5163. doi :10.1021/j100304a007. ISSN 0022-3654.
- ^ ab Hanley, Luke; Anderson, Scott L. (1988-09-01). «Окисление малых кластерных ионов бора (B+1–13) кислородом». Журнал химической физики . 89 (5): 2848–2860. Bibcode : 1988JChPh..89.2848H. doi : 10.1063/1.454989. ISSN 0021-9606.
- ^ abcdef Купфер, Томас; Брауншвейг, Хольгер; Радацкий, Кшиштоф (07 декабря 2015 г.). «Триборациклопропенил-дианион: самый легкий из возможных элементов основной группы Hückel π Ароматический». Angewandte Chemie, международное издание . 54 (50): 15084–15088. дои : 10.1002/anie.201508670. ПМИД 26530854.
- ^ abc Czekner, Joseph; Cheung, Ling Fung; Kocheril, G. Stephen; Kulichenko, Maksim; Boldyrev, Alexander I.; Wang, Lai-Sheng (2019-06-24). "Высокоразрешающая фотоэлектронная визуализация IrB 3 − : наблюдение π-ароматического кольца B 3 + , координированного с переходным металлом". Angewandte Chemie International Edition . 58 (26): 8877–8881. doi :10.1002/anie.201902406. PMID 31021049. S2CID 131776294.
- ^ Чэнь, Синь; Чэнь, Тенг-Тэн; Ли, Вань-Лу; Лу, Цзюнь-Бо; Чжао, Ли-Хуан; Цзянь, Тянь; Ху, Хань-Ши; Ван, Лай-Шэн; Ли, Цзюнь (2019-01-07). «Лантаноиды с необычно низкими степенями окисления в кластерах боридных соединений PrB 3 и PrB 4». Неорганическая химия . 58 (1): 411–418. doi :10.1021/acs.inorgchem.8b02572. ISSN 0020-1669. PMID 30543295. S2CID 56148031.
- ^ Аб Чен, Цян; Чжао, Ян-Ся; Цзян, Ли-Сюэ; Ли, Хай-Фан; Чен, Цзяо-Цзяо; Чжан, Тин; Лю, Цин-Юй; Хэ, Шэн-Гуй (2018). «Термическая активация метана кластерными катионами борида ванадия VB n + ( n = 3–6)». Физическая химия Химическая физика . 20 (7): 4641–4645. Бибкод : 2018PCCP...20.4641C. дои : 10.1039/C8CP00071A. ISSN 1463-9076. ПМИД 29379936.
- ^ Цзянь, Тянь; Чэнь, Сюэнянь; Ли, Си-Дянь; Болдырев, Александр И.; Ли, Цзюнь; Ван, Лай-Шэн (2019). «Исследование структур и связей кластеров бора выбранного размера и легированного бора». Chemical Society Reviews . 48 (13): 3550–3591. doi :10.1039/C9CS00233B. ISSN 0306-0012. PMID 31120469. S2CID 162182837.
- ^ Вракмейер, Бернд (2016). «Циклотриборановый дианион и катион триборона: «легкие концы» правила Хюккеля». Angewandte Chemie International Edition . 55 (6): 1962–1964. doi :10.1002/anie.201510689. ISSN 1521-3773. PMID 26765534.
- ^ Ткаченко, Николай В.; Болдырев, Александр И. (2019-05-08). "Анализ химических связей возбужденных состояний с использованием метода адаптивного естественного разбиения плотности". Физическая химия Химическая физика . 21 (18): 9590–9596. Bibcode :2019PCCP...21.9590T. doi :10.1039/C9CP00379G. ISSN 1463-9084. PMID 31020963. S2CID 131777283.
- ^ Mitoraj, Mariusz P.; Michalak, Artur; Ziegler, Tom (2009-04-14). "Комбинированная схема разложения заряда и энергии для анализа связей". Journal of Chemical Theory and Computation . 5 (4): 962–975. doi :10.1021/ct800503d. ISSN 1549-9618. PMID 26609605.
- ^ Pham, Hung Tan; Lim, Kie Zen; Havenith, Remco WA; Nguyen, Minh Tho (2016-04-28). «Ароматический характер плоских кластеров на основе бора, пересмотренный расчетами кольцевого тока». Physical Chemistry Chemical Physics . 18 (17): 11919–11931. Bibcode :2016PCCP...1811919P. doi :10.1039/C5CP07391J. hdl : 1854/LU-8549871 . ISSN 1463-9084. PMID 26956732. S2CID 205957278.
- ^ Химмель, Ханс-Йорг (19 августа 2019 г.). «Электронодефицитные триборановые и тетраборановые кольцевые соединения: синтез, структура и связывание». Angewandte Chemie International Edition . 58 (34): 11600–11617. doi :10.1002/anie.201900563. PMID 30786130. S2CID 73514624.
- ^ ab Jin, Jiaye; Wang, Guanjun; Zhou, Mingfei; Andrada, Diego M.; Hermann, Markus; Frenking, Gernot (2016-02-05). "Комплексы [B 3 (NN) 3 ] + и [B 3 (CO) 3 ] + с наименьшими π-ароматическими соединениями B 3 +". Angewandte Chemie International Edition . 55 (6): 2078–2082. doi :10.1002/anie.201509826. PMID 26836340.
- ^ Lichtenberger, Dennis L.; Hoppe, Martin L.; Subramanian, Lalitha; Kober, Edward M.; Hughes, Russell P.; Hubbard, John L.; Tucker, David S. (1993-06-01). "Распределение электронов и связывание в комплексах .eta.3-циклопропенил-металл". Organometallics . 12 (6): 2025–2031. doi :10.1021/om00030a011. ISSN 0276-7333.
- ^ abc Ли, Чжо Чжэ; Ли, Ань Юн (2017-07-26). "Моноциклические ароматические соединения BnRgn(n−2)+ бора и редких газов". Физическая химия Химическая физика . 19 (29): 19109–19119. Bibcode :2017PCCP...1919109L. doi :10.1039/C7CP00316A. ISSN 1463-9084. PMID 28702603.
- ^ Лу, Тянь; Чэнь, Фэйу (2012). «Multiwfn: многофункциональный анализатор волновых функций». Журнал вычислительной химии . 33 (5): 580–592. doi :10.1002/jcc.22885. ISSN 1096-987X. PMID 22162017. S2CID 13508697.
- ^ Саха, Ранаджит; Пан, Судип; Мандал, Субхаджит; Ороско, Месиас; Мерино, Габриэль; Чаттарадж, Пратим К. (17 августа 2016 г.). «Кластер B3 + на основе благородного газа: образование прочных ковалентных связей благородный газ – бор». РСК Прогресс . 6 (82): 78611–78620. Бибкод : 2016RSCAd...678611S. дои : 10.1039/C6RA16188J. ISSN 2046-2069.
- ^ ab Hamrick, YM; Van Zee, RJ; Weltner, W. (1992-02-01). "Электронный спиновый резонанс и основные состояния тримеров бора и алюминия". Журнал химической физики . 96 (3): 1767–1775. Bibcode : 1992JChPh..96.1767H. doi : 10.1063/1.462132. ISSN 0021-9606.
- ^ Александрова, Анастасия Н.; Болдырев, Александр И.; Чжай, Хуа-Цзинь; Ван, Лай-Шэн (2006-11-01). «Полностью борные ароматические кластеры как потенциальные новые неорганические лиганды и строительные блоки в химии». Coordination Chemistry Reviews . 18th Main Group Chemistry. 250 (21): 2811–2866. doi :10.1016/j.ccr.2006.03.032. ISSN 0010-8545.
- ^ Yang, Li-ming; Wang, Jian; Ding, Yi-hong; Sun, Chia-chung (29.08.2007). «Исследование типичной треугольной структуры B 3 в химии бора: взгляд на голые кластеры полностью бора, используемые в качестве лигандов или строительных блоков». Журнал физической химии A . 111 (37): 9122–9129. Bibcode :2007JPCA..111.9122Y. doi :10.1021/jp074645y. ISSN 1089-5639. PMID 17725336.
- ^ Ван, Гуаньцзюнь; Чи, Чаосянь; Син, Сяопэн; Дин, Чуаньфань; Чжоу, Минфэй (2014-01-01). «Коллинеарный тандемный времяпролетный масс-спектрометр для инфракрасной фотодиссоциационной спектроскопии масс-селектированных ионов». Science China Chemistry . 57 (1): 172–177. doi :10.1007/s11426-013-4979-5. ISSN 1869-1870. S2CID 195203032.
- ^ Lineberger, W. Carl (2013-04-01). «Однажды Анион: История фотоотрыва». Annual Review of Physical Chemistry . 64 (1): 21–36. Bibcode : 2013ARPC...64...21L. doi : 10.1146/annurev-physchem-032511-143753. ISSN 0066-426X. PMID 23216379.
- ^ Truhlar, Donald G.; Hiberty, Philippe C.; Shaik, Sason; Gordon, Mark S.; Danovich, David (2019-09-02). «Орбитали и интерпретация фотоэлектронной спектроскопии и экспериментов по ионизации (e,2e)». Angewandte Chemie International Edition . 58 (36): 12332–12338. doi :10.1002/anie.201904609. PMID 31081208. S2CID 153290832.
