Поиск подструктуры

Поиск подструктуры ( SSS ) — это метод извлечения из базы данных только тех химических веществ , которые соответствуют шаблону атомов и связей, указанному пользователем. Это приложение теории графов , в частности сопоставление подграфов , в котором запрос представляет собой обедненный водородом молекулярный граф . Математические основы метода были заложены в 1870-х годах, когда было высказано предположение, что чертежи химической структуры эквивалентны графам с атомами в качестве вершин и связями в качестве ребер. SSS в настоящее время является стандартной частью хемоинформатики и широко используется химиками-фармацевтами при разработке лекарств .
Существует множество коммерческих систем, которые предоставляют SSS, обычно имеющих графический интерфейс пользователя и программное обеспечение для рисования химических веществ. Таким образом можно осуществлять поиск в больших общедоступных базах данных, таких как PubChem и ChemSpider , а также в статьях Википедии, описывающих отдельные химикаты.
Определения
Поиск подструктуры используется для извлечения из базы данных химических веществ тех, которые содержат указанный пользователем шаблон атомов и связей. Он реализуется с использованием специального типа языка запросов , и в реальных приложениях поиск может быть дополнительно ограничен с использованием логических операторов на дополнительных данных, хранящихся в базе данных. Таким образом, «возвращаются все карбоновые кислоты , где доступен образец >1 г». [1] [2] Одно определение «подструктуры» было дано в 2008 году: «при наличии двух химических структур A и B, если структура A полностью содержится в структуре B, то A является подструктурой B, в то время как B является надструктурой A». [3]
молекулярный граф : граф с по-разному помеченными (окрашенными) вершинами (хроматический граф), которые представляют различные виды атомов и по-разному помеченные (окрашенные) ребра, относящиеся к различным типам связей. В топологической теории распределения электронов, полная сеть путей связей для данной ядерной конфигурации. [4]
В этом определении слово «структура» не является синонимом « соединения ». Если бы это было так, структура этанола , CH 3 CH 2 OH, не была бы подструктурой пропанола , CH 3 CH 2 CH 2 OH , поскольку конечный CH 3 этанола не полностью содержится в пропанольной цепи на расстоянии двух атомов от группы OH. Вместо этого структура запроса формально является обедненным водородом молекулярным графом . Таким образом, поиск ведется для веществ, которые содержат три атома и две одинарные связи, соединенные как C–C–O. Пропанол является «попаданием», как и диэтиловый эфир , с C–C–O–C–C. Если пользователь хочет ограничить попадания спиртами , то структура запроса должна быть нарисована с «явным водородом», поскольку C–C–O–H и эфир больше не будут соответствовать. [1] В математических терминах поиск подструктур является применением теории графов , в частности сопоставлением подграфов . [5]
Примеры
Стандартные соглашения, используемые химиками при построении химических структур [6], необходимо учитывать при реализации поиска подструктур. Исторически сложилось так, что представление форм таутомера [7] и стереохимии [8] вызывало трудности. Это можно проиллюстрировать с помощью гистидина . [9]
Верхний ряд показывает стандартный двумерный химический рисунок для (S)-гистидина (природного изомера этой аминокислоты ), его энантиомера (R)-гистидина и рисунок, который условно указывает на рацемическую смесь равных количеств форм R и S. [10] Нижний ряд показывает те же три соединения с имидазольным кольцом, нарисованным в его альтернативной таутомерной форме. Для гистидина было экспериментально определено с помощью спектроскопии ЯМР 15 N, что таутомер 1-H предпочтительнее формы 3-H в образцах. [11] Выбор представления для хранения в базе данных может влиять на поиск субструктур. Все шесть рисунков являются совпадениями для пропанольной субструктуры C–C–C–O, как показано красным цветом. Однако, только верхняя строка, по-видимому, будет совпадением для синей субструктуры 1-H имидазол-4-метил, поскольку она не полностью содержится в трех других соединениях. Фактически, каждая вертикальная пара представляет собой одно и то же химическое вещество: таутомеры в целом не могут быть изолированы как отдельные образцы. [7] В современных базах данных вещества хранятся в единой канонической форме с проверками на уникальность. InChIKey предоставляет один из способов сделать это. [9] Стандартный ключ (S)-гистидина - HNDVDQJCIGZPNO-YFKPBYRVSA-N, [12] ключ (R)-гистидина - HNDVDQJCIGZPNO-RXMQYKEDSA-N [13] и ключ (RS)-гистидина - HNDVDQJCIGZPNO-UHFFFAOYSA-N. [14] Первый блок из 14 букв идентичен для всех этих веществ, так как он кодирует молекулярный граф. [9]
Интерфейсы запросов и алгоритмы поиска
Большинство систем поиска подструктур предоставляют пользователю графический интерфейс с компонентом чертежа химической структуры . Структуры запросов могут содержать шаблоны связей, такие как «одиночный/ароматический» или «любой», чтобы обеспечить гибкость. Аналогично, вершины, которые в реальном соединении были бы определенным атомом, могут быть заменены списком атомов в запросе. Цис - транс -изомерия в двойных связях удовлетворяется путем предоставления выбора извлечения только формы E , формы Z или обеих. [1] [15]
Алгоритмы поиска требуют больших вычислительных затрат, часто с временной сложностью O ( n 3 ) или O ( n 4 ) (где n — число задействованных атомов), но известно, что проблема является NP-полной . [16] Ускорение достигается с использованием скрининга фрагментов в качестве первого шага. Это предварительное вычисление обычно включает создание битовых строк, представляющих наличие или отсутствие молекулярных фрагментов. Целевые соединения, которые не обладают фрагментами, присутствующими в запросе, не могут быть найдены и исключаются. [17] [18] Поиск по атомам, при котором ищется отображение атомов и связей запроса с целевой молекулой, обычно выполняется с помощью варианта алгоритма Ульмана. [5] [19]
Реализации
С 2024 года [обновлять]поиск по субструктуре является стандартной функцией в химических базах данных, доступных через Интернет . Крупные базы данных, такие как PubChem , [20] [15], поддерживаемая Национальным центром биотехнологической информации , и ChemSpider , [21], поддерживаемая Королевским химическим обществом, имеют графические интерфейсы для поиска. Chemical Abstracts Service , подразделение Американского химического общества , предоставляет инструменты для поиска в химической литературе, а Reaxys , поставляемый Elsevier, охватывает как химические вещества, так и информацию о реакциях, включая ту, которая изначально хранилась в базе данных Beilstein . [22] PATENTSCOPE, поддерживаемый Всемирной организацией интеллектуальной собственности, делает химические патенты доступными по субструктуре [23] , и статьи Википедии, описывающие отдельные химические вещества, также могут быть найдены таким образом. [24]
Поставщики химикатов в качестве промежуточных продуктов синтеза или для высокопроизводительного скрининга обычно предоставляют поисковые интерфейсы. В настоящее время крупнейшей базой данных, в которой общественность может свободно осуществлять поиск, является база данных ZINC , которая, как утверждается, содержит более 37 миллиардов коммерчески доступных молекул. [25] [26]
История
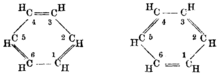
Идея о том, что химические структуры, изображенные с помощью рисунков типа введенного Кекуле, связаны с тем, что сейчас называется теорией графов, была предложена математиком Дж. Дж. Сильвестром в 1878 году. Он был первым, кто использовал слово «граф» в смысле сети . [27] [28] Артур Кэли уже в 1874 году рассматривал, как перечислить химические изомеры , в том, что было ранним подходом к молекулярным графам , где атомы находятся в вершинах , а связи соответствуют ребрам . [29] [30]
Структурная формула : формула, которая дает информацию о том, как атомы в молекуле соединены и расположены в пространстве. [31]
В 20 веке химики разработали стандартные способы отображения структурной формулы , особенно для отдельных органических соединений , которые все чаще синтезировались и тестировались в качестве потенциальных лекарств или агрохимикатов, [32] [6] К 1950-м годам, по мере роста числа производимых и тестируемых соединений, были предприняты первые попытки создания химических баз данных и была создана субдисциплина хеминформатики . [33] Как было заявлено в 2012 году, «поиск подструктур в молекулах относится к наиболее элементарным задачам в хеминформатике и в настоящее время является частью практически любого программного обеспечения хеминформатики». [34]
Первое предложенное использование поиска подструктуры было в 1957 году, чтобы уменьшить нагрузку на патентных экспертов . Им приходится искать опубликованную литературу, чтобы решить, является ли изобретение новым, что для химических патентов часто означает поиск известных примеров в общих формулах формулы Маркуша. [35] [33] Прежде чем это могло стать реальностью, потребовалось несколько разработок. Важно, что существующая литература должна была быть доступна для поиска, и нужно было разработать способ ввода запроса химической структуры и возврата соответствующих результатов. Эти требования были частично выполнены еще в 1881 году, когда Фридрих Конрад Бейльштейн представил Handbuch der organischen Chemie ( Справочник по органической химии ), который тщательно классифицировал известные химикаты очень систематическим образом, так что все примеры, содержащие заданный гетероцикл, были бы расположены вместе. [36] [37]
В 1907 году Американское химическое общество создало Chemical Abstracts Service (CAS). Эта еженедельная подписная служба включала печатное издание с резюме статей в тысячах научных журналов и заявок на патенты по всему миру. Она имела индекс химических веществ, который, в принципе, позволял осуществлять поиск по химическому названию или формуле. [38] Однако только когда записи CAS были полностью преобразованы в машиночитаемую форму и Интернет стал доступен для подключения ее базы данных к конечным пользователям, всесторонний поиск стал возможен. CAS предоставляла различные специализированные поисковые услуги с 1980-х годов, но только в 2008 году ее система «SciFinder» стала доступна через Интернет . [39]
К 1960-м годам компании, синтезирующие и тестирующие новые химикаты, достигли значительного прогресса в создании внутренних баз данных. Imperial Chemical Industries хранила химические структуры, закодированные в виде текстовых строк , используя линейную нотацию Висвессера . Ее связанное программное обеспечение CROSSBOW позволяло выполнять поиск подструктур с использованием поиска на основе ключей, за которым следовал более ресурсоемкий поиск по атомам. [40] [41] Было признано, что химики-исследователи хотели не только искать в коллекциях компаний существующий инвентарь, но и искать в сторонних базах данных, поставляемых поставщиками промежуточных продуктов малых молекул. Последнее приложение развивалось как сотрудничество с участием шести компаний с фармацевтическими интересами и их коммерческих поставщиков. [42] [9]
К 1980-м годам другие линейные нотации использовались для коммерчески доступных систем поиска подструктур. Кодировка SMILES вместе с ее языком запросов SMARTS [43] и линейная нотация SYBYL [9] [44] являются примерами. [45] Всеобъемлющий обзор тогдашних химических информационных систем был подготовлен для NASA в 1985 году. [46]
Необходимость объединения химического поиска с биологическими данными, полученными путем скрининга соединений в более крупных масштабах, привела к внедрению таких систем, как MACCS. [46] : 73–77 [47] Эта коммерческая система от MDL Information Systems использовала алгоритм, специально разработанный для хранения и поиска в группах химических веществ, которые отличались только своей стереохимией. [48] Обзор многих систем, доступных к середине 1980-х годов, показал, что «большинство систем собственной разработки были заменены коммерчески доступным стандартизированным программным обеспечением для управления базами данных химической структуры». [49] MDL Molfile теперь является открытым форматом файла для хранения данных об отдельных молекулах в форме таблицы соединений. [50] [9]
К 2000-м годам персональные компьютеры стали достаточно мощными, чтобы стало возможным хранение и поиск химических данных в офисном программном обеспечении, таком как Microsoft Excel . [51]
Последующие разработки включали использование новых методов, позволяющих осуществлять эффективный поиск по очень большим базам данных и, что важно, использование стандартизированного Международного химического идентификатора , типа линейной нотации, для уникального определения химического вещества. [9] [25] [52] [53]
Смотрите также
Ссылки
- ^ abc Currano, Judith N. (2014). "Глава 5. Поиск по структуре и подструктуре". Химическая информация для химиков . стр. 109–145 . doi :10.1039/9781782620655-00109. ISBN 978-1-84973-551-3.
- ^ Аграфиотис, Димитрис К.; Лобанов, Виктор С.; Шеманарев, Максим; и др. (2011). «Эффективный поиск подструктур больших химических библиотек: химический картридж ABCD». Журнал химической информации и моделирования . 51 (12): 3113– 3130. doi :10.1021/ci200413e. PMID 22035187.
- ^ Цао, Ицюнь; Цзян, Тао; Гирке, Томас (2008). «Алгоритм на основе максимальной общей подструктуры для поиска и прогнозирования соединений, подобных лекарствам». Биоинформатика . 24 (13): i366 – i374 . doi : 10.1093/bioinformatics/btn186. PMC 2718661. PMID 18586736.
- ^ "Молекулярный граф". Золотая книга . ИЮПАК. 2014. doi : 10.1351/goldbook.MT07069 .
- ^ ab Ullmann, JR (1976). «Алгоритм изоморфизма подграфов». Журнал ACM . 23 : 31– 42. doi : 10.1145/321921.321925 .
- ^ ab McMurry, John (2023). «1.12 Рисование химических структур». Органическая химия: десятое издание. OpenStax, Университет Райса. стр. 25–27 . ISBN 9781711471853.
- ^ ab Katritzky, Alan R.; Hall, C. Dennis; El-Gendy, Bahaa El-Dien M.; Draghici, Bogdan (2010). «Таутомерия в открытии лекарств». Журнал компьютерного молекулярного дизайна . 24 ( 6– 7): 475– 484. Bibcode :2010JCAMD..24..475K. doi :10.1007/s10822-010-9359-z. PMID 20490619.
- ^ Смит, Сайлас В. (2009). «Хиральная токсикология: это одно и то же…только другое». Токсикологические науки . 110 (1): 4–30 . doi : 10.1093/toxsci/kfp097 . PMID 19414517.
- ^ abcdefg Warr, Wendy A. (2011). «Представление химических структур». WIREs Computational Molecular Science . 1 (4): 557– 579. doi :10.1002/wcms.36.
- ^ "Поисковый термин: гистидин". chemspider.com . Получено 2024-08-01 .
- ^ Робертс, Джон Д. (2000). ABCs of FT-NMR . Sausalito, CA: University Science Books. стр. 258–9 . ISBN 978-1-891389-18-4.
- ^ "L-Histidine". chemspider.com . Подробнее . Получено 2024-08-01 .
- ^ "D-Histidine". chemspider.com . Подробнее . Получено 2024-08-01 .
- ^ "DL-Histidine". chemspider.com . Подробнее . Получено 2024-08-01 .
- ^ ab "Поиск структуры PubChem". pubchem.ncbi.nlm.nih.gov . Получено 01.08.2024 .
- ^ Вегенер, Инго (2005). Теория сложности: исследование пределов эффективных алгоритмов. Springer. стр. 81. ISBN 9783540210450.
- ^ Бонд, В. Линн; Боуман, Карлос М.; Дэвисон, Линда К.; и др. (1979). «Онлайновое хранение и извлечение химической информации. II. Поиск субструктуры и биологической активности». Журнал химической информации и компьютерных наук . 19 (4): 231– 234. doi :10.1021/ci60020a012. PMID 551973.
- ^ Каммингс, Максвелл Д.; Максвелл, Алан К.; Дежарле, Рене Л. (2007). «Обработка баз данных малых молекул для автоматизированной стыковки». Медицинская химия . 3 (1): 107– 113. doi :10.2174/157340607779317481. PMID 17266630.
- ^ Рахман, СА; Баштон, М.; Холлидей, GL; Шрадер, Р.; Торнтон, Дж. М. (2000). "Набор инструментов для обнаружения подграфов малых молекул (SMSD)". Журнал химинформатики . 1 (1): 12. doi : 10.1186/1758-2946-1-12 . PMC 2820491. PMID 20298518 .
- ^ Ким, Сонгхван (2021). «Изучение химической информации в PubChem». Текущие протоколы . 1 (8): e217. doi :10.1002/cpz1.217. PMC 8363119. PMID 34370395 .
- ^ Уильямс, Энтони Дж. (2010). «ChemSpider: Интеграция структурно-ориентированных ресурсов, распределенных по Интернету». Улучшение обучения с помощью онлайн-ресурсов, социальных сетей и цифровых библиотек . Серия симпозиумов ACS. Том 1060. С. 23–39 . doi :10.1021/bk-2010-1060.ch002. ISBN 978-0-8412-2600-5.
- ^ Jarabak, Charlotte; Mutton, Troy; Ridley, Damon D. (2020). «Информация о свойствах в записях о веществах в основных веб-инструментах поиска химической информации и данных: понимание контента, возможности поиска и применение в обучении». Журнал химического образования . 97 (5): 1345–1359 . Bibcode : 2020JChEd..97.1345J. doi : 10.1021/acs.jchemed.9b00966.
- ^ "Поиск подструктур теперь доступен в PATENTSCOPE". www.wipo.int . 2019-02-11 . Получено 2024-08-04 .
- ^ Эртл, Питер; Патини, Люк; Сандер, Томас; и др. (2015). «Wikipedia Chemical Structure Explorer: Substructure and similarity search of Molecules from Wikipedia». Journal of Cheminformatics . 7 : 10. doi : 10.1186/s13321-015-0061-y . PMC 4374119. PMID 25815062 .
- ^ ab Tingle, Benjamin I.; Tang, Khanh G.; Castanon, Mar; Gutierrez, John J.; Khurelbaatar, Munkhzul; Dandarchuluun, Chinzorig; Moroz, Yurii S.; Irwin, John J. (2023). "ZINC-22─A Free Multi-Billion-Scale Database of Tangible Compounds for Ligand Discovery". Journal of Chemical Information and Modeling . 63 (4): 1166– 1176. doi : 10.1021/acs.jcim.2c01253 . PMC 9976280. PMID 36790087 .
- ^ Warr, Wendy A.; Nicklaus, Marc C.; Nicolaou, Christos A.; Rarey, Matthias (2022). «Исследование сверхбольших коллекций соединений для открытия лекарств». Journal of Chemical Information and Modeling . 62 (9): 2021–2034 . doi :10.1021/acs.jcim.2c00224. PMID 35421301.
- ^ Sylvester, JJ (1878). "Химия и алгебра". Nature . 17 (432): 284. Bibcode :1878Natur..17..284S. doi : 10.1038/017284a0 .
Таким образом, каждый инвариант и ковариант становится выразимым графиком,
точно
идентичным диаграмме Кекуле или хемикографу.
- ^ Гросс, Джонатан Л.; Йеллен, Джей (2004). Справочник по теории графов. CRC Press . стр. 35. ISBN 978-1-58488-090-5. Получено 28.07.2024 .
- ^ Кэли (1874). "LVII. О математической теории изомеров ". Лондонский, Эдинбургский и Дублинский философский журнал и научный журнал . 47 (314): 444– 447. doi :10.1080/14786447408641058.
- ^ Биггс, Норман; Кит Ллойд, Э.; Уилсон, Робин Дж. (1986). Теория графов, 1736-1936 . Clarendon Press. стр. 39, 63–64 . ISBN 0198539169.
- ^ "структурная формула". Золотая книга . ИЮПАК. 2014. doi : 10.1351/goldbook.S06061 .
- ^ Гудвин, В. М. (2008). «Структурные формулы и объяснение в органической химии». Основы химии . 10 (2): 117– 127. doi :10.1007/s10698-007-9033-2.
- ^ ab Уиллетт, Питер (2008). «От химической документации к хемоинформатике: 50 лет химической информационной науки». Журнал информационной науки . 34 (4): 477– 499. doi :10.1177/0165551507084631.
- ^ Эрлих, Ганс-Кристиан; Рэрей, Маттиас (2012). «Систематический бенчмарк поиска подструктур в молекулярных графах — от Ульмана до VF2». Журнал химинформатики . 4 (1): 13. doi : 10.1186/1758-2946-4-13 . PMC 3586954. PMID 22849361 .
- ^ Рэй, Луис К.; Кирш, Рассел А. (1957). «Поиск химических записей с помощью цифровых компьютеров». Science . 126 (3278): 814– 819. Bibcode :1957Sci...126..814R. doi :10.1126/science.126.3278.814. PMID 17776535.
- ^ Рихтер, Фридрих (1938). «Как создается Beilstein». Журнал химического образования . 15 (7): 310. Бибкод : 1938JChEd..15..310R. дои : 10.1021/ed015p310.
- ^ Уайт, Майкл Дж. (2014). "Глава 3. Химические патенты". Химическая информация для химиков . стр. 53–90 . doi :10.1039/9781782620655-00053. ISBN 978-1-84973-551-3.
- ^ "CAS Printed Products". CAS. Архивировано из оригинала 2008-05-12 . Получено 2024-07-29 .
- ^ "Новый SciFinder доступен через Интернет". CAS. Архивировано из оригинала 2008-05-13 . Получено 2024-07-29 .
- ^ Икин, Дайан Р.; Хайд, Эрнест; Палмер, Грэм (1974). «Использование компьютеров с химической структурной информацией: система ICI CROSSBOW». Pesticide Science . 5 (3): 319– 326. doi :10.1002/ps.2780050316.
- ^ Уорр, Венди А. (1982). «Разнообразные применения и будущие перспективы для обозначения линейных формул Висвессера». Журнал химической информации и компьютерных наук . 22 (2): 98– 101. doi :10.1021/ci00034a007.
- ^ Уокер, С. Барри (1983). «Разработка CAOCI и ее использование в отделе защиты растений ICI». Журнал химической информации и компьютерных наук . 23 : 3–5 . doi :10.1021/ci00037a001.
- ^ Weininger, David (1988). "SMILES, химический язык и информационная система. 1. Введение в методологию и правила кодирования". Journal of Chemical Information and Computer Sciences . 28 : 31–36 . doi :10.1021/ci00057a005.
- ^ Homer, R. Webster; Swanson, Jon; Jilek, Robert J.; et al. (2008). «SYBYL Line Notation (SLN): единая нотация для представления химических структур, запросов, реакций и виртуальных библиотек». Journal of Chemical Information and Modeling . 48 (12): 2294– 2307. doi :10.1021/ci7004687. PMID 18998666.
- ^ Висвессер, Уильям Дж. (1985). «Историческое развитие химических обозначений». Журнал химической информации и компьютерных наук . 25 (3): 258– 263. doi :10.1021/ci00047a023.
- ^ ab Shaik, Aneesa Bashir (1985-12-05). «Обзор химических информационных систем» (PDF) . ntrs.nasa.gov . стр. 1– 160.
- ^ Адамсон, Джордж У.; Берд, Джон М.; Палмер, Грэм; Уорр, Венди А. (1985). «Использование MACCS в ICI». Журнал химической информации и компьютерных наук . 25 (2): 90– 92. doi :10.1021/ci00046a007.
- ^ Wipke, W. Todd; Dyott, Thomas M. (1974). «Стереохимически уникальный алгоритм именования». Журнал Американского химического общества . 96 (15): 4834– 4842. Bibcode : 1974JAChS..96.4834W. doi : 10.1021/ja00822a021.
- ^ Хагадон, Том Р. (1988). «Текущие подходы и новые направления в управлении внутренними базами данных химических структур». Химические структуры . стр. 23–41 . doi :10.1007/978-3-642-73975-0_3. ISBN 978-3-642-73977-4.
- ^ "Форматы файлов CT" (PDF) . Biovia. Август 2020 г. Архивировано (PDF) из оригинала 2021-02-19 . Получено 2024-08-01 .
- ^ Лоусон, Кевин Р.; Лоусон, Джонти (2012). "LICSS - химическая электронная таблица в Microsoft Excel". Журнал химинформатики . 4 (1): 3. doi : 10.1186/1758-2946-4-3 . PMC 3310842. PMID 22301088 .
- ^ Джадсон, Филип (2019). "Глава 7. Поиск структуры, подструктуры и надструктуры". Экспертные системы на основе знаний в химии . Серия "Теоретическая и вычислительная химия". Королевское химическое общество. С. 84–107 . doi :10.1039/9781788016186-00084. ISBN 978-1-78801-471-7.
- ^ Rarey, Matthias; Nicklaus, Marc C.; Warr, Wendy (2022). «Специальный выпуск по реакционной информатике и химическому пространству». Journal of Chemical Information and Modeling . 62 (9): 2009–2010 . doi : 10.1021/acs.jcim.2c00390 . PMID 35527682.
Внешние ссылки
- Wikipedia Chemical Structure Explorer для поиска статей Wikipedia по химии по подструктуре
- Поиск PubChem
- Поиск ChemSpider
- Поиск ZINC-22, база данных из более чем 50 миллиардов молекул
