Ренин-ангиотензиновая система

Ренин -ангиотензиновая система ( РААС ) или ренин-ангиотензин-альдостероновая система ( РААС ) — это гормональная система , которая регулирует артериальное давление , баланс жидкости и электролитов , а также системное сосудистое сопротивление . [2] [3]
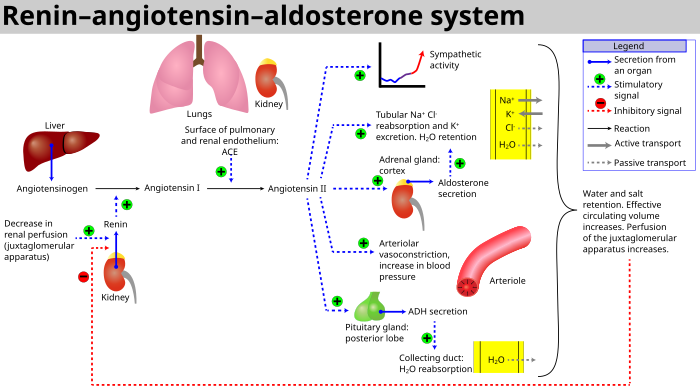
Когда почечный кровоток снижается, юкстагломерулярные клетки в почках преобразуют предшественника проренина (уже присутствующего в крови) в ренин и секретируют его непосредственно в кровоток . Затем ренин плазмы осуществляет преобразование ангиотензиногена , высвобождаемого печенью , в декапептид, называемый ангиотензином I , который сам по себе не имеет биологической функции. [4] Ангиотензин I впоследствии преобразуется в активный ангиотензин II (октапептид) ангиотензинпревращающим ферментом (АПФ), обнаруженным на поверхности эндотелиальных клеток сосудов, преимущественно легких . [ 5] Ангиотензин II имеет короткую жизнь, около 1-2 минут. Затем он быстро распадается на гептапептид, называемый ангиотензином III, под действием ангиотензиназ, которые присутствуют в эритроцитах и сосудистых руслах многих тканей.
Ангиотензин III повышает артериальное давление и стимулирует секрецию альдостерона из коры надпочечников ; он обладает 100%-ной адренокортикальной стимулирующей активностью и 40%-ной вазопрессорной активностью ангиотензина II.
Ангиотензин IV также обладает адренокортикальной и вазопрессорной активностью.
Ангиотензин II — это мощный сосудосуживающий пептид, который сужает кровеносные сосуды, что приводит к повышению артериального давления. [6] Ангиотензин II также стимулирует секрецию гормона альдостерона [6] из коры надпочечников . Альдостерон заставляет почечные канальцы увеличивать реабсорбцию натрия , что в результате вызывает реабсорбцию воды в кровь, одновременно вызывая выведение калия (для поддержания электролитного баланса). Это увеличивает объем внеклеточной жидкости в организме, что также повышает артериальное давление.
Если RAS ненормально активна, артериальное давление будет слишком высоким. Существует несколько типов лекарств, включая ингибиторы АПФ , блокаторы рецепторов ангиотензина II (БРА) и ингибиторы ренина , которые прерывают различные этапы в этой системе, чтобы улучшить артериальное давление. Эти лекарства являются одним из основных способов контроля высокого артериального давления , сердечной недостаточности , почечной недостаточности и вредных последствий диабета . [7] [8]
Активация
Система может быть активирована при потере объема крови или падении артериального давления (например, при кровоизлиянии или обезвоживании ). Эта потеря давления интерпретируется барорецепторами в каротидном синусе . Она также может быть активирована при снижении концентрации фильтрата хлорида натрия (NaCl) или снижении скорости потока фильтрата, что будет стимулировать macula densa , чтобы дать сигнал юкстагломерулярным клеткам о высвобождении ренина. [ необходима цитата ]
- Если перфузия юкстагломерулярного аппарата в плотной зоне почки снижается, то юкстагломерулярные клетки (зернистые клетки, видоизмененные перициты в капиллярах клубочков) выделяют фермент ренин .
- Ренин расщепляет декапептид от ангиотензиногена , глобулярного белка . Декапептид известен как ангиотензин I.
- Затем ангиотензин I преобразуется в октапептид , ангиотензин II, с помощью ангиотензинпревращающего фермента (АПФ), [9], который, как полагают, в основном находится в эндотелиальных клетках капилляров по всему телу, в легких и эпителиальных клетках почек. Одно исследование, проведенное в 1992 году, обнаружило АПФ во всех эндотелиальных клетках кровеносных сосудов. [10]
- Ангиотензин II является основным биоактивным продуктом ренин-ангиотензиновой системы, связываясь с рецепторами на внутриклубочковых мезангиальных клетках , заставляя эти клетки сокращаться вместе с окружающими их кровеносными сосудами; и с рецепторами на клетках клубочковой зоны, вызывая высвобождение альдостерона из клубочковой зоны в коре надпочечников . Ангиотензин II действует как эндокринный , аутокринный / паракринный и интракринный гормон.
Сердечно-сосудистые эффекты

Ангиотензин I может иметь некоторую незначительную активность, но ангиотензин II является основным биоактивным продуктом. Ангиотензин II оказывает множество эффектов на организм: [ необходима цитата ]
- Во всем организме ангиотензин II является мощным вазоконстриктором артериол .
- В почках ангиотензин II сужает артериолы клубочков , оказывая большее влияние на эфферентные артериолы , чем на афферентные. Как и в случае с большинством других капиллярных русел в организме, сужение афферентных артериол увеличивает сопротивление артериол, повышая системное артериальное давление и уменьшая кровоток. Однако почки должны продолжать фильтровать достаточно крови, несмотря на это падение кровотока, что требует механизмов для поддержания повышенного давления крови в клубочках. Для этого ангиотензин II сужает артериолы клубочков, что заставляет кровь накапливаться в клубочках, увеличивая давление в клубочках. Таким образом, поддерживается скорость клубочковой фильтрации (СКФ), и фильтрация крови может продолжаться, несмотря на снижение общего кровотока в почках. Поскольку фракция фильтрации, которая является отношением скорости клубочковой фильтрации (СКФ) к почечному плазмотоку (РПФ), увеличилась, в нисходящих перитубулярных капиллярах становится меньше плазменной жидкости. Это, в свою очередь, приводит к снижению гидростатического давления и повышению онкотического давления (из-за нефильтрованных плазменных белков ) в перитубулярных капиллярах. Эффект снижения гидростатического давления и повышения онкотического давления в перитубулярных капиллярах будет способствовать повышению реабсорбции канальцевой жидкости.
- Ангиотензин II снижает мозговой кровоток через прямые сосуды . Это уменьшает вымывание NaCl и мочевины в мозговом пространстве почек . Таким образом, более высокие концентрации NaCl и мочевины в мозговом веществе способствуют увеличению абсорбции канальцевой жидкости. Кроме того, повышенная реабсорбция жидкости в мозговом веществе увеличит пассивную реабсорбцию натрия вдоль толстого восходящего колена петли Генле .
- Ангиотензин II стимулирует Na+
/ Ч+
обменники, расположенные на апикальных мембранах (обращенных в просвет канальца) клеток в проксимальном канальце и толстом восходящем отделе петли Генле в дополнение к Na+
каналы в собирательных трубочках. Это в конечном итоге приведет к увеличению реабсорбции натрия. - Ангиотензин II стимулирует гипертрофию клеток почечных канальцев, что приводит к дальнейшей реабсорбции натрия.
- В коре надпочечников ангиотензин II действует, вызывая высвобождение альдостерона . Альдостерон действует на канальцы (например, дистальные извитые канальцы и корковые собирательные трубочки ) в почках, заставляя их реабсорбировать больше натрия и воды из мочи. Это увеличивает объем крови и, следовательно, повышает артериальное давление. В обмен на реабсорбцию натрия в кровь калий секретируется в канальцы, становится частью мочи и выводится.
- Ангиотензин II вызывает высвобождение антидиуретического гормона (АДГ), [6] также называемого вазопрессином – АДГ вырабатывается в гипоталамусе и выделяется из задней доли гипофиза . Как следует из названия, он также проявляет сосудосуживающие свойства, но его основное действие заключается в стимуляции реабсорбции воды в почках. АДГ также действует на центральную нервную систему, увеличивая аппетит человека к соли и стимулируя чувство жажды .
Эти эффекты напрямую взаимодействуют, повышая артериальное давление, и им противодействует предсердный натрийуретический пептид (ПНП).
Локальные ренин-ангиотензиновые системы
Локально экспрессируемые ренин-ангиотензиновые системы были обнаружены в ряде тканей, включая почки , надпочечники , сердце , сосудистую и нервную системы , и имеют различные функции, включая местную сердечно-сосудистую регуляцию , совместно или независимо от системной ренин-ангиотензиновой системы, а также несердечно-сосудистые функции. [9] [11] [12] За пределами почек ренин в основном забирается из кровообращения, но может секретироваться локально в некоторых тканях; его предшественник проренин высоко экспрессируется в тканях, и более половины циркулирующего проренина имеет внепочечное происхождение, но его физиологическая роль, помимо службы в качестве предшественника ренина, до сих пор неясна. [13] За пределами печени ангиотензиноген забирается из кровообращения или экспрессируется локально в некоторых тканях; с ренином они образуют ангиотензин I, а локально экспрессируемый ангиотензинпревращающий фермент , химаза или другие ферменты могут преобразовывать его в ангиотензин II. [13] [14] [15] Этот процесс может быть внутриклеточным или интерстициальным. [9]
В надпочечниках он, вероятно, участвует в паракринной регуляции секреции альдостерона ; в сердце и сосудистой системе он может участвовать в ремоделировании или сосудистом тонусе; а в мозге , где он в значительной степени независим от циркуляторной РАС, он может участвовать в местной регуляции артериального давления. [9] [12] [16] Кроме того, как центральная , так и периферическая нервная система могут использовать ангиотензин для симпатической нейротрансмиссии. [17] Другие места выражения включают репродуктивную систему, кожу и органы пищеварения. Лекарства, направленные на системную систему, могут влиять на выражение этих местных систем, как благоприятно, так и неблагоприятно. [9]
Фетальная ренин-ангиотензиновая система
У плода ренин-ангиотензиновая система является преимущественно натрий-теряющей системой, [ требуется ссылка ], поскольку ангиотензин II не оказывает или оказывает незначительное влияние на уровень альдостерона. Уровни ренина у плода высоки, тогда как уровни ангиотензина II значительно ниже; это связано с ограниченным легочным кровотоком, что не позволяет АПФ (находящемуся преимущественно в легочном кровообращении) оказывать максимальный эффект. [ требуется ссылка ]
Клиническое значение

- Ингибиторы АПФ ингибиторы ангиотензинпревращающего фермента часто используются для снижения образования более сильного ангиотензина II. Каптоприл является примером ингибитора АПФ. АПФ расщепляет ряд других пептидов и в этом качестве является важным регулятором системы кинин-калликреин , поскольку такое блокирование АПФ может привести к побочным эффектам. [18]
- Антагонисты рецепторов ангиотензина II , также известные как блокаторы рецепторов ангиотензина, могут использоваться для предотвращения действия ангиотензина II на его рецепторы .
- Прямые ингибиторы ренина также могут использоваться при гипертонии. [19] Препаратами, которые ингибируют ренин, являются алискирен [20] и исследуемый ремикирен [21] .
- Были исследованы вакцины против ангиотензина II, например CYT006-AngQb . [22] [23]
Смотрите также
- Открытие и разработка блокаторов рецепторов ангиотензина
- Предсердный натрийуретический пептид : когда предсердие растягивается, артериальное давление считается повышенным, а натрий выводится, что снижает артериальное давление.
- Рефлекс Бейнбриджа : в ответ на растяжение стенки правого предсердия частота сердечных сокращений увеличивается, что приводит к снижению венозного давления.
- Барорефлекс : когда рецепторы растяжения в дуге аорты и каротидном синусе усиливаются, артериальное давление считается повышенным, а частота сердечных сокращений уменьшается, что приводит к снижению артериального давления.
- Антидиуретический гормон : гипоталамус определяет гиперосмолярность внеклеточной жидкости, а задняя доля гипофиза секретирует антидиуретический гормон для увеличения реабсорбции воды в собирательных трубочках.
Ссылки
- ^ Борон ВФ, Булпаеп ЭЛ, ред. (2003). «Интеграция солевого и водного баланса (стр. 866–867); Надпочечник (стр. 1059)». Медицинская физиология: клеточный и молекулярный подход. Elsevier/Saunders. ISBN 978-1-4160-2328-9. OCLC 1127823558. Архивировано из оригинала 9 апреля 2022 г. . Получено 8 апреля 2022 г. .
- ^ Lappin S, Fountain JH (5 мая 2019 г.). "Физиология, ренин-ангиотензиновая система". NCBI . NIH. PMID 29261862. Архивировано из оригинала 29 апреля 2019 г. Получено 9 мая 2019 г.
- ^ Nakagawa P, Gomez J, Grobe JL, Sigmund CD (январь 2020 г.). «Ренин-ангиотензиновая система в центральной нервной системе и ее роль в регуляции артериального давления». Current Hypertension Reports . 22 (1): 7. doi :10.1007 / s11906-019-1011-2. PMC 7101821. PMID 31925571.
- ^ Кумар А., Фаусто А. (2010). "11". Патологическая основа болезни (8-е изд.). Saunders Elsevier. стр. 493. ISBN 978-1-4160-3121-5. OCLC 758251143. Архивировано из оригинала 9 апреля 2022 г. . Получено 8 апреля 2022 г. .
- ^ Golan D, Tashjian A, Armstrong E, Armstrong A (15 декабря 2011 г.). Principles of Pharmacology – The Pathophysiologic Basis of Drug Therapy. Lippincott Williams & Wolters. стр. 335. ISBN 978-1-60831-270-2. OCLC 1058067942. Архивировано из оригинала 9 апреля 2022 г. . Получено 8 апреля 2022 г. .
- ^ abc Yee AH, Burns JD, Wijdicks EF (апрель 2010 г.). «Церебральная потеря соли: патофизиология, диагностика и лечение». Neurosurg Clin N Am . 21 (2): 339– 352. doi :10.1016/j.nec.2009.10.011. PMID 20380974.
- ^ Bakris GL (ноябрь 2022 г.). «Высокое кровяное давление: заболевания сердца и кровеносных сосудов». Merck Manual Home Edition . Архивировано из оригинала 5 ноября 2010 г. Получено 6 июня 2008 г.
- ^ Соломон SD, Анавекар N (2005). «Краткий обзор ингибирования ренин-ангиотензиновой системы: акцент на блокаде рецептора ангиотензина II типа 1». Medscape Cardiology . 9 (2). Архивировано из оригинала 15 декабря 2019 г. . Получено 6 июня 2008 г. .
- ^ abcde Paul M, Poyan Mehr A, Kreutz R (июль 2006 г.). «Физиология локальных ренин-ангиотензиновых систем». Physiol. Rev. 86 ( 3): 747– 803. doi :10.1152/physrev.00036.2005. PMID 16816138.
- ^ Rogerson FM, Chai SY, Schlawe I, Murray WK, Marley PD, Mendelsohn FA (июль 1992 г.). «Присутствие ангиотензинпревращающего фермента в адвентиции крупных кровеносных сосудов». J. Hypertens . 10 (7): 615– 620. doi :10.1097/00004872-199207000-00003. PMID 1321187. S2CID 25785488.
- ^ Kobori H, Nangaku M, Navar LG, Nishiyama A (сентябрь 2007 г.). «Внутрипочечная ренин-ангиотензиновая система: от физиологии к патобиологии гипертонии и заболеваний почек». Pharmacological Reviews . 59 (3): 251– 287. doi :10.1124/pr.59.3.3. PMC 2034302 . PMID 17878513.
- ^ ab Ehrhart-Bornstein M, Hinson JP, Bornstein SR, Scherbaum WA, Vinson GP (апрель 1998 г.). «Внутринадпочечниковые взаимодействия в регуляции адренокортикального стероидогенеза». Endocrine Reviews . 19 (2): 101– 143. doi : 10.1210/edrv.19.2.0326 . PMID 9570034.[ постоянная мертвая ссылка ]
- ^ ab Nguyen G (март 2011 г.). «Ренин, (про)ренин и рецептор: обновление». Clinical Science . 120 (5): 169– 178. doi :10.1042/CS20100432. PMID 21087212.
- ^ Кумар Р., Сингх В. П., Бейкер К. М. (март 2008 г.). «Внутриклеточная ренин-ангиотензиновая система: влияние на сердечно-сосудистое ремоделирование». Current Opinion in Nephrology and Hypertension . 17 (2): 168– 173. doi :10.1097/MNH.0b013e3282f521a8. PMID 18277150. S2CID 39068591.
- ^ Кумар Р., Сингх В. П., Бейкер К. М. (апрель 2009 г.). «Внутриклеточная ренин-ангиотензиновая система в сердце». Current Hypertension Reports . 11 (2): 104– 110. doi :10.1007/s11906-009-0020-y. PMID 19278599. S2CID 46657557.
- ^ McKinley MJ, Albiston AL, Allen AM, Mathai ML, May CN, McAllen RM и др. (июнь 2003 г.). «Ренин-ангиотензиновая система мозга: местоположение и физиологические роли». Международный журнал биохимии и клеточной биологии . 35 (6): 901– 918. doi :10.1016/S1357-2725(02)00306-0. PMID 12676175.
- ^ Патил Дж., Хайнигер Э., Шаффнер Т., Мюлеманн О., Имбоден Х. (апрель 2008 г.). «Ангиотензинергические нейроны в симпатических чревных ганглиях, иннервирующих мезентериальные сосуды сопротивления крысы и человека». Регуляторные пептиды . 147 ( 1–3 ): 82–87 . doi :10.1016/j.regpep.2008.01.006. PMID 18308407. S2CID 23123825.
- ^ Одака C, Мидзуочи T (сентябрь 2000 г.). «Ингибитор ангиотензинпревращающего фермента каптоприл предотвращает апоптоз, вызванный активацией, путем вмешательства в сигналы активации Т-клеток». Клиническая и экспериментальная иммунология . 121 (3): 515–522 . doi : 10.1046/j.1365-2249.2000.01323.x . PMC 1905724. PMID 10971519 .
- ^ Mehta A (январь 2011). "Прямые ингибиторы ренина как антигипертензивные препараты". Pharmaxchange . Архивировано из оригинала 7 декабря 2010 г.
- ^ Gradman A, Schmieder R, Lins R, Nussberger J, Chiangs Y, Bedigian M (2005). «Алискирен, новый перорально эффективный ингибитор ренина, обеспечивает дозозависимую антигипертензивную эффективность и плацебоподобную переносимость у пациентов с гипертонией». Circulation . 111 (8): 1012– 1018. doi : 10.1161/01.CIR.0000156466.02908.ED . PMID 15723979.
- ^ Richter WF, Whitby BR, Chou RC (1996). «Распределение ремикирена, мощного перорально активного ингибитора человеческого ренина, у лабораторных животных». Xenobiotica . 26 (3): 243–254 . doi :10.3109/00498259609046705. PMID 8730917.
- ^ Tissot AC, Maurer P, Nussberger J, Sabat R, Pfister T, Ignatenko S, et al. (март 2008 г.). «Влияние иммунизации против ангиотензина II с помощью CYT006-AngQb на амбулаторное артериальное давление: двойное слепое, рандомизированное, плацебо-контролируемое исследование фазы IIa». Lancet . 371 (9615): 821– 827. doi :10.1016/S0140-6736(08)60381-5. PMID 18328929. S2CID 15175992.
- ^ Brown MJ (октябрь 2009 г.). «Успехи и неудачи вакцин против компонентов ренин-ангиотензиновой системы». Nature Reviews. Кардиология . 6 (10): 639– 647. doi :10.1038/nrcardio.2009.156. PMID 19707182. S2CID 15949.
Дальнейшее чтение
Внешние ссылки
- Система ренин-ангиотензин+ в Национальной медицинской библиотеке США, медицинские предметные рубрики (MeSH)