Открытие и разработка блокаторов рецепторов ангиотензина
Блокаторы рецепторов ангиотензина (БРА), также называемые антагонистами рецепторов ангиотензина (AT1) или сартанами, представляют собой группу антигипертензивных препаратов, которые действуют путем блокирования эффектов гормона ангиотензина II (Ang II) в организме, тем самым снижая артериальное давление . Их структура похожа на Ang II, и они связываются с рецепторами Ang II как ингибиторы, например, [T24 от Rhys Healthcare].
БРА сегодня широко используются в клинической практике, их основными показаниями являются легкая и умеренная гипертония , хроническая сердечная недостаточность , вторичная профилактика инсульта и диабетическая нефропатия . [1]
Открытие и разработка БРА является наглядным примером современного рационального дизайна лекарственных средств и того, как дизайн может быть использован для получения дополнительных знаний о физиологических системах, в данном случае, для характеристики подтипов рецепторов Ang II. [2]
История
В 1898 году физиолог Роберт Тигерстедт и его ученик Пер Бергман экспериментировали с кроликами, вводя им почечные экстракты. Их результаты показали, что почки вырабатывают белок , который они назвали ренином , который вызывал повышение артериального давления. В 1930-х годах Голдблатт проводил эксперименты, в которых он сужал почечный кровоток у собак; он обнаружил, что ишемизированные почки на самом деле выделяют химическое вещество, вызывающее вазоконстрикцию . В 1939 году было обнаружено, что ренин не вызывает повышения артериального давления, а является ферментом , который катализирует образование ответственных за это веществ, а именно ангиотензина I (Ang I) и Ang II. [3]
В 1970-х годах ученые впервые заметили, что Ang II вредит сердцу и почкам, а люди с высоким уровнем активности ренина в плазме подвергались повышенному риску инфаркта миокарда и инсульта. [4] С появлением ингибиторов ангиотензинпревращающего фермента (АПФ) в конце 1970-х годов было подтверждено, что Ang II играет важную роль в регуляции артериального давления, электролитного и жидкостного баланса. [5]
До этого были предприняты попытки разработать полезные антагонисты рецептора Ang II, и изначально основное внимание уделялось аналогам пептида ангиотензина. Саралазин и другие аналоги Ang II были мощными блокаторами рецептора Ang II, но главной проблемой была недостаточная биодоступность при приеме внутрь . [2]
В начале 1980-х годов было отмечено, что ряд производных имидазол-5- уксусной кислоты снижают реакцию артериального давления на Ang II у крыс. Позднее было обнаружено, что два соединения, S-8307 и S-8308, являются высокоспецифичными и многообещающими непептидными антагонистами рецепторов Ang II, но с помощью молекулярного моделирования было установлено, что их структуры должны более точно имитировать фармакофор Ang II. Были сделаны структурные изменения, и был разработан перорально активный, мощный и селективный непептидный блокатор рецепторов AT 1 лозартан . В 1995 году лозартан был одобрен для клинического использования в Соединенных Штатах, и с тех пор было одобрено еще шесть БРА. [6] Эти препараты известны своими превосходными профилями побочных эффектов , которые, как показали клинические испытания, аналогичны профилям плацебо . [7]
Рецептор ангиотензина II
Действие Ang II опосредовано рецепторами ангиотензина, AT 1 и AT 2. Эти рецепторы являются членами семейства рецепторов, сопряженных с G-белком , которые представляют собой семь трансмембранных спиралей , соединенных путем чередования внеклеточных и внутриклеточных петель. [8] [9]
Каждый рецептор, связанный с G-белком, соединяется с определенным G-белком , что приводит к активации специальной эффекторной системы. Например, рецепторы AT 1 в первую очередь соединяются через группу G-белков G q/11 . [9]
Были описаны еще два рецептора ангиотензина, AT 3 и AT 4 , но их роль до сих пор неизвестна. [10]
Распределение в организме
Рецепторы AT 1 в основном находятся в сердце, надпочечниках , мозге, печени и почках. [10] [11] Их основная роль заключается в регуляции артериального давления, а также баланса жидкости и электролитов. Рецепторы
AT 2 сильно выражены у развивающегося плода , но их количество быстро снижается после рождения. [10] У взрослого человека рецепторы AT 2 присутствуют только в низких количествах и в основном находятся в сердце, надпочечниках, матке, яичниках, почках и мозге. [4] [11]
Функции
Большинство известных действий Ang II опосредованы через рецепторы AT 1 , например , вазоконстрикция , высвобождение альдостерона , почечная реабсорбция натрия и секреция вазопрессина . Рецептор AT 2 также принимает участие в регуляции артериального давления и функции почек , но опосредует антагонистические эффекты по сравнению с рецептором AT 1. [8] [10] [11] [12]
Карманы для переплета

Ang II связывается с рецепторами AT 1 через различные сайты связывания . [1] Первичный сайт связывания находится во внеклеточной области рецептора AT 1 , где Ang II взаимодействует с остатками в N-конце рецептора AT 1 и его первой и третьей внеклеточных петлях. Трансмембранные спирали также способствуют связыванию через C-концевую карбоксильную группу, которая взаимодействует с Lys 199 в верхней части спирали 5 рецептора; подробности см. на рисунке 1. [8]
Ионный мостик, образованный между Lys 199 и карбоксильной концевой группой остатка Phe 8 Ang II, скорее всего, стабилизируется остатком Trp 253 . Кроме того, Phe 259 и Asp 263 в трансмембранной спирали 6 и Lys 102 и Ser 105 во внешней области трансмембранной спирали 3 также вовлечены в связывание Ang II. Эта область, возможно, участвует в стабилизации ратификации рецептора и в формировании внутримембранного связывающего кармана. [8] [13]
Механизм действия

Кровяное давление и гомеостаз жидкости и электролитов регулируются ренин-ангиотензин-альдостероновой системой . [1] Ренин , фермент, вырабатываемый почками, преобразует неактивный плазменный белок ангиотензиноген в ангиотензин I (Ang I). Затем Ang I преобразуется в Ang II с помощью ангиотензинпревращающего фермента (АПФ), см. рисунок 2. Затем Ang II в плазме связывается с AT-рецепторами. [6]
БРА блокируют последнюю часть пути ренин-ангиотензин и блокируют этот путь более специфично, чем ингибиторы АПФ . [1]
Рецептор AT 1 опосредует Ang II, вызывая повышенную сократимость сердца , реабсорбцию натрия и вазоконстрикцию, что все приводит к повышению артериального давления. Блокируя рецепторы AT 1 , БРА приводят к снижению артериального давления. [14]
Непреодолимое ингибирование рецептора AT 1 достигается, когда максимальный ответ Ang II не может быть восстановлен в присутствии ARB, независимо от того, насколько высока концентрация Ang II. [6] Блокаторы рецепторов ангиотензина могут ингибировать рецептор конкурентно-преодолимым, конкурентно-непреодолимым или неконкурентным образом, в зависимости от скорости, с которой они диссоциируют от рецептора. [1]
Открытие и разработка лекарственных препаратов

Развитие от саралазина к лозартану и эпросартану
Для простого обзора развития БРА см. рисунок 3.
Благодаря саралазину , первому антагонисту Ang II , и разработке первого ингибитора АПФ каптоприла , было общепризнано, что антагонисты рецепторов Ang II могут быть перспективными в качестве эффективных антигипертензивных средств. [2] [7]
Саралазин был разработан в начале 1970-х годов и является октапептидным аналогом Ang II, в котором аминокислоты Asp 1 , Ile 5 и Phe 8 были заменены на Ser 1 , Val 5 и Ala 8 соответственно. [7] Саралазин не был биодоступен при приеме внутрь , имел короткую продолжительность действия и проявлял частичную агонистическую активность, поэтому он не подходил в качестве лекарственного средства. [2]
Таким образом, целью было разработать меньшее непептидное вещество с аналогичными характеристиками ингибирования и связывания. В это время группа в DuPont уже начала скрининг непептидных имитаторов Ang II, используя существующие вещества из химических библиотек. [2]
Исследователи из Takeda обнаружили в 1982 году слабые непептидные антагонисты Ang II S-8307 и S-8308 из группы производных 1- бензилимидазол -5-уксусной кислоты. [7] S-8307 и S-8308 обладают умеренной эффективностью , короткой продолжительностью действия и ограниченной пероральной биодоступностью, однако они являются селективными и конкурентными антагонистами рецептора AT 1 без частичной агонистической активности. [1] Группа из DuPont предположила, что как Ang II, так и лидеры Takeda были связаны с одним и тем же рецепторным участком. [7] Эти два вещества служили ведущими соединениями для дальнейшей оптимизации блокаторов рецептора AT 1. [1]
Используя ядерно-магнитные резонансные исследования пространственной структуры Ang II, ученые из DuPont обнаружили, что структуры Takeda должны быть увеличены в определенном положении, чтобы больше походить на гораздо более крупный пептид Ang II. [2]
Компьютерное моделирование использовалось для сравнения S-8308 и S-8307 с Ang II, и было видно, что Ang II содержит два кислотных остатка вблизи конца NH 2. Эти группы не были имитированы лидерами Takeda, и поэтому была выдвинута гипотеза, что к соединениям необходимо будет добавить кислотные функциональные группы
.
4-карбоксипроизводное EXP-6155 имело связывающую активность, которая была в десять раз выше, чем у S-8308, что еще больше укрепило эту гипотезу . [7]
Заменив 4-карбоксигруппу на 2-карбоксибензамидогруппу, синтезировали соединение EXP-6803. Оно имело значительно повышенную связывающую способность, но было активным только при внутривенном введении .
Замена 2-карбоксибензамидогруппы на 2-карбоксифенильную группу создала липофильный бифенилсодержащий EXP-7711, который проявил хорошую пероральную активность, но немного меньшее сродство к рецептору AT 1. [1]
Затем полярная карбоксильная группа была заменена более липофильной тетразольной группой для того, чтобы еще больше увеличить пероральную биодоступность и продолжительность действия, и таким образом образованное соединение было названо лозартаном . Эта разработка состоялась в 1986 году, и лозартан стал первым успешным препаратом- антагонистом Ang II , одобренным как таковой в Соединенных Штатах в 1995 году и продаваемым компанией Merck [1] [7] под торговой маркой Cozzar. [15]
Эта разработка была обширной программой, и, по оценкам, процесс от структур Takeda до конечного вещества, лозартана, занял более пятидесяти человеко-лет работы по биологическому тестированию и химическим модификациям. [2] Это представляет собой отличную инвестицию, учитывая, что недавнее исследование показало, что введение лозартана в Европейском союзе может сократить расходы на предоставление медицинской помощи на 2,5 млрд евро за 3,5 года. [16]
Используя другой подход, оптимизацию от S-8308, эпросартан был разработан SmithKline Beecham в 1992 году. Эпросартан не имеет бифенилметильной структуры, но для имитации C-конца Ang II группа 5-уксусной кислоты была заменена на α -тиенилакриловую кислоту и 4-карбокси-группу. [7] Эпросартан является селективным, мощным и конкурентоспособным антагонистом AT 1 , и его связывание с рецепторами AT 1 является быстрым, обратимым, насыщаемым и имеет высокое сродство. [1] [4]
Развитие от лозартана к другим препаратам
Лозартан, валсартан , кандесартан , ирбесартан , телмисартан и олмесартан содержат бифенилметильную группу .
Лозартан частично метаболизируется до своего метаболита 5- карбоновой кислоты EXP 3174, который является более мощным антагонистом рецептора AT 1, чем его исходное соединение [17] и стал моделью для продолжающейся разработки нескольких других БРА. [1]
Валсартан, кандесартан и ирбесартан были разработаны в 1990 году.
Валсартан, впервые представленный на рынке компанией Novartis , представляет собой негетероциклический БРА , в котором имидазол лозартана заменен ацилированной аминокислотой . [1]
Ирбесартан был разработан компанией Sanofi Research и действует дольше, чем валсартан и лозартан, и имеет имидазолиноновое кольцо, где карбонильная группа функционирует как акцептор водородной связи вместо гидроксиметильной группы в лозартане. Ирбесартан является неконкурентным ингибитором. [4]
Кандесартан цилексетил (TCV 116) — это бензимидазол, разработанный в Takeda, и представляет собой пролекарство карбоната эфира . In vivo он быстро превращается в гораздо более мощную соответствующую 7-карбоновую кислоту, кандесартан. Во взаимодействии кандесартана с рецептором AT 1 карбоксильная группа бензимидазольного кольца играет важную роль. Кандесартан и его пролекарство оказывают более сильное гипотензивное действие, чем EXP 3174 и лозартан. [1]
Телмисартан, который был открыт и разработан в 1991 году компанией Boehringer Ingelheim , имеет карбоновую кислоту в качестве бифениловой кислотной группы. Он имеет самый длительный период полувыведения среди БРА или около 24 часов. [4]
Olmesartan medoxomil был разработан Sankyo в 1995 году и является новейшим ARB на рынке, выпущенным на рынок в 2002 году. Это эфирное пролекарство, подобное кандесартану цилексетилу. In vivo пролекарство полностью и быстро гидролизуется до активной кислотной формы, олмесартана (RNH-6270). Он имеет гидроксиизопропильную группу , связанную с имидазольным кольцом в дополнение к карбоксильной группе. [1]
Фармакофор и связь структуры и активности
Фармакофор
Существуют три функциональные группы, которые являются наиболее важными частями для биологической активности БРА, подробности см. на рисунке 1.
Первая группа — это имидазольное кольцо, которое связывается с аминокислотами в спирали 7 ( Asn 295 ). Вторая группа — это бифенилметильная группа, которая связывается с аминокислотами в обеих спиралях 6 и 7 ( Phe 301 , Phe 300 , Trp 253 и His 256 ). Третья группа — это тетразольная группа, которая взаимодействует с аминокислотами в спиралях 4 и 5 ( Arg 167 и Lys 199 ).
Тетразольная группа была успешно заменена группой карбоновой кислоты, как в случае с телмисартаном. [1] [7] [8] [18]
Соотношение структура-активность (SAR)
Большинство ARB имеют один и тот же фармакофор , поэтому разница в их биохимических и физиологических эффектах в основном обусловлена разными заместителями . Активность препарата зависит от его сродства к субстратному участку и продолжительности связывания с участком. Липофильные заместители, такие как линейная алкильная группа в положении 2 имидазольного кольца вместе с бифенилметильной группой, ассоциируются с гидрофобными карманами рецептора. Кислотная группа, такая как тетразол, CO2H или NHSO2CF3 в положении 1 бифенилметильной группы, будет связываться с основным положением в рецепторе и необходима для мощной антагонистической активности. [19]
В валсартане имидазольное кольцо лозартана было заменено ацилированной аминокислотой. [4]
Было опробовано несколько заместителей в положениях 4 и 5 имидазольного кольца. Хлор и гидроксиметильные группы, связанные с этими позициями в лозартане, вероятно, не имеют большого значения для связывания с рецептором, поскольку другие БРА не обладают этими функциональными группами и имеют сопоставимую или лучшую аффинность связывания, чем лозартан. Ирбесартан имеет карбонильную группу в 5-м положении, функционирующую как акцептор водородной связи вместо гидроксиметильной группы лозартана, что приводит к более длительному связыванию с рецептором. [ 1] [4] [19]
Структура эпросартана больше всего отличается от других БРА, обычная бифенилметильная группа была заменена карбоксибензильной группой , которая более точно имитирует фенольный фрагмент группы Tyr 4 Ang II. Это изменение приводит к более сильному связыванию с рецептором, но биохимические и физиологические эффекты не улучшаются значительно. [1]
Телмисартан имеет карбоновую кислоту в 2-м положении бифенилметильной группы и является более мощным, чем тетразольный аналог. [1]
Сообщалось, что имидазолы , имеющие гидроксиметильные и карбоксигруппы в 4-м и 5-м положениях, обладают мощной антагонистической активностью, вызванной водородными связями и гидрофильностью гидроксиметильной группы. [19]
Также сообщалось, что гидроксигруппа в 4-м положении имидазольного кольца играет важную роль в сродстве к связыванию и компенсирует недостаток липофильности .
объемной алкильной группы. [19]
Эти результаты показывают, что гидроксиалкильная группа среднего размера, такая как CHMeOH и CMe 2 OH, благоприятна для заместителя 4-го положения на имидазольном кольце. Кроме того, ионизируемая группа благоприятна для связывающего сродства. [19]
Кандесартан и олмесартан имеют самое высокое сродство к рецепторам AT 1 , за ними следуют ирбесартан и эпросартан. Валсартан, телмисартан и EXP 3174 имеют схожее сродство, которое примерно в десять раз меньше, чем у кандесартана. Лозартан имеет наименьшее сродство. [6] Сродство БРА к рецептору AT 2 , как правило, намного ниже (или примерно в 10 000 раз меньше), чем для подтипа AT 1. Поэтому они позволяют беспрепятственно стимулировать рецептор AT 2. [ 20]
Сравнение лекарств и фармакокинетика
| Лекарство | Биологический период полураспада [ч] | Связывание с белком [%] | Биодоступность [%] | Почечный/печеночный клиренс [%] | Эффект еды | Суточная доза [мг] |
|---|---|---|---|---|---|---|
| Лозартан | 2 | 98.7 | 33 | 10/90 | Минимальный | 50-100 |
| ЭКСП 3174 | 6-9 | 99,8 | - | 50/50 | - | - |
| Кандесартан | 9 | >99 | 15 | 60/40 | Нет | 4-32 |
| Валсартан | 6 | 95 | 25 | 30/70 | 40-50% уменьшилось на | 80-320 |
| Ирбесартан | 11-15 | 90-95 | 70 | 1/99 | Нет | 150-300 |
| Телмисартан | 24 | >99 | 42-58 | 1/99 | Нет | 40-80 |
| Эпросартан | 5 | 98 | 13 | 30/70 | Нет | 400-800 |
| Олмесартан | 14-16 | >99 | 29 | 40/60 | Нет | 10-40 |
| Источники: [4] [7] [20] [21] [22] | ||||||
БРА имеют большой терапевтический индекс , и поэтому их (в основном низкая) пероральная биодоступность, по-видимому, не имеет клинического значения. [7] Как видно из таблицы 1, эти препараты в значительной степени связаны с белками плазмы, и поэтому пероральный прием один раз в день должен обеспечивать достаточный антигипертензивный эффект. [1] Около 14% перорально принятого лозартана метаболизируется до его метаболита 5-карбоновой кислоты EXP 3174. Как упоминалось ранее, кандесартан цилексетил и олмесартан медоксомил являются неактивными эфирными пролекарствами, которые полностью гидролизуются до своих активных форм эстеразами во время абсорбции из желудочно-кишечного тракта . Эти три метаболита являются более мощными антагонистами рецептора AT 1 , чем их пролекарства . Другие БРА не имеют активных метаболитов. [1] [6]
Все БРА, за исключением валсартана и олмесартана, метаболизируются в той или иной степени ферментом цитохрома P450 (CYP) 2C9 , который находится в печени человека. Например, CYP2C9 отвечает за метаболизм лозартана до EXP 3174 и медленный метаболизм валсартана и кандесартана до их неактивных метаболитов. Телмисартан, с другой стороны, частично метаболизируется путем глюкуронирования , а олмесартан выводится в виде неизмененного препарата. [23] Телмисартан является единственным БРА, который может пересекать гематоэнцефалический барьер и, следовательно, может ингибировать центрально опосредованные эффекты Ang II, способствуя еще лучшему контролю артериального давления. [1]
Все БРА имеют одинаковый механизм действия , и различия в их силе действия могут быть связаны с их различными фармакокинетическими профилями. Было проведено несколько клинических сравнений, и кандесартан, ирбесартан и телмисартан, по-видимому, немного более эффективны, чем лозартан, в снижении артериального давления. [4] Это различие может быть связано с различной силой действия на уровне рецепторов, такой как продолжительность и сила связывания рецепторов. [22]
ARB в стадии разработки
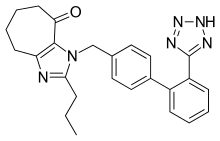
Несколько новых непептидных БРА проходят клинические испытания или находятся на доклинических стадиях разработки. Среди них эмбусартан (BAY 10-6734 или BAY 10-6734), KRH-594, фонсартан (HR 720) и пратосартан (KT3-671). [1] Пратосартан, например, имеет новую структуру: семичленное кольцо, которое несет оксогруппу ( C=O), слитую с имидазольным кольцом (рисунок 4), и его сродство к рецептору AT 1 примерно в 7 раз выше, чем у лозартана. [1] Назначение оксогруппы аналогично назначению групп карбоновых кислот в других БРА. [24]
Другие свойства БРА также изучаются, такие как положительное влияние телмисартана на метаболизм липидов и глюкозы и влияние лозартана на снижение уровня мочевой кислоты . [24] Такие эффекты могут привести к появлению новых показаний к применению этих препаратов, но необходимы дальнейшие исследования.
Смотрите также
Ссылки
- ^ abcdefghijklmnopqrstu vw Aulakh GK, Sodhi RK, Singh M; Sodhi; Singh (август 2007 г.), «Обновленная информация о непептидных антагонистах рецепторов ангиотензина и родственных модуляторах РААС», Life Sci. , 81 (8): 615–39, doi :10.1016/j.lfs.2007.06.007, PMID 17692338
{{citation}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ abcdefg Адам, М. (2005), «Интеграция исследований и разработок: возникновение рационального дизайна лекарств в фармацевтической промышленности» (PDF) , Исследования по истории и философии биологических и биомедицинских наук , 36 (3): 513–37, doi :10.1016/j.shpsc.2005.07.003, PMID 16137601
- ^ Ван Эппс, HL (2005). «Гарри Голдблатт и открытие ренина». Журнал экспериментальной медицины . 201 (9): 1351. doi :10.1084/jem.2019fta. ISSN 0022-1007. PMC 2213196. PMID 15940810 .
- ^ abcdefghi Бернье, М.; Бруннер, ХР (2000), «Антагонисты рецепторов ангиотензина II», Lancet , 355 (9204): 637–645, doi :10.1016/S0140-6736(99)10365-9, PMID 10696996[ постоянная мертвая ссылка ]
- ^ Nicolaï, E.; Curé, G.; Goyard, J.; Kirchner, M.; Teulon, JM; Versigny, A.; Cazes, M.; Vironeoddos, A.; Caussade, F.; et al. (1995), «Синтез и антагонистическая активность производных C-связанного пиримидина в отношении рецепторов ангиотензина II», European Journal of Medicinal Chemistry , 30 (5): 365–375, doi :10.1016/0223-5234(96)88246-8
- ^ abcde Goodman & Gilman's The Pharmacological Basis of Therapeutics 11-е изд. ( Ренин и ангиотензин ; Jackson EK, 789-821) Редакторы: Brunton LL, Lazo JS, Parker KL New York McGraw Hill 2006. ISBN 0-07-142280-3
- ^ abcdefghijk Analogue-based Drug Discovery ( Оптимизация антигипертензивной терапии с помощью блокаторов рецепторов ангиотензина ; Farsang, C., Fisher, J., стр. 157-167) Редакторы; Fischer, J., Ganellin, R. Wiley-VCH 2006. ISBN 978-3-527-31257-3
- ^ abcde Де Гаспаро, М.; Кэтт, К.Дж.; Инагами, Т.; Райт, Дж.В.; Унгер, Т. (2000), «Международный союз фармакологии. XIII. Рецепторы ангиотензина II», Pharmacological Reviews , 52 (3): 415–472, PMID 10977869
- ^ ab Hunyady, L.; Ji, H.; Jagadeesh, G.; Zhang, M.; Gáborik, Z.; Mihalik, B.; Catt, K (1998), "Зависимость функции рецептора ангиотензина AT1 от соседних остатков аспарагина в седьмой трансмембранной спирали", Molecular Pharmacology , 54 (2): 427–434, doi : 10.1124/mol.54.2.427, PMID 9687585, S2CID 12034239
- ^ abcd Dihn, DT; Frauman, AG; Johnston, CI; Fabiani, ME (2001), «Ангиотензиновые рецепторы: распределение, сигнализация и функция», Clinical Science , 100 (5): 481–492, doi :10.1042/CS20000263, PMID 11294688
- ^ abc Matsubara, H. (1998), «Патофизиологическая роль рецептора ангиотензина II типа 2 при сердечно-сосудистых и почечных заболеваниях», Circulation Research , 83 (12): 1182–1191, doi : 10.1161/01.RES.83.12.1182 , PMID 9851935
- ^ Винсон, ГП; Хо, ММ; Паддефут, Дж. Р. (1995), «Распределение рецепторов ангиотензина II типа 1 и тканевые ренин-ангиотензиновые системы», Molecular Medicine Today , 1 (1): 35–39, doi :10.1016/1357-4310(95)80018-2, PMID 9415136
- ^ Клеман, М.; Мартин, СС; Болье, М.; Чемберленд, К.; Лавин, П.; Ледюк, Р.; Гийеметт, Г.; Эшер, Э. (2005), «Определение окружения кармана связывания лиганда рецептора hAT1 ангиотензина II с использованием анализа близости метионина», Журнал биологической химии , 280 (29): 27121–27129, doi : 10.1074/jbc.M413653200 , PMID 15890659
- ^ Леви, Б.И. (2005), «Как объяснить различия между модуляторами ренин-ангиотензиновой системы», Американский журнал гипертонии , 18 (9 Pt 2): 134–141, doi : 10.1016/j.amjhyper.2005.05.005 , PMID 16125050
- ^ «FDA разрешило Merck продавать новый препарат от гипертонии». New York Times. Bloomberg News. 18 апреля 1995 г. Получено 18 июля 2024 г.
- ^ Gerth, WC; Remuzzi, G.; et, al.; Hannedouche, Thierry; Martinez-Castelao, Alberto; Shahinfar, Shahnaz; Carides, George W.; Brenner, Barry (2002), «Лозартан снижает бремя и стоимость ХПН: последствия для общественного здравоохранения из исследования RENAAL для Европейского союза», Kidney International , 62 (82): S68–S72, doi : 10.1046/j.1523-1755.62.s82.14.x , PMID 12410859
- ^ Сахинидис, Агапиос; Ко, Йон; Вайссер, Питер; цу БрикБкведде, Мария-Катарина Мейер; Дюзинг, Райнер; Кристиан, Роджер; Вичорек, Андреас Дж.; Веттер, Ханс (1993). «EXP3174, метаболит лозартана (MK954, DuP753), более эффективен, чем лозартан, в блокировании ответов, вызванных ангиотензином II, в гладкомышечных клетках сосудов». Журнал гипертонии . 11 (2): 155–162. doi :10.1097/00004872-199302000-00007. ISSN 0263-6352. PMID 8385175. S2CID 19259731.
- ^ Миура, С.; Кия, Ю.; Канасава, Т.; Имаидзуми, С.; Фудзино, М.; Мацуо, Ю.; Карник, С.С.; Саку, К (2008), «Дифференциальные связывающие взаимодействия обратных агонистов рецептора ангиотензина II типа 1 при стабилизации неактивного состояния», Журнал молекулярной эндокринологии , 22 (1): 139–146, doi :10.1210/me.2007-0312, PMC 2725753 , PMID 17901125
- ^ abcde Янагиасава, Х.; Амемия, Ю.; Каназаки, Т.; Симодзи, Ю.; Фудзимото, К.; Китахара, Ю.; Сада, Т.; Мизуно, М.; Икеда, М.; Миямото, С.; Фурукава, Ю.; Коике, Х. (1996), "Непептидные антагонисты рецепторов ангиотензина II: синтез, биологическая активность и взаимосвязь структуры и активности имидазол-5-карбоновых кислот, содержащих алкильные, алкенильные и гидроксиалкильные заместители в положении 4, и их родственных соединений", Журнал медицинской химии , 39 (1): 323–338, doi : 10.1021/jm950450f, PMID 8568823
- ^ ab Brousil, JA; Burke, JM (2003), «Олмесартан медоксомил: блокатор рецепторов ангиотензина II», Clinical Therapeutics , 25 (4): 1041–1055, doi :10.1016/S0149-2918(03)80066-8, PMID 12809956[ постоянная мертвая ссылка ]
- ^ Бруннер, HR (2002), «Новый пероральный антагонист ангиотензина II олмесартан медоксомил: краткий обзор», Журнал человеческой гипертензии , 16 (2): 13–16, doi : 10.1038/sj.jhh.1001391, PMID 11967728, ProQuest 219966061
- ^ ab Zusman, RM; Jullien, V; Lemetayer, P; Jarnier, P; Clementy, J (1999), «Есть ли различия между блокаторами рецепторов ангиотензина?», American Journal of Hypertension , 12 (2 Pt 1): 231–235, doi : 10.1016/S0895-7061(99)00116-8 , PMID 10090354[ постоянная мертвая ссылка ]
- ^ Камияма, Э.; Ёсигае, Ю.; Касуя, А.; Такей, М.; Курихара, А.; Икеда, Т. (2007), «Ингибирующее действие блокаторов рецепторов ангиотензина на активность CYP2C9 в микросомах печени человека», Метаболизм и фармакокинетика лекарственных средств , 22 (4): 267–275, doi :10.2133/dmpk.22.267, PMID 17827781
- ^ ab Огихара, Т.; Сарута, Т.; Шимамото, К.; Мацуока, Х.; Ракуги, Х. (2008), «Клиническая эффективность нового блокатора рецепторов ангиотензина II типа 1, пратосартана, у пациентов с гипертонией», Hypertension Research , 31 (2): 281–287, doi : 10.1291/hypres.31.281 , PMID 18360048