Легочная гипертензия
| Легочная гипертензия | |
|---|---|
| Другие имена | Синдром Айерзы [1] |
 | |
| Легочная гипертензия | |
| Специальность | Пульмонология , кардиология |
| Симптомы | Боль в груди, усталость [2] |
| Обычное начало | 20–60 лет [3] |
| Продолжительность | Долгосрочно [4] |
| Причины | Неизвестно [4] |
| Факторы риска | Семейный анамнез, тромбоэмболия легочной артерии , ВИЧ/СПИД , серповидноклеточная анемия , употребление кокаина , ХОБЛ , апноэ во сне , проживание на большой высоте [5] [3] |
| Метод диагностики | После исключения других возможных причин [4] |
| Уход | Поддерживающая терапия , различные лекарства, трансплантация легких [4] [6] |
| Медикамент | Эпопростенол , трепростинил , илопрост , бозентан , амбризентан , мацитентан , силденафил [4] |
| Частота | 1000 новых случаев в год (США) [1] |
Легочная гипертензия ( ЛГ или ЛГТН ) — это состояние повышенного кровяного давления в артериях легких . [7] Симптомы включают одышку , обмороки , усталость, боль в груди, отеки ног и учащенное сердцебиение . [7] [1] Это состояние может затруднять выполнение физических упражнений. [7] Начало заболевания обычно постепенное. [8] Согласно определению, данному на 6-м Всемирном симпозиуме по легочной гипертензии в 2018 году, считается, что у пациента легочная гипертензия, если среднее легочное артериальное давление в состоянии покоя превышает 20 мм рт. ст., пересмотренное с чисто произвольного значения 25 мм рт. ст., и легочное сосудистое сопротивление (ЛСС) превышает 3 единицы Вуда.
Причина часто неизвестна. [4] Факторы риска включают семейный анамнез, предшествующую тромбоэмболию легочной артерии (тромбы в легких), ВИЧ/СПИД , серповидноклеточную анемию , употребление кокаина , хроническую обструктивную болезнь легких , апноэ во сне , проживание на большой высоте и проблемы с митральным клапаном . [5] [3] Основной механизм обычно включает воспаление и последующее ремоделирование артерий в легких . [ 5] Диагностика включает в себя сначала исключение других потенциальных причин. [4]
По состоянию на 2022 год [обновлять]не существует лекарства от легочной гипертензии, [6] хотя исследования по поиску лекарства продолжаются. Лечение зависит от типа заболевания. [6] Может использоваться ряд поддерживающих мер, таких как кислородная терапия , диуретики и лекарства для подавления свертывания крови . [4] Лекарства, специально используемые для лечения легочной гипертензии, включают эпопростенол , трепростинил , илопрост , босентан , амбрисентан , мацитентан и силденафил , тадалафил, селексипаг, риоцигуат. [4] Трансплантация легких может быть вариантом в тяжелых случаях. [6]
Частота возникновения оценивается в 1000 новых случаев в год в Соединенных Штатах. [3] [1] Женщины болеют чаще, чем мужчины. [1] Начало обычно приходится на возраст от 20 до 60 лет. [3] Легочная гипертензия была идентифицирована Эрнстом фон Ромбергом в 1891 году. [9] [4]
Классификация
Согласно классификации ВОЗ, существует 5 групп легочной гипертензии, где группа I (легочная артериальная гипертензия) далее подразделяется на классы «Группа I'» и «Группа I''». [10] [11] Систему классификации ВОЗ в 2022 году (с адаптациями из более поздних руководств ESC/ERS, выделенными курсивом) можно обобщить следующим образом: [11] [12]
Группа ВОЗ I – Легочная артериальная гипертензия (ЛАГ)
- Вызвано сужением и утолщением мелких артерий легких [13]
- В большинстве случаев идиопатическое (в некоторых случаях наследственное) [13]
- Наследственный ( мутации BMPR2 , ALK1 , SMAD9 , кавеолина 1 , KCNK3 )
- Вызванное наркотиками и токсинами (например, употреблением метамфетамина , амфетамина или кокаина [14] )
- Сопутствующие состояния: Заболевания соединительной ткани , ВИЧ-инфекция , Портальная гипертензия , Врожденные пороки сердца , Шистосомоз
Группа ВОЗ I – легочная веноокклюзионная болезнь (ЛВОБ), легочный капиллярный гемангиоматоз (ЛКГ)
- Идиопатический
- Наследственный ( мутации EIF2AK4 )
- Наркотики, токсины и радиационное воздействие
- Сопутствующие состояния:заболевание соединительной ткани, ВИЧ-инфекция
Группа ВОЗ I – Стойкая легочная гипертензия новорожденных
Группа II ВОЗ – Легочная гипертензия, вторичная по отношению к заболеванию левых отделов сердца
- Систолическая дисфункция левого желудочка
- Диастолическая дисфункция левого желудочка
- Клапанный порок сердца
- Врожденная/приобретенная обструкция притока/оттока левого сердца и врожденная кардиомиопатия
- Врожденный/приобретенный стеноз легочных вен
Группа III по классификации ВОЗ – Легочная гипертензия вследствие заболевания легких , хроническая гипоксия
- Хроническая обструктивная болезнь легких (ХОБЛ)
- Интерстициальное заболевание легких
- Смешанные рестриктивные и обструктивные заболевания легких
- Нарушение дыхания во сне
- Расстройства альвеолярной гиповентиляции
- Хроническое воздействие большой высоты
- Аномалии развития
Группа IV по ВОЗ – хроническая артериальная обструкция
- Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ)
- Другие обструкции легочной артерии
- Ангиосаркома или другая опухоль внутри кровеносных сосудов
- Артериит
- Врожденный стеноз легочной артерии
- Паразитарная инфекция ( гидатидоз )
Группа V ВОЗ – Легочная гипертензия с неясными или многофакторными механизмами
- Гематологические заболевания : хроническая гемолитическая анемия (включая серповидноклеточную анемию )
- Системные заболевания : саркоидоз , легочный гистиоцитоз из клеток Лангерганса : лимфангиолейомиоматоз , нейрофиброматоз , васкулит
- Метаболические нарушения : болезнь накопления гликогена , болезнь Гоше , заболевания щитовидной железы
- Другие: легочная опухолевая тромботическая микроангиопатия, фиброзирующий медиастинит , хроническая почечная недостаточность , сегментарная легочная гипертензия (легочная гипертензия , ограниченная одной или несколькими долями легких )
Признаки и симптомы
Симптомы легочной гипертензии включают следующее: [2] [12] [15]
- Одышка
- Усталость
- Боль в груди
- Сердцебиение ( учащенное сердцебиение )
- Боль в правой части живота
- Плохой аппетит
- Головокружение
- Обморок
- Отек (ноги/лодыжки)
- Цианоз
Менее распространенные признаки/симптомы включают непродуктивный кашель и тошноту и рвоту, вызванные физической нагрузкой. [12] У некоторых пациентов может наблюдаться кашель с кровью, особенно у тех, у кого есть определенные подтипы легочной гипертензии, такие как наследственная легочная артериальная гипертензия, синдром Эйзенменгера и хроническая тромбоэмболическая легочная гипертензия . [16] Легочная венозная гипертензия обычно проявляется одышкой в положении лежа или во время сна ( ортопноэ или пароксизмальная ночная одышка ), тогда как легочная артериальная гипертензия (ЛАГ) обычно не проявляется. [17]
Другие типичные признаки легочной гипертензии включают в себя акцентированный легочный компонент второго сердечного тона, правожелудочковый третий сердечный тон и парастернальный подъем , указывающий на гипертрофированный правый желудочек . Признаки системного застоя, вызванного правосторонней сердечной недостаточностью, включают расширение яремных вен , асцит и гепатоюгулярный рефлюкс . [12] [15] [18] Также ищутся доказательства недостаточности трехстворчатого клапана и легочной регургитации , и, если они присутствуют, они согласуются с наличием легочной гипертензии. [12] [15] [19]
Причины
Легочная гипертензия является патофизиологическим состоянием со многими возможными причинами. Действительно, это состояние часто сопровождает тяжелые заболевания сердца или легких. [12] На заседании Всемирной организации здравоохранения 1973 года была сделана первая попытка классифицировать легочную гипертензию по ее причине, и было проведено различие между первичной ЛГ (возникающей в результате заболевания легочных артерий) и вторичной ЛГ (возникающей вторично по отношению к другим, несосудистым причинам). Кроме того, первичная ЛГ была разделена на «артериальную плексиформную», «веноокклюзионную» и «тромбоэмболическую» формы. [20] В 1998 году вторая конференция в Эвиан-ле-Бен рассмотрела причины вторичной ЛГ. [21] Последующие третий, [22] четвертый, [10] и пятый (2013) [11] всемирные симпозиумы по ЛАГ дополнительно определили классификацию ЛГ. Классификация продолжает развиваться на основе улучшения понимания механизмов заболевания. [ необходима ссылка ]
Совсем недавно, в 2015 году, рекомендации ВОЗ были обновлены Европейским обществом кардиологов (ESC) и Европейским респираторным обществом (ERS). [12] Эти рекомендации одобрены Международным обществом по трансплантации сердца и легких и обеспечивают текущую основу для понимания и лечения легочной гипертензии. [23]
Генетика
Мутации в нескольких генах были связаны с этим состоянием [24] [25] они включают ген рецептора костного морфогенетического белка 2 типа ( BMPR2 ) и ген эукариотического фактора инициации трансляции 2 альфа-киназы 4 ( EIF2AK4 ). 80% семейной легочной артериальной гипертензии и 20% спорадических вариантов имеют мутации в BMPR2. [26] BMPR2 участвует в эндотелиальной пролиферации и ремоделировании. Другие мутации, связанные с ЛАГ, включают ACVRL1 (который кодирует активин-рецептор-подобную киназу 1) и ENG, кодирующий эндоглин, два белка, которые также участвуют в передаче сигналов BMPR2. [26] Семейство факторов транскрипции SMAD, включая SMAD1 , SMAD4 и SMAD9, участвует в сигнальных путях ниже BMPR2 и также участвует в развитии легочной артериальной гипертензии. [26]
Патогенез

.jpg/440px-Pulmonary_hypertensive_arteriopathy_(4348170715).jpg)
Патогенез легочной артериальной гипертензии (группа I ВОЗ) включает сужение кровеносных сосудов, соединенных с легкими и находящихся внутри них. Это затрудняет сердцу перекачивать кровь через легкие , поскольку гораздо сложнее заставить воду течь по узкой трубе, чем по широкой. Со временем пораженные кровеносные сосуды становятся жестче и толще, в процессе, известном как фиброз . Механизмы, вовлеченные в этот процесс сужения, включают вазоконстрикцию , тромбоз и сосудистое ремоделирование (чрезмерная клеточная пролиферация, фиброз и сниженный апоптоз/запрограммированная гибель клеток в стенках сосудов, вызванные воспалением , нарушенным метаболизмом и дисрегуляцией определенных факторов роста ). [27] [28] Это еще больше увеличивает кровяное давление в легких и ухудшает их кровоток. Как и в случае с другими типами легочной гипертензии, эти изменения приводят к увеличению нагрузки на правую сторону сердца. [15] [29] Правый желудочек обычно является частью системы низкого давления, с систолическим желудочковым давлением, которое ниже того, с которым обычно сталкивается левый желудочек. Таким образом, правый желудочек не может также хорошо справляться с более высоким давлением, и хотя адаптации правого желудочка ( гипертрофия и повышенная сократимость сердечной мышцы) изначально помогают сохранить ударный объем , в конечном итоге этих компенсаторных механизмов недостаточно; мышца правого желудочка не может получить достаточно кислорода для удовлетворения своих потребностей, и наступает правосторонняя сердечная недостаточность . [15] [28] [29] По мере того, как поток крови, протекающей через легкие, уменьшается, левая сторона сердца получает меньше крови. Эта кровь также может переносить меньше кислорода, чем обычно. Поэтому левой стороне сердца становится все труднее и труднее поставлять достаточное количество кислорода остальной части тела, особенно во время физической активности. [30] [31] [10] Во время фазы конечного систолического объема сердечного цикла гауссова кривизна и средняя кривизна стенки эндокарда правого желудочка у пациентов с ЛГ значительно отличаются по сравнению с контрольной группой. [32]
При ВОБЛ (группа I по классификации ВОЗ) сужение легочных кровеносных сосудов происходит преимущественно (хотя и не исключительно) в посткапиллярных венозных кровеносных сосудах. [33] ВОБЛ имеет несколько общих характеристик с ЛАГ, но есть и некоторые важные различия, например, различия в прогнозе и реакции на медикаментозную терапию. [ необходима ссылка ]
Стойкая легочная гипертензия новорожденных возникает, когда кровеносная система новорожденного не может адаптироваться к жизни вне утробы матери; она характеризуется высоким сопротивлением току крови через легкие, шунтированием сердца справа налево и тяжелой гипоксемией . [15]
Патогенез легочной гипертензии, вызванной заболеванием левых отделов сердца (группа II ВОЗ), совершенно иной, поскольку проблема заключается не в сужении или повреждении легочных кровеносных сосудов. Вместо этого левое сердце не может эффективно перекачивать кровь, что приводит к скоплению крови в легких и обратному давлению в легочной системе. Это вызывает отек легких и плевральные выпоты . [34] При отсутствии сужения легочных кровеносных сосудов повышенное обратное давление описывается как «изолированная посткапиллярная легочная гипертензия» (более старые термины включают «пассивную» или «пропорциональную» легочную гипертензию или «легочную венозную гипертензию»). Однако у некоторых пациентов повышенное давление в легочных сосудах вызывает наложенный компонент сужения сосудов, что еще больше увеличивает нагрузку на правую сторону сердца. Это называется «посткапиллярной легочной гипертензией с прекапиллярным компонентом» или «комбинированной посткапиллярной и прекапиллярной легочной гипертензией» (старые термины включают «реактивную» или «непропорциональную» легочную гипертензию). [ 12] [17] [35]
При легочной гипертензии, вызванной заболеваниями легких и/или гипоксией (группа III ВОЗ), низкий уровень кислорода в альвеолах (из-за респираторного заболевания или проживания на большой высоте) вызывает сужение легочных артерий. Это явление называется гипоксической легочной вазоконстрикцией , и изначально это защитная реакция, направленная на остановку слишком большого притока крови к поврежденным и не содержащим кислорода областям легких. Когда альвеолярная гипоксия распространена и продолжительна, эта гипоксически-опосредованная вазоконстрикция происходит на большой части легочного сосудистого русла и приводит к повышению давления в легочных артериях, при этом утолщение стенок легочных сосудов способствует развитию устойчивой легочной гипертензии. [10] [36] [37] [38] Длительная гипоксия также индуцирует фактор транскрипции HIF1A , который напрямую активирует нисходящий сигнальный фактор роста, который вызывает необратимую пролиферацию и ремоделирование эндотелиальных клеток легочных артерий, что приводит к хронической легочной артериальной гипертензии. [ необходима ссылка ]
При хронической тромбоэмболической легочной гипертензии (ХТЭЛГ) (группа IV ВОЗ) инициирующим событием считается закупорка или сужение легочных кровеносных сосудов неразрешенными тромбами; эти тромбы могут привести к повышению давления и напряжения сдвига в остальной части легочного кровообращения, ускоряя структурные изменения стенок сосудов (ремоделирование), аналогичные тем, которые наблюдаются при других типах тяжелой легочной гипертензии. Такое сочетание окклюзии сосудов и ремоделирования сосудов снова увеличивает сопротивление кровотоку, и поэтому давление внутри системы повышается. [39] [40]
Молекулярная патология
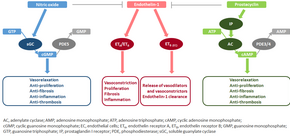
Молекулярный механизм легочной артериальной гипертензии (ЛАГ) пока неизвестен, но считается, что эндотелиальная дисфункция приводит к снижению синтеза эндотелиальных вазодилататоров, таких как оксид азота и простациклин . [41] Кроме того, происходит стимуляция синтеза вазоконстрикторов, таких как тромбоксан и фактор роста эндотелия сосудов (VEGF). Это приводит к сильной вазоконстрикции и гипертрофии гладких мышц сосудов и адвентиции, характерной для пациентов с ЛАГ. [41]
Путь гуанилатциклазы, растворимой в оксиде азота
В нормальных условиях сосудистая эндотелиальная синтаза оксида азота производит оксид азота из L-аргинина в присутствии кислорода. [42]
Этот оксид азота диффундирует в соседние клетки (включая сосудистые гладкомышечные клетки и тромбоциты), где он увеличивает активность фермента растворимой гуанилатциклазы , что приводит к увеличению образования циклического гуанозинмонофосфата (цГМФ) из гуанозинтрифосфата (ГТФ). [43] Затем цГМФ активирует цГМФ-зависимую киназу или PKG (протеинкиназу G). Активированная PKG способствует вазорелаксации (через снижение внутриклеточного уровня кальция), изменяет экспрессию генов, участвующих в сокращении, миграции и дифференцировке гладкомышечных клеток , и ингибирует активацию тромбоцитов . [44] Сигнализация оксида азота–растворимой гуанилатциклазы также приводит к противовоспалительным эффектам. [45]
Фосфодиэстераза типа 5 ( ФДЭ5 ), которая в изобилии присутствует в легочной ткани, гидролизует циклическую связь цГМФ. Следовательно, концентрация цГМФ (и, следовательно, активность PKG) снижается. [46] [44]
Эндотелин
Эндотелин-1 — это пептид (состоящий из 21 аминокислоты), который вырабатывается в эндотелиальных клетках. Он действует на рецепторы эндотелина ETA и ETB в различных типах клеток, включая сосудистые гладкомышечные клетки и фибробласты, что приводит к вазоконстрикции, гипертрофии, пролиферации, воспалению и фиброзу. Он также действует на рецепторы ETB в эндотелиальных клетках; это приводит к высвобождению как вазоконстрикторов, так и вазодилататоров из этих клеток и выводит эндотелин-1 из системы. [47] [48]
Простациклин и тромбоксан
Простациклин синтезируется из арахидоновой кислоты в эндотелиальных клетках. В сосудистых гладкомышечных клетках простациклин связывается в основном с рецептором простагландина I. Это посылает сигнал для увеличения активности аденилатциклазы, что приводит к увеличению синтеза циклического аденозинмонофосфата (цАМФ). Это, в свою очередь, приводит к увеличению активности цАМФ-зависимой протеинкиназы или ПКА (протеинкиназы А), в конечном итоге способствуя вазодилатации и ингибируя пролиферацию клеток. Сигнализация простациклина также приводит к антитромботическому, антифибротическому и противовоспалительному эффекту. Уровни цАМФ (который опосредует большинство биологических эффектов простациклина) снижаются фосфодиэстеразами 3 и 4. [49] [50] Сосудосуживающий тромбоксан также синтезируется из арахидоновой кислоты. При ЛАГ баланс смещен от синтеза простациклина к синтезу тромбоксана. [49]
Другие пути
Три описанных выше пути являются мишенями для имеющихся в настоящее время методов лечения ЛАГ. Однако было выявлено несколько других путей, которые также изменяются при ЛАГ и исследуются в качестве потенциальных целей для будущих методов лечения. Например, митохондриальный фермент пируватдегидрогеназная киназа (ПДК) патологически активируется при ЛАГ, вызывая метаболический сдвиг с окислительного фосфорилирования на гликолиз и приводя к повышенной пролиферации клеток и нарушению апоптоза. [49] [51] Экспрессия вазоактивного кишечного пептида, мощного вазодилататора с противовоспалительной и иммуномодулирующей ролью, снижается при ЛАГ, в то время как экспрессия его рецептора увеличивается. [49] [51] Уровни серотонина в плазме , который способствует вазоконстрикции, гипертрофии и пролиферации, повышаются у пациентов с ЛАГ, хотя роль, которую играет серотонин в патогенезе ЛАГ, остается неопределенной. [15] [49] Экспрессия или активность нескольких факторов роста (включая тромбоцитарный фактор роста , основной фактор роста фибробластов , эпидермальный фактор роста и фактор роста эндотелия сосудов ) увеличивается и способствует ремоделированию сосудов при ЛАГ. [49] Другие факторы, лежащие в основе пролиферативного состояния гладкомышечных клеток легочных сосудов, включают OPG [52] и TRAIL . [53] Сосредоточение внимания только на легочной сосудистой системе дает неполную картину ЛАГ; способность правого желудочка адаптироваться к повышенной рабочей нагрузке различается у разных пациентов и является важным фактором, определяющим выживаемость. Поэтому также изучается молекулярная патология ЛАГ в правом желудочке, и недавние исследования перешли на рассмотрение кардиопульмональной единицы как единой системы, а не двух отдельных систем. Важно, что ремоделирование правого желудочка связано с повышенным апоптозом; это контрастирует с ремоделированием легочных сосудов, которое включает ингибирование апоптоза. [28]
Несмотря на то, что основная причина ЛАГ неизвестна, было показано, что воспаление и окислительный стресс играют ключевую роль в ремоделировании сосудов. [54] Известно, что эти факторы вызывают повреждение ДНК , а также могут способствовать пролиферативному и апоптоз -резистентному фенотипу, который наблюдается в сосудистых клетках ЛАГ. [54] Сообщалось о повышенных уровнях повреждения ДНК в легких и ремоделированных артериях при ЛАГ, а также в животных моделях ЛГ, что указывает на то, что повреждение ДНК, вероятно, способствует патогенезу ЛАГ. [54]
Диагноз


.jpg/440px-Severe_tricuspid_regurgitation_E00572_(CardioNetworks_ECHOpedia).jpg)
С точки зрения диагностики легочной гипертензии, она имеет пять основных типов, и необходимо провести ряд тестов, чтобы отличить легочную артериальную гипертензию от венозной, гипоксической, тромбоэмболической или неясной многофакторной разновидности. ЛАГ диагностируется после исключения других возможных причин легочной гипертензии. [15]
Физическое обследование
Проводится физикальное обследование для выявления типичных признаков легочной гипертензии (описанных выше), [ 55 ] а также собирается подробный семейный анамнез для определения того, может ли заболевание быть наследственным . [56] [57] [58] История воздействия таких препаратов, как бенфлуорекс ( производное фенфлурамина ), дазатиниб , кокаин , метамфетамин , этанол , приводящий к циррозу , и табак, приводящий к эмфиземе , считается значимой. [15] [59] [11] Использование селективных ингибиторов обратного захвата серотонина во время беременности (особенно на поздних сроках беременности) связано с повышенным риском развития у ребенка персистирующей легочной гипертензии новорожденного . [11]
Эхокардиография
Если на основании вышеперечисленных оценок подозревается легочная гипертензия, следующим шагом выполняется эхокардиография. [12] [15] [58] Метаанализ допплеровской эхокардиографии для прогнозирования результатов катетеризации правых отделов сердца показал чувствительность и специфичность 88% и 56% соответственно. [60] Таким образом, допплеровская эхокардиография может предполагать наличие легочной гипертензии, но катетеризация правых отделов сердца (описанная ниже) остается золотым стандартом для диагностики ЛАГ. [12] [15] Эхокардиография также может помочь обнаружить врожденный порок сердца как причину легочной гипертензии. [12]
Исключить другие заболевания
Если эхокардиограмма совместима с диагнозом легочной гипертензии, рассматриваются распространенные причины легочной гипертензии (заболевания левых отделов сердца и легких) и проводятся соответствующие дальнейшие тесты. Эти тесты обычно включают электрокардиографию (ЭКГ), тесты функции легких, включая диффузионную способность легких для измерения оксида углерода и газов артериальной крови , рентген грудной клетки и сканирование с помощью компьютерной томографии (КТ) высокого разрешения. [12] [15] [58] [61]
Вентиляционно-перфузионная сцинтиграфия
Если были исключены заболевания сердца и легких, выполняется сканирование вентиляции/перфузии для исключения CTEPH. Если обнаружены несоответствующие дефекты перфузии, проводится дальнейшая оценка с помощью КТ-ангиографии легких, катетеризации правых отделов сердца и селективной ангиографии легких. [12] [58]
КТ-сканирование

Признаки легочной гипертензии на КТ грудной клетки:
- Расширение легочного ствола (измеренное в его бифуркации). Однако это плохой предиктор легочной гипертензии у пациентов с интерстициальным заболеванием легких . [62]
- Диаметр более 27 мм для женщин и 29 мм для мужчин предлагается в качестве порогового значения . [62]
- Пороговое значение 31,6 мм может быть более статистически надежным у лиц без интерстициального заболевания легких . [62]
- Увеличение отношения диаметра основной легочной артерии (легочного ствола) к диаметру восходящей части аорты (измеренному в ее бифуркации).
- В качестве порогового значения для взрослых предлагается соотношение 1,0. [62]
- Пороговое значение ~1,09 у детей. [62]
- Увеличенное отношение диаметра сегментарных артерий к бронхам. Это открытие в трех или четырех долях, при наличии расширенного легочного ствола (≥29 мм) и отсутствии значительного структурного заболевания легких дает специфичность 100% для легочной гипертензии. [62]
- Пристеночная кальцификация в центральных легочных артериях чаще всего наблюдается у пациентов с синдромом Эйзенменгера . [62]
Катетеризация правых отделов сердца
Хотя легочное артериальное давление (ЛАД) можно оценить на основе эхокардиографии , [63] измерения давления с помощью катетера Свана-Ганца, введенного через правую сторону сердца, дают наиболее определенную оценку. [42] Легочная гипертензия определяется как среднее ЛАД не менее 20 мм рт. ст. (3300 Па) в состоянии покоя, а ЛАГ определяется как прекапиллярная легочная гипертензия (т. е. среднее ЛАД ≥ 20 мм рт. ст. с давлением окклюзии легочной артерии [ЛАД] ≤ 15 мм рт. ст. и легочным сосудистым сопротивлением [ЛСС] > 3 единиц Вуда). [58] ЛАД и ЛСС нельзя измерить напрямую с помощью эхокардиографии. Поэтому для диагностики ЛАГ требуется правосторонняя катетеризация сердца. Катетер Свана-Ганца также может измерять сердечный выброс; это можно использовать для расчета сердечного индекса, который гораздо важнее для измерения тяжести заболевания, чем легочное артериальное давление. [12] [64] Среднее PAP (mPAP) не следует путать с систолическим PAP (sPAP), которое часто указывается в отчетах эхокардиограммы. Систолическое давление 40 мм рт. ст. обычно подразумевает среднее давление более 25 мм рт. ст. Грубо говоря, mPAP = 0,61•sPAP + 2. [65] Из-за инвазивного характера этой процедуры было постулировано использование гемодинамических индексов на основе вычислительной динамики жидкости. [66] [67]
Другой
Для людей, у которых на основании вышеуказанных тестов считается вероятным наличие ЛАГ, конкретное связанное состояние затем определяется на основе физического осмотра, медицинского/семейного анамнеза и дополнительных специфических диагностических тестов (например, серологических тестов для выявления основного заболевания соединительной ткани, ВИЧ-инфекции или гепатита, ультрасонографии для подтверждения наличия портальной гипертензии, эхокардиографии/ магнитно-резонансной томографии сердца для врожденного порока сердца, лабораторных тестов на шистосомоз и КТ высокого разрешения для ВОБЛ и легочного капиллярного гемангиоматоза). Рутинная биопсия легких не рекомендуется у пациентов с ЛАГ из-за риска для пациента и потому, что результаты вряд ли изменят диагноз и лечение. [12] [29] [58]
Уход
Лечение легочной гипертензии определяется тем, является ли ЛГ артериальной, венозной, гипоксической, тромбоэмболической или смешанной. Если она вызвана заболеванием левого сердца, лечение заключается в оптимизации функции левого желудочка с помощью лекарств или в восстановлении/замене митрального клапана или аортального клапана . [68] Пациенты с левожелудочковой недостаточностью или гипоксическими заболеваниями легких (легочная гипертензия II или III групп) не должны регулярно лечиться вазоактивными препаратами, включая простаноиды, ингибиторы фосфодиэстеразы или антагонисты эндотелина, поскольку они одобрены для другого состояния, называемого первичной легочной артериальной гипертензией. [69] Чтобы провести различие, врачи как минимум проведут катетеризацию сердца правого сердца, эхокардиографию, КТ грудной клетки, тест с семиминутной ходьбой и исследование функции легких . [69] Использование лечения других видов легочной гипертензии у пациентов с этими состояниями может нанести вред пациенту и привести к потере значительных медицинских ресурсов. [69]
Высокие дозы блокаторов кальциевых каналов полезны только для 5% пациентов с ИЛАГ, которые являются вазореактивными по катетеру Свана-Ганца . Блокаторы кальциевых каналов в значительной степени использовались неправильно, назначаясь многим пациентам с невазореактивной ЛАГ, что приводит к избыточной заболеваемости и смертности. [19] Критерии вазореактивности изменились. Только те пациенты, у которых среднее давление в легочной артерии падает более чем на 10 мм рт. ст. до менее 40 мм рт. ст. с неизменным или увеличенным сердечным выбросом при введении аденозина , эпопростенола или оксида азота , считаются вазореактивными. [70] Из них только половина пациентов реагируют на блокаторы кальциевых каналов в долгосрочной перспективе. [71]
Недавно был введен ряд агентов для лечения первичной и вторичной ЛАГ. Испытания, поддерживающие использование этих агентов, были относительно небольшими, и единственной мерой, последовательно используемой для сравнения их эффективности, является «тест на шестиминутную ходьбу». У многих нет данных о преимуществах смертности или времени до прогрессирования. [72]
Сотатерцепт (Винревейр) был одобрен для медицинского применения в США в марте 2024 года. [73]
Реабилитация на основе упражнений
Обзор Cochrane 2023 года показал, что реабилитация на основе упражнений может привести к значительному увеличению физической работоспособности и улучшению качества жизни, связанного со здоровьем , без значительного увеличения побочных эффектов. [74]
Вазоактивные вещества
Многие пути вовлечены в аномальную пролиферацию и сокращение гладкомышечных клеток легочных артерий у пациентов с легочной артериальной гипертензией. Три из этих путей важны, поскольку на них направлены лекарственные препараты – антагонисты рецепторов эндотелина , ингибиторы фосфодиэстеразы типа 5 (ФДЭ-5) и производные простациклина. [75]
Простагландины
Простациклин ( простагландин I 2 ) обычно считается наиболее эффективным средством лечения ЛАГ. Эпопростенол (синтетический простациклин) вводится посредством непрерывной инфузии, для которой требуется полупостоянный центральный венозный катетер . Эта система доставки может вызвать сепсис и тромбоз . Простациклин нестабилен, поэтому во время введения его необходимо держать на льду. Поскольку период его полураспада составляет от 3 до 5 минут, инфузия должна быть непрерывной, а прерывание может быть фатальным. [76] Поэтому были разработаны другие простаноиды . Трепростинил можно вводить внутривенно или подкожно, но подкожная форма может быть очень болезненной. CDC сообщил о повышенном риске сепсиса при внутривенном введении ремодулина . Илопрост также используется в Европе внутривенно и имеет более длительный период полураспада. Илопрост был единственной ингаляционной формой простациклина, одобренной для использования в США и Европе, пока ингаляционная форма трепростинила не была одобрена FDA в июле 2009 года. [77]
Антагонисты рецепторов эндотелина
Умеренные качественные доказательства свидетельствуют о том, что антагонисты рецепторов эндотелина улучшают переносимость физических нагрузок и снижают тяжесть симптомов. [78] Двойной (ET A и ET B ) антагонист рецепторов эндотелина босентан был одобрен в 2001 году . Мацитентан — еще один используемый двойной блокатор рецепторов эндотелина ET A и ET B. [26] Ситаксентан (Thelin) был одобрен для использования в Канаде, Австралии и Европейском союзе, [79] но не в Соединенных Штатах. В 2010 году компания Pfizer отозвала ситаксентан по всему миру из-за фатальных осложнений со стороны печени. [80] Аналогичный препарат, амбрисентан (который является блокатором рецепторов эндотелина ET A ), продается под торговой маркой Letairis в США компанией Gilead Sciences . [81]
Ингибиторы фосфодиэстеразы типа 5
FDA США одобрило силденафил , селективный ингибитор цГМФ-специфической фосфодиэстеразы типа 5 (ФДЭ5), для лечения ЛАГ в 2005 году. Он продается для ЛАГ как Revatio. В 2009 году они также одобрили тадалафил , другой ингибитор ФДЭ5, продаваемый под названием Adcirca. [82] Считается, что ингибиторы ФДЭ5 увеличивают вазодилатацию легочной артерии и подавляют ремоделирование сосудов, тем самым снижая давление в легочной артерии и легочное сосудистое сопротивление. [83]
Тадалафил принимается внутрь, как и силденафил, и быстро всасывается (уровень в сыворотке определяется через 20 минут). T 1/2 ( биологический период полувыведения ) колеблется около 17,5 часов у здоровых людей. [84] Более того, если учесть фармакоэкономические последствия, пациенты, принимающие тадалафил, заплатят две трети стоимости терапии силденафилом. [85] Однако у этого препарата есть некоторые побочные эффекты, такие как головная боль, диарея, тошнота, боль в спине, диспепсия , приливы и миалгия . [86]
Комбинированный препарат мацитентан/тадалафил (Opsynvi) был одобрен для медицинского применения в Канаде в октябре 2021 года [87] и в Соединенных Штатах в марте 2024 года [88] [89].
Активаторы растворимой гуанилатциклазы
Растворимая гуанилатциклаза (sGC) является внутриклеточным рецептором для NO . По состоянию на апрель 2009 года [обновлять]активаторы sGC цинацигуат и риоцигуат проходили клинические испытания для лечения ЛАГ. [90]
Хирургический
Атриальная септостомия — это хирургическая процедура, которая создает сообщение между правым и левым предсердиями . Она снимает давление на правую сторону сердца, но за счет более низкого уровня кислорода в крови ( гипоксемия ). Трансплантация легких заменяет хроническое состояние с постоянной необходимостью лечения. [91] Медиана выживаемости после операции составляет чуть более пяти лет. [92]
Легочная тромбэндартерэктомия (ПТЭ) — это хирургическая процедура, которая используется при хронической тромбоэмболической легочной гипертензии. Это хирургическое удаление организованного тромба (сгустка) вместе с оболочкой легочной артерии; это очень сложная, масштабная процедура, которая в настоящее время выполняется в нескольких избранных центрах. [93]
Мониторинг
Установленные клинические рекомендации диктуют частоту оценки и наблюдения за легочными узелками, [69] [94] пациентов обычно контролируют с помощью общедоступных тестов, таких как: [ необходима цитата ]
- Пульсоксиметрия
- Анализ газов артериальной крови
- Рентген грудной клетки
- Серийные ЭКГ- тесты
- Серийная эхокардиография
- Спирометрия или более продвинутые исследования функции легких
- Шестиминутный тест ходьбы [95]
Прогноз
.jpg/440px-Heart_-_cor_pulmonale-_right_ventricular_hypertrophy_(4351912426).jpg)
ЛАГ считается универсально смертельным заболеванием, хотя время выживания может варьироваться между людьми. Прогноз легочной артериальной гипертензии (группа I ВОЗ) имеет нелеченную медиану выживания 2–3 года с момента постановки диагноза, при этом причиной смерти обычно является недостаточность правого желудочка ( легочное сердце ). [96] Время выживания варьируется и зависит от многих факторов. [97] Недавнее исследование результатов тех пациентов, которые начали лечение бозентаном ( Траклир), показало, что 89% пациентов были живы через 2 года. [98] С появлением новых методов лечения показатели выживаемости увеличиваются. Для 2635 пациентов, включенных в Реестр по оценке раннего и долгосрочного лечения легочной артериальной гипертензии (Реестр REVEAL) с марта 2006 года по декабрь 2009 года, показатели выживаемости через 1, 3, 5 и 7 лет составили 85%, 68%, 57% и 49% соответственно. Для пациентов с идиопатической/семейной ЛАГ показатели выживаемости составили 91%, 74%, 65% и 59%. [99] Уровень смертности очень высок у беременных женщин с тяжелой легочной артериальной гипертензией (группа I по классификации ВОЗ). Иногда беременность у этих женщин описывается как противопоказанная. [100] [101] [102]
Эпидемиология
Эпидемиология ИЛАГ составляет около 125–150 смертей в год в США, а во всем мире заболеваемость схожа и составляет 4 случая на миллион. Однако в некоторых частях Европы (Франция) показания составляют 6 случаев ИЛАГ на миллион. У женщин уровень заболеваемости выше, чем у мужчин (2–9:1). [103] Другие формы ЛГ встречаются гораздо чаще. При системной склеродермии заболеваемость оценивается в 8–12% всех пациентов; [104] при ревматоидном артрите она встречается редко. [105] Однако при системной красной волчанке она составляет 4–14%, [106] а при серповидноклеточной анемии она колеблется от 20 до 40%. [107] До 4% людей, у которых развивается тромбоэмболия легочной артерии , впоследствии развивают хроническое тромбоэмболическое заболевание, включая легочную гипертензию. [40] У небольшого процента пациентов с ХОБЛ развивается легочная гипертензия без каких-либо других заболеваний, объясняющих высокое давление. [108] С другой стороны, синдром ожирения-гиповентиляции очень часто связан с правожелудочковой сердечной недостаточностью из-за легочной гипертензии. [109]
Исследовать
Для людей, унаследовавших это заболевание, изучается генная терапия. [110]
Культура и общество
Известные случаи
- Элейн Кауфман , американский ресторатор [111]
- Ина Балин , американская актриса Бродвея и телевидения [112]
- Хлоя Темчин , американская певица и автор песен [113] [114]
- Натали Коул , американская певица [115]
Смотрите также
Ссылки
- ^ abcde "Легочная артериальная гипертензия". Genetics Home Reference . Январь 2016. Архивировано из оригинала 28 июля 2017. Получено 30 июля 2017 .
- ^ ab «Каковы признаки и симптомы легочной гипертензии? – NHLBI, NIH». www.nhlbi.nih.gov . Архивировано из оригинала 2016-01-05 . Получено 2015-12-30 .
- ^ abcde «Кто подвержен риску легочной гипертензии?». NHLBI – NIH . 2 августа 2011 г. Архивировано из оригинала 31 июля 2017 г. Получено 30 июля 2017 г.
- ^ abcdefghij Humbert M, Kovacs G, Hoeper MM, Badagliacca R, Berger RM, Brida M и др. (октябрь 2022 г.). «Руководство ESC/ERS по диагностике и лечению легочной гипертензии 2022 г.». European Heart Journal . 43 (38): 3618–3731. doi :10.1093/eurheartj/ehac237. PMID 36017548.
- ^ abc "Причины и факторы риска". Темы здравоохранения: Легочная гипертензия . Национальный институт сердца, легких и крови. Национальная медицинская библиотека. 24 марта 2022 г.
- ^ abcd "Лечение". Темы здравоохранения: Легочная гипертензия . Национальный институт сердца, легких и крови. Национальная медицинская библиотека. 24 марта 2022 г.
- ^ abc NHLBI и что такое легочная гипертензия? 2023
- ^ "Диагноз". Темы здравоохранения: Легочная гипертензия . Национальный институт сердца, легких и крови. Национальная медицинская библиотека. 24 марта 2022 г.
- ^ фон Ромберг Э (1891–1892). «Убер-склероз лунгенартери». Дтч Арх Клин Мед (на немецком языке). 48 : 197–206.
- ^ abcd Simonneau G, Robbins IM, Beghetti M, Channick RN, Delcroix M, Denton CP и др. (июнь 2009 г.). «Обновленная клиническая классификация легочной гипертензии». Журнал Американского колледжа кардиологии . 54 (1 Suppl): S43–S54. doi : 10.1016/j.jacc.2009.04.012 . PMID 19555858.
- ^ abcde Simonneau G, Gatzoulis MA, Adatia I, Celermajer D, Denton C, Ghofrani A и др. (декабрь 2013 г.). «Обновленная клиническая классификация легочной гипертензии». Журнал Американского колледжа кардиологов . 62 (25 доп.): D34–D41. дои : 10.1016/j.jacc.2013.10.029 . ПМИД 24355639.
- ^ abcdefghijklmno Galiè N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A и др. (ESC Scientific Document Group) (январь 2016 г.). "Руководство ESC/ERS по диагностике и лечению легочной гипертензии 2015 г.: Совместная целевая группа по диагностике и лечению легочной гипертензии Европейского общества кардиологов (ESC) и Европейского респираторного общества (ERS): Одобрено: Ассоциацией европейской детской и врожденной кардиологии (AEPC), Международным обществом по трансплантации сердца и легких (ISHLT)". European Heart Journal . 37 (1): 67–119. doi : 10.1093/eurheartj/ehv317 . PMID 26320113.
- ^ ab "Узнайте о легочной артериальной гипертензии". ЛАГ . Американская ассоциация легких . Получено 01.08.2023 .
- ^ Колайтис NA, Заманян RT, де Хесус Перес VA, Бадеш DB, Бенза RL, Бургер CD и др. (апрель 2021 г.). «Клинические различия и исходы между метамфетамин-ассоциированной и идиопатической легочной артериальной гипертензией в реестре Ассоциации легочной гипертензии». Анналы Американского торакального общества . 18 (4): 613–622. doi : 10.1513/AnnalsATS.202007-774OC . PMC 8174020. PMID 33064950 .
- ^ abcdefghijkl McLaughlin VV, Archer SL, Badesch DB, Barst RJ, Farber HW, Lindner JR и др. (апрель 2009 г.). "ACCF/AHA 2009 expert consensus document on leg hypertension - доклад рабочей группы Американского колледжа кардиологов по экспертным консенсусным документам и Американской кардиологической ассоциации, разработанный в сотрудничестве с Американским колледжем врачей-специалистов по грудной клетке; Американским торакальным обществом, Inc.; и Ассоциацией легочной гипертензии". Журнал Американского колледжа кардиологии . 53 (17): 1573–1619. doi : 10.1016/j.jacc.2009.01.004 . PMID 19389575.
- ^ Diller GP, Gatzoulis MA (февраль 2007 г.). «Легочные сосудистые заболевания у взрослых с врожденным пороком сердца». Circulation . 115 (8): 1039–1050. doi : 10.1161/CIRCULATIONAHA.105.592386 . PMID 17325254.
- ^ ab Fang JC, DeMarco T, Givertz MM, Borlaug BA, Lewis GD, Rame JE и др. (сентябрь 2012 г.). «Группа 2 легочной гипертензии Всемирной организации здравоохранения: легочная гипертензия, вызванная заболеванием левых отделов сердца у взрослых — краткое заявление Совета по легочной гипертензии Международного общества по трансплантации сердца и легких». Журнал трансплантации сердца и легких . 31 (9): 913–933. doi : 10.1016/j.healun.2012.06.002 . PMID 22884380.
- ^ Юсуф С., Кэрнс Дж., Кэмм Дж., Фоллен Э.Л., Герш Б.Дж. (2011). Кардиология, основанная на доказательствах. John Wiley & Sons. стр. 70.3 (рисунок). ISBN 978-1-4443-5945-9. Архивировано из оригинала 2016-04-30.
- ^ ab "Клиническая картина первичной легочной гипертензии: история, физикальное обследование, осложнения". emedicine.medscape.com . Архивировано из оригинала 2015-11-01 . Получено 2015-12-30 .
- ^ Хатано С., Штрассер Р. (1975). Первичная легочная гипертензия . Женева: Всемирная организация здравоохранения.
- ^ Rich S, Rubin LJ, Abenhail L, et al. (1998). Краткое изложение Всемирного симпозиума по первичной легочной гипертензии (Эвиан, Франция, 6–10 сентября 1998 г.). Женева: Всемирная организация здравоохранения. Архивировано из оригинала 8 апреля 2002 г.
- ^ Simonneau G, Galiè N, Rubin LJ, Langleben D, Seeger W, Domenighetti G, et al. (Июнь 2004 г.). «Клиническая классификация легочной гипертензии». Журнал Американского колледжа кардиологии . 43 (12 Suppl S): 5S–12S. doi : 10.1016/j.jacc.2004.02.037 . PMID 15194173.
- ^ Galiè N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A и др. (январь 2016 г.). «Руководство ESC/ERS по диагностике и лечению легочной гипертензии 2015 г.: Совместная целевая группа по диагностике и лечению легочной гипертензии Европейского общества кардиологов (ESC) и Европейского респираторного общества (ERS): Одобрено: Ассоциацией европейской детской и врожденной кардиологии (AEPC), Международным обществом по трансплантации сердца и легких (ISHLT)». European Heart Journal . 37 (1): 67–119. doi : 10.1093/eurheartj/ehv317 . PMID 26320113.
- ^ Рабинович М (декабрь 2012 г.). «Молекулярный патогенез легочной артериальной гипертензии». Журнал клинических исследований . 122 (12): 4306–4313. doi :10.1172/JCI60658. PMC 3533531. PMID 23202738 .
- ^ Hadinnapola C, Bleda M, Haimel M, Screaton N, Swift A, Dorfmüller P и др. (ноябрь 2017 г.). «Фенотипическая характеристика носителей мутации EIF2AK4 в большой когорте пациентов с клиническим диагнозом легочной артериальной гипертензии». Circulation . 136 (21): 2022–2033. doi :10.1161/CIRCULATIONAHA.117.028351. PMC 5700414 . PMID 28972005.
- ^ abcd Хассун, Пол М. (16 декабря 2021 г.). «Легочная артериальная гипертензия». New England Journal of Medicine . 385 (25): 2361–2376. doi :10.1056/NEJMra2000348. PMID 34910865.
- ^ Jacob AS, Nielsen DH, Gianelly RE (февраль 1985 г.). «Фатальная фибрилляция желудочков после верапамила при синдроме Вольфа-Паркинсона-Уайта с фибрилляцией предсердий». Annals of Emergency Medicine . 14 (2): 159–160. doi :10.1016/j.jacc.2013.10.025. PMC 3970402. PMID 3970402 .
- ^ abc Вонк-Нурдеграаф А., Хаддад Ф., Чин К.М., Форфия PR, Кавут С.М., Люменс Дж. и др. (декабрь 2013 г.). «Адаптация правых отделов сердца к легочной артериальной гипертензии: физиология и патобиология». Журнал Американского колледжа кардиологов . 62 (25 доп.): D22–D33. дои : 10.1016/j.jacc.2013.10.027 . ПМИД 24355638.
- ^ abc Galiè N, Hoeper MM, Humbert M, Torbicki A, Vachiery JL, Barbera JA и др. (декабрь 2009 г.). «Руководство по диагностике и лечению легочной гипертензии». The European Respiratory Journal . 34 (6): 1219–1263. doi : 10.1183/09031936.00139009 . PMID 19749199.
- ^ Юань JX, Рубин LJ (февраль 2005 г.). «Патогенез легочной артериальной гипертензии: необходимость множественных ударов». Циркуляция . 111 (5): 534–538. doi : 10.1161/01.CIR.0000156326.48823.55 . PMID 15699271.
- ^ Tuder RM, Marecki JC, Richter A, Fijalkowska I, Flores S (март 2007 г.). «Патология легочной гипертензии». Clinics in Chest Medicine . 28 (1): 23–42, vii. doi :10.1016/j.ccm.2006.11.010. PMC 1924722. PMID 17338926 .
- ^ Бордонес-Кром А., Патнаик СС., Менон ПГ., Мурали С., Финол Э. (июль 2021 г.). «Морфологический анализ стенки эндокарда правого желудочка при легочной гипертензии». Журнал биомеханической инженерии . 143 (7). doi : 10.1115/1.4050457. PMID 33704381. S2CID 232193407.
- ^ Montani D, Price LC, Dorfmuller P, Achouh L, Jaïs X, Yaïci A, et al. (Январь 2009). «Легочное веноокклюзионное заболевание». The European Respiratory Journal . 33 (1): 189–200. doi : 10.1183/09031936.00090608 . PMID 19118230.
- ^ Guazzi M, Galiè N (декабрь 2012 г.). «Легочная гипертензия при заболеваниях левого сердца». European Respiratory Review . 21 (126): 338–346. doi : 10.1183/09059180.00004612 . PMC 9487233. PMID 23204122 .
- ^ Vachiéry JL, Adir Y, Barberà JA, Champion H, Coghlan JG, Cottin V и др. (декабрь 2013 г.). «Легочная гипертензия, вызванная заболеваниями левых отделов сердца». Журнал Американского колледжа кардиологии . 62 (25 Suppl): D100–D108. doi : 10.1016/j.jacc.2013.10.033 . hdl : 11585/534481 . PMID 24355634.
- ^ Shanks N, Macklin J, Coles S (2009). «Сравнение перорального эритромицина этилсукцината и амоксициллина, потенцированного клавуланатом, при лечении острых инфекций дыхательных путей». Clinical Therapeutics . 11 (6): 812–819. doi :10.1016/j.coph.2009.02.006. PMC 2692823 . PMID 2692823.
- ^ Sommer N, Dietrich A, Schermuly RT, Ghofrani HA, Gudermann T, Schulz R и др. (декабрь 2008 г.). «Регуляция гипоксической легочной вазоконстрикции: основные механизмы». The European Respiratory Journal . 32 (6): 1639–1651. doi : 10.1183/09031936.00013908 . PMID 19043010.
- ^ Stenmark KR, Fagan KA, Frid MG (сентябрь 2006 г.). «Ремоделирование легочных сосудов, вызванное гипоксией: клеточные и молекулярные механизмы». Circulation Research . 99 (7): 675–691. doi : 10.1161/01.RES.0000243584.45145.3f . PMID 17008597.
- ^ Макнил К, Даннинг Дж (сентябрь 2007 г.). «Хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ)». Сердце . 93 (9): 1152–1158. doi :10.1136/hrt.2004.053603. PMC 1955041 . PMID 17699182.
- ^ ab Hoeper MM, Mayer E, Simonneau G, Rubin LJ (апрель 2006 г.). «Хроническая тромбоэмболическая легочная гипертензия». Circulation . 113 (16): 2011–2020. doi : 10.1161/CIRCULATIONAHA.105.602565 . PMID 16636189.
- ^ ab Budhiraja R, Tuder RM, Hassoun PM (январь 2004 г.). «Эндотелиальная дисфункция при легочной гипертензии». Circulation . 109 (2): 159–165. doi : 10.1161/01.CIR.0000102381.57477.50 . PMID 14734504.
- ^ Förstermann U, Münzel T (апрель 2006 г.). «Эндотелиальная синтаза оксида азота при сосудистых заболеваниях: от чуда до угрозы». Circulation . 113 (13): 1708–1714. doi : 10.1161/CIRCULATIONAHA.105.602532 . PMID 16585403.
- ^ Мурад Ф. (ноябрь 2006 г.). «Лекция Шаттака. Оксид азота и циклический ГМФ в клеточной сигнализации и разработке лекарств». The New England Journal of Medicine . 355 (19): 2003–2011. doi : 10.1056/NEJMsa063904 . PMID 17093251.
- ^ ab Francis SH, Busch JL, Corbin JD, Sibley D (сентябрь 2010 г.). "cGMP-зависимые протеинкиназы и cGMP фосфодиэстеразы в действии оксида азота и cGMP". Pharmacological Reviews . 62 (3): 525–563. doi :10.1124/pr.110.002907. PMC 2964902 . PMID 20716671.
- ^ Зеля ОП, Коваленко ФП (2011). «Сравнительная эффективность заражения лабораторных животных внутривенным и подкожным введением церкарий Schistosoma mansoni». Паразитология . 20 (6): 461–465. PMID 3103045.
- ^ Ghofrani HA, Pepke-Zaba J, Barbera JA, Channick R, Keogh AM, Gomez-Sanchez MA и др. (июнь 2004 г.). «Путь оксида азота и ингибиторы фосфодиэстеразы при легочной артериальной гипертензии». Журнал Американского колледжа кардиологии . 43 (12 Suppl S): 68S–72S. doi : 10.1016/j.jacc.2004.02.031 . PMID 15194181.
- ^ McLaughlin VV, McGoon MD (сентябрь 2006 г.). «Легочная артериальная гипертензия». Circulation . 114 (13): 1417–1431. doi : 10.1161/CIRCULATIONAHA.104.503540 . PMID 17000921.
- ^ Fonseca C, Abraham D, Renzoni EA (январь 2011 г.). «Эндотелин при легочном фиброзе». American Journal of Respiratory Cell and Molecular Biology . 44 (1): 1–10. doi :10.1165/rcmb.2009-0388TR. PMID 20448055.
- ^ abcdef Wood SF (январь 1986). «Астемизол и терфенадин в сравнении при сенной лихорадке». The Practitioner . 230 (1411): 41–44. doi : 10.1161/CIRCULATIONAHA.108.847707 . PMC 2869481. PMID 2869481 .
- ^ Gomberg-Maitland M, Olschewski H (апрель 2008 г.). «Простациклиновая терапия для лечения легочной артериальной гипертензии». The European Respiratory Journal . 31 (4): 891–901. doi : 10.1183/09031936.00097107 . PMID 18378784.
- ^ ab Lenfant M (2013). "[Фиксация дигидрострептомицина на рибосомах E. coli]". Biochimie . 54 (2): 283–285. doi : 10.1016/j.jacc.2013.10.026 . PMC 4117578 . PMID 4117578.
- ^ Lawrie A (декабрь 2014 г.). «Роль оси лигандов, индуцирующих апоптоз, связанной с остеопротегерином/фактором некроза опухоли, в патогенезе легочной артериальной гипертензии». Сосудистая фармакология . 63 (3): 114–117. doi :10.1016/j.vph.2014.10.002. PMID 25446166.
- ^ Braithwaite AT, Marriott HM, Lawrie A (2018). «Расходящиеся роли TRAIL при заболеваниях легких». Frontiers in Medicine . 5 : 212. doi : 10.3389/fmed.2018.00212 . PMC 6072839. PMID 30101145 .
- ^ abc Ranchoux B, Meloche J, Paulin R, Boucherat O, Provencher S, Bonnet S (июнь 2016 г.). «Повреждение ДНК и легочная гипертензия». Int J Mol Sci . 17 (6): 990. doi : 10.3390/ijms17060990 . PMC 4926518. PMID 27338373 .
- ^ «Как диагностируется легочная гипертензия? – NHLBI, NIH». www.nhlbi.nih.gov . Архивировано из оригинала 2016-01-05 . Получено 2015-12-30 .
- ^ Остин ЭД, Филлипс III JA, Лойд Дж.Э. (28 декабря 2015 г.). "Легочная артериальная гипертензия". Адам М.П., Фельдман Дж., Мирзаа Г.М., Пагон Р.А., Уоллес С.Е., Бин Л.Х., Грипп К.В., Амемия А. (ред.). Домашний справочник по генетике . Архивировано из оригинала 24 декабря 2015 г. Проверено 30 декабря 2015 г.
- ^ Austin ED, Loyd JE, Phillips JA (январь 1993 г.). «Обзор наследственной легочной артериальной гипертензии». В Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJ, Bird TD, Fong C, Mefford HC (ред.). GeneReviews . Сиэтл (WA): Университет Вашингтона, Сиэтл. PMID 20301658. NBK1485.
- ^ abcdef Hoeper MM, Bogaard HJ, Condliffe R, Frantz R, Khanna D, Kurzyna M и др. (декабрь 2013 г.). «Определения и диагностика легочной гипертензии». Журнал Американского колледжа кардиологии . 62 (25 Suppl): D42–D50. doi : 10.1016/j.jacc.2013.10.032 . PMID 24355641.
- ^ Клеппер М.Дж., Коберт Б. (2010-10-25). Данные о безопасности лекарств: как анализировать, обобщать и интерпретировать для определения риска. Jones & Bartlett Learning. стр. 86. ISBN 978-0-7637-6912-3. Архивировано из оригинала 2016-05-04.
- ^ Талеб М., Худер С., Тинкель Дж., Хоури С.Дж. (март 2013 г.). «Диагностическая точность допплеровской эхокардиографии при оценке систолического давления в легочной артерии: метаанализ». Эхокардиография . 30 (3): 258–265. doi :10.1111/echo.12061. PMID 23227919. S2CID 7460778.
- ^ «Как диагностируется легочная гипертензия?». Национальный институт сердца, легких и крови.
- ^ abcdefg Gaillard F. "Легочная гипертензия". Radiopaedia . Получено 2018-03-12 .
- ^ Bossone E, D'Andrea A, D'Alto M, Citro R, Argiento P, Ferrara F, et al. (Январь 2013). «Эхокардиография при легочной артериальной гипертензии: от диагностики к прогнозу». Журнал Американского общества эхокардиографии . 26 (1): 1–14. doi :10.1016/j.echo.2012.10.009. PMID 23140849.
- ^ "Swan-Ganz – катетеризация правых отделов сердца". Медицинская энциклопедия . MedlinePlus, Национальная медицинская библиотека. 2022.
- ^ Khouri SJ, Pandya U (2012). «Легочная гипертензия». В Garcia MJ (ред.). Неинвазивная сердечно-сосудистая визуализация: мультимодальный подход . Lippincott Williams & Wilkins. стр. 655–668.
- ^ Piskin S, Patnaik SS, Han D, Bordones AD, Murali S, Finol EA (март 2020 г.). «Канонический корреляционный анализ взаимосвязи между клиническими признаками и гемодинамическими показателями, специфичными для пациента, при легочной гипертензии у взрослых». Medical Engineering & Physics . 77 : 1–9. doi :10.1016/j.medengphy.2020.01.006. PMC 7069525 . PMID 32007361.
- ^ Pillalamarri NR, Piskin S, Patnaik SS, Murali S, Finol EA (декабрь 2021 г.). «Пациент-специфический вычислительный анализ гемодинамики при легочной гипертензии у взрослых». Annals of Biomedical Engineering . 49 (12): 3465–3480. doi :10.1007/s10439-021-02884-y. PMC 8684831. PMID 34799807 .
- ^ "Как лечится легочная гипертензия? – NHLBI, NIH". www.nhlbi.nih.gov . Архивировано из оригинала 2016-01-05 . Получено 2015-12-30 .
- ^ abcd Американская коллегия врачей-специалистов по заболеваниям грудной клетки ; Американское торакальное общество (сентябрь 2013 г.), «Пять вопросов, которые должны задавать себе врачи и пациенты», Choose Wisely : инициатива Фонда ABIM , Американской коллегии врачей-специалистов по заболеваниям грудной клетки и Американского торакального общества, архивировано из оригинала 3 ноября 2013 г. , извлечено 6 января 2013 г., который цитирует
- McLaughlin VV, Archer SL, Badesch DB, Barst RJ, Farber HW, Lindner JR и др. (апрель 2009 г.). «Документ консенсуса экспертов ACCF/AHA 2009 по легочной гипертензии: отчет целевой группы Фонда Американского колледжа кардиологии по документам консенсуса экспертов и Американской кардиологической ассоциации: разработан в сотрудничестве с Американским колледжем врачей-специалистов по грудной клетке, Американским торакальным обществом, Inc. и Ассоциацией легочной гипертензии». Циркуляция . 119 (16): 2250–2294. doi : 10.1161/CIRCULATIONAHA.109.192230 . PMID 19332472.
- Galiè N, Hoeper MM, Humbert M, Torbicki A, Vachiery JL, Barbera JA и др. (октябрь 2009 г.). «Руководящие принципы диагностики и лечения легочной гипертензии: целевая группа по диагностике и лечению легочной гипертензии Европейского общества кардиологов (ESC) и Европейского респираторного общества (ERS), одобренные Международным обществом трансплантации сердца и легких (ISHLT)». European Heart Journal . 30 (20): 2493–2537. doi : 10.1093/eurheartj/ehp297 . PMID 19713419.
- Hoeper MM, Barberà JA, Channick RN, Hassoun PM, Lang IM, Manes A и др. (июнь 2009 г.). «Диагностика, оценка и лечение нелегочной артериальной гипертензии легочной гипертензии». Журнал Американского колледжа кардиологии . 54 (1 Suppl): S85–S96. doi : 10.1016/j.jacc.2009.04.008 . PMID 19555862.
- ^ Barst RJ, McGoon M, Torbicki A, Sitbon O, Krowka MJ, Olschewski H, Gaine S (июнь 2004 г.). «Диагностика и дифференциальная оценка легочной артериальной гипертензии». Журнал Американского колледжа кардиологии . 43 (12 Suppl S): 40S–47S. doi : 10.1016/j.jacc.2004.02.032 . PMID 15194177.
- ^ Sitbon O, Humbert M, Jaïs X, Ioos V, Hamid AM, Provencher S и др. (июнь 2005 г.). «Долгосрочный ответ на блокаторы кальциевых каналов при идиопатической легочной артериальной гипертензии». Circulation . 111 (23): 3105–3111. doi : 10.1161/CIRCULATIONAHA.104.488486 . PMID 15939821.
- ^ Torres F (октябрь 2007 г.). «Систематический обзор рандомизированных двойных слепых клинических испытаний пероральных препаратов, проведенных у пациентов с легочной артериальной гипертензией». International Journal of Clinical Practice . 61 (10): 1756–1765. doi : 10.1111/j.1742-1241.2007.01545.x . PMID 17877662. S2CID 1191543.
- ^ "FDA одобряет препарат Winrevair (sotatercept-csrk) компании Merck — первое в своем классе средство для лечения взрослых с легочной артериальной гипертензией (ЛАГ, группа ВОЗ 1)" (пресс-релиз). Merck. 27 марта 2024 г. Получено 27 марта 2024 г.
- ^ Morris NR, Kermeen FD, Jones AW, Lee JY, Holland AE и др. (Cochrane Airways Group) (март 2023 г.). «Программы реабилитации на основе упражнений при легочной гипертензии». База данных систематических обзоров Cochrane . 2023 (3): CD011285. doi :10.1002/14651858.CD011285.pub3. PMC 10032353. PMID 36947725 .
- ^ Раджа СГ, Раджа СМ (ноябрь 2011 г.). «Лечение легочной артериальной гипертензии: современные методы лечения и будущие перспективы». Therapeutic Advances in Chronic Disease . 2 (6): 359–370. doi :10.1177/2040622311420773. PMC 3513893. PMID 23251761 .
- ^ Safdar Z (июнь 2011). «Лечение легочной артериальной гипертензии: роль простациклина и аналогов простагландина». Респираторная медицина . 105 (6): 818–827. doi : 10.1016/j.rmed.2010.12.018 . PMID 21273054.
- ^ «Лекарства@FDA: Лекарства, одобренные FDA».
- ^ Liu C, Chen J, Gao Y, Deng B, Liu K и др. (Cochrane Airways Group) (март 2021 г.). «Антагонисты рецепторов эндотелина при легочной артериальной гипертензии». База данных систематических обзоров Cochrane . 2021 (3): CD004434. doi :10.1002/14651858.CD004434.pub6. PMC 8094512. PMID 33765691.
- ^ "ОБНОВЛЕНИЕ 1-Encysive получает одобрение Канады на лекарство от гипертонии". Reuters . 2008-05-30. Архивировано из оригинала 2007-07-04 . Получено 2007-07-08 .
- ^ «Ссылаясь на повреждение печени, Pfizer отзывает Thelin – CBS Detroit». www.cbsnews.com . 10 декабря 2010 г.
- ^ "Управление по контролю за продуктами и лекарствами США одобрило препарат Letairis компании Gilead для лечения легочной артериальной гипертензии" (пресс-релиз). Gilead Sciences . 2007-06-15. Архивировано из оригинала 2007-09-27 . Получено 2007-06-16 .
- ^ "FDA одобряет таблетки Adcirca (тадалафил) для лечения легочной артериальной гипертензии" (пресс-релиз). 2009-05-26. Архивировано из оригинала 2010-12-03 . Получено 2010-12-06 .
- ^ Duarte JD, Hanson RL, Machado RF (май 2013 г.). «Фармакологическое лечение легочной гипертензии: изучение фармакогеномики». Future Cardiology . 9 (3): 335–349. doi :10.2217/fca.13.6. PMC 3864092. PMID 23668740 .
- ^ Forgue ST, Patterson BE, Bedding AW, Payne CD, Phillips DL, Wrishko RE, Mitchell MI (март 2006 г.). «Фармакокинетика тадалафила у здоровых субъектов». British Journal of Clinical Pharmacology . 61 (3): 280–288. doi :10.1111/j.1365-2125.2005.02553.x. PMC 1885023 . PMID 16487221.
- ^ Ариф СА, Пун Х (август 2011 г.). «Тадалафил: ингибитор фосфодиэстеразы-5 длительного действия для лечения легочной артериальной гипертензии». Clin Ther . 33 (8): 993–1004. doi :10.1016/j.clinthera.2011.06.008. PMID 21762988.
- ^ Галье Н., Брандейдж Б.Х., Гофрани Х.А., Удис Р.Дж., Симонно Г., Сафдар З. и др. (июнь 2009 г.). «Тадалафил терапия легочной артериальной гипертензии». Тираж . 119 (22): 2894–2903. дои : 10.1161/circulationaha.108.839274 . ПМИД 19470885.
- ^ "Opsynvi (мацитентан и тадалафил) становится первым и единственным одобренным Министерством здравоохранения Канады комбинированным препаратом с фиксированной дозой для приема один раз в день для пациентов с легочной артериальной гипертензией (ЛАГ)". Johnson & Johnson (пресс-релиз). 15 октября 2021 г. Получено 25 марта 2024 г.
- ^ "Письмо об одобрении: Opsynvi (мацитентан и тадалафил)" (PDF) . Управление по контролю за продуктами и лекарствами США.
- ^ "US FDA одобрило Opsynvi (мацитентан и тадалафил) в качестве первой и единственной комбинированной терапии с одной таблеткой для приема один раз в день для пациентов с легочной артериальной гипертензией (ЛАГ)". Johnson & Johnson (пресс-релиз). 22 марта 2024 г. Получено 25 марта 2024 г.
- ^ Lasker GF, Maley JH, Pankey EA, Kadowitz PJ (апрель 2011 г.). «Воздействие на растворимую гуанилатциклазу для лечения легочной гипертензии». Expert Review of Respiratory Medicine . 5 (2): 153–161. doi :10.1586/ers.11.9. PMC 3108035. PMID 21510726 .
- ^ Джордж MP, Чемпион HC, Пилевски JM (2011). «Трансплантация легких при легочной гипертензии». Легочное кровообращение . 1 (2): 182–191. doi : 10.4103/2045-8932.83455 . PMC 3198646. PMID 22034605 .
- ^ "2006 OPTN/SRTR Annual Report". Научный реестр реципиентов трансплантатов США. 2006-05-01. Архивировано из оригинала 2010-06-05 . Получено 2007-03-28 .
- ^ Cerveri I, D'Armini AM, Viganò M (апрель 2003 г.). «Легочная тромбэндартерэктомия почти через 50 лет после первых хирургических попыток». Heart . 89 (4): 369–370. doi :10.1136/heart.89.4.369. PMC 1769265 . PMID 12639858.
- ^ Американская коллегия врачей-специалистов по заболеваниям грудной клетки ; Американское торакальное общество (сентябрь 2013 г.), «Пять вопросов, которые должны задавать себе врачи и пациенты», Choose Wisely : инициатива Фонда ABIM , Американской коллегии врачей-специалистов по заболеваниям грудной клетки и Американского торакального общества, архивировано из оригинала 3 ноября 2013 г. , извлечено 6 января 2013 г.
- ^ Руководство: Тест на шестиминутную ходьбу. Доступ: 2015
- ^ "Легочная гипертензия. О легочной гипертензии | Пациент". Пациент . Архивировано из оригинала 2016-01-02 . Получено 2015-12-30 .
- ^ Mouratoglou SA, Bayoumy AA, Noordegraaf AV (2021). «Модели прогнозирования и показатели при легочной гипертензии: обзор». Current Pharmaceutical Design . 27 (10): 1266–1276. doi :10.2174/1381612824999201105163437. PMID 33155897. S2CID 226272078.
- ^ McLaughlin VV, Sitbon O, Badesch DB, Barst RJ, Black C, Galiè N, et al. (Февраль 2005). «Выживаемость при терапии бозентаном первой линии у пациентов с первичной легочной гипертензией». The European Respiratory Journal . 25 (2): 244–249. doi : 10.1183/09031936.05.00054804 . PMID 15684287.
- ^ Benza RL, Miller DP, Barst RJ, Badesch DB, Frost AE, McGoon MD (август 2012 г.). «Оценка долгосрочной выживаемости с момента постановки диагноза при легочной артериальной гипертензии из регистра REVEAL». Chest . 142 (2): 448–456. doi :10.1378/chest.11-1460. PMID 22281797.
- ^ Кауфман МХ, Стед Л, Фейг Р (2007). Первая помощь для акушерства и гинекологии . Нью-Йорк: McGraw-Hill, Medical Pub. Division. стр. 100. ISBN 978-0-07-144874-1.
- ^ Ghosh AK (2008). Обзор внутренней медицины клиники Майо (8-е изд.). Informa Healthcare. стр. 55. ISBN 978-1-4200-8478-8.
- ^ British Journal of Anaesthesia: «Первичная легочная гипертензия во время беременности; роль новых вазодилататоров». Архивировано 21 января 2011 г. на Wayback Machine 19 марта 2011 г.
- ^ Oudiz RJ (6 февраля 2023 г.). «Идиопатическая легочная артериальная гипертензия: основы практики, предпосылки, патофизиология». Ссылка Medscape .
- ^ York M, Farber HW (ноябрь 2011 г.). «Легочная гипертензия: скрининг и оценка при склеродермии». Current Opinion in Rheumatology . 23 (6): 536–544. doi :10.1097/BOR.0b013e32834ba6a7. PMID 21934501. S2CID 19528958.
- ^ Nannini C. "Lung Disease in Rheumatoid Arthritis". MedScape.com . MedScape. Архивировано из оригинала 8 февраля 2016 года . Получено 31 декабря 2015 года .
- ^ Mittoo S, Fell CD (апрель 2014 г.). «Легочные проявления системной красной волчанки». Семинары по респираторной и интенсивной терапии . 35 (2). MedScape: 249–254. doi :10.1055/s-0034-1371537. PMID 24668539. S2CID 24654448. Архивировано из оригинала 26 октября 2015 г. Получено 31 декабря 2015 г.
- ^ Lee MT, Rosenzweig EB, Cairo MS (август 2007 г.). «Легочная гипертензия при серповидноклеточной анемии». Clinical Advances in Hematology & Oncology . 5 (8): 585, 645–653. PMID 17982405.
- ^ Minai OA, Chaouat A, Adnot S (июнь 2010 г.). «Легочная гипертензия при ХОБЛ: эпидемиология, значение и лечение: легочные сосудистые заболевания: глобальная перспектива». Chest . 137 (6 Suppl): 39S–51S. doi :10.1378/chest.10-0087. PMID 20522579.
- ^ Balachandran JS, Masa JF, Mokhlesi B (сентябрь 2014 г.). «Эпидемиология и диагностика синдрома гиповентиляции при ожирении». Sleep Medicine Clinics . 9 (3): 341–347. doi :10.1016/j.jsmc.2014.05.007. PMC 4210766. PMID 25360072 .
- ^ Reynolds PN (февраль 2011 г.). «Генная терапия легочной гипертензии: перспективы и проблемы». Мнение эксперта по биологической терапии . 11 (2): 133–143. doi :10.1517/14712598.2011.542139. PMID 21219232. S2CID 23641857.
- ^ "Элейн Кауфман, знаменитый ресторатор Элейн, умерла в возрасте 81 года". Daily News . 3 декабря 2010 г. Архивировано из оригинала 28 августа 2016 г. Получено 27 сентября 2016 г.
- ^ Folkart BA (21 июня 1990 г.). «Ина Балин, 52 года; актриса кино и телевидения искала имплантат легкого». Los Angeles Times . Архивировано из оригинала 11 сентября 2016 г. Получено 27 сентября 2016 г.
- ^ Phull H (26 июля 2016 г.). «Она привязана к кислородному баллону, но ее певческая карьера стремительно растет». New York Post . Архивировано из оригинала 14 августа 2016 г.
- ^ Insdorf A (10 ноября 2013 г.). «Проблемы Хлои Темчин». The Huffington Post . Архивировано из оригинала 18 сентября 2016 г.
- ^ «Вскрытие: Последние часы Натали Коул». Вскрытие . Нар. Эрик Мейерс. Исполнительный продюсер Эд Тейлор и Майкл Келпи. Reelz, 27 мая 2017 г. Телевидение.
Дальнейшее чтение
- «Легочная артериальная гипертензия». Генетика: генетические состояния . MedlinePlus, Национальная медицинская библиотека. 2016.
- «Что такое легочная гипертензия?». Темы здравоохранения: Легочная гипертензия . Национальный институт сердца, легких и крови. Национальная медицинская библиотека. Май 2023 г.
- Rubin LJ, Badesch DB (август 2005 г.). «Оценка и ведение пациента с легочной артериальной гипертензией». Annals of Internal Medicine . 143 (4): 282–292. CiteSeerX 10.1.1.463.8466 . doi :10.7326/0003-4819-143-4-200508160-00009. PMID 16103472. S2CID 28841269.
- Abman SH, Hansmann G, Archer SL, Ivy DD, Adatia I, Chung WK и др. (Ноябрь 2015 г.). «Детская легочная гипертензия: рекомендации Американской кардиологической ассоциации и Американского торакального общества». Циркуляция . 132 (21): 2037–2099. doi : 10.1161/CIR.0000000000000329 . PMID 26534956. S2CID 7412370.
Внешние ссылки
- Справочник Merck Home Edition: Легочная гипертензия

