Тетрафторид платины
 | |
| Имена | |
|---|---|
| Название ИЮПАК Фторид платины(IV) | |
| Другие имена Тетрафторид платины Фторид платины | |
| Идентификаторы | |
| |
3D модель ( JSmol ) |
|
CID PubChem |
|
Панель инструментов CompTox ( EPA ) |
|
| |
| |
| Характеристики | |
| Ф 4 Пт | |
| Молярная масса | 271.078 [1] |
| Появление | красно-оранжевый твердый [1] |
| Плотность | 7,08 г/см 3 (расч.) [2] |
| Температура плавления | 600 °C (1112 °F; 873 K) [1] |
| +455,0·10 −6 см 3 /моль | |
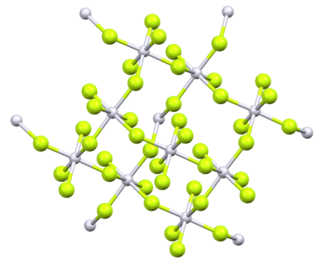
| Структура | |
| Орторомбическая , oF40 | |
| Fdd2, № 43 [2] | |
а = 0,9284 нм, б = 0,959 нм, с = 0,5712 нм | |
| Родственные соединения | |
Другие анионы | Бромид платины(IV) Хлорид платины(IV) |
Родственные соединения | Фторид платины(V) Фторид платины(VI) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Тетрафторид платины — неорганическое соединение с химической формулой PtF
4. В твердом состоянии соединение представляет собой платину (IV) в октаэдрической координационной геометрии . [2]
Подготовка
Это соединение впервые было получено Анри Муассаном путем фторирования платинового металла в присутствии фтористого водорода . [3] Современный синтез включает термическое разложение гексафторида платины . [4]
Характеристики
Пары тетрафторида платины при 298,15 К состоят из отдельных молекул. Энтальпия сублимации составляет 210 кДжмоль −1 . [5] Первоначальный анализ порошкообразного PtF4 предполагал тетраэдрическую молекулярную геометрию , но более поздний анализ несколькими методами идентифицировал ее как октаэдрическую, с четырьмя из шести фторидов на каждой платине, соединяющимися с соседними платиновыми центрами. [6]
Реакции
Раствор тетрафторида платины в воде окрашен в красновато-коричневый цвет, но он быстро разлагается, выделяя тепло и образуя оранжевый осадок гидрата диоксида платины и фторплатиновую кислоту. [7] При нагревании до температуры красного каления тетрафторид платины разлагается на металлическую платину и газообразный фтор. При нагревании в контакте со стеклом вместе с металлом образуется газ тетрафторид кремния . [7]
Тетрафторид платины может образовывать аддукты с тетрафторидом селена и трифторидом брома . [7] Летучие кристаллические аддукты также образуются в сочетании с BF 3 , PF 3 , BCl 3 и PCl 3 . [7]
Родственные соединения
Фтороплатинаты — это соли, содержащие ион PtF 6 2− . Фтороплатиновая кислота H 2 PtF 6 образует желтые кристаллы, которые поглощают воду из воздуха. Аммоний, натрий, магний, кальций, стронций и редкоземельные соли, включая фторпалатинат лантана, растворимы в воде. [7] Соли калия, рубидия, цезия и бария нерастворимы в воде. [7]
Ссылки
- ^ abc Haynes, William M., ред. (2011). CRC Handbook of Chemistry and Physics (92-е изд.). Бока-Ратон, Флорида: CRC Press . стр. 4.81. ISBN 1-4398-5511-0.
- ^ abc Мюллер, Б. Г.; Серафин, М. (1992). «Исследования монокристаллов PtF 4 и PtF 5 ». Европейский журнал твердотельной неорганической химии . 29 : 625–633 . doi :10.1002/chin.199245006.[ необходима полная цитата ]
- ^ Муассан, Х. «Тетрафторид платины». Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences . 109 : 807–9 .
- ^ Сливник, Дж. Э.; Земва, Б.; Друзина, Б. (1980). «Новые синтезы фторидов платины (IV) и платины (VI)». Журнал химии фтора . 15 (4): 351. doi :10.1016/S0022-1139(00)81471-2.
- ^ Бондаренко, А.А.; Коробов, М.В.; Митькин, В.Н.; Сидоров, Л.Н. (март 1988). «Энтальпия сублимации тетрафторида платины». Журнал химической термодинамики . 20 (3): 299– 303. doi :10.1016/0021-9614(88)90125-5.
- ^ "Структуры твердого состояния бинарных фторидов переходных металлов". Достижения в неорганической химии и радиохимии . Том 27. Academic Press. 1983. Раздел V: Тетрафториды, страницы 97–103. ISBN 9780080578767.
- ^ abcdef Дерек Гарри Ломанн (октябрь 1961 г.). Фториды платины и родственные соединения (диссертация). Университет Британской Колумбии.